作为近年来肺部肿瘤外科的新兴技术,肺段切除术并不"新",据文献报道,早在1939年,Churchill就将段切除术用于治疗细支气管炎。但是,正如序言所说,"随着人群防癌意识的提高、防癌体检的开展,首诊患者中小肺癌的比例越来越高。迎合着医学个体化精准治疗理念、患者微创化快速康复需求",原本逐渐被人们所忽略的段切除术,终于在市场的带动下,在神州大地遍地开花。而随着其不断推广、进行的同时,关于其创伤小、恢复快、疗效稳定的核心价值,也在不断地收到多方面的质疑和论证,迄今仍无共识。目前,关于肺段在小肺癌中的治疗主要存在两个价值假设:
肺功能损害:肺段≈楔形<肺叶
抗肿瘤作用:肺段≈肺叶>楔形
因此在本帖中,郑医生将主要从这两个方面出发,探讨段切除的核心价值。
一、段切可以较好地保护肺功能?
在理论上,段切除术更符合生理解剖,相对于楔形与肺叶切除术而言,能够最大程度减少肺功能损害,有利于保护肺功能。
2016年发表于《American Journal of Surgery》的一项研究中,作者回顾性分析了2010年9月到2013年8月在Morsani College of medicine接收机器人辅助段切与叶切患者的临床病历资料,最终纳入253例患者,其中叶切208例,段切43例。研究发现,段切组患者的术前FEV1和DLCO指标都要明显低于叶切组。
通过模拟计算,作者得到了预测肺功能损耗以及预测术后肺功能。分析显示,段切除组的肺功能丢失要显著低于叶切出组。这也就是说,段切除组患者在基础肺功能显著弱于叶切的前提下,通过段切,实现了与叶切组相近的术后残存肺功能。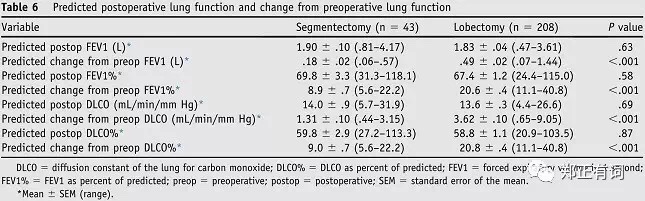
但是,这个研究的价值仍然是十分有限的,为什么?因为其仅仅从理论水平,通过计算机模拟而得到的数值,并基于这个数值得到结论,这种纯靠模拟而得到的结论在一定程度上并不能反应真实世界的情况。
为此,日本千叶大学医学院的胸外科团队纳入了2009-2012年在其中心接收叶切/段切的IA期非小细胞肺癌(NSCLC)患者,并评估其术前与术后肺功能变化,以术后FVC/术前FVC作为FVC的恢复量,而以术后FEV1/术前FEV1作为FEV1的回复量,绘制散点图并拟合曲线。如下图所示,在长达两年的术后随访中,两组患者的术后FVC及FEV1的恢复程度都在不断增加,但两组之间并无显著差异。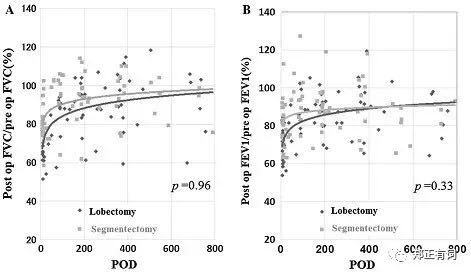
此外,作者还收集两组患者术前与术后6月的影像学检查结果,重建估算不同情况下的肺容量与肺重量,并基于术前指标及手术方案计算术后预测指标。通过比较发现,在段切除组,术后实际肺容量/肺重量与预测肺容量/肺重量相近;而在叶切除组,术后实际肺容量/肺重量则要显著高于预测肺容量/肺重量。作者认为,叶切除组更为显著的复张代偿现象是造成这种差异的主要原因。
二、段切可以实现较好的抗肿瘤效果?
基于上文假设,这个较好的抗肿瘤效果应该可以诠释为"优于楔形而等于肺叶",因此要验证段切的抗肿瘤效果,就必须反复地与楔形/肺叶进行比较方可确定。为此,郑医生检索到了2016、2017年,发表在pubmed上的关于肺段的所有英文文献,将其中以评估抗肿瘤作用的文献进行了简单归纳,以纳入数据库不同分为以下两种:1.基于自身数据库而进行的研究;2.基于SEER数据库而进行的研究。
1. 基于自身数据库而进行的研究
命题1:段切 vs 叶切
首先是日本Niigata University Hospital带来的回顾性研究,纳入251例纯毛玻璃表现,且临床评估T1aN0M0 NSCLC,治疗方案为叶切/段切。通过PMS匹配两组患者的临床病理因素,包括年龄、性别、吸烟状态、肺活量、FEV1、CEA、肿瘤大小、病理类型(腺癌/鳞癌/其他),最终得到87对临床病理因素匹配的患者,分析发现,两组人员在总生存和无疾病生存方面均无显著差异(如下图所示)。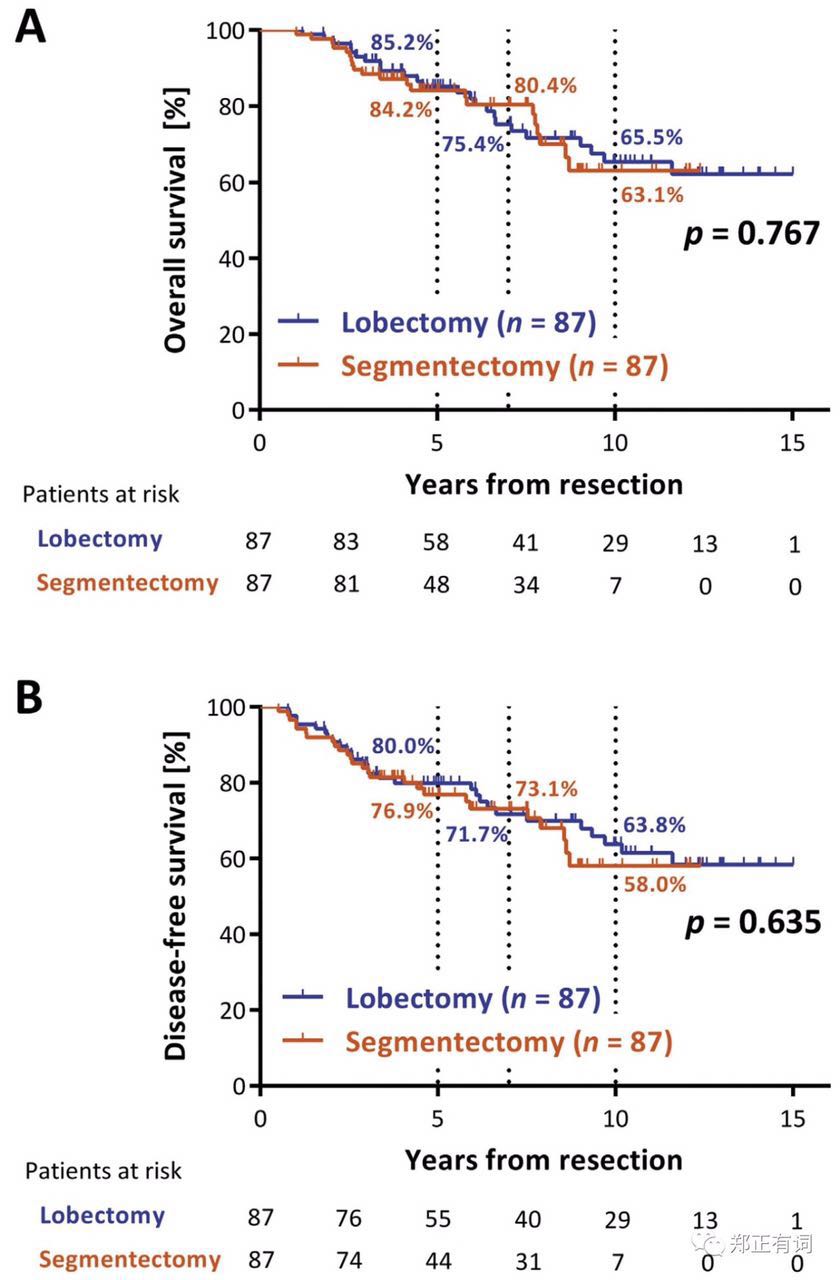
对此,作者指出,段切除术之所以不劣于叶切除,一个重要的解释研究中远处转移是最主要的复发模式,而不论在段切组还是叶切组(71% vs 70%),因此局部切除范围的大小不会对此产生影响。此外,作者认为,纯GGO中贴壁生长为主型腺癌比较多见,而在混合型GGO中,则多见微乳头型腺癌,而在这部分患者中,即便开展积极的叶切除,其远期生存仍然不尽如人意,因为局部切除并不能减少其远处转移的几率,这可能与不同病理类型下的差异性的生物学行为有关
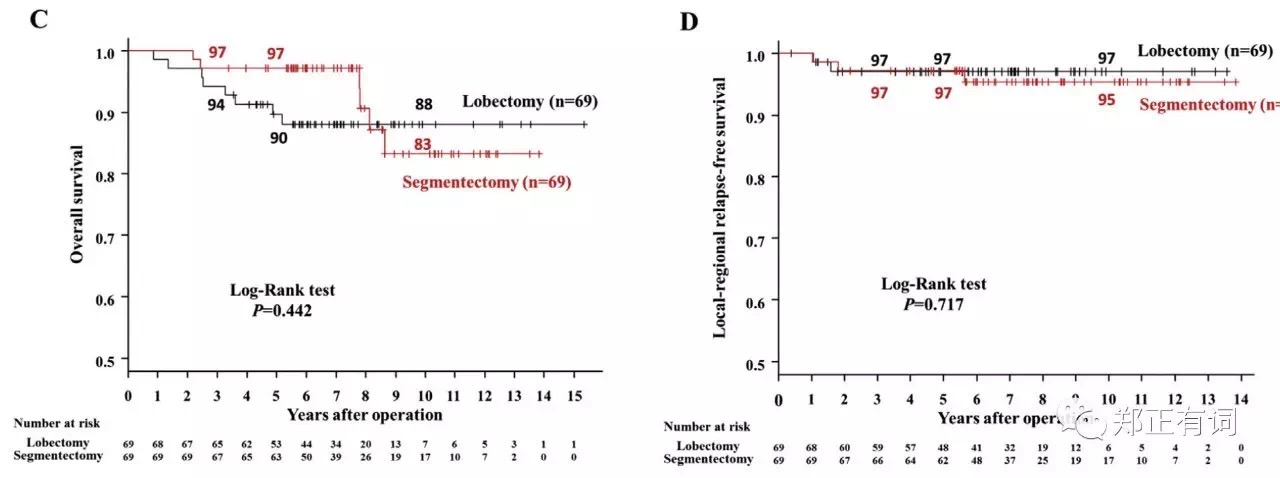
第二项报道则来自日本大阪国立医院,纳入1997-2010年在其中心接收段切/叶切的影像学表现为部分实性或完全实性的临床IA期 NSCLC。最终,纳入312个患者,其中段切除80例,其5-、10-OS分别时97.5%和83.5%;叶切除232例,其5-、10-OS 分别是 87.75%和75.0%;段切组患者预后要明显好于叶切组,p=0.019。
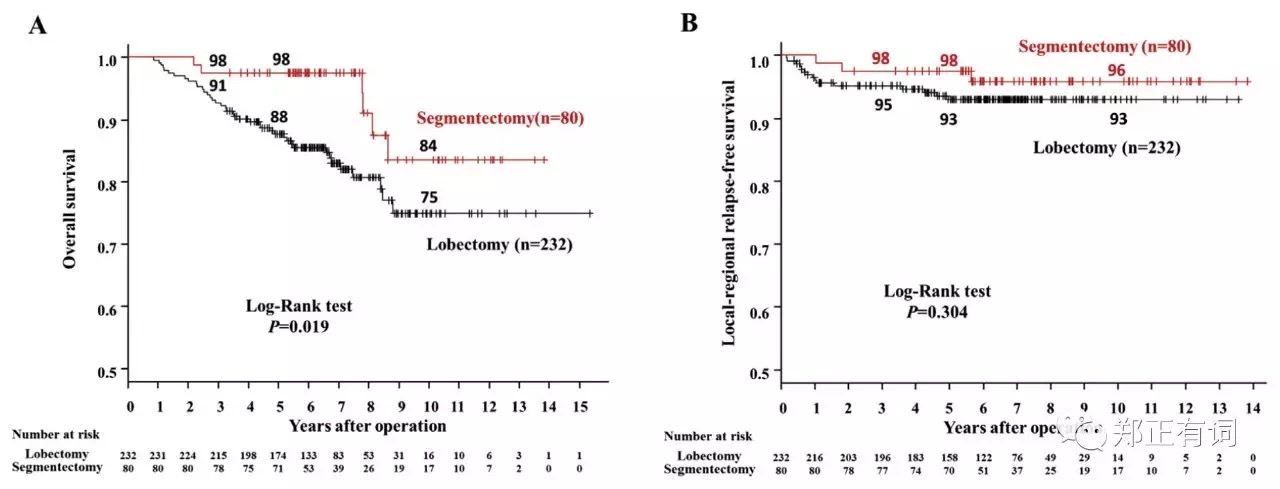
作者指出,这种现象可能与该中心长期实施的治疗指引相关,具体如下: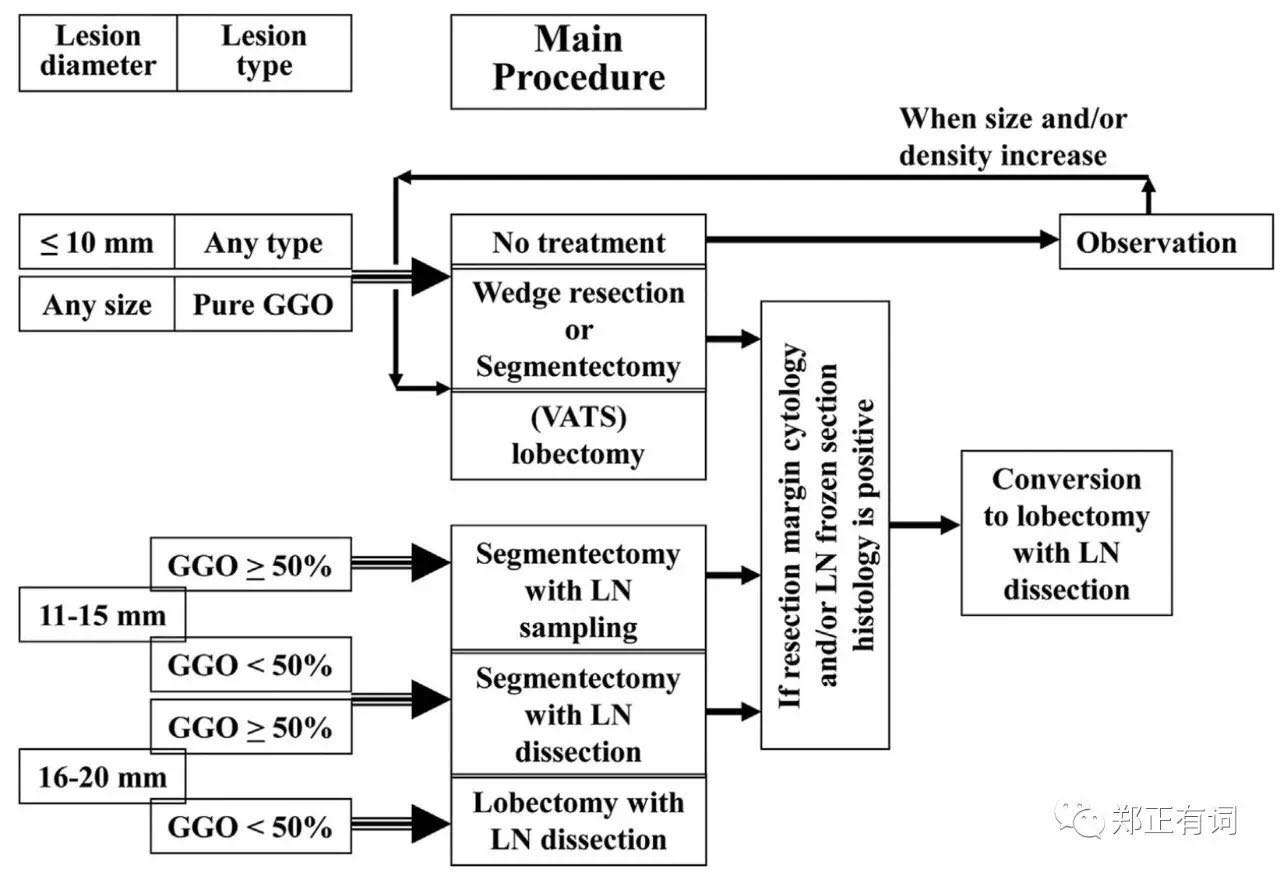
大阪国立医院肺部小结节治疗指南
为了屏蔽这种选择偏倚,作者以年龄、性别、结节大小、CT表现、实性成分比例、术前是否确诊这些因素进行匹配,最终得到69对临床资料相互匹配的段切和叶切患者。通过分析发现,两组患者在OS和DFS并无显著区别。
就目前而言,纯实性恶性结节往往表现出比混合实性更高的侵袭性,因此在该人群中寻找预后较好的人群开展段切除就显得十分有必要。而在腺癌各大分型中,贴壁生长为主型的预后最好。基于以上考虑,Hattori等学者开展回顾性研究,纳入200例临床IA期的纯实性肺腺癌,治疗方案为叶切/段切,所有患者接收术前PET/CT检查。研究发现,全组患者中,贴壁生长为主型腺癌有57例(29%),回归分析显示,PET SUVmax是该病理类型的唯一独立关联因素。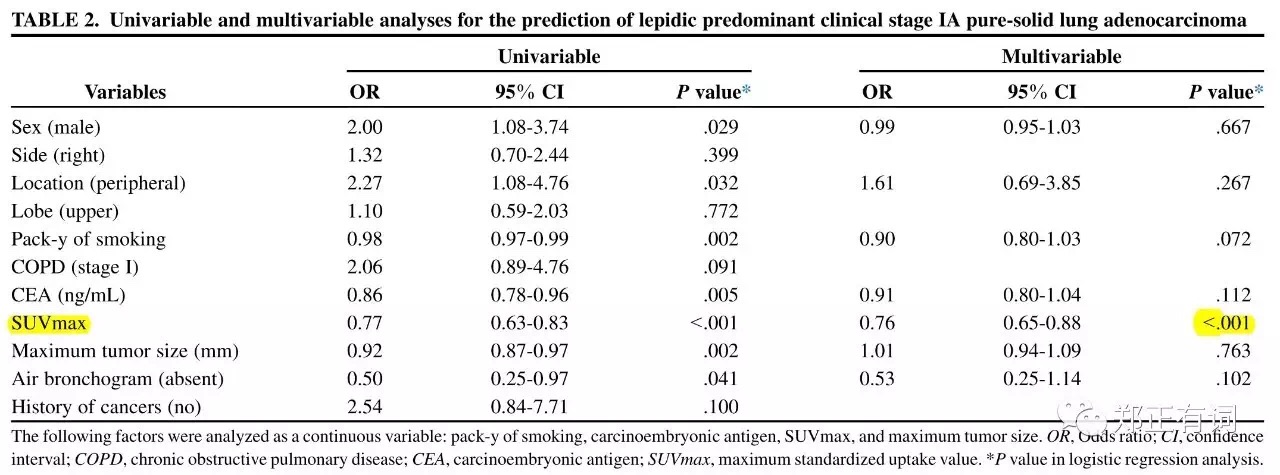
基于ROC曲线获得的切点,作者将SUVmax分为≤3.3和>3.3两组,分析指示,在SUVmax≤3.3的人群中,段切和叶切组患者预后无明显差异,而在SUVmax>3.3患者中,叶切人群预后要显著优于段切。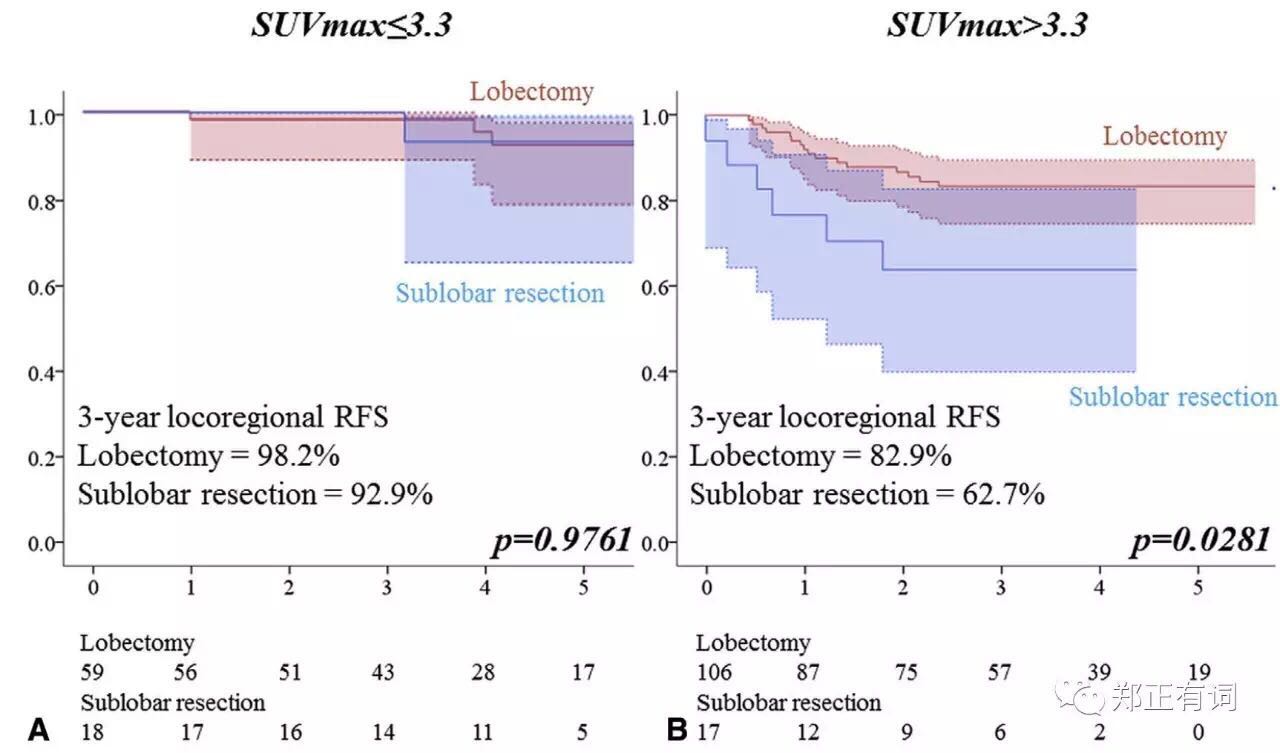
命题2:段切 vs 楔形
日本的Nishio等学者回顾性分析了237例接收段切/楔形的临床IA期 NSCLC患者,并基于影像学表现而得的结节实性成分百分比(C/T)而将入组病历分成两组。他们发现,在C/T<0.5的人群中,47例接收亚肺叶切除的患者(46段+1楔)中,均未见复发病历。
而在C/T>0.5亚组中,有190个患者。叶切72例,段切118例,两组的5-、10-年OS分别是93.0%、78.3%以及86.4%、70.0%(p=0.123);两组的5-、10-局部无复发生存率分别是90.3%、76.4%以及75.4%、61.8%(p=0.032)。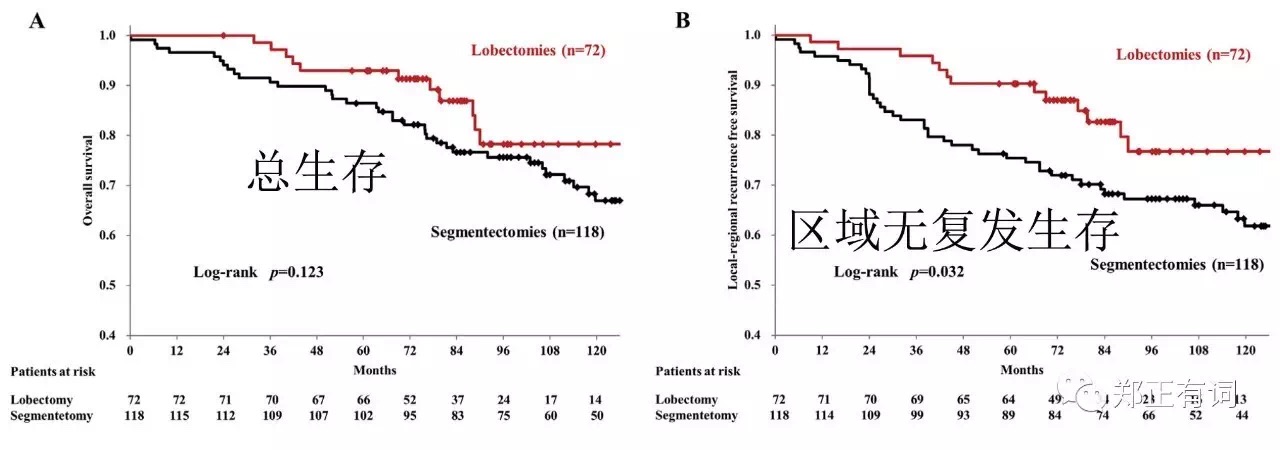
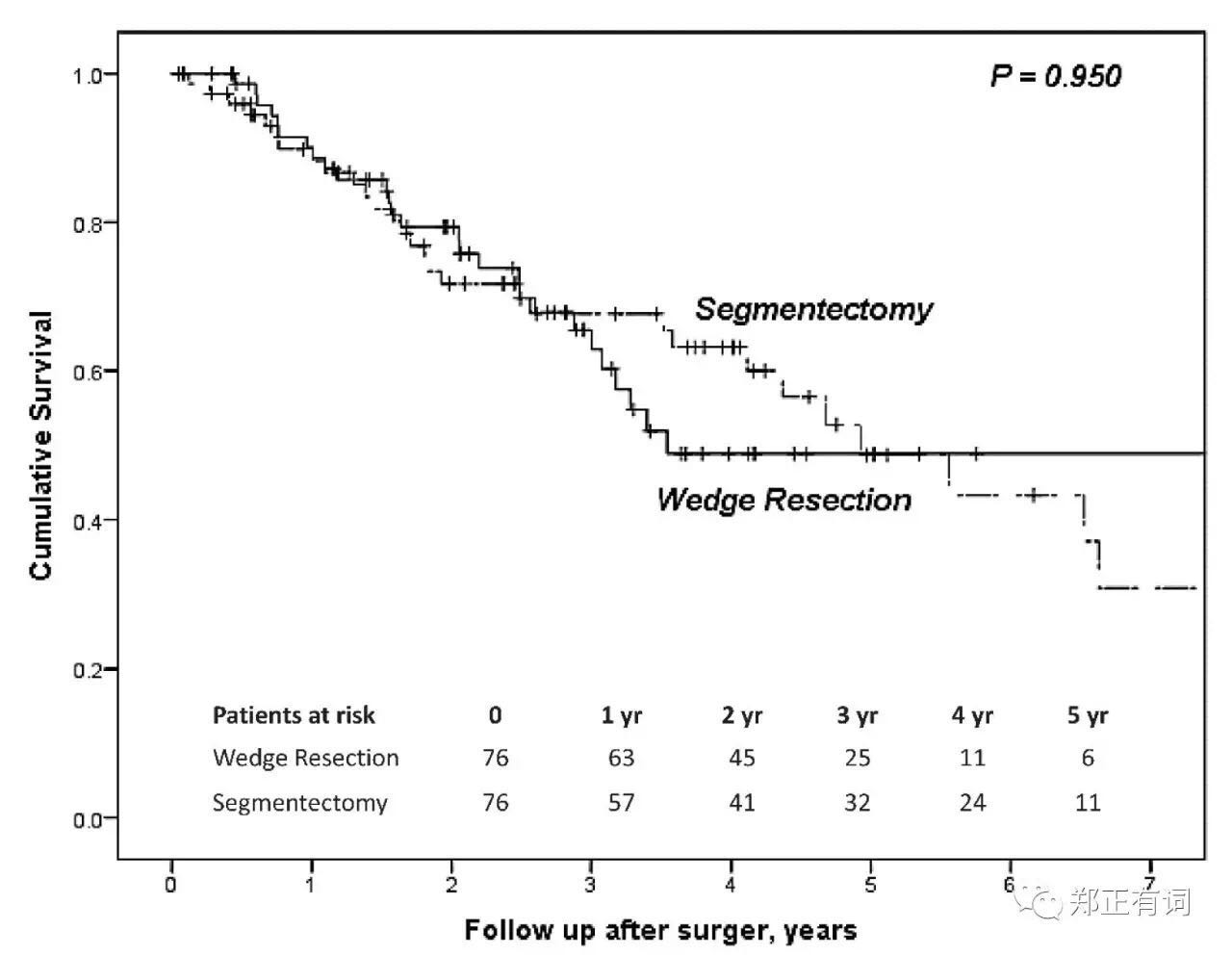
以性别、年龄、结节最大径、实性成分比例以及肿瘤部位进行PMS匹配,得到59对叶切和段切患者,两组的5-、10-年OS分别是94.8%、79.3%以及91.5%、74.9%(p=0.234);两组的5-、10-局部无复发生存率分别是91.5%、77.1%以及76.3%、67.2%(p=0.082)。相比楔形切除,段切除能够更加有效地延缓局部复发。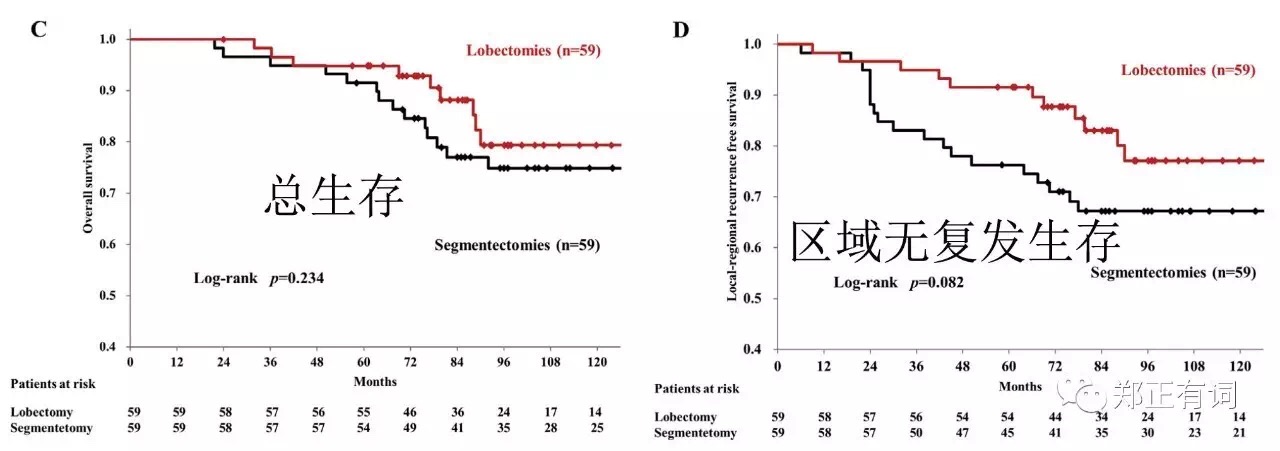 而在另一项研究中,Altorki等学者纳入了临床IA期 接收段切/楔形切除地NSCLC患者,排除了多原发/类癌/原位癌以及微小浸润性癌,讨论段切和楔形切除在侵袭性早期肺癌的治疗作用。最终纳入289名患者,其中楔形160例,肺段129例,发现段切除组患者切除淋巴结数目更多(7 vs 4,p<0.001)、且实现更充裕的切缘距离(1.5 vs 1.0,p=0.001)。但两组人群在复发率/转移率/3-、5-OS/DFS均无显著差异;而这一结果在PMS匹配后仍无明显改善。基于此,作者认为,尽管段切组可实现更彻底得淋巴结清扫,但在这个淋巴结转移率低下的人群中,并不能促成生存期的优势。
而在另一项研究中,Altorki等学者纳入了临床IA期 接收段切/楔形切除地NSCLC患者,排除了多原发/类癌/原位癌以及微小浸润性癌,讨论段切和楔形切除在侵袭性早期肺癌的治疗作用。最终纳入289名患者,其中楔形160例,肺段129例,发现段切除组患者切除淋巴结数目更多(7 vs 4,p<0.001)、且实现更充裕的切缘距离(1.5 vs 1.0,p=0.001)。但两组人群在复发率/转移率/3-、5-OS/DFS均无显著差异;而这一结果在PMS匹配后仍无明显改善。基于此,作者认为,尽管段切组可实现更彻底得淋巴结清扫,但在这个淋巴结转移率低下的人群中,并不能促成生存期的优势。
2. SEER数据库分析
2016、2017年度,基于SEER数据库发表的关于早期肺癌的相关研究一共有4篇,有基于肿瘤大小而进行的段切/叶切/楔形切除的预后比较(JCO,何建行教授)、有在>1cm而≤2cm腺癌进行的叶切/段切的预后比较(JTO,赵泽瑞)、有在浸润性腺癌/鳞癌人群中进行的段切/楔形的预后比较和在高龄人群中进行的段切/叶切的预后比较(Oncotarget,陈海泉教授)。不论哪项研究,均得到相同的结果,就是叶切是保证最佳抗肿瘤效果的重要保障,亚肺叶切除中,只有在<1cm人群中,段切才显示出对楔形切除的优越性。
从目前的证据来看,在某些患者中开展段切除确实可以实现"预后好、创伤小、恢复快"的三赢局面。但是如何进行选择,将是在很长时间内,需要持续面对、深入思考的问题。
肿瘤治疗走过了传统医学和循证医学,其数据来源也从单纯依靠个体经验走到了依靠群体经验。大数据时代的到来和个体化精准治疗理念的推广,或许能在未来的某一天真正地回答这些问题。
1. Churchill ED, Belsey R: Segmental Pneumonectomy In Bronchiectasis: The Lingula Segment Of the Left Upper Lobe. Ann Surg 1939, 109:481-499.
2. Echavarria MF, Cheng AM, Velez-Cubian FO, Ng EP, Moodie CC, Garrett JR, Fontaine JP, Robinson LA, Toloza EM: Comparison of pulmonary function tests and perioperative outcomes after robotic-assisted pulmonary lobectomy vs segmentectomy. Am J Surg 2016, 212:1175-1182.
3. Suzuki H, Morimoto J, Mizobuchi T, Fujiwara T, Nagato K, Nakajima T, Iwata T, Yoshida S, Yoshino I: Does segmentectomy really preserve the pulmonary function better than lobectomy for patients with early-stage lung cancer? Surg Today 2017, 47:463-469.
4. Koike T, Kitahara A, Sato S, Hashimoto T, Aoki T, Koike T, Yoshiya K, Toyabe S, Tsuchida M: Lobectomy Versus Segmentectomy in Radiologically Pure Solid Small-Sized Non-Small Cell Lung Cancer. Ann Thorac Surg 2016, 101:1354-1360.
5. Hattori A, Matsunaga T, Takamochi K, Oh S, Suzuki K: Indications for sublobar resection of clinical stage IA radiologic pure-solid lung adenocarcinoma. J Thorac Cardiovasc Surg 2017.
6. Kodama K, Higashiyama M, Okami J, Tokunaga T, Imamura F, Nakayama T, Inoue A, Kuriyama K: Oncologic Outcomes of Segmentectomy Versus Lobectomy for Clinical T1a N0 M0 Non-Small Cell Lung Cancer. Ann Thorac Surg 2016, 101:504-511.
7. Nishio W, Yoshimura M, Maniwa Y, Kitamura Y, Tane K, Takenaka D, Adachi S: Re-Assessment of Intentional Extended Segmentectomy for Clinical T1aN0 Non-Small Cell Lung Cancer. Ann Thorac Surg 2016, 102:1702-1710.
8. Altorki NK, Kamel MK, Narula N, Ghaly G, Nasar A, Rahouma M, Lee PC, Port JL, Stiles BM: Anatomical Segmentectomy and Wedge Resections Are Associated with Comparable Outcomes for Patients with Small cT1N0 Non-Small Cell Lung Cancer. J Thorac Oncol 2016, 11:1984-1992.
9. Zhao ZR, Situ DR, Lau RWH, Mok TSK, Chen GG, Underwood MJ, Ng CSH: Comparison of Segmentectomy and Lobectomy in Stage IA Adenocarcinomas. J Thorac Oncol 2017, 12:890-896.
10. Zhang Y, Yuan C, Zhang Y, Sun Y, Chen H: Survival following segmentectomy or lobectomy in elderly patients with early-stage lung cancer. Oncotarget 2016, 7:19081-19086.
11. DaiC, Shen J, Ren Y, Zhong S, Zheng H, He J, Xie D, Fei K, Liang W, Jiang G et al: Choice of Surgical Procedure forPatients With Non-Small-Cell Lung Cancer 1 to 2 cm AmongLobectomy, Segmentectomy, and Wedge Resection: A Population-Based Study. J ClinOncol 2016, 34:3175-3182.
12. Zhang Y, Sun Y, Chen H: A propensity score matching analysis of survival following segmentectomy or wedge resection in early-stage lung invasive adenocarcinoma or squamous cell carcinoma. Oncotarget 2016, 7:13880-13885.











 苏公网安备32059002004080号
苏公网安备32059002004080号


