
CGP与NSCLC 真实世界大数据
摘要号2514 构建和验证一个真实世界的NSCLC临床基因数据库,收集患者的临床特征,治疗,基因测序和预后信息
在临床肿瘤领域,基因检测有诊断,预后和预测价值。仅依靠临床试验,登记系统和审查机构的数据来进行人群研究是不够的,不仅成本高,且仅代表小众群体。如果能整合电子病历记录(EHR)和在临床实践中收集到的患者基因数据,有可能克服这些障碍。纳入Flatiron健康数据库中诊断为NSCLC,且进行了CGP(FMI)检测的患者。EHR的处理过程包括整合结构化的数据,并从非结构化的文档中提取重要信息。HER和CGP数据经过反识别处理,并与HIPAA兼容过程链接。收集的数据包括临床特征,>300个基因的变异状态,肿瘤突变符合(TMB),治疗及其相关的真实世界反应,进展和总生存。这一NSCLC队列(n=1619)的临床特征和基因特征与既往报道一致:中位年龄66岁,75%的患者有吸烟史,80%为非鳞癌,EGFR,ALK和ROS的变异率分别为18%,4%和1%。有驱动基因(EGFR, ALK, ROS1, MET, BRAF, RET, or ERBB2; n = 576)的患者多见于年轻,女性,非吸烟者,且患者的预后更好(35 vs 19m,LR p<0.0001);接受NCCN指南推荐方案治疗的患者,OS更长(42 vs 28m,LR p=0.001)。在仅接受EGFR,ALK,ROS1单个基因检测的患者,再行CGP发现有高达30%的患者为假阴性。CGP的准确性得到后续临床疗效的支持。例如,5例之前接受ALK检测阴性的患者,在CGP检测到ALK阳性后,接受ALK抑制剂治疗,HER记录中,患者至少都取得了PR的疗效。22%(n=353)的患者接受了免疫治疗。TMB可以预测nivolumab的疗效,包括PD-L1阴性的患者。本研究中,通路整合基因数据库和EHR临床信息,我们展现和确立了一种新型的,快速产生大型,研究级的,纵向的临床基因数据库。这一方法为我们理解肿瘤基因组学和促进精准医学发展提供了强有力的工具。
摘要号e20627 临床实践中采用FMI CGP或者其他基于NGS的产品进行分子检测的肺癌患者临床特征分析
随着二代测序技术的发展和数据分析的成熟,在常规临床实践中,相关检测如FMI开发的CGP已经在晚期肺癌的全面分子诊断中扮演重要角色,为肺癌患者的最佳治疗模式提供重要依据。本研究的目的在于使用真实世界的电子病例记录(EHR)数据库,对比接受FMI和其他类型分子诊断的晚期NSCLC患者特征。Flatiron平台收录了美国大型癌症诊所中每个患者的EHR。患者的纳入标准为:晚期NSCLC,从2011年1月1日开始,在Flatiron联网的癌症诊所中有≥2次门诊记录。分子诊断基于5个肺癌生物标志物:EGFR,ALK,KRAS,ROS1,PD-L1。根据患者接受分子诊断的方式分为3种:FMI,其他NGS和非NGS;分别记录患者在诊断为晚期NSCLC时的人口学和肿瘤特征以及治疗史。截至2016年9月30日,晚期NSCLC队列中纳入了30,489例患者,分为4组:FMI(n=1019),其他NGS(n=1327),非NGS(n=15205),没有检测(n=12938)。与预期一致,近年来接受FMI或其他NGS检测的患者数目持续增长。相比于其他分子检测组,FMI组的患者更为年轻(66 vs 68-69岁),多为非吸烟人群(25% vs. 17-19%),鳞癌居多(13% vs. 8-10%)。接受FMI检测的患者,30%为初治患者,而接受其他NGS和非NGS检测的初治患者比例分别为38%和53%。在接受FMI检测的1019例患者中,565例有FMI检测后的第一次治疗信息,24%(136例患者)接受了NCCN推荐的靶向治疗。FMI组患者中,528例(52%)接受了至少1次其他类型的分子检测:EGFR(89%),ALK (83%),ROS1(39%),KRAS(31%), PD-L1(18%);检测的类型为67%FISH,55%PCR,17%其他NGS,15%IHC。与接受其他分子检测的患者相比,FMI组患者的年龄,吸烟史,病理类型不同。这一分析基于大型真实世界的患者队列,分析接受FMI患者的特征,研究支持后续继续采用FMI开发的全面分子检测去发现少见驱动基因并接受最佳治疗。
摘要号6599 CGP vs 传统分子诊断用于晚期NSCLC基因检测的成本性价比
目前用于NSCLC的分子诊断方式包括单基因检测,少量基因套餐和CGP(检测所有类型的基因变异—碱基替换,拷贝数变化,插入/缺失和重排)。指南推荐应全面探寻NSCLC的分子特征,使其能有机会接受现有的靶向治疗或参加新药的临床研究。本研究旨在探寻对比传统分子诊断,采用CGP用于晚期NSCLC分子检测带来的获益和增加的成本。研究采用决策分析模型,评估CGP(FMI研发)应用比例的增加,对比传统分子检测对患者OS和美国商业健康计划预算的影响。预估患者OS延长1年,需要进行CGP检测的患者人数。模型的参数均来自目前已经发表的研究数据和真实世界数据。每200万人口中,估计532人会罹患晚期NSCLC,266人接受分子检测。CGP的应用比例从2%增加到10%(+21接受CGP),人群的OS可延长2年,每人每月(PMPM)的财政预算增加$0.018。增加的财政负担主要来源于治疗药物的变化,治疗时间的延长,生存的延长(累积$0.013PMPM),其余为CGP检测费用($0.005PMPM)。对比传统分子诊断,预估患者OS延长1年,大约需要11人进行CGP检测。本研究提示,对比传统分子诊断,增加CGP检测晚期NSCLC,可以延长患者的OS,且因此增加的财政预算较少,增加的支出主要来源于有效治疗药物的费用和患者生存的延长。
CGP探寻少见肺癌的分子治疗靶点
摘要号11595 ALK融合可见于非NSCLC外的多种其他类型肿瘤中,且对ALK抑制剂治疗有效
ALK基因融合是NSCLC的驱动基因,但其在除NSCLC以外的其他瘤种中的特征目前知之甚少。采用CGP检测了92784例临床晚期的恶性肿瘤,平均测序深度>600X。TMB根据最少1.1Mb的测序DNA计算。92784例患者中,17127(18.5%)为NSCLC,75657(81.5%)为非-NSCLC。697例(0.8%)患者检测到ALK融合,其中554例(79%)为NSCLC,143例(21%)为除-NSCLC以外的其他67种肿瘤:39例肉瘤(包括30例非-子宫和子宫平滑肌肉瘤,炎性肌纤维母细胞瘤);24例血液淋巴系统恶性肿瘤(包括非霍奇金淋巴瘤,骨髓瘤,组织细胞性恶性肿瘤);3例神经胶质瘤;2例间皮瘤;2例成神经细胞瘤;2例未分化恶性肿瘤;1例黑色素瘤。NSCLC中(3.2%),ALK融合的发生率显著高于非-NSCLC(P<0.0001)。相比于NSCLC中ALK阳性的患者,非-NSCLC中,ALK阳性的患者年龄更大(P<0.0001),女性更多见(P<0.0001)。与ALK融合配体中,NSCLC肺癌EML4更常见,占84%,而非-NSCLC中,EML4仅占31%(P<0.0001)。在非NSCLC中,较ALK阴性患者,ALK融合阳性患者的TMB显著更低(平均5.01 mutations/Mb,P=0.006)。会上还同时报道了ALK阳性的非NSCLC接受ALK抑制剂治疗的疗效。在非-NSCLC中,ALK融合罕见,中上皮性和间充质性恶性肿瘤中都可见。初步的临床支持,ALK抑制剂用于ALK融合的非NSCLC中同样有效。
摘要号9072 发现晚期非小细胞肺癌新的治疗靶点--BRAF融合
除突变外,BRAF基因还可发生断裂重排,形成新的融合基因。BRAF融合的发生率低于BRAF V600突变。目前,BRAF融合是Spitzoid型黑色素瘤和其他实体瘤的新兴治疗靶点。在NSCLC中,BRAF的融合发生率较低,小样本量的研究提示其发生率约为1-2%。 研究采用全面基因组测序(CGP)检测了17,128例NSCLC肿瘤标本。在42例(0.2%)NSCLC患者中检测到BRAF融合。检测患者的中位年龄为67岁(范围:44-93岁)。在BRAF阳性的患者中,55%为女性。检测肿瘤标本,48%为原发灶,52%为转移灶。最常见的融合配体为AGK,DOCK4和TRIM24。同时发现了大量新的BRAF融合基因型。与BRAF融合基因共存的常见驱动基因有TP53(67%),CDKN2A(31%),EGFR(29%)和CDKN2B(26%)。在BRAF融合队列中,3例(3/42,7%)患者的肿瘤突变负荷(TMB)>20 mut/Mb,但总体的TMB较低(中位数为3.8 mut/Mb)。在BRAF融合驱动的NSCLC患者中,10例(24%)患者同时检测到EGFR短片段的变异。其中2例患者同时有BRAF融合和EGFR 19del和T790M突变。会议上同时还报道了BRAF融合型NSCLC患者,接受BRAF和MEK抑制剂治疗后,疗效显著。这一研究结果提示,BRAF融合在NSCLC的发生率较低,可能与EGFR突变型患者接受EGFR-TKI治疗的获得性耐药有关。基于研究中的病例报道结果,有必要进行进一步的前瞻性研究,进一步验证MEK抑制剂用于这类患者的疗效。这一研究提示BRAF融合有望成为NSCLC新的治疗靶点,为NSCLC的个体化治疗再添新武器。
摘要号11621 肺大细胞神经内分泌癌中的BRAF突变分析
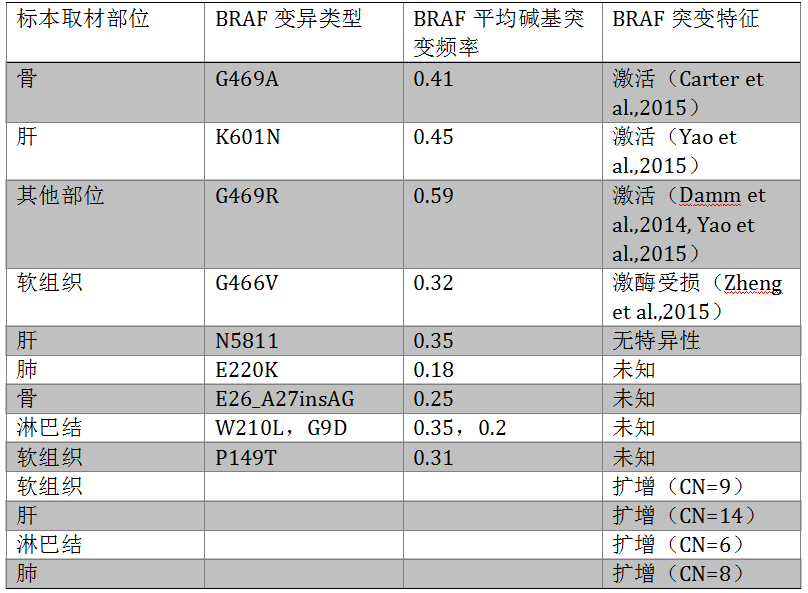
肺大细胞神经内分泌癌(L-LCNEC)虽然属于NSCLC,但其肿瘤方案同SCLC。本研究中我们关注L-LCNEC中BRAF突变。采用CGP检测300例组织确诊为L-LCNEC。肿瘤组织标本来自肺的原发灶或转移灶。在13例患者中检测到14个独特的BRAF变异(扩增或突变),汇总见下表1。其中 1例69岁的L-LCNEC患者,对依托泊苷顺铂耐药,检测到BRAF 非-V600E突变(G469R),接受了BRAF抑制剂治疗后,疗效显著,且患者外周血ctDNA突变监测也进一步验证了患者的疗效(外周血克隆碱基突变频率从基线时接近50%,治疗后检测不到),这一患者验证了驱动基因靶向治疗的重要性。虽然L-LCNEC是一类罕见肿瘤,但其也可能存在活化突变,可以接受靶向治疗。这一研究提示了对这类患者进行CGP的重要性。
表1. BRAF突变类型和特征
摘要号8517 CGP检测对比肺大细胞神经内分泌癌(L-LCNEC)和SCLC的基因变异和TMB(CGP)
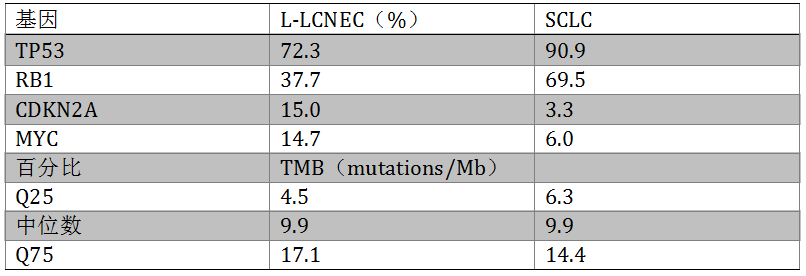
SCLC和L-LCNEC都是侵袭性很强的肿瘤,与吸烟史有关,两者在临床,组织学和基因特征上有重叠。我们在1187例患者中比较了两者基因学上的相似性。采用CGP检测了300例L-LCNEC和887例SCLC。两者中都可见的常见变异基因包括TP53,RB1,MYC/MYCL1,MLL2,LRP1B和PTEN;突变频率有一些差异(见表2)。在两种肿瘤中,RB1突变与TP53突变显著共存(p<0.001),但与STK11和CDKN2A互斥(p<0.001)。在L-LCNEC中,RB1与KRAS突变互斥,但SCLC中,两者不互相排斥。SCLC和L-LCNEC中TMB的四分位间距分别位7.9和12.6,75%百分位分别位14.4和17.1。会议上还报道了两种肿瘤中分别接受相应靶向药物和免疫治疗(尤其是TMB高的患者)的疗效变化。考虑到L-LCNEC独特的基因突变谱和临床特征,可根据其基因特征进一步分为SCLC样(TP53/RB1突变)和NSCLC-样(两者或任意基因为野生型)。与NSCLC和黑色素瘤类似,仅TMB高的患者可能从免疫治疗中获益。
表2. L-LCNEC和SCLC的基因突变频率
CGP检测在临床的应用
摘要号9010 ALK阳性NSCLC患者中,EML4-ALK不同变体(V3 vs非V3)的耐药突变比较
ALK重排是NSCLC的重要驱动基因。目前的研究提示EML4-ALK的不同变体接受ALK抑制剂治疗的PFS存在差异。研究采用FMI开发的CGP检测了临床实践中收集的634例ALK+NSCLC的组织标本。共704个肿瘤标本,其中676个为组织标本,28个外周血标本。634例ALK+患者的变体类型如下:EML4-ALK v1 (E13; A20) 200例 (32%),EML4-ALK v2 (E20; A20) 50例 (8%), EML4-ALK v3 (E6; A20) 204例(32%),其他EML4-ALK 变体78例(12%),非EML4-ALK 重排102例 (16%)。尽管这一数据集中,EML4-ALK v1和v3的比例相当,相比于v1,检测到已知ALK耐药突变的患者(n=40)与v3显著相关(P < 0.0002)。相比于v1,G1202R突变与EML4-ALK v3显著相关(P < 0.002);与其他非v3相比,亦有统计学差异(P=0.02)。不同变体的耐药突变总结如下表3。患者总体的TMB较低(中位数,v1: 1.8,v3: 2.5,非-v3: 1.8 mutations/Mb),尽管3组直接也有统计学意义(v1 vs v3,p=0.0008;v3 vs 非-v3,p=0.003),但这一差异可能没有临床意义。对有治疗前后肿瘤组织的患者,不仅检测了ALK融合变体,还检测了非ALK机制的获得性耐药机制,如在1例ALK靶向治疗进展后的患者中检测到MET激酶区的扩增。这一研究提示,采用NGS检测肿瘤组织或外周血标本,不仅可以检测ALK融合配体,增加我们对ALK+NSCLC分子生物的了解,还能发现潜在的耐药机制,从而指导后续ALK抑制剂的选择。
表3. 不同变体中耐药突变的发生率
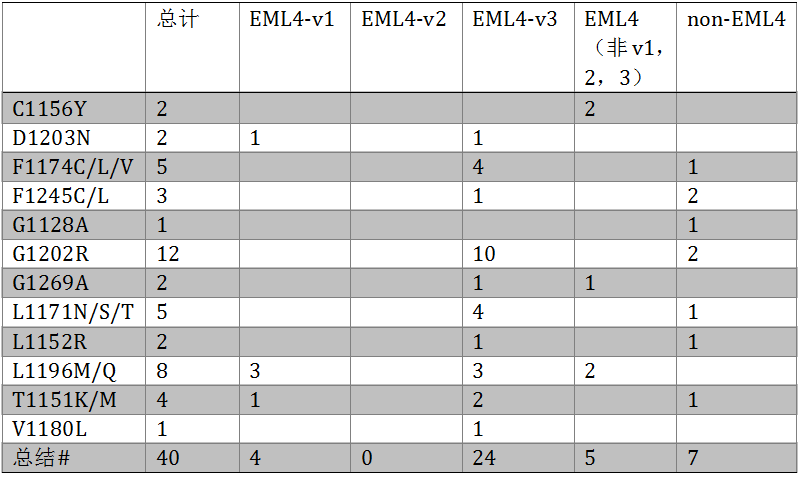
#8例患者有≥2个耐药突变;v:变体。
摘要号9025 采用多基因检测试剂盒探寻晚期NSCLC ctDNA的突变谱
目前,组织活检仍是晚期NSCLC基因检测的金标准,ctDNA检测可以作为补充。研究采用FMI开发的液体活检多基因检测套餐(可检测62个基因)连续检测了1019例NSCLC患者的ctDNA。每个检测样本均采用最大体细胞等位基因突变丰度(MSAF)估计外周血是否有ctDNA的片段。入组患者的中位年龄69岁(范围8-94);54%为女性。组织学类型包括:腺癌(n=720),NSCLC-未定型(NSCLC NOS;n=179),鳞癌(n=57),LC NOS(n=51),大细胞癌(n=6),肉瘤样癌(n=6)。总人群中,检测到≥1个基因变异(GA)的患者占71%;MSAF>0的患者中,83%的患者有≥1个GA。共22例患者有配对组织和血浆样本,要求两种标本的采集时间相差不到1个月,且血浆标本中ctDNA的MSAF>0:在组织标本中共检测到64个GA,其中33个(52%)在ctDNA中也同时检测到。在55例组织标本无法进行基因检测的患者中,采用ctDNA检测,有43例(78%)患者检测到≥1个GA。在856例MSAF>0的患者中,平均每个样本有1.8个GA。最常见的GA包括:TP53(57%),EGFR(23%)和KRAS(17%)。与基于组织检测的FMI基因数据库(n=19264)比较,多数基因的变异丰度相似,KRAS(组织突变丰度更高 27% vs 17%,P<0.0001)和T790M(ctDNA突变率更高7% vs 2%,P<0.0001)例外。这提示靶向耐药后液体活检可能更优。5%(39/856)的患者中检测到激酶融合(ALK,ROS1,RET,FGFR3,PDGFRA)。在ctDNA中还检测到多种获得性耐药突变,且发现了一些新的耐药机制:如克唑替尼耐药后的ctDNA中发现MET Y1230C和EGFR扩增,EGFR抑制剂耐药患者中,检测到FGFR3-TACC3融合,奥希替尼耐药后检测到多个EGFR 获得性耐药突变。这一研究显示,采用经过确认的捕获方法发现84%的外周血标本中存在ctDNA。提示在部分NSCLC中,可以采用液体活检补充组织活检,指导临床治疗。
总结
上述汇总了2017年ASCO会议上,肺癌基因测序研究的进展。二代测序已经逐步从科研走上临床。采用FMI开发的CGP进行大规模的肺癌样本测序,不仅可以构建真实世界的临床基因数据库,为后续研究特供重要依据;而且CGP在临床的应用还可以挖掘新的治疗靶点,让更多患者有机会接受靶向治疗,最终延长患者的总生存。此外,对于少见类型的肺癌,目前有效的治疗方案较少,患者预后差。对这类患者进行CGP检测,可以发现有意义的基因变异,还能检测TMB,探索免疫治疗的可能。另外,CGP在组织中和ctDNA中都可以探索新的耐药机制,液体活检补充组织检测,为临床提供有价值的信息。
专家点评
非小细胞肺癌的治疗是肿瘤精准治疗的典范,这得益于我们对NSCLC基因特征的认识。除EGFR,ALK,ROS1等常见治疗靶点外,NSCLC新的驱动基因发生频率均较低(<2%),如RET融合,BRAF突变等。靶向治疗时代,使得驱动基因阳性晚期NSCLC的中位总生存从过去的10个月延长到39个月。当下,我们该如何进一步优化肺癌的治疗呢?第一,靶向治疗的优化:明确靶向耐药机制,开发新一代的抑制剂克服耐药;第二,治疗靶点的拓展:探寻新的更多的治疗靶点,让更多的患者有机会接受靶向治疗;第三,免疫治疗的合理应用:发掘免疫治疗的真正优势人群,如TMB高的患者。以上种种均离不开基因检测。全面基因组测序(CGP)是可能在未来发挥一定作用。同时,优化现有的测序技术,探寻更多可以替代组织的生物材料,如血浆,尿液等,让更多患者有机会进行测序。上述的研究探索,为未来指明了研究方向:如真实世界临床基因数据库的构建,可以实现临床特征和基因特征有效的联结,提高测序和基因分析的效率;对少见类型肺癌的基因组学研究,探寻新的治疗靶点,颠覆传统治疗;耐药后的再检测指导后续用药;ctDNA的检测补充组织检测等。











 苏公网安备32059002004080号
苏公网安备32059002004080号


