编译: 龙猫
来源:肿瘤资讯
在过去十几年间,成人ALL的预后得到显著改善,这主要是因为使用了更有效的化疗,其治疗效果类似于在儿童ALL的治疗效果和异基因造血干细胞移植。部分ALL亚型的生物学特征为靶向治疗提供了可能性,尽管目前酪氨酸激酶抑制剂已应用于费城染色体阳性的ALL,但最有前景的新方法之一是靶向ALL原始细胞表达的表面抗原CD19,CD20,CD22,CD33和CD52的单克隆抗体。在B细胞性非霍奇金淋巴瘤及伯基特成熟B细胞淋巴瘤或白血病患者,抗CD20的单克隆抗体利妥昔单抗的使用能有效提高患者预后。
尽管大部分B细胞表达CD20抗原,但仅有30%-50%的B细胞前体ALL原始细胞表达CD20抗原。作者团队和其他研究者发现成人B细胞前体ALL中CD20表达与预后不良相关,提示可以在化疗中加入利妥昔单抗联合治疗。一些单组研究已经证实化疗联合利妥昔单抗能够改善部分患者结局,为证实这一可能的效果,作者团队进行了一个多中心、随机对照实验评估化疗联合利妥昔单抗治疗Ph阴性、CD20阳性的B细胞性ALL的效果。
研究设计
实验(GRAALL-2005)于2006年-2014年进行,包括56个法国中心和9个瑞士中心。在诱导和后期强化期间随机评价Hyper-环磷酰胺和利妥昔单抗在CD20+ B细胞前体ALL的应用效果。加用利妥昔单抗的研究命名为GRAALL-2005/R。
研究人群
18-59岁,Ph阴性、CD20阳性的B细胞前体ALL,排除伯基特成熟B细胞淋巴瘤或白血病。共220位患者随机分为使用利妥昔单抗组和对照组,除去不符合条件的9例患者(5例Ph阳性、3例CD20-、1例人类免疫缺陷病毒感染)和2例失访患者,剩余104例患者利妥昔单抗组105人,对照组104人。
治疗及流程
利妥昔单抗方法:静脉灌注,350mg/m2/day,诱导阶段,第1天和第7天;需要时可行挽救性再诱导,第1天和第7天;巩固治疗,第1、3、4、6天;强化治疗,第1天和第7天;后期巩固治疗,第7天和第9天;维持治疗,6次;整个治疗期间一共使用利妥昔单抗16-18次。
数据分析
主要终点是无事件生存期,事件包括诱导失败、复发、死亡;次要终点是血液学缓解、初次缓解期间累积复发发生率和累积死亡发生率、总生存期、安全性。缓解率由Fisher精确检验进行比较;时间数据的事件,除了累积发生率,分别用Kaplan-Meier法估算和通过对数秩检验进行组间比较,在 Cox模型基础上的估算风险比和95%置信区间。
结果
病人特点
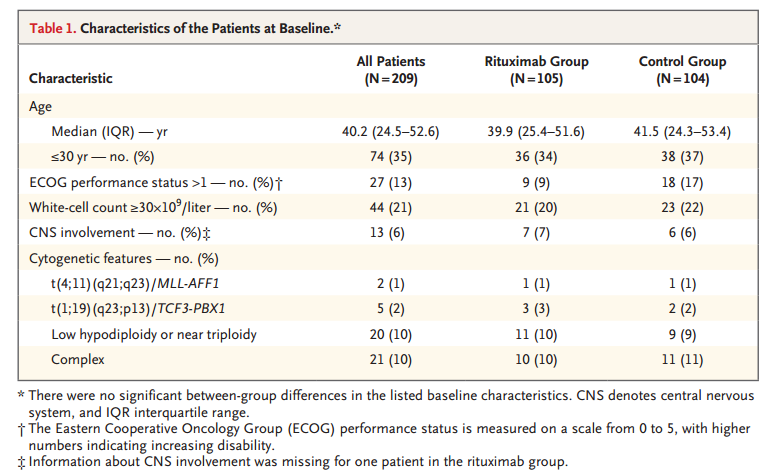
治疗前两组患者临床病理特征平衡(表1),CD20阳性原始细胞中位百分比为66%(范围为20至100),并且百分数均匀地分布在各组之间。
结局
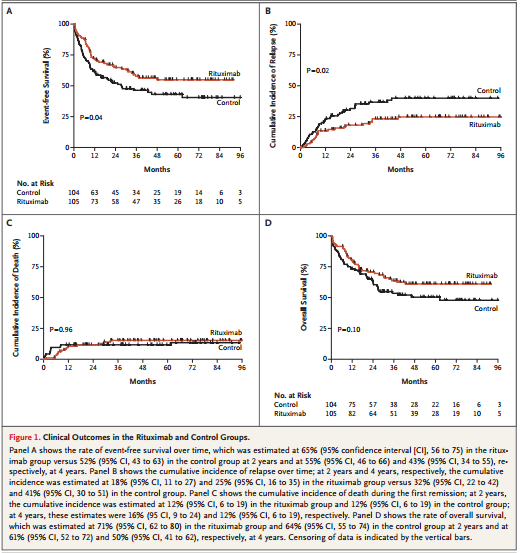
截至2015年6月1日,经过30个月的中位随访,共有101例(48%)出现至少一个事件:利妥昔单抗组44例(42%)和对照组57例(55%)。17例诱导失败(利妥昔单抗组8例和对照组9例),57例复发(利妥昔单抗组22例和对照组35例),27例在缓解期间死亡(利妥昔单抗组14例和对照组13例)。
利妥昔单抗组患者无事件生存期比对照组长(图1A, HR: 0.66; 95% CI: 0.45-0.98; P = 0.04)。无事件生存率的差异主要是由于利妥昔单抗组复发率低(图1B, SDH: 0.52; 95% CI: 0.31-0.89; P =0.02);相反,在初次缓解期间两组累积死亡率相似(图1C , SDH: 0.98; 95% CI: 0.45-2.12; P =0.96)。无事件生存率的获益并没有转化为显著的总生存期延长(图1D , HR: 0.70; 95% CI: 0.46-1.07; P =0.10)。
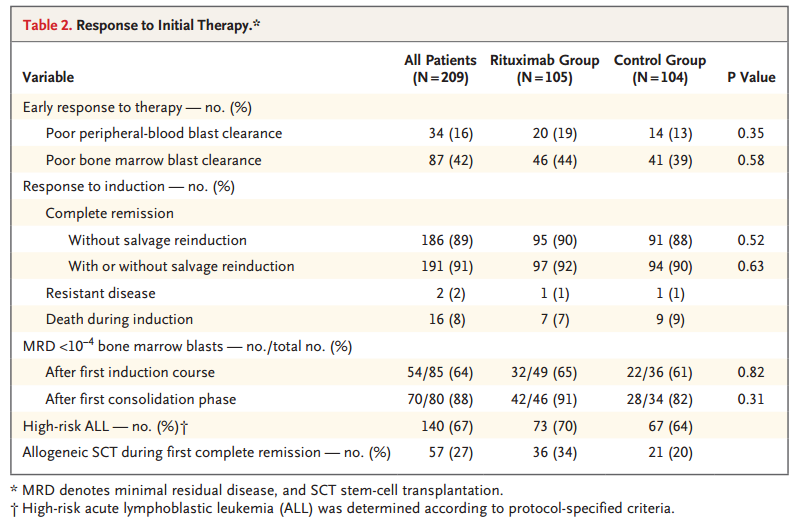
早期外周血和骨髓原始细胞清除在两组间没有显著差异。诱导或再诱导后,对照组CR 90%(10494例),利妥昔单抗组CR 92%(10597例)。在第一阶段诱导和巩固治疗后,对照组85例患者存在微小残留病灶(41%),利妥昔单抗组80例(38%)。第一阶段诱导结束后,利妥昔单抗组中患者微小残留病变的水平低于10-4(即10,000个正常细胞中骨髓原始细胞<1个)的占65%,对照组为61%;第一阶段巩固治疗结束后利妥昔单抗组达到91%而对照组为82%,见表2。
总体而言,两组中可以进行异基因移植的高风险患者比例相似。但在初次缓解期间利妥昔单抗组接受移植的患者比对照组多(34% vs 20%, 表2)。对照组中接受移植的21例患者,6例复发和5例死亡,其中2例死亡是在缓解期间发生的。利妥昔单抗组中接受移植36名患者有5例复发和14例死亡,缓解期间发生的死亡为9例;尽管如此,事后分析发现利妥昔单抗组的无事件生存期和总生存期仍旧比对照组的长(HR: 0.59; 95% CI: 0.37-0.93; P = 0.02和HR 0.55; 95% CI: 0.34-0.91; P = 0.02)。利妥昔单抗组复发率低(SDH: 0.49; 95% CI: 0.27-0.89; P = 0.02),初次缓解期间两组的累积死亡发生率相似(SDH: 0.79; 95% CI: 0.43-0.47; P = 0.46)。
预后因素和亚组分析
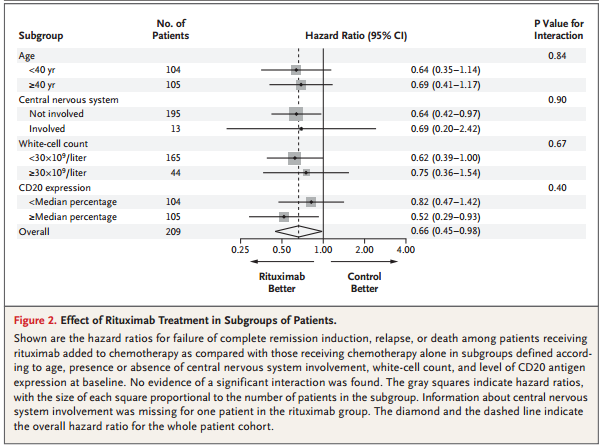
除了随机分配到对照组外,高龄、中枢神经系统受累、诊断时白细胞计数较高是无事件生存期短的影响因素。将利妥昔单抗组患者根据年龄、是否中枢神经系统受累、白细胞计数、CD20表达水平进行亚组分组,事后分析显示没有治疗-亚组交互作用,虽然没有统计学意义,但在高表达CD20的患者中利妥昔单抗有更明显的作用,见表2。
持续应用利妥昔单抗治疗的效果与安全性
在连续治疗阶段,接受利妥昔单抗计划治疗病人百分比:诱导阶段94%(99/105);强化治疗第1天84%(77/92);强化治疗第3天77%(71/92);强化治疗第4天88%(70/80);强化治疗第6天80%(56/70);强化治疗第7天76% (35/46);强化治疗第9天79%((34/43)。
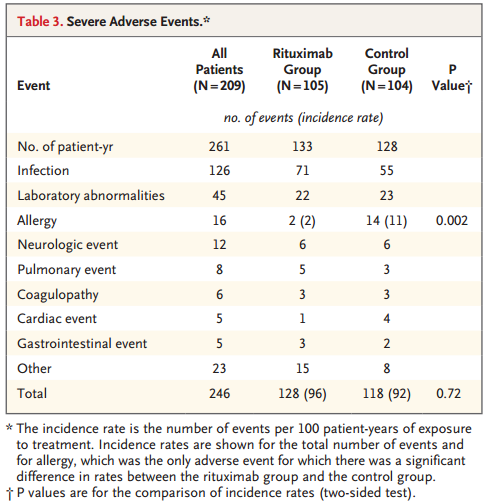
总体上,124例患者出现246例严重不良事件,两组间严重不良事件的总发生率无显著差异(表3)。虽然利妥昔单抗组的感染事件稍频繁,但无统计学差异。16例严重过敏事件中,只有2例为利妥昔单抗组(P = 0.002)。所有的含门冬酰胺酶治疗阶段均单独分析,这个副作用并未显著影响门冬酰胺酶治疗,至少坚持使用到后期强化治疗结束。然而,相比利妥昔单抗组,对照组在治疗过程中有更多的患者因为天然大肠杆菌门冬酰胺酶临床过敏反应转变为门冬酰胺酶的欧文氏菌形式。
讨论
本研究结果显示在标准化疗方案中加入利妥昔单抗有效提高成人CD20阳性ALL的无事件生存期,这主要是因为在初次缓解期间患者的累积复发率降低、毒副作用或累积死亡率无明显增加。虽然利妥昔单抗组比对照组接受异基因干细胞移植的病人多,但复发减少和无事件生存期的提高并不能解释为受益于移植,主要原因有以下三方面:首先,移植过程中死亡的患者多数为利妥昔单抗小组;第二,通过灵敏度分析发现复发率减少和无事件生存率及总生存率提高依旧是接受移植的患者较为显著。最后,调整为移植后的时间相关协变量分析也发现利妥昔单抗的治疗效果。
利妥昔单抗对高表达CD20的白血病原始细胞有更好的治疗作用,这说明利妥昔单抗通过结合到白血病细胞发挥直接作用。然而其间接作用是通过两组对比意外发现的,对比发现利妥昔单抗组患者出现门冬酰胺酶过敏反应的比较少,这说明在治疗过程中,接受利妥昔单抗治疗的患者可能有更高门冬酰胺酶累积剂量。利妥昔单抗的这种保护作用可能与清除正常B细胞抑制抗门冬酰胺酶的抗体产生有关,至少在理论上是这样的,而且这些抗体参与过敏反应是已知。然而,在大部分包含门冬酰胺酶的治疗阶段,两组研究并不支持这一假设。人们可能仍然认为利妥昔单抗组出现无症状的抗门冬酰胺酶抗体几率更低,这可能会减弱门冬酰胺酶治疗的效果。
本研究整个治疗过程中利妥昔单抗一共使用16-18次;这一方案主要是基于以往利妥昔单抗治疗非霍奇金淋巴瘤的经验性方案,在M.D安德森癌症中心的单组研究中,利妥昔单抗使用了相同剂量但一共使用了12次,进一步研究有助于制定更合理的方案。在本研究中,重复使用利妥昔单抗降低复发率而不影响CR或微小残留病变的CR。因此,长期应用利妥昔单抗可能发挥我们所观察到的好的治疗效果。
另一个未解问题是,是否化疗中加入利妥昔单抗的化疗对CD20的表达水平低于20%的患者也有益。本研究以20%作为划分点,有32%的Ph阴性B细胞前体ALL患者为CD20阳性;M.D安德森癌症中心的研究中也以20%作为划分点,CD20阳性患者占47%,但所有患者中将近20%为Ph阳性的ALL患者,且Ph阳性ALL患者中CD20阳性比例稍高。一些研究指出利妥昔单抗可能对CD20表达低于20%的患者也有效,Thomas的研究以10%作为划分点,结果也有显著的预后价值。另一发现是,诱导化疗阶段,被划分为CD20阴性的ALL原始细胞CD20表达上调。因此,在CD20表达基准线以下的患者,使用较高亲和性的抗CD20抗体,比如obinutuzumab 和 ofatumumab,可能是一个更好的替代方案。
尽管本研究在次要终点和事后分析上存在局限性,但研究结果证实了化疗联合利妥昔单抗治疗CD20阳性、Ph阴性的B细胞前体ALL的有益效果。ALL原始细胞表达的其他表面抗原,如CD19或CD22,也可能通过各种抗体或嵌合抗原受体的T细胞靶向治疗,这已在复发或难治性ALL患者显示了治疗效果。
版权属良医汇肿瘤资讯App所有。欢迎个人转发分享。其他任何媒体、网站如需转载或引用本网版权所有内容须获得授权且在醒目位置处注明“转自:良医汇肿瘤资讯App”
责任编辑:Lilith
欲了解更多血液肿瘤、淋巴瘤相关资讯,与全国各地血液肿瘤、淋巴瘤医生交流与讨论,请扫描以下二维码,添加肿瘤资讯小助手-Dinna微信,备注“血液肿瘤”!
参考文献
Maury S, Chevret S, Thomas X, Heim D, Leguay T et al. Rituximab in B-Lineage Adult Acute Lymphoblastic Leukemia. N Engl J Med. 2016 Sep 15;375(11):1044-53.















 苏公网安备32059002004080号
苏公网安备32059002004080号


