2025年接近尾声,各大会议陆续公布了众多肺癌领域的相关研究进展,【肿瘤资讯】整理其中较为重要的研究数据,从驱动基因阳性、驱动基因阴性、小细胞肺癌三个维度进行梳理,以飨读者。本文重点聚焦“驱动基因阴性”领域的重要进展。
早期及围手术期非小细胞肺癌(NSCLC)患者的治疗
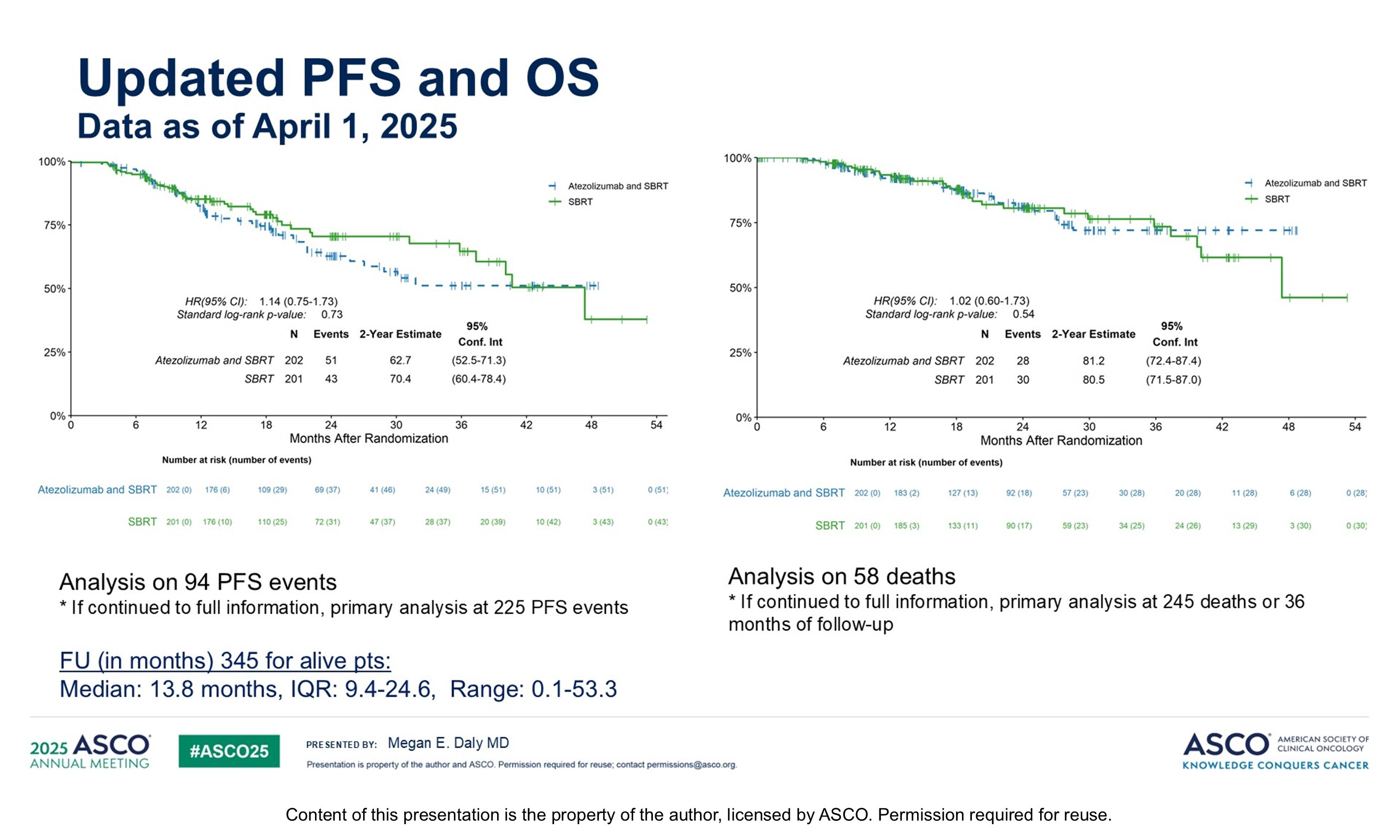
SBRT±阿替利珠单抗在早期NSCLC患者中的疗效及安全性:SWOG S1914研究(2025 ASCO)
既往一项II期随机对照临床研究发现,对于早期不可手术切除NSCLC患者,在SBRT治疗的基础上进一步联合纳武利尤单抗可以给患者带来额外生存获益。该研究旨在通过更大样本的III期随机对照临床研究来验证这一假设。
研究纳入1-3期不可手术切除的早期NSCLC患者,按1:1的比例随机分为单纯放疗(7.5~18Gy,隔天一次,共计3~8次)或在此基础上联合6个月的标准剂量阿替利珠单抗治疗。主要研究终点为OS。研究发现,给予免疫治疗后,不仅未能给患者带来额外的生存获益,反而导致生存时间缩短,与既往研究结果并不一致,最终研究被提前终止。首次数据分析时, 全组中位随访时间为9.9个月,两组2年PFS率分别为51.8%和68.6%,2年OS率分别为77.8%和81.5%,基于无效性分析规则,研究提前终止。更新13.8个月随访时间的研究数据显示,两组2年的PFS率分别为62.7%和70.4%,2年OS率分别为81.2%和80.5%。
与此同时,在相似的人群、相似的研究设计,给予帕博利珠单抗17个周期治疗的III期KEYNOTE-867研究同样是阴性结果,基于其无效性期中分析,研究同样被提前关闭,帕博利珠单抗未能改善这部分患者的EFS和OS,且增加了毒性。
CheckMate-816研究5年随访数据(2025 ASCO)
III期CheckMate-816研究在I-III期NSCLC患者中探索了,在标准含铂双药化疗基础上进一步联合纳武利尤单抗新辅助治疗的疗效及安全性。首次数据公布时,两组pCR分别为24.0%和2.2%,EFS的HR=0.63,本次更新了其5年随访数据并同步发表于《新英格兰医学杂志》。研究纳入Ib-III期NSCLC患者,按1:1的比例随机分为3周期含铂双药化疗,或在此基础上联合360mg,静脉,每3周一次的纳武利尤单抗治疗,随后进行手术,术后不进行免疫维持治疗。
5年数据分析时,两组中位OS分别为未达到和73.7个月,HR=0.72,P=0.0479,5年OS率分别为65%和55%。
Ib-II期以及III期患者OS的HR分别为0.77和0.70,PD-L1<1%和≥1%的患者,OS的HR分别为0.89和0.51。两组中位EFS分别为59.6个月和21.1个月,HR=0.68;5年EFS率分别为49%和34%。探索性分析发现,新辅助治疗后出现完全病理缓解的患者,OS更好。联合治疗组,出现pCR和未出现pCR的患者,5年OS率分别为95%和56%,5年EFS率分别为88%和35%。
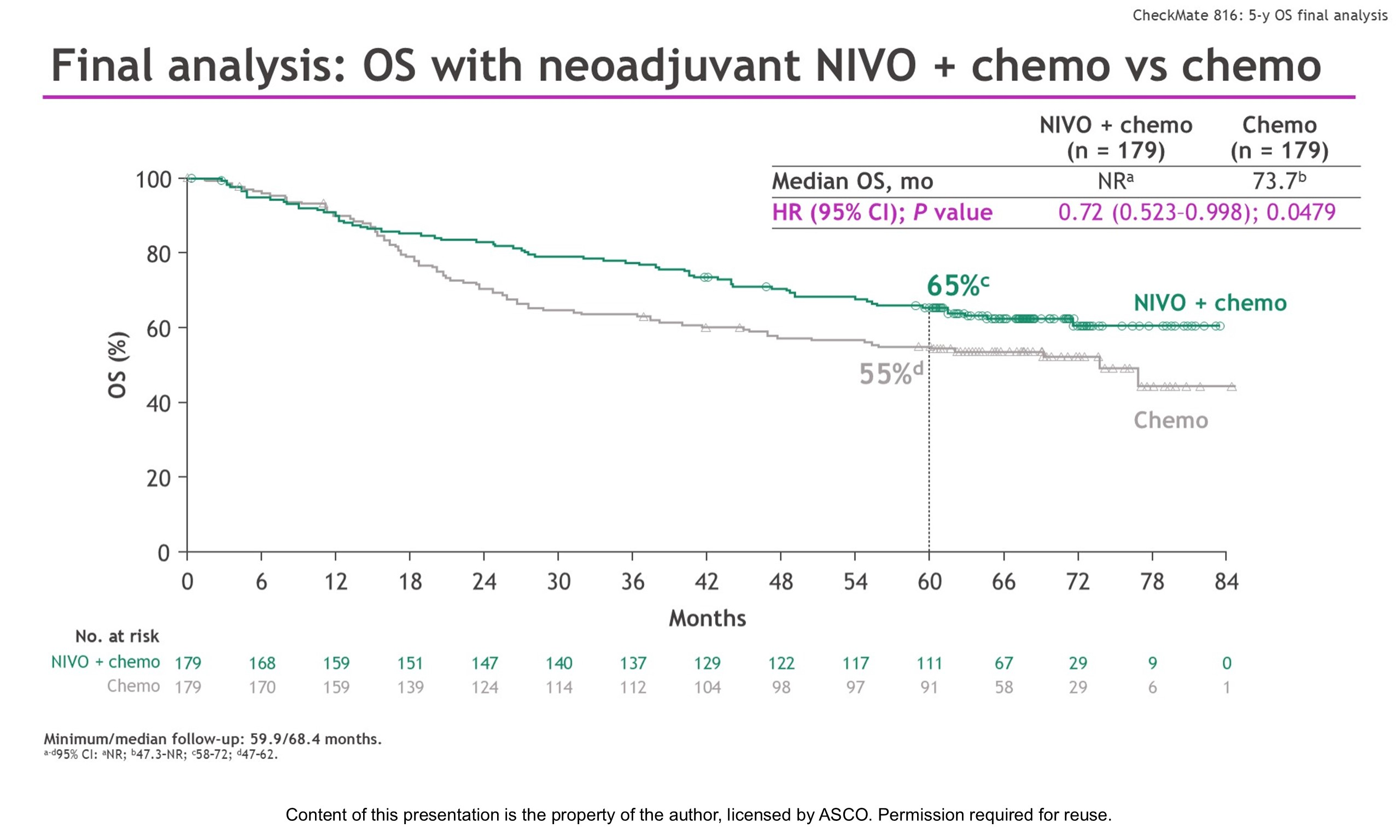
CheckMate-816研究的OS数据
CheckMate77T研究更新数据2025 (ASCO)
该研究同样探索了纳武利尤单抗联合含铂双药化疗新辅助治I-III期NSCLC患者的疗效及安全性。但与CheckMate-816研究不同的是,该研究允许患者手术后接受1年的免疫检查的抑制剂维持治疗。
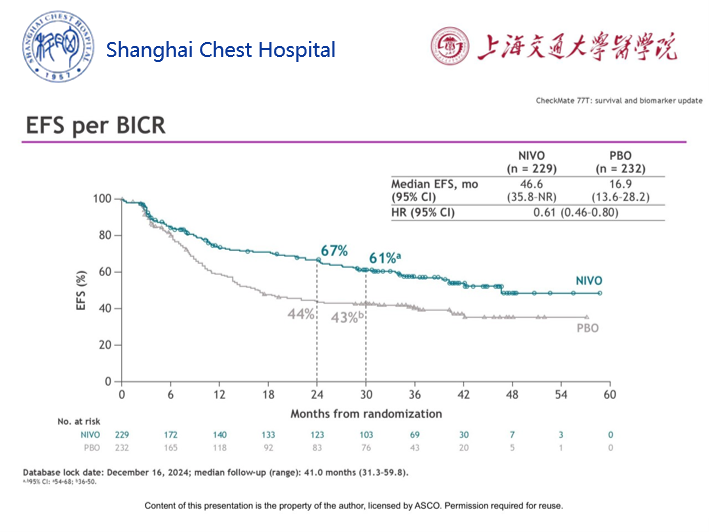
本次数据更新时,全组中位随访时间41.0个月。中位EFS分别为46.6个月和16.9个月,HR=0.61,2年EFS率分别为67%和44%。
KEYNOTE-671研究5年随访数据(2025 ESMO)
KEYNOTE--671研究在可手术切除的I-III期NSCLC患者中探索了,在含铂双药化疗基础上给予围手术期帕博利珠单抗治疗的疗效及安全性。首次期中分析时,EFS HR=0.58,两组MPR分别为30.2%和11.0%,pCR分别为18.1%和4.0%;第2次期中分析时,OS HR=0.72,本研究公布了5年随访数据。
5年更新时,两组中位OS分别为未达到和70.7个月,HR=0.74,5年OS率分别为64.6%和53.6%;中位EFS分别为57.1个月和18.4个月,HR=0.58,5年EFS率分别为49.9%和26.5%。
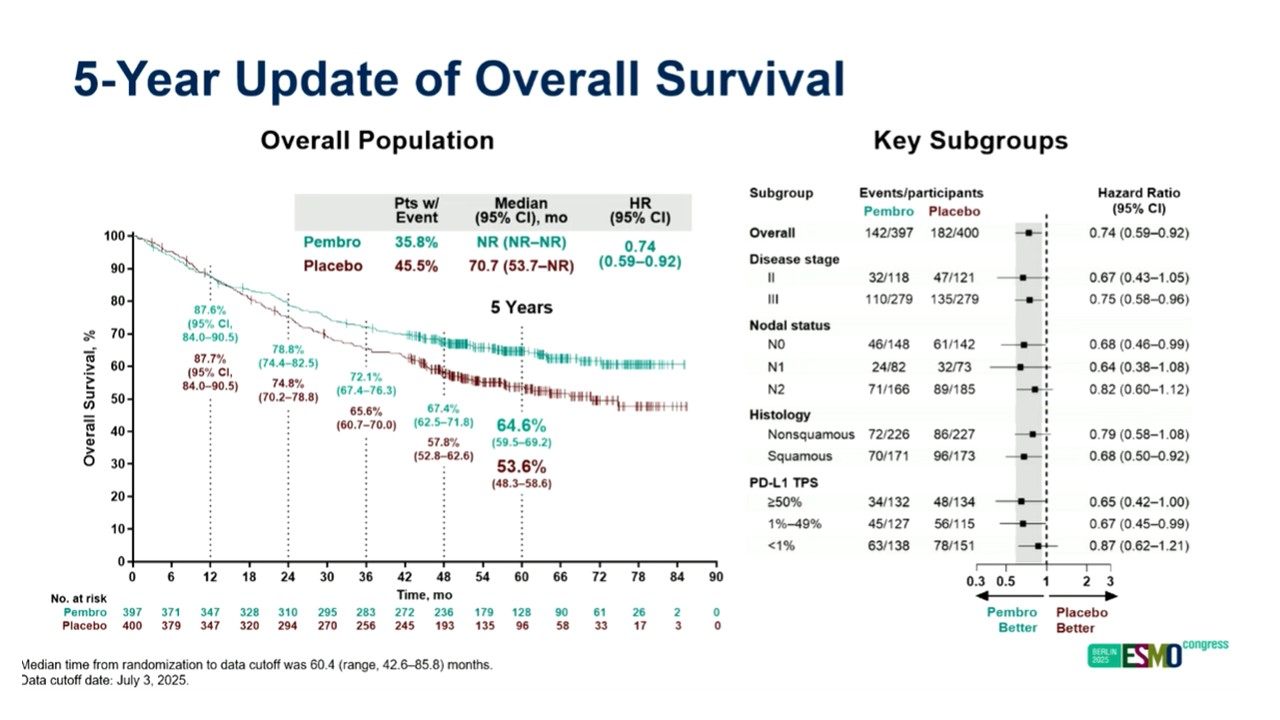 两组OS数据
两组OS数据
阿替利珠单抗联合Tiragolumab围术期治疗可切除NSCLC患者的疗效及安全性(SKYSCRAPER-05研究,2025 WCLC)
该研究旨在探索阿替利珠单抗联合针对TIGIT的单克隆抗体——Tiragolumab围术期治疗可切除NSCLC患者的可行性。研究纳入初治、II-III期NSCLC患者且患者驱动基因突变阴性,根据PD-L1表达水平分为队列a和队列b。队列a纳入PD-L1≥50%的患者,队列b无论患者PD-L1表达水平均允许入组。队列a的治疗剂量为 Tiragolumab 600mg,每三周一次联合阿替利珠单抗1200mg,每三周一次;队列b为Tiragolumab 600gm,每三周一次联合阿替利珠单抗1200mg,每三周一次并联合含铂双药化疗,4周期以后进行手术,随后进行上限1年的免疫维持治疗。主要研究终点为pCR。最终,队列a和队列b分别入组8例和42例患者,在整体人群中,队列a和队列b的MPR分别为71%和51%,pCR均为29%,在队列b中,PD-L1<1%、1~49%和≥50%的患者,MPR分别为43%、60%和63%,pCR分别为22%、20%和63%。两组24个月的EFS率分别为86%和60%。
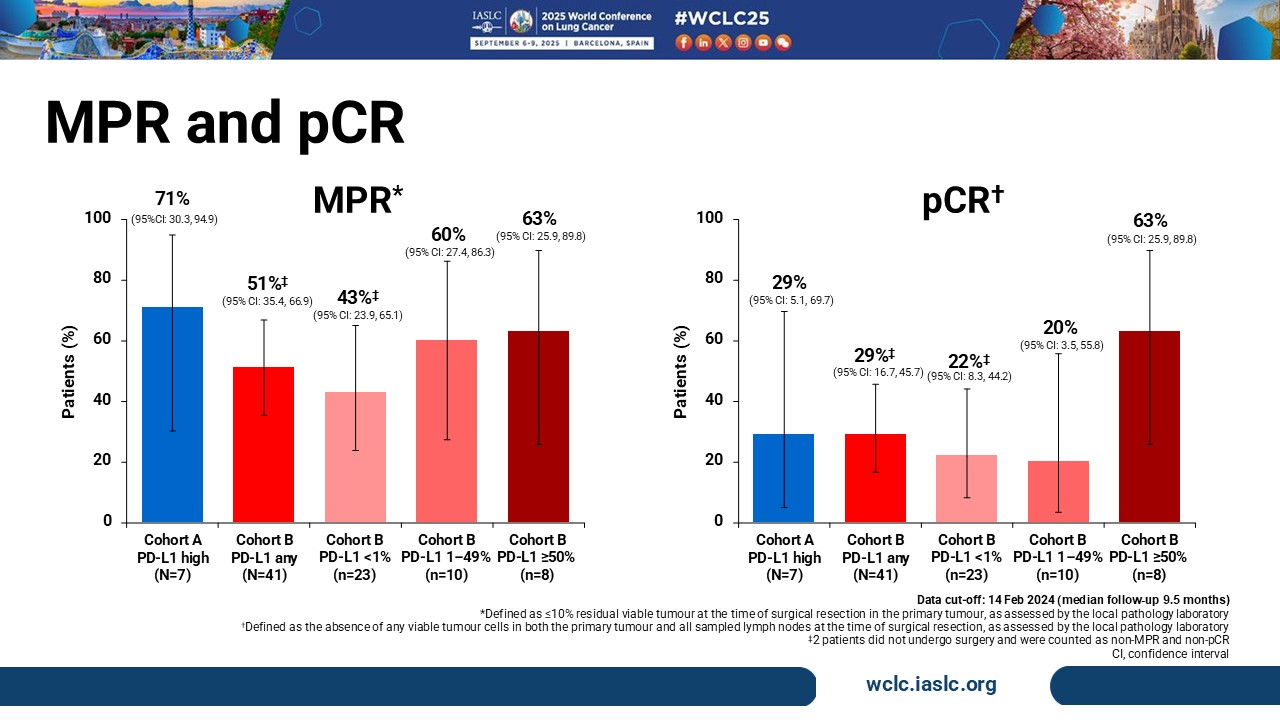
在新辅助治疗阶段,两组3级及以上治疗相关不良反应发生率分别为29%和32%。
III期不可手术切除患者的治疗
III期不可手术切除NSCLC患者同步放化疗后给予贝莫苏拜单抗±安罗替尼维持治疗的疗效及安全性(2025 ASCO)
对于不可手术切除的III期NSCLC患者,同步放化疗是标准治疗选择,本研究旨在探索对于这部分患者,若同步放化疗后未出现疾病进展,接受贝莫苏拜单抗联合或不联合安罗替尼治疗的疗效及安全性。最终,双药维持组、单免疫维持组和安慰剂组分别入组209例、212例和132例患者。IIIc期患者占比分别为24.4%、21.2%和18.2%。与安慰剂组相比,双药维持提高了疗效,两组中位PFS分别为15.1个月和4.2个月,HR=0.49,P<0.0001;单免疫治疗组与安慰剂组的中位PFS分别为9.7个月和4.2个月,HR=0.53,P<0.0001,三组治疗相关3级及以上不良反应发生率分别为48.8%、29.4%和19.7%。
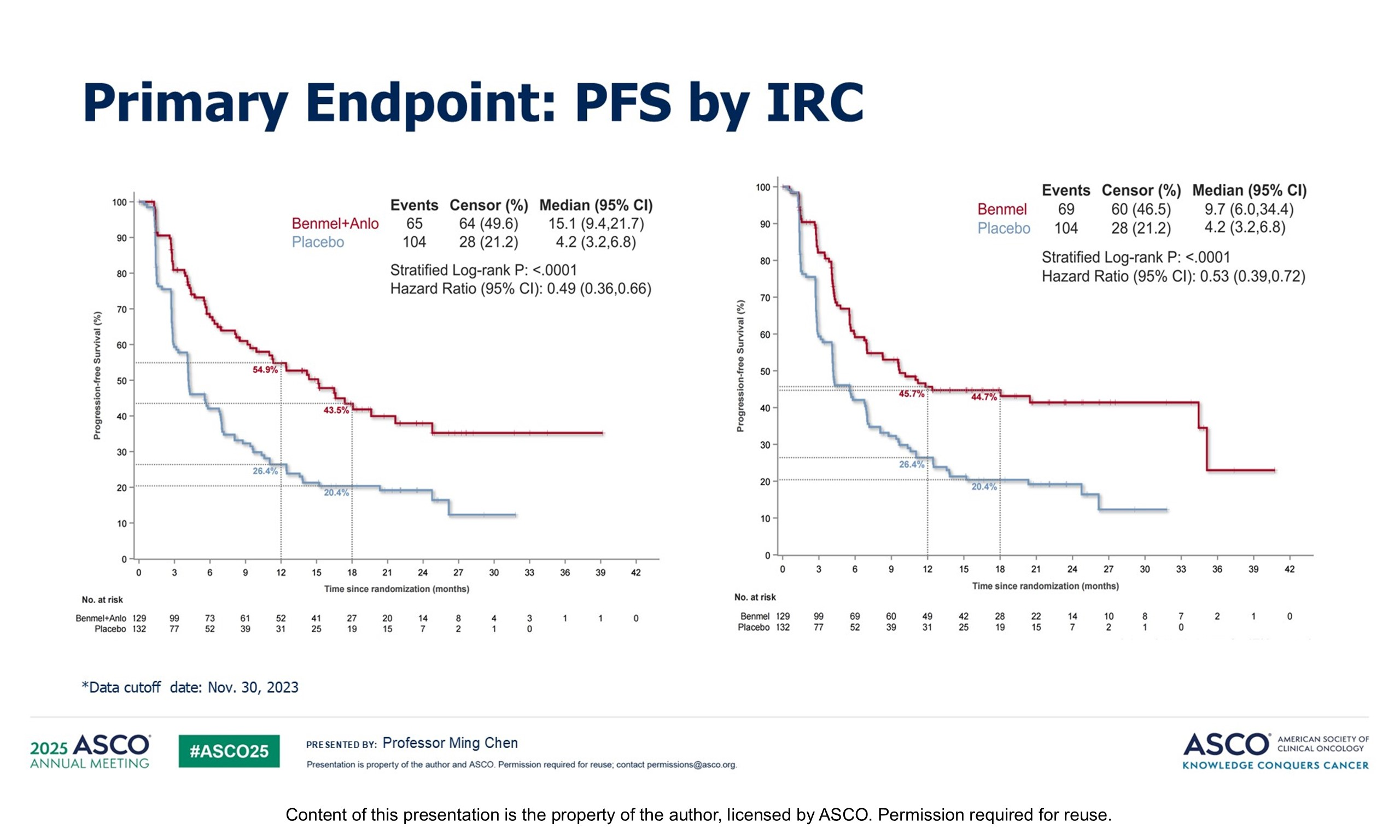
因此,对于不可手术切除的III期NSCLC患者,同步放化疗后若患者疾病未进展的患者,给予贝莫苏拜单抗维持或联合安罗替尼,提供了有效的治疗选择,OS数据目前尚不成熟。
不可手术切除的NSCLC患者,同步放化疗后接受度伐利尤单抗或阿替利珠单抗联合Tiragolumab维持治疗的疗效及安全性:一项III期开放标签临床试验(SKYSCRAPER-03研究,2025 ESMO)
基于PACIFIC研究数据,对于III期不可手术切除的晚期NSCLC患者,同步放化疗后若未进展,需接受1年度伐利尤单抗治疗。本研究旨在探索阿替利珠单抗联合Tiragolumab维持治疗的疗效及安全性。符合入组标准的患者按1:1的比例随机,主要研究终点为PFS。联合治疗并未给患者带来任何获益。联合治疗组和单纯度伐利尤单抗组的中位PFS分别为14.2个月和13.8个月,HR=1.00;中位OS分别为45.8个月和45.6个月;
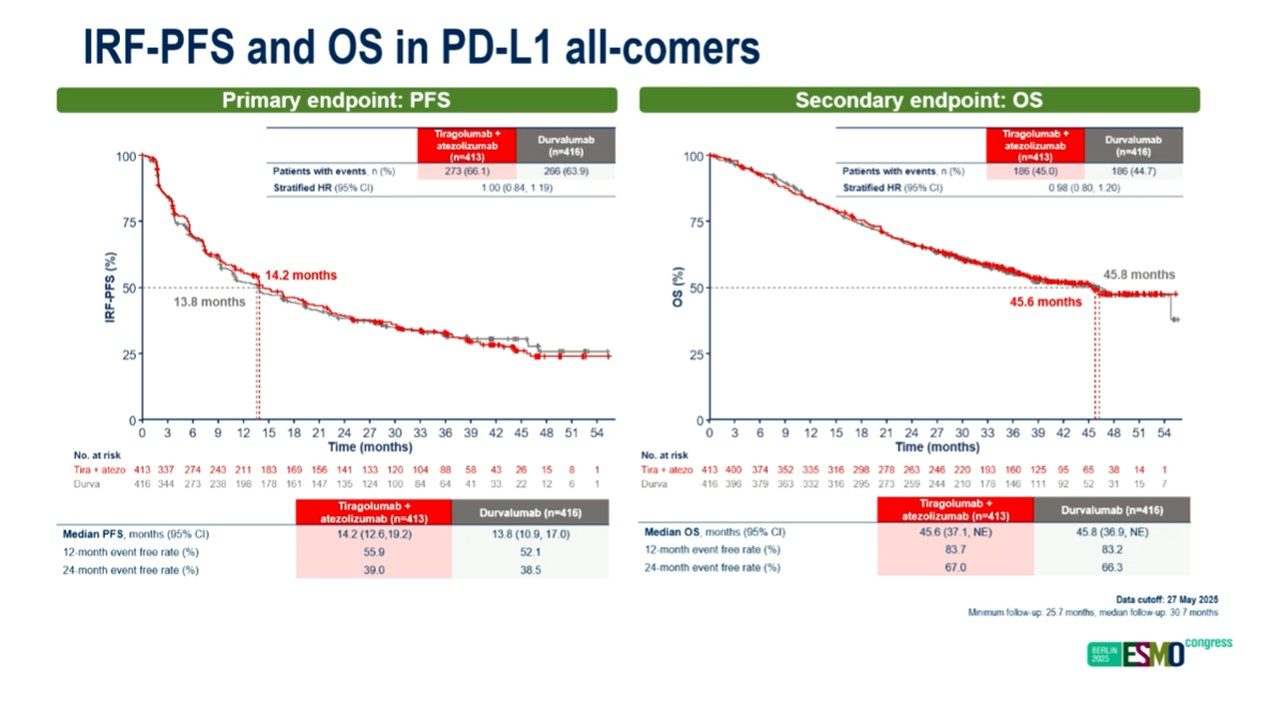
两组3级及以上治疗相关不良反应发生率分别为13.8%和10.7%。
晚期患者的治疗
贝莫苏拜单抗联合安罗替尼或帕博利珠单抗一线治疗PD-L1≥1%的局部晚期或转移性NSCLC患者的疗效及安全性:一项III期随机对照临床研究(COMPASS研究,2025 ASCO)
基于KeyNote-042研究结果,对于PD-L1≥1%的晚期NSCLC患者,帕博利珠单抗单药是标准治疗选择,本研究旨在探索贝莫苏拜单抗联合安罗替尼相较于帕博利珠单抗在这部分患者中的疗效及安全性。联合治疗组和帕博利珠单抗组分别入组354例和177例患者,基线特点均衡可比,两组中位PFS分别为11.0个月和7.1个月,6个月PFS率分别为74.7%和56.8%,HR=0.70,P=0.0057,PD-L1≥50%和<50%的患者,HR分别为0.60和0.63。ORR分别为57.3%和39.5%,DCR分别为85.9%和79.1%。两组3级及以上治疗相关不良反应发生发生率分别为58.5%和29.0%。
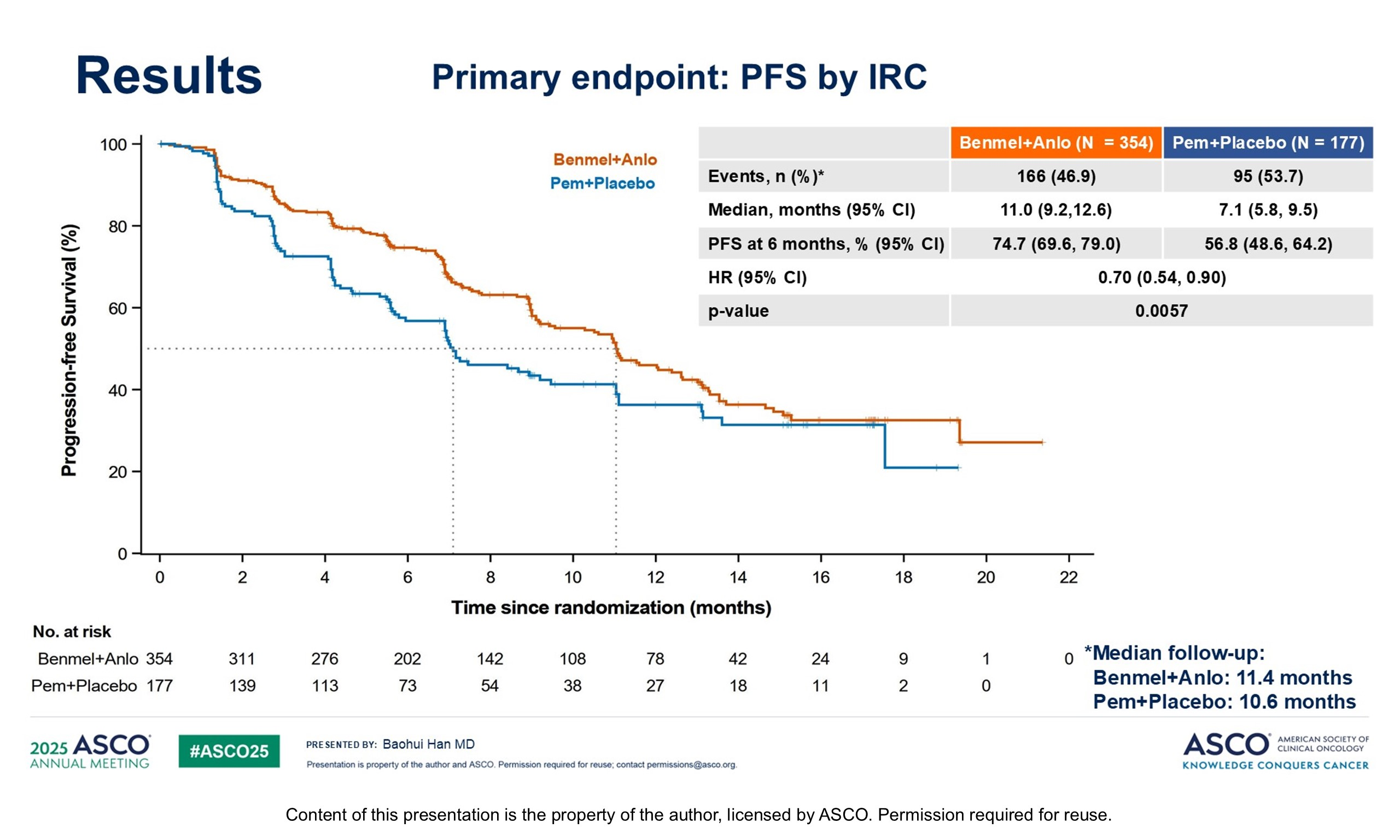
对于PD-L1≥1%的晚期NSCLC患者,贝莫苏拜单抗联合安罗替尼提供了更好的PFS。
贝莫苏拜单抗联合化疗并序贯安罗替尼治疗在晚期非鳞NSCLC患者中的疗效及安全性(2025 ASCO)
本研究旨在探索对于晚期非鳞NSCLC患者,一线接受化疗联合贝莫苏拜单抗治疗后未出现疾病进展的患者,在贝莫苏拜单抗治疗的基础上,联合安罗替尼维持治疗的疗效及安全性。研究纳入初治转移性非鳞NSCLC患者,按1:1的比例随机分为紫杉醇+卡铂+替雷利珠单抗;或紫杉醇+卡铂+贝莫苏拜单抗,4周期后未出现疾病进展的患者,分别接受替雷利珠单抗或贝莫苏拜单抗联合安罗替尼维持治疗,主要研究终点为PFS,次要研究终点为OS。
联合治疗组和替雷利珠单抗组分别入组278例和284例患者,脑转移患者占比分别为2.16%和2.82%,两组中位PFS分别为10.12个月和7.79个月,HR=0.64,P=0.0038,PD-L1<1%、1%~49%和≥50%的患者,HR分别为0.74,0.47和1.04,两组ORR分别为71.9%和65.4%,DCR分别为91.0%和88.7%。
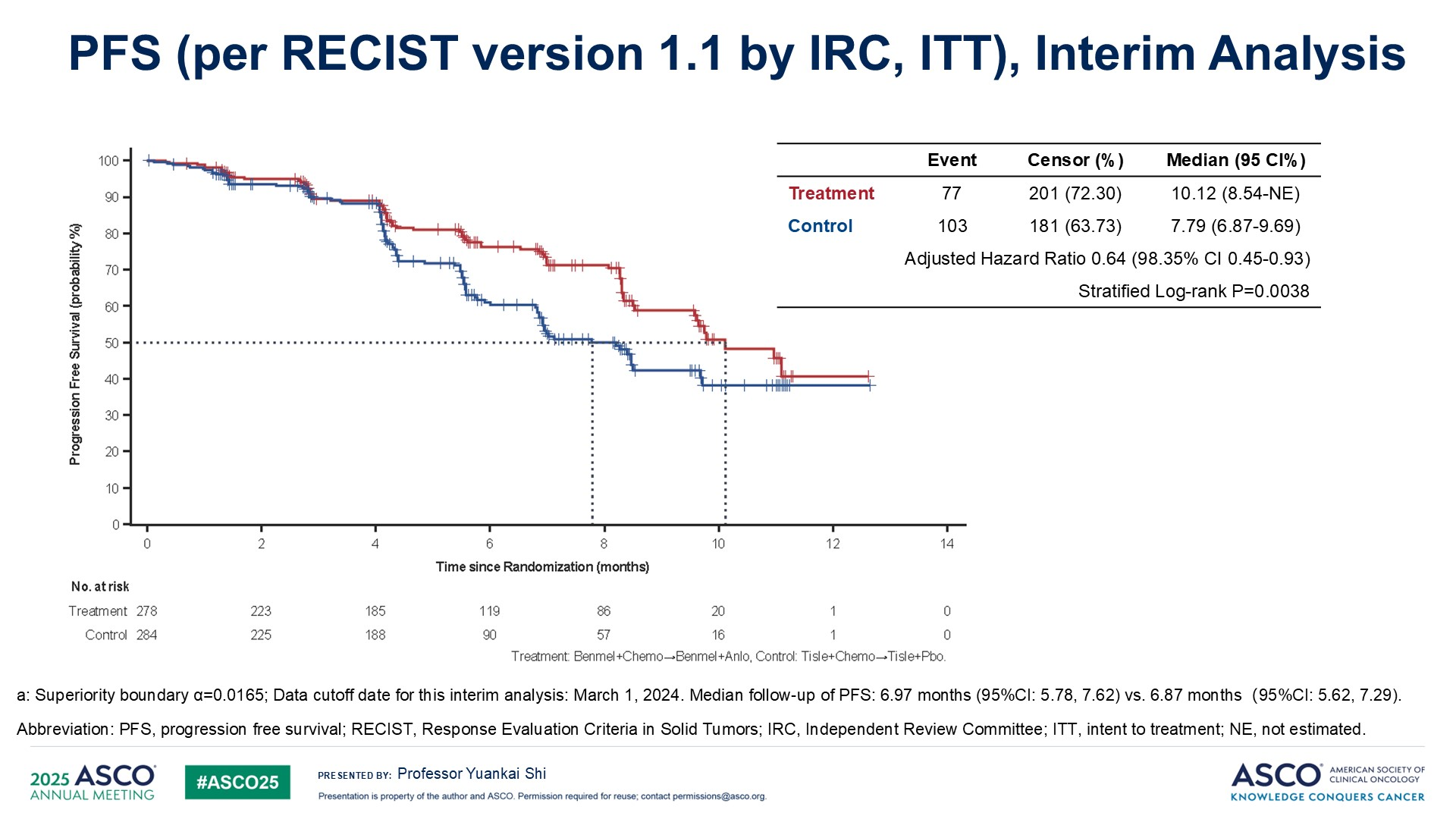
3级及以上治疗相关不良反应发生率分别为85.4%和78.9%。贝莫苏拜单抗联合含铂双药化疗并序贯安罗替尼治疗相较于当前标准治疗具有更好的PFS。
帕博利珠单抗联合化疗或帕博利珠单抗单药一线治疗PD-L1≥50%的晚期NSCLC患者的疗效及安全性(2025 ESMO)
基于KEYNOTE-024研究数据,帕博利珠单抗单药是PD-L1≥50%晚期NSCLC患者的标准一线治疗选择。本研究旨在探索标准治疗基础上,进一步联合含铂双药化疗能否给患者带来相应的生存获益。符合入组标准的患者按1:1的比例随机分为帕博利珠单抗单药或进一步联合4周期含铂双药化疗。主要研究终点为6周时,研究者评估的ORR和DCR,次要研究终点为12周时ORR、PFS和OS。
最终,联合治疗组和单药治疗组分别入组42例和30例患者,首次数据分析时由于无效而提前终止。6周时,联合治疗组和单药治疗组的ORR分别为33%和23%,12周时分别为50%和47%;中位PFS分别为10个月和6个月,HR=0.91,中位OS分别为33个月和28个月,HR=0.89,两组3级及以上治疗相关不良反应发生率分别为54%和35%,严重不良反应发生率分别为72%和58%。
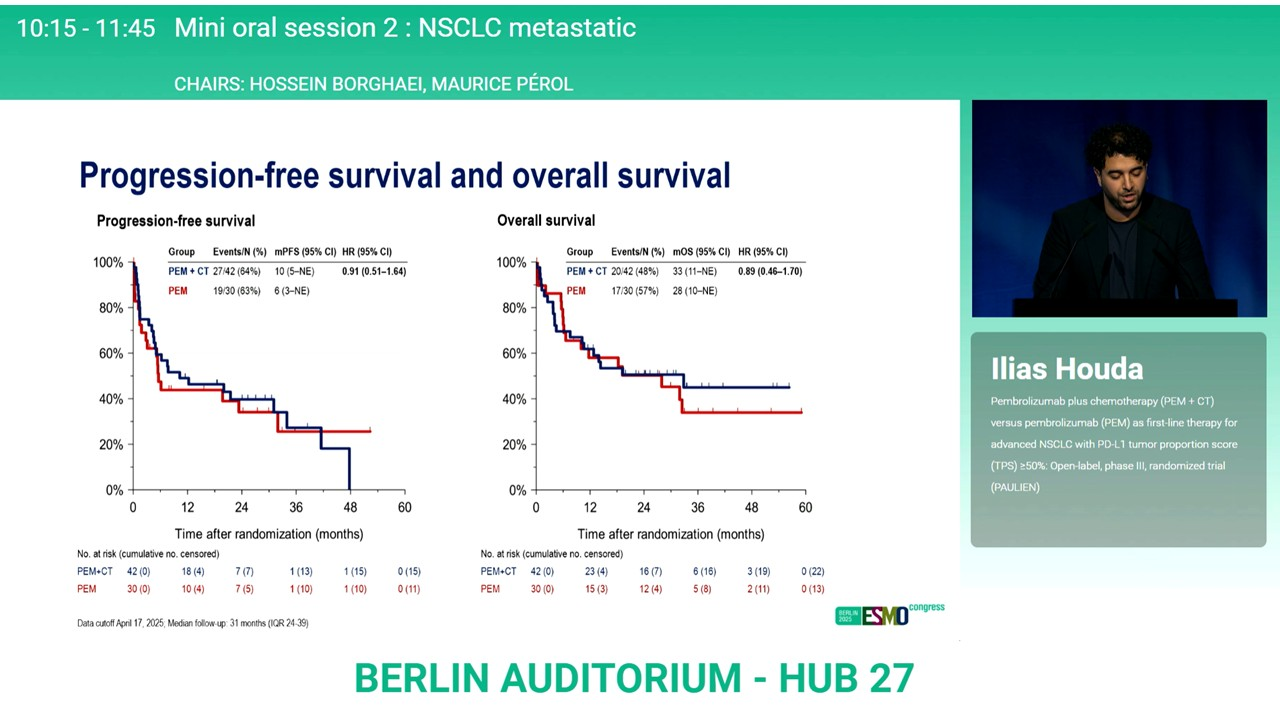
因此,对于PD-L1≥50%的NSCLC患者,无需在帕博利珠单抗基础上联合化疗,本研究因无效性而提前终止。
依沃西单抗或替雷利珠单抗联合化疗一线治疗鳞状NSCLC患者的疗效及安全性(HARMONi-6研究,2025 ESMO)
对于晚期鳞癌患者,标准治疗为含铂双药化疗联合免疫检查点抑制剂,本研究旨在探索化疗基础上联合依沃西(一款针对PD-1和VEGF的单抗)的疗效及安全性。符合入组标准的患者,按1:1的比例随机分为标准剂量含铂双药化疗联合替雷利珠单抗或伊沃西单抗,主要研究终点为PFS,次要研究终点为OS。
最终,依沃西单抗组和替雷利珠单抗组均入组266例患者,脑转移患者占比分别为3.4%和6.4%,两组中位PFS分别为11.14个月和6.90个月,HR=0.60,P<0.00001;PD-L1<1%、1%~49%和≥50%的患者,HR分别为0.55、0.66和0.71,两组ORR分别为75.9%和66.5%。
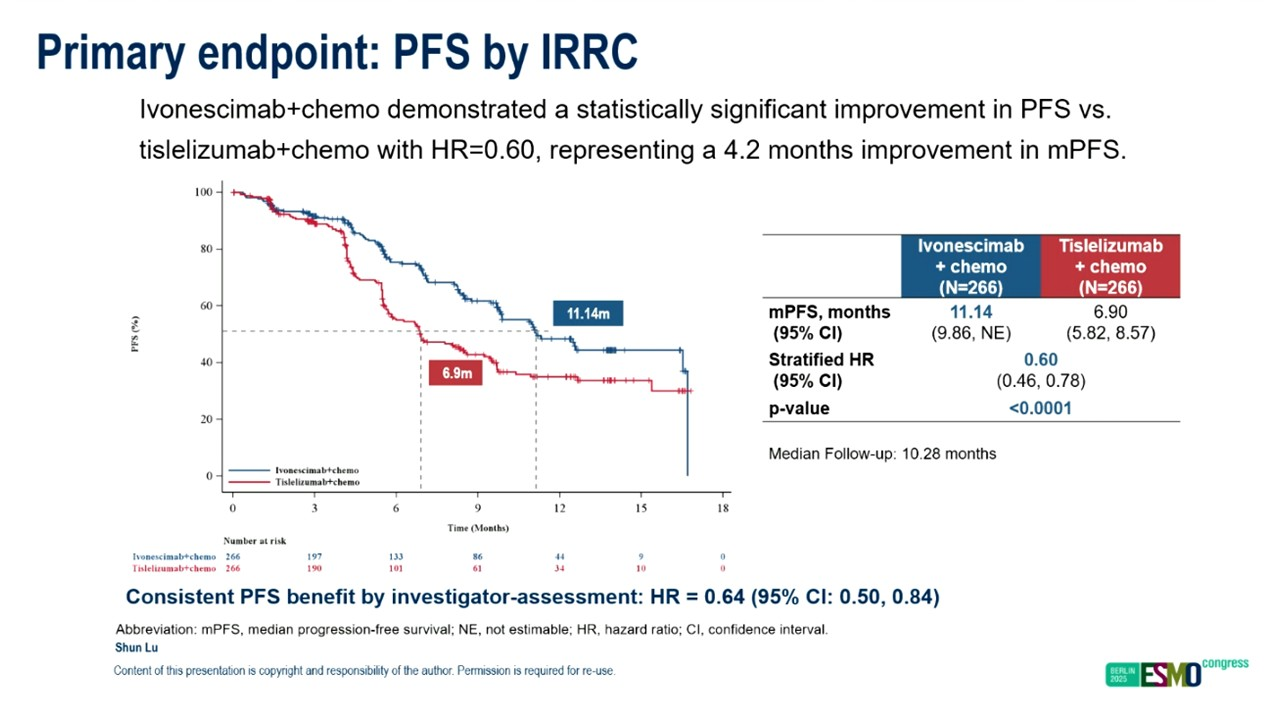
两组3级及以上治疗相关不良反应发生率分别为63.9%和54.3%。
小 结
整体而言,今年的三大学术会议,在驱动基因突变阴性的患者中,仍然围绕围手术期期治疗、III期不可切除的NSCLC患者治疗优化及晚期患者进行研究。围手术期治疗阶段的长期随访数据的公布,为患者接受围手术期治疗提供了更加充分的循证医学证据,但需要对术前/术后的获益进行析因;局部晚期及晚期患者中,多项临床研究数据的公布提示对TIGIT靶点的阻断可能不能给患者带来进一步获益,需要探索新的治疗策略。
排版编辑:肿瘤资讯-HYF











 苏公网安备32059002004080号
苏公网安备32059002004080号


