2025年第48届圣安东尼奥乳腺癌研讨会(SABCS)汇聚了全球顶尖的乳腺癌研究成果。在HER2阳性早期乳腺癌领域,本次大会公布了多项重磅口头报告,重点涵盖了HR+/HER2+患者辅助内分泌治疗策略的优化、生物标志物(sTILs及ctDNA)在预测与预后中的价值、ADC药物在新辅助及辅助治疗中的应用探索,以及去蒽环类药物方案的安全性与患者报告结局(PROs)。【肿瘤资讯】特此整理了本次大会中七项HER2阳性早期乳腺癌领域的研究进展,以飨读者。
中文标题:芳香化酶抑制剂或他莫昔芬辅助治疗 HR+/HER2+ 早期乳腺癌患者的疗效:来自 ALTTO(BIG 2-06)试验的探索性分析
英文标题:Adjuvant aromatase inhibitor or tamoxifen in patients with hormone receptor-positive/HER2-positive early breast cancer: An exploratory analysis from the ALTTO (BIG 2-06) trial
讲者:Matteo Lambertini, University of Genova – IRCCS Ospedale Policlinico San Martino, Genoa, Italy
研究背景
激素受体阳性(HR+)/HER2阳性(HER2+)早期乳腺癌(EBC)患者的最佳辅助内分泌治疗(ET)方案仍存争议。本研究通过10年随访数据,探讨经中心实验室确认HR+/HER2+状态、接受现代化疗(CT)及曲妥珠单抗(T)为基础治疗的EBC患者中不同类型ET的疗效。
研究方法
ALTTO(BIG 2-06)是一项国际多中心Ⅲ期临床试验,将HER2+ EBC患者随机分配至四种含CT的辅助抗HER2治疗方案:单用T、单用拉帕替尼(L)、序贯治疗(T→L)或联合治疗(T+L)。本研究排除单用L组患者、HR-/HER2+患者以及未启动辅助ET的HR+肿瘤患者。所有患者的HER2和HR状态均经中心实验室验证。
比较接受选择性雌激素受体调节剂(SERM)与芳香化酶抑制剂(AI)治疗患者的无病生存期(DFS)、远处复发时间(TTDR)和总生存期(OS)。为规避不朽时间偏倚风险,随访期间切换ET方案的HR+/HER2+患者被排除。按基线绝经状态进行预设亚组分析。
在绝经前女性中,比较单用SERM、SERM+卵巢功能抑制(OFS)及AI±OFS(根据CT后绝经状态决定)方案。采用多变量Cox比例风险回归模型分析辅助ET对生存结局的影响,协变量包括CT时序(同步/序贯)、肿瘤分级(G1/2、G3、GX)、年龄(连续变量)、肿瘤大小(T,连续变量)以及腋窝淋巴结分层变量(N0、N1-3、N≥4、N/A)。以SERM组为参照计算校正风险比(aHR)。
研究结果
共纳入2,651例HR+/HER2+患者,其中1,518例(57.3%)接受SERM(99.5%为他莫昔芬),1,133例(42.7%)接受AI。在1,259例绝经前患者中,903例(71.7%)单用SERM,238例(18.9%)接受SERM+OFS,118例(9.4%)接受AI±OFS。中位随访时间9.9年(IQR 7.0-10.0年)。总体分析显示,AI组与SERM组的10年DFS率分别为80.1%和76.5%(aHR 0.65;95% CI 0.52-0.82)。与SERM组相比,AI组局部复发率(0.9% vs. 2.4%)和远处复发率(9.3% vs. 12.1%)均更低。
亚组分析表明,无论患者(年龄、绝经状态、体重指数)、肿瘤(T、N、G、HR+水平、HER2 FISH比值)或治疗(抗HER2方案、CT类型及时序)特征如何,AI均优于SERM。AI组与SERM组的10年TTDR率分别为85.7%和83.1%(aHR 0.65;95% CI 0.50-0.85),10年OS率分别为88.9%和89.1%(aHR 0.73;95% CI 0.53-1.00)。
仅绝经前患者中,AI±OFS、SERM+OFS和单用SERM组的10年DFS率分别为90.0%、77.3%和77.6%(AI±OFS vs. SERM:aHR 0.44;95% CI 0.23-0.85;SERM+OFS vs. SERM:aHR 0.87;95% CI 0.61-1.23)。三组的10年TTDR率分别为92.8%、82.9%和85.1%(AI±OFS vs. SERM:aHR 0.57;95% CI 0.27-1.18;SERM+OFS vs. SERM:aHR 0.94;95% CI 0.62-1.41),10年OS率分别为95.6%、88.7%和91.3%(AI±OFS vs. SERM:aHR 0.68;95% CI 0.27-1.73;SERM+OFS vs. SERM:aHR 极 0.98;95% CI 0.58-1.66)。
结论
本项针对ALTTO试验中经中心实验室确认HR+/HER2+状态、接受现代CT联合抗HER2治疗的EBC患者的大规模10年随访分析表明,使用AI可显著改善DFS和TTDR,但OS无显著差异。AI的DFS获益在绝经前和绝经后患者中均得到验证。这些数据有助于优化HR+/HER2+ EBC患者的辅助ET选择,并提示有必要在此领域设计专门临床试验。
中文标题:THP 方案治疗的 Ⅱ/Ⅲ 期 HER2+ 乳腺癌中的肿瘤浸润淋巴细胞(TILs)与病理完全缓解(pCR):来自 ECOG-ACRIN-1181/CompassHER2 pCR 试验的次要结果
英文标题:Tumor infiltrating lymphocytes (TILs) and pathologic complete response (pCR) in stage II/III HER2+ breast cancer treated with taxane, trastuzumab, and pertuzumab (THP): secondary results from the ECOG-ACRIN-1181/CompassHER2 pCR trial
讲者:Sunil S Badve, Emory School of Medicine, Atlanta, GA
研究背景
TILs与HER2阳性乳腺癌病理完全缓解(pCR)及生存期的关联尚未明确,既往多项研究结果存在不一致。本研究对EA1181试验进行次要分析,评估基质TILs(sTILs)与pCR率的相关性。
研究方法
EA1181试验(NCT04266249)入组解剖学临床分期为II/III期的HER2阳性乳腺癌患者,术前接受4周期曲妥珠单抗+帕妥珠单抗联合12周紫杉醇或每3周一次多西他赛×4次(THP)治疗后进行手术。通过全切面苏木精-伊红(H&E)染色肿瘤活检切片评估sTILs密度。sTILs评分按方案作为连续变量(每10%增量)和分类变量(按Denkert等2018年标准以60%为界),同时采用三阴性乳腺癌常用的探索性30%截断值进行分析。使用Cox比例风险模型评估sTILs与pCR的关联,并调整可获得的基线因素。采用Fisher精确检验分析sTILs(按分类)与临床病理特征的相关性。
研究结果
在EA1181试验治疗的2141例HER2阳性乳腺癌患者中,1328例(62%)可获得H&E切片。sTILs评估人群与总体人群具有可比性。
总体pCR率为44.5%,HER2+/ER-亚组为64%,HER2+/ER+亚组为33%。sTILs分布为:623例(47%)<10%,297例(22%)10%-59%,408例(31%)≥60%,因此合并后两组(705例[53%]sTILs≥10%)。
单变量和多变量分析显示,sTILs增加(作为连续变量)与HER2+/ER+和HER2+/ER-亚组pCR率升高均相关(p<0.001;见表)。sTILs作为分类变量(<10% vs ≥10%)分析时,与全体患者(合并)及HER2+/ER+亚组pCR显著相关。
在探索性分析中,采用<30% vs ≥30%截断值时,单变量分析显示HER2+/ER+疾病(p<0.001)和HER2+/ER-疾病(p=0.002)均与pCR相关;但多变量分析中,sTILs≥30%仅在HER2+/ER+疾病中保持pCR的显著预测价值。其他分子生物标志物、内在亚型和免疫特征的探索性分析将后续报告。

结论
sTILs与THP治疗后pCR相关,进一步支持免疫机制在HER2阳性乳腺癌中的重要作用,并提示其可能成为评估病理反应的可靠预测工具。基线sTILs或可为未来优化治疗的术前试验设计提供参考。EA1181试验中基线sTILs与无复发生存期的关联将在未来报告。
中文标题:HER2+ 早期乳腺癌中的循环肿瘤 DNA(ctDNA):PHERGain 新辅助个体化治疗研究的转化分析
英文标题:Circulating tumor DNA (ctDNA) in human epidermal growth factor receptor 2-positive (HER2[+]) Early Breast Cancer (EBC): Translational analysis of PHERGain neoadjuvant tailored treatment study
讲者:Antonio Llombart-Cussac, Hospital Arnau de Vilanova; Translational Oncology Group, Facultad de Ciencias de la Salud, Universidad Cardenal Herrera-CEU; Medica Scientia Innovation Research (MedSIR), Valencia, Spain
研究背景
HER2靶向治疗显著改善了HER2阳性早期乳腺癌患者的预后,促使研究者探索不同的降阶梯治疗策略。ctDNA作为一种新兴工具,在早期乳腺癌中可用于风险分层和实时监测,为个体化治疗决策提供可能。PHERGain研究证实了采用FDG正电子发射断层扫描(PET)引导、pCR调整策略的可行性,该策略可使接受曲妥珠单抗和帕妥珠单抗(HP)双靶向新辅助治疗的I-IIIA期HER2阳性早期乳腺癌患者安全地省略化疗(CT)。这一PET和pCR引导的方法使37.9%的患者避免了化疗,且整体适应性治疗组的3年无浸润性疾病生存(iDFS)率达到94.8%。
该子研究旨在评估一种不依赖肿瘤组织的表观基因组学ctDNA检测技术,用于微小残留病灶检测,以提升pCR和3年iDFS的预测效能,从而在PHERGain研究框架内为HER2阳性早期乳腺癌患者制定更精准的新辅助/辅助治疗策略。
研究方法
试验设计及研究人群细节已既往发表。在356例随机分组患者中,A组(标准治疗)63例和B组(适应性治疗)267例接受了手术。PHERGuide子研究的主要目的是评估所有纳入患者中两个治疗周期后的ctDNA清除与pCR(ypT0/is ypN0)之间的相关性。次要目的包括分析ctDNA水平与患者预后的关联。
血液样本分别在基线、新辅助治疗两个周期后及术前采集。共纳入351例患者的932份样本(336份基线样本、311份第二周期样本和285份术前样本),采用Guardant RevealTM进行分析。该检测是一种不依赖肿瘤组织的表观基因组学方法,可提供二元ctDNA检测结果及预估肿瘤分数。ctDNA清除定义为基线可检测到ctDNA但后续时间点转为不可检测。分类变量采用逻辑回归模型分析,生存结果通过Cox比例风险回归评估。
研究结果
在932份样本中,801份符合本子研究分析条件(A组161份,B组640份)。在288份可分析的基线样本中,204份(71%)检测到ctDNA。检出率与疾病分期显著相关:I期33%(9/27)、II期73%(154/217)、III期93%(41/44)(p < 0.001)。在基线可检测到ctDNA的患者中,126/167(75.4%)和124/149(83.2%)分别在两个治疗周期后及术前实现ctDNA清除。两个治疗周期后(p = 0.003)及术前时间点(p < 0.001)的ctDNA清除与达到pCR显著相关。基线ctDNA状态与pCR无显著相关性(p = 0.583)。所有术前可检测到ctDNA的患者(n = 25)均未达到pCR。基线ctDNA阳性与较差的3年iDFS相关(92.5% vs. 100%,HR 0.20;95%CI 0.02-0.98;p = 0.046)。
结论
这些发现表明,在接受新辅助HER2靶向治疗的HER2阳性期乳腺癌患者中,ctDNA清除与pCR存在显著相关性。此外,基线可检测到ctDNA提示3年预后较差。需进一步开展前瞻性研究验证该结果。
中文标题:新型 HER2 ADC 药物 ARX788 治疗后的 pCR:来自 I-SPY2.2 试验的结果
英文标题:Pathologic complete response rates (pCR) after the novel HER2 ADC ARX788: Results from the I-SPY2.2 trial
讲者:Paula R Pohlmann, University of Texas MD Anderson Cancer Center, Houston, TX
研究背景
I-SPY2.2是一项针对新辅助治疗乳腺癌的多中心II期平台序贯多重分配随机试验(SMART),在A阶段评估新方案,必要时在B/C阶段继续标准治疗。B阶段治疗由肿瘤反应预测亚型(RPS;Wolf, Cancer Cell 2022)指导,该分型整合免疫、DNA修复和管腔基因表达特征与HR、HER2状态,将乳腺癌分为6种亚型。
ARX788是一种抗HER2抗体药物偶联物(ADC),通过位点特异性偶联不可裂解的微管蛋白聚合抑制剂Amberstatin(AS269)。RPS S5(HER2+/非管腔型)和S6(HER2+/管腔型)患者有资格在A阶段接受ARX788治疗(每3周1次,共4周期)。主要终点为研究性A阶段或完整治疗序贯后的pCR。
研究方法
患者在治疗期间接受系列MRI扫描。A或B阶段后的预测应答者可提前手术,其余患者继续B/C阶段治疗(包括TCHP×6或THP±AC)。采用贝叶斯协变量调整模型评估ARX788序贯手术的疗效,估计pCR率并与固定亚型特异性阈值比较。为评估多决策治疗方案(A/B/C阶段)的pCR率,我们使用贝叶斯模型(考虑pCR发生时间)并将率值与基于I-SPY数据(N=1,818)建立的亚型特异性动态对照(DC)进行比较。
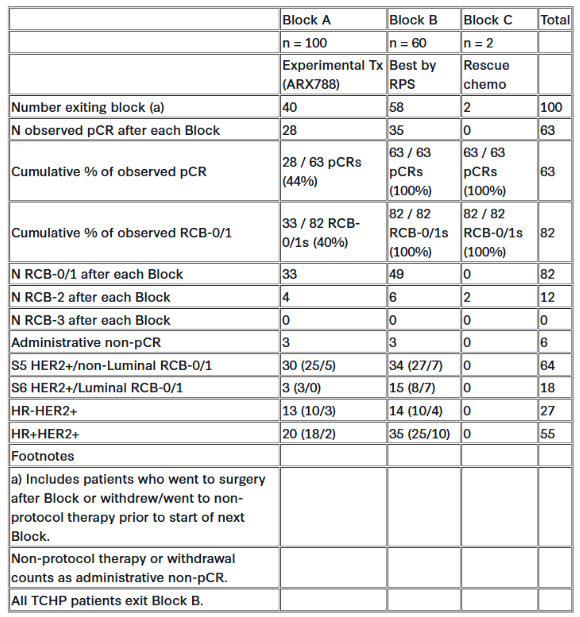
研究结果
2022年9月至2024年12月期间,100例患者随机接受ARX788治疗。联合化疗序贯治疗后,63/100例达到pCR,82/100例达到RCB 0/1,且均未使用蒽环类药物。值得注意的是,40例患者仅接受A阶段治疗后即手术,其中33例(82%)达到RCB 0/1,避免了长期传统化疗。RPS S6(HER2+/管腔型)亚组pCR率达39%,显著高于17%的DC率,超过预设的优效性概率阈值。单纯受体状态与疗效无关,凸显分子分型对治疗选择的重要性。无RCB-3病例。
95%患者出现眼部毒性(9%为3级),6%发生间质性肺炎(2%为3级),无治疗相关死亡。8例患者因不良事件未完成全部ARX788治疗。
结论
ARX788序贯化疗/抗HER2治疗显示出高疗效,特别是在HER2+/管腔型亚组中优于动态对照(DC),表明相当比例患者可避免长期化疗。目前正在开展研究以制定和实施策略预防治疗相关眼部毒性。I-SPY2.2验证了基于分子诊断和个体化应答适应策略的个性化新辅助治疗价值。
临床试验编号:NCT01042379
中文标题:德曲妥珠单抗对比恩美曲妥珠单抗治疗新辅助治疗后有残留浸润性病灶的高危 HER2 阳性原发性乳腺癌患者:DESTINY-Breast05 研究的中期分析
英文标题:Trastuzumab deruxtecan (T-DXd) vs trastuzumab emtansine (T-DM1) in patients with high-risk human epidermal growth factor receptor 2-positive (HER2+) primary breast cancer (BC) with residual invasive disease after neoadjuvant therapy: Interim analysis of DESTINY-Breast05
讲者:Sibylle Loibl, GBG Neu-Isenburg and Goethe University, Neu-Isenburg, Germany
研究背景
在3期DESTINY-Breast05研究(NCT04622319)中,针对接受新辅助治疗(NAT)后仍有残留浸润性病灶的HER2阳性乳腺癌(HER2+ BC)患者,对比了T-DXd与T-DM1的疗效。结果显示,T-DXd在主要终点无浸润性疾病生存期(IDFS)和关键次要终点无病生存期(DFS)方面,较T-DM1取得了具有统计学显著性和临床意义的改善(Geyer, ESMO 2025)。约80%的患者在腋窝淋巴结存在浸润性残留病灶,93%的患者接受了辅助放疗(56%为同步放疗 [n = 918];37%为序贯放疗 [n = 605]),79%的患者接受了HER2双靶向新辅助治疗。安全性总体可控,未发现新的安全信号。在此,我们报告DESTINY-Breast05研究中期分析的更多疗效和安全性数据。
研究方法
患者若在接受包含抗HER2治疗和紫杉烷类化疗的新辅助治疗(NAT)后仍有残留浸润性HER2阳性乳腺癌,且具有高复发风险(定义为NAT前呈cT4、N0-3、M0或cT1-3、N2-3、M0,或NAT后呈cT1-3、N0-1、M0伴腋窝淋巴结阳性 [ypN1-3]),则按1:1的比例随机分配接受T-DXd 5.4 mg/kg或T-DM1 3.6 mg/kg治疗,每3周一次,共14个周期。所有接受辅助放疗(RT)的患者均需进行连续胸部计算机断层扫描(CT);具体细节将在文中呈现。放疗可与研究治疗同步进行,也可在启动研究治疗前进行(序贯)。接受序贯治疗的患者需在放疗结束时额外进行一次CT扫描。
研究结果
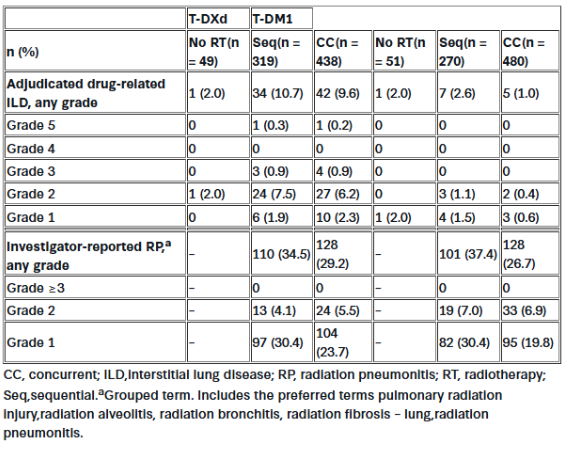
截至数据截止日期(2025年7月2日),共有1635例患者被随机分配至T-DXd组(n = 818)或T-DM1组(n = 817)。两组的中位治疗持续时间相似;两组中均有超过70%的患者接受了14个周期的研究治疗。临床相关亚组的疗效结果将在会议中呈现。
表中总结了按辅助放疗时机分类的经判定与药物相关的间质性肺病(ILD)以及研究者报告的放射性肺炎情况。在接受T-DXd治疗的患者中,经判定与药物相关的ILD发生率为9.6%;大多数ILD事件为1级或2级,0.2%的患者发生5级事件。未观察到因辅助放疗时机不同而产生的显著差异。两组中研究者报告的放射性肺炎发生率相似(T-DXd组为31.4%,T-DM1组为30.5%),未发生≥3级事件,且大多数为1级。
结论
此次补充分析进一步阐明了在新辅助治疗后HER2阳性乳腺癌残留病灶患者中,T-DXd相较于T-DM1的积极获益,支持T-DXd作为该治疗背景下潜在的新标准治疗方案。辅助放疗的时机并未影响T-DXd治疗中经判定与药物相关的ILD发生率。
中文标题:DESTINY-Breast11(DB-11)的安全性:在高危 HER2+ 早期乳腺癌中,新辅助 T-DXd 单药治疗或序贯紫杉醇 + 曲妥珠单抗 + 帕妥珠单抗(THP)对比剂量密集多柔比星 + 蒽环类药物序贯 THP(ddAC-THP)的安全性
英文标题:DESTINY-Breast11 (DB-11) safety: neoadjuvant trastuzumab deruxtecan (T-DXd) alone or followed by paclitaxel + trastuzumab + pertuzumab (THP) vs dose-dense doxorubicin + cyclophosphamide followed by THP (ddAC-THP) in high-risk, HER2+ early-stage breast cancer (eBC)
讲者:Giuseppe Curigliano, Division of Early Drug Development for Innovative Therapies, European Institute of Oncology, IRCCS & Department of Oncology and Hematology-Oncology, University of Milano, Milano, Italy
研究背景
HER2阳性eBC的新辅助标准治疗采用双重HER2阻断联合细胞毒性药物,存在短期和长期毒性。DB-11研究显示,与ddAC-THP相比,T-DXd-THP方案具有统计学显著和临床意义的病理完全缓解获益及更优的安全性。本文报告临床相关不良事件(AEs)数据。
研究方法
将高危(≥T3、淋巴结阳性[N1-3]或炎性)HER2阳性eBC患者随机分配至新辅助T-DXd(8周期)、T-DXd-THP(4+4周期)或ddAC-THP(4+4周期)组。每6周进行胸部高分辨率CT扫描。特别关注的不良事件包括经判定的间质性肺病/肺炎(建议全身性激素治疗)和左心室功能不全(LVD)。同时描述临床相关AEs(恶心/呕吐[N/V]、中性粒细胞减少和外周神经病变)。结果在安全性分析集(至少接受一剂研究药物)中报告。
研究结果
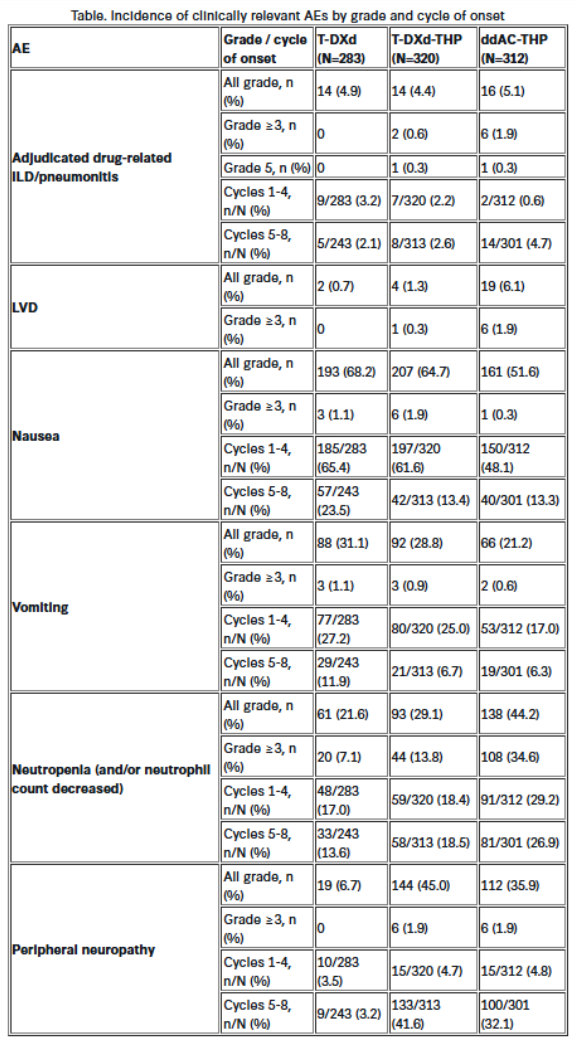
在初步分析中(数据截止日期2025年3月12日;N=915),各组所有级别的经判定药物相关ILD/肺炎发生率均较低(见表);在THP治疗阶段(第5-8周期)与第1-4周期相比,T-DXd-THP组该发生率维持稳定,而ddAC-THP组则有所升高。
严重不良事件(T-DXd 0.4%;T-DXd-THP 0.6%;ddAC-THP 2.9%)、≥3级经判定药物相关ILD/肺炎以及所有级别/≥3级LVD的发生率均在ddAC-THP组最高。
在发生经判定药物相关ILD/肺炎的患者中,T-DXd组、T-DXd-THP组和ddAC-THP组分别有71.4%、64.3%和56.3%接受了类固醇治疗;分别有57.1%、71.4%和81.3%的病例获得缓解。恶心/呕吐在T-DXd组和T-DXd-THP组较ddAC-THP组更为常见,但在第1周期前使用3种推荐预防性止吐药的比例较低(T-DXd 14.1%;T-DXd-THP 16.9%;ddAC-THP 39.7%);分别有55.5%(T-DXd)、57.2%(T-DXd-THP)和40.4%(ddAC-THP)的患者使用了2种推荐止吐药。恶心/呕吐主要为低级别且非严重,发生率在第1-4周期后下降。整个周期中,中性粒细胞减少症发生率在ddAC-THP组最高;粒细胞集落刺激因子的使用率在T-DXd组(16.1%)和T-DXd-THP组(22.7%)低于ddAC-THP组(87.2%)。周围神经病变发生率在T-DXd组最低;在所有治疗组中,事件主要为低级别且非严重,且大多数发生在THP阶段。
结论
各治疗组经判定的药物相关间质性肺病/肺炎发生率均较低,T-DXd和T-DXd-THP组的≥3级事件少于ddAC-THP组。LVD和中性粒细胞减少发生率以ddAC-THP组最高。虽然T-DXd和T-DXd-THP组的N/V发生率高于ddAC-THP组,且T-DXd-THP组的外周神经病变发生率更高,但这些事件通常为低级别非严重事件,表明其安全性可通过推荐治疗方案进行管理。
中文标题:DESTINY-Breast11 研究中的患者报告结局(PROs):在高危 HER2+ 早期乳腺癌中,新辅助 T-DXd 单药治疗或序贯紫杉醇 + 曲妥珠单抗 + 帕妥珠单抗(THP)对比剂量密集多柔比星 + 蒽环类药物序贯 THP(ddAC-THP)的疗效
英文标题:Patient-reported outcomes (PROs) in DESTINY-Breast11: neoadjuvant treatment (NAT) with trastuzumab deruxtecan (T-DXd) alone or followed by paclitaxel + trastuzumab + pertuzumab (THP) vs dose-dense doxorubicin + cyclophosphamide followed by THP (ddAC-THP) in high-risk, HER2+ early-stage breast cancer (eBC)
讲者:Shanu Modi, Department of Medicine, Breast Medicine Service, Memorial Sloan Kettering Cancer Center, New York, NY
研究背景
DESTINY-Breast11 III期研究显示,在高危HER2阳性早期乳腺癌中,T-DXd-THP新辅助治疗相较于ddAC-THP方案,在病理完全缓解率方面表现出统计学显著且临床意义的改善,并具有更好的安全性特征。本文报告新辅助治疗期间的躯体功能(PF)和患者报告的耐受性。
研究方法
高危(≥T3、淋巴结阳性[N1-3]或炎性)HER2阳性早期乳腺癌患者随机接受新辅助治疗:T-DXd(8周期)、T-DXd-THP(4+4周期)或ddAC-THP(4+4周期)。
采用EORTC生活质量问卷核心30(QLQ-C30)躯体功能(PF)子量表评估躯体功能。通过CTCAE患者报告结局版、EORTC-QLQ-C30及EORTC项目库中的选定条目评估20种症状性不良事件(AEs)。患者治疗耐受性总体印象量表评估总体副作用困扰。描述性患者报告结局分析包括所有接受至少1剂研究干预的患者。
研究结果
T-DXd、T-DXd-THP和ddAC-THP组分别有283、320和312例患者开始治疗。与ddAC-THP组相比,T-DXd和T-DXd-THP组在新辅助治疗期间维持或改善躯体功能的患者比例更高(各周数值范围分别为:42.7-75.5%、43.7-75.7%和24.0-62.4%)。
新辅助治疗期间,T-DXd和T-DXd-THP组的总体副作用困扰程度低于ddAC-THP组,高副作用困扰的患者-周比例数值更低(T-DXd 45.8%;T-DXd-THP 43.0%;ddAC-THP 49.5%)。
在评估的20种症状性不良事件中,T-DXd组和T-DXd-THP组分别有14种和13种总体优于ddAC-THP组(两组均更优:腹泻、食欲减退、味觉改变、口腔/咽喉溃疡、麻木/刺痛、肌肉疼痛、关节疼痛、胸痛、咳嗽、呼吸困难、皮疹、潮热、失眠;T-DXd组:鼻出血)。尽管所有组别均存在,但有5种不良事件在T-DXd和/或T-DXd-THP组总体差于ddAC-THP组(两组均更差:脱发、头痛、恶心、呕吐;T-DXd组:便秘;T-DXd-THP组:鼻出血)。在评估对日常活动影响的症状性不良事件(头痛、失眠、关节疼痛、口腔/咽喉溃疡、肌肉疼痛、麻木/刺痛)中,所有组别均观察到对日常活动的干扰有限。
结论
与ddAC-THP相比,T-DXd或T-DXd-THP方案能使更多患者维持或改善躯体功能。T-DXd和T-DXd-THP方案患者报告的治疗负担(耐受性、症状性不良事件)低于ddAC-THP方案。这些发现,结合T-DXd-THP相较于ddAC-THP的良好安全性和疗效特征,支持T-DXd-THP作为高危HER2阳性早期乳腺癌的可耐受治疗方案。
排版编辑:肿瘤资讯-zxy













 苏公网安备32059002004080号
苏公网安备32059002004080号


