近年来,随着对神经内分泌肿瘤分子机制研究的不断深入,依维莫司凭借其确切的临床疗效,在该疾病的治疗中占据了一定地位。在临床实践中,如何科学合理地应用依维莫司,实现对患者的有效管理,是提升治疗效果、改善患者生活质量的关键所在。本文为复旦大学附属肿瘤医院陈洁教授对依维莫司在神经内分泌肿瘤治疗中的研发历程及全程管理进行系统的梳理与分享,以期为临床实践提供参考。

神经内分泌肿瘤概述:病理诊断与治疗靶点
神经内分泌肿瘤的复杂性与病理诊断标准
神经内分泌肿瘤是一类具有复杂性与异质性的肿瘤。它起源于神经内分泌细胞,可分为功能性与非功能性肿瘤,亦有遗传性与散发性之分。
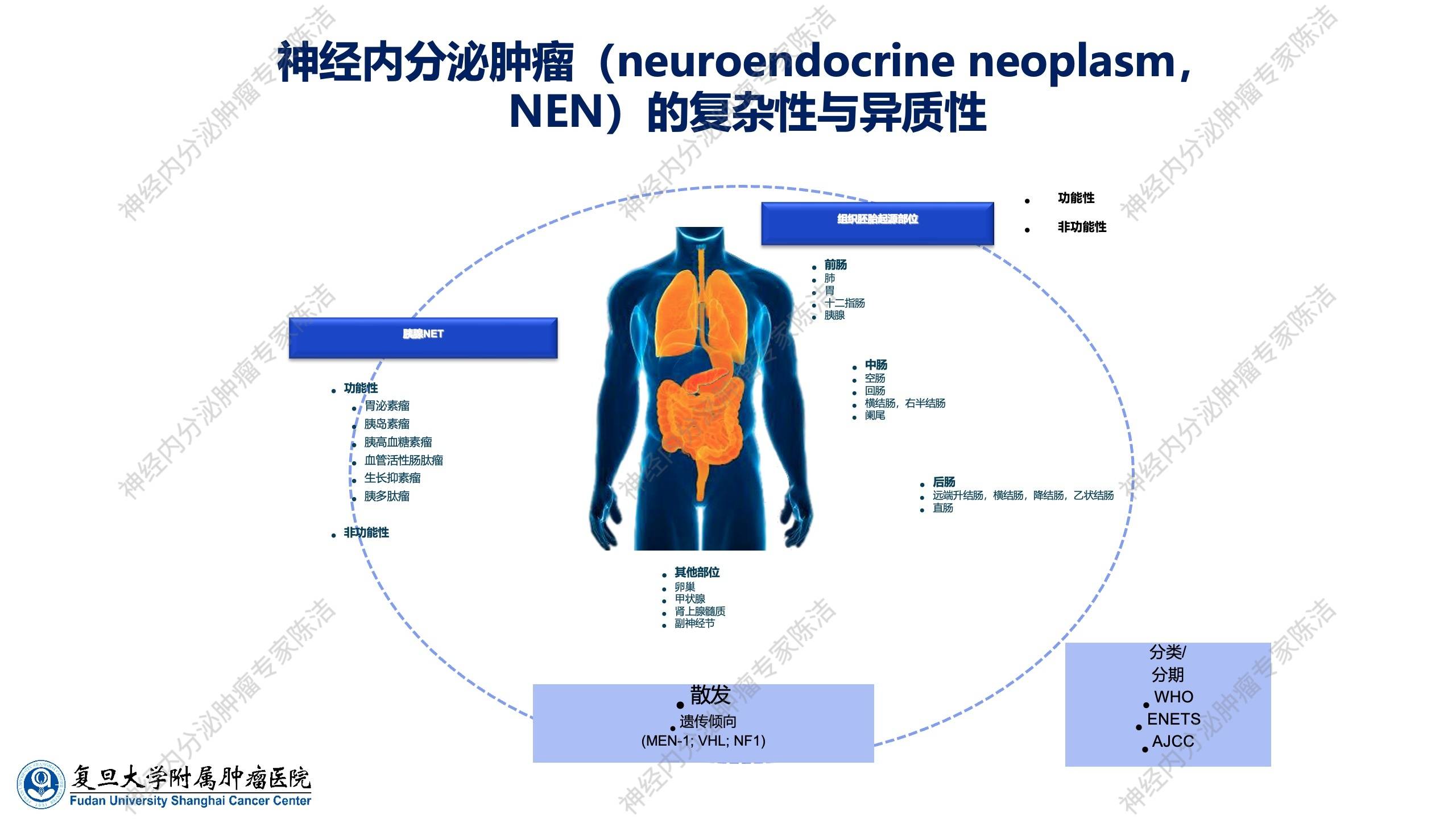
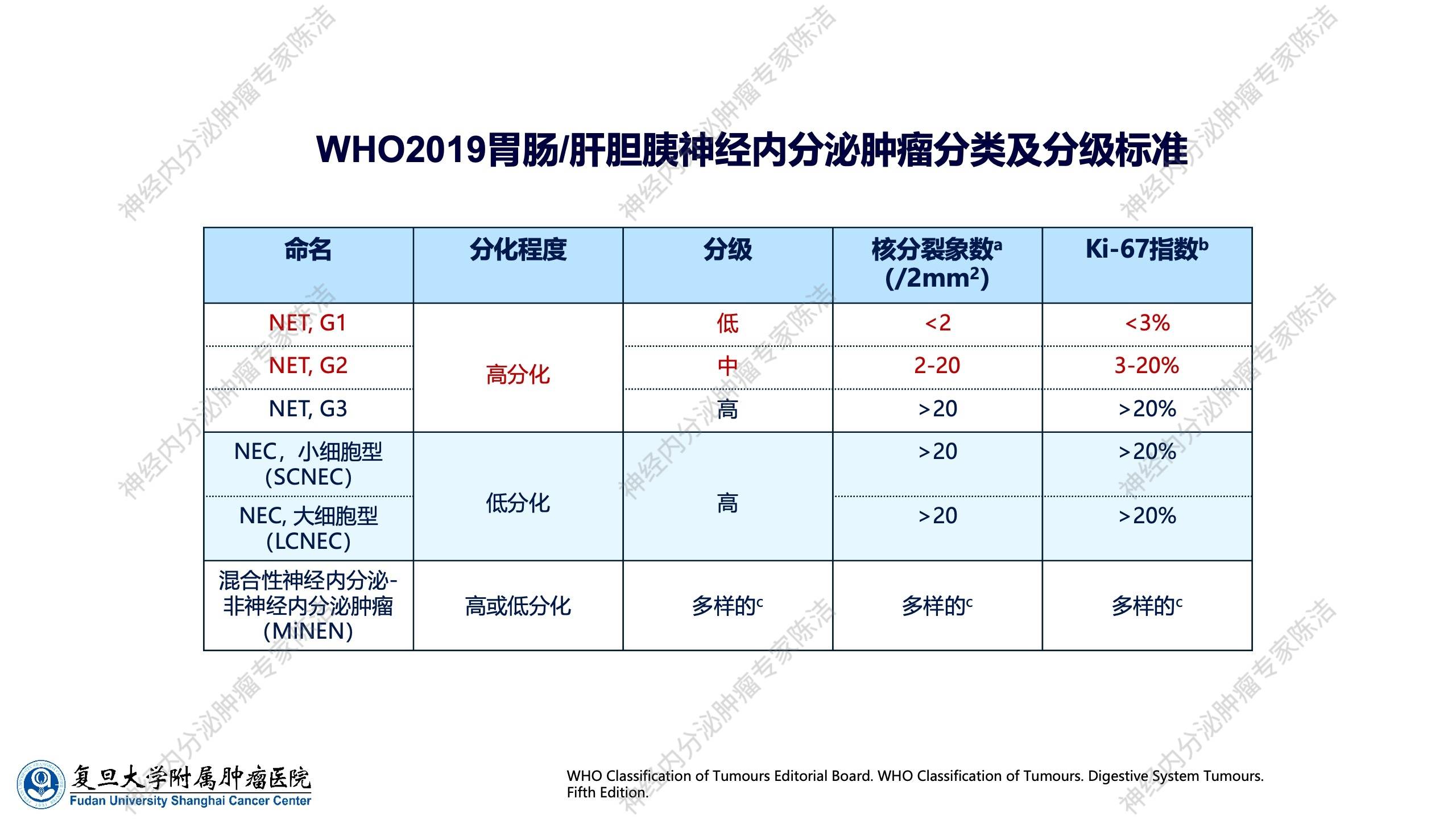
WHO 2019胃肠/肝胆胰神经内分泌肿瘤分类与分级标准对神经内分泌肿瘤的分类分级诊断进行了更新。根据分化程度,神经内分泌肿瘤被分为高分化的瘤(NET)和低分化的癌(NEC),以及一类混合性神经内分泌-非神经内分泌肿瘤。高分化的瘤(NET)依据核分裂象和Ki-67指数进一步分为G1、G2、G3三级,级别由低到高,恶性度亦相应由低到高。
值得注意的是,胸部支气管、肺、纵隔神经内分泌肿瘤的命名与胃肠胰肝胆的命名不一样。在胸部神经内分泌肿瘤中,分化好的类型称为典型类癌和非典型类癌,其中,典型类癌大致相当于胃肠胰神经内分泌肿瘤的G1级;而非典型类癌大致相当于胃肠胰神经内分泌肿瘤的G2至G3级别。大细胞神经内分泌癌和小细胞神经内分泌癌的命名在各个系统基本一致。

2021年,WHO对支气管肺神经内分泌肿瘤的病理诊断标准进行了更新。该标准与消化系统略有不同,其在判读类别时重视“坏死”的问题。此外,该标准还涉及TTF1、P40等标记物,用以辅助鉴别肺部其他类型的肿瘤。因此,不同部位神经内分泌肿瘤的病理诊断标准存在差异,临床医生必须熟悉常见的病理诊断标准,以准确解读病理科医生提供的病理报告,判断其规范性,并据此指导后续的临床诊疗。

胸腺神经内分泌肿瘤的分类与支气管肺神经内分泌肿瘤相似,亦分为典型类癌、非典型类癌、大细胞神经内分泌癌和小细胞神经内分泌癌,其诊断标准相应更为简化。

神经内分泌肿瘤的治疗史与关键靶点
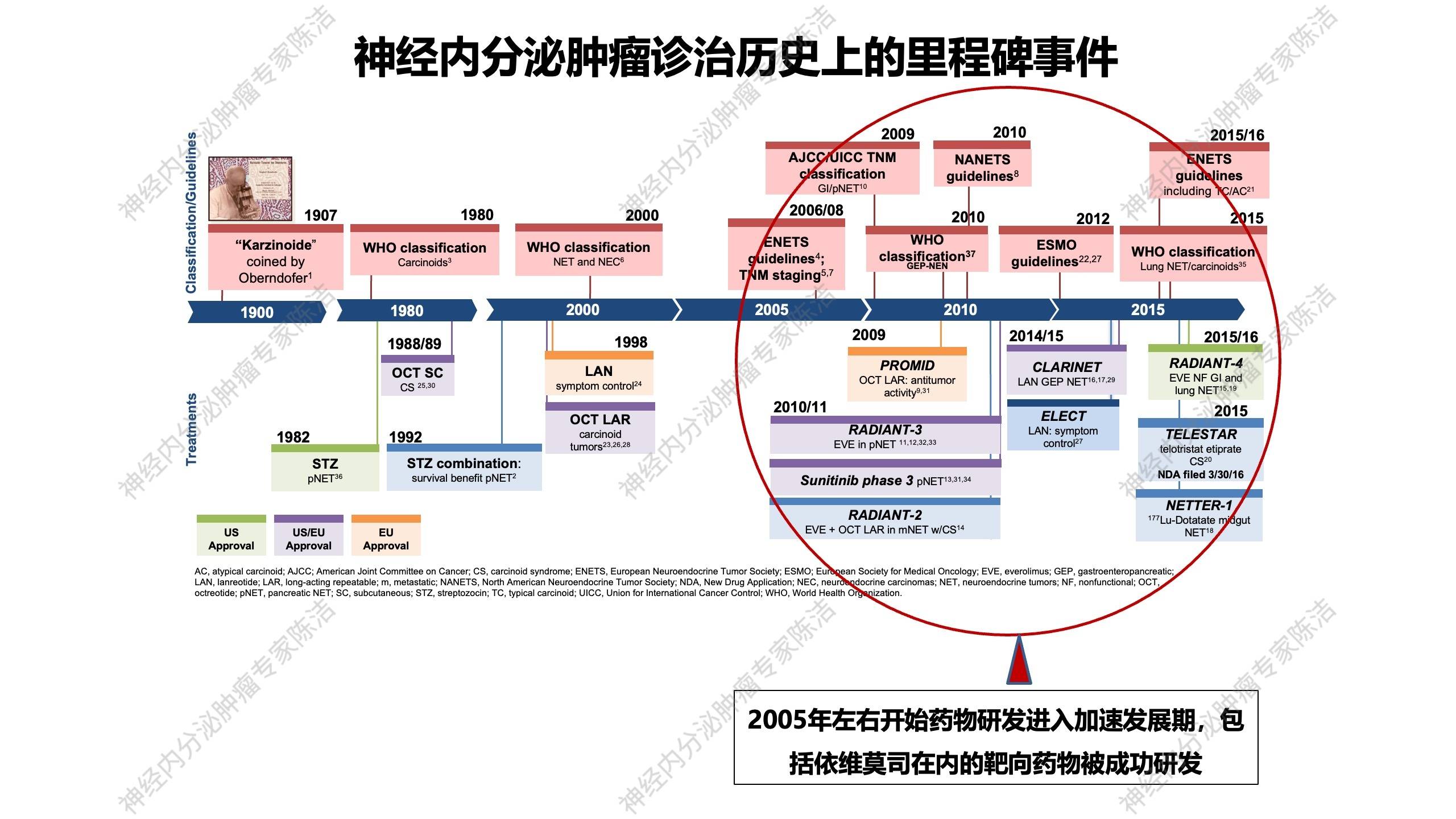
回顾神经内分泌肿瘤的治疗史:该类肿瘤于1907年由德国病理学家Oberndofer发现,但在将近70多年后才出现首个治疗药物——烷化剂类化疗药“链尿霉素”。到了20世纪80年代末,首个生长抑素类似物(SSA)奥曲肽开始用于临床治疗类癌综合征。90年代末,第二个SSA药物兰瑞肽开始应用于临床。与此同时,自20世纪80年代开始,WHO开始对神经内分泌肿瘤进行病理命名和分类的统一管理,使得全球在该领域逐步采用统一的学术语言。2006年前后,欧洲成立了神经内分泌肿瘤学会(ENETS),并开始颁布神经内分泌肿瘤的临床诊治指南。
直至2010年左右,神经内分泌肿瘤治疗领域迎来了重要突破:两种分别针对不同治疗靶点的靶向药物研发成功,即依维莫司(mTOR抑制剂)和舒尼替尼。这标志着神经内分泌肿瘤治疗正式进入了靶向治疗时代。自2010年至今,该领域的发展日趋活跃,临床研究日益增多,包括SSA药物应用的拓展、抗激素分泌新药的研发、肽受体放射性核素治疗的Ⅲ期临床试验成功等。WHO也在不断更新其病理诊断标准。除ENETS外,北美神经内分泌肿瘤学会(NANETS)也相继成立,世界大型肿瘤学会如ASCO、ESMO也开始重视这一瘤种。近十年来,神经内分泌肿瘤虽属小瘤种,但领域内的学术发展也在日益蓬勃。
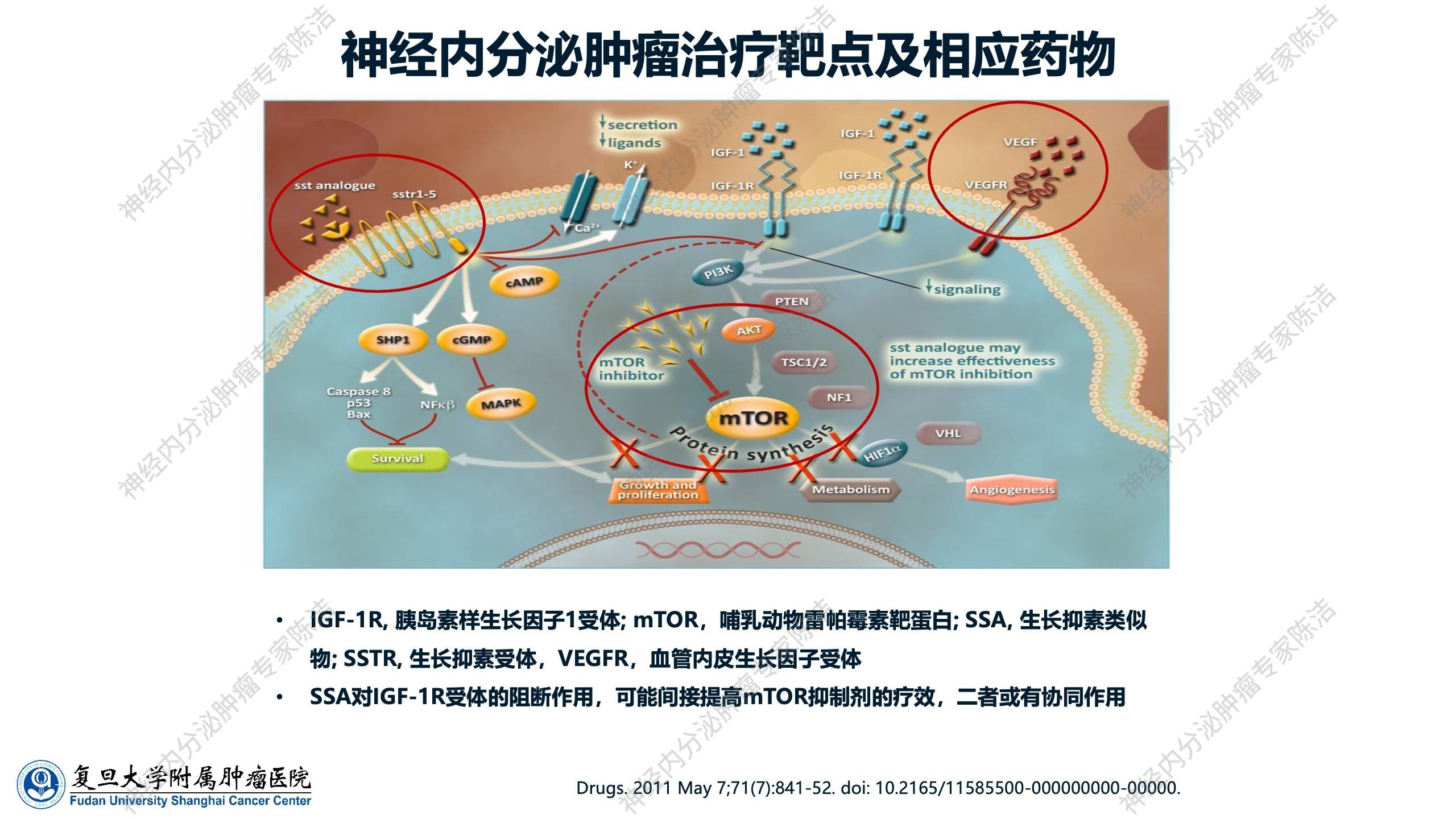
在神经内分泌肿瘤治疗领域,目前的治疗靶点与相应药物主要包括:
SSA及其受体(SSTR):SSTR是最早发现且临床广为应用的靶点。
mTOR受体:位于SSA信号通路的下游。mTOR受体包含三个复合物,其中mTORC1是主要复合物,其靶向药物包括依维莫司。mTOR通路是调控神经内分泌肿瘤细胞生长的核心通路之一。
VEGF受体信号通路:神经内分泌肿瘤多属于富血供肿瘤,此通路控制肿瘤血管生成。因此,抑制肿瘤血管生成的通路亦是关键靶点。代表性药物为一系列小分子TKI类(酪氨酸激酶抑制剂)抗血管生成靶向药物。
这些信号通路并非彼此孤立,而是相互作用,形成一个复杂的网络。例如,胰岛素样生长因子1受体(IGF-1R)是神经内分泌肿瘤细胞生长的另一重要受体,其受到SSA的调控,同时其下游可激活mTOR受体。在受体信号通路的交互作用中,SSA与mTOR受体之间可能存在协同作用,这为联合治疗的临床试验设计提供了理论依据。联合治疗临床试验设计的初衷,便是从机制层面探究何种药物能够联合应用,此亦为现有神经内分泌肿瘤治疗靶点及相应药物的研究思路。
依维莫司的作用机制与关键临床试验
mTOR信号通路的角色
mTOR信号通路实际上是正常人体细胞的核心信号通路之一,具有重要的生理作用。如前所述,它包含多个分子,其中最重要的是mTORC1。在生理情况下,该通路受到各种生长因子,特别是胰岛素样生长因子的激活,进而发挥调控细胞生长、增殖、凋亡、血管生成以及糖脂代谢的作用。正因为mTOR通路具有如此多样的正常生理功能,当使用其抑制剂(如依维莫司)时,对这些正常生理功能的干扰便会表现为药物的各种不良反应。理解其机制,对于后续管理这些不良反应至关重要。在神经内分泌肿瘤中,mTOR通路是一个呈异常激活状态的通路。mTORC1是该通路的核心环节,亦是依维莫司的核心作用靶点。
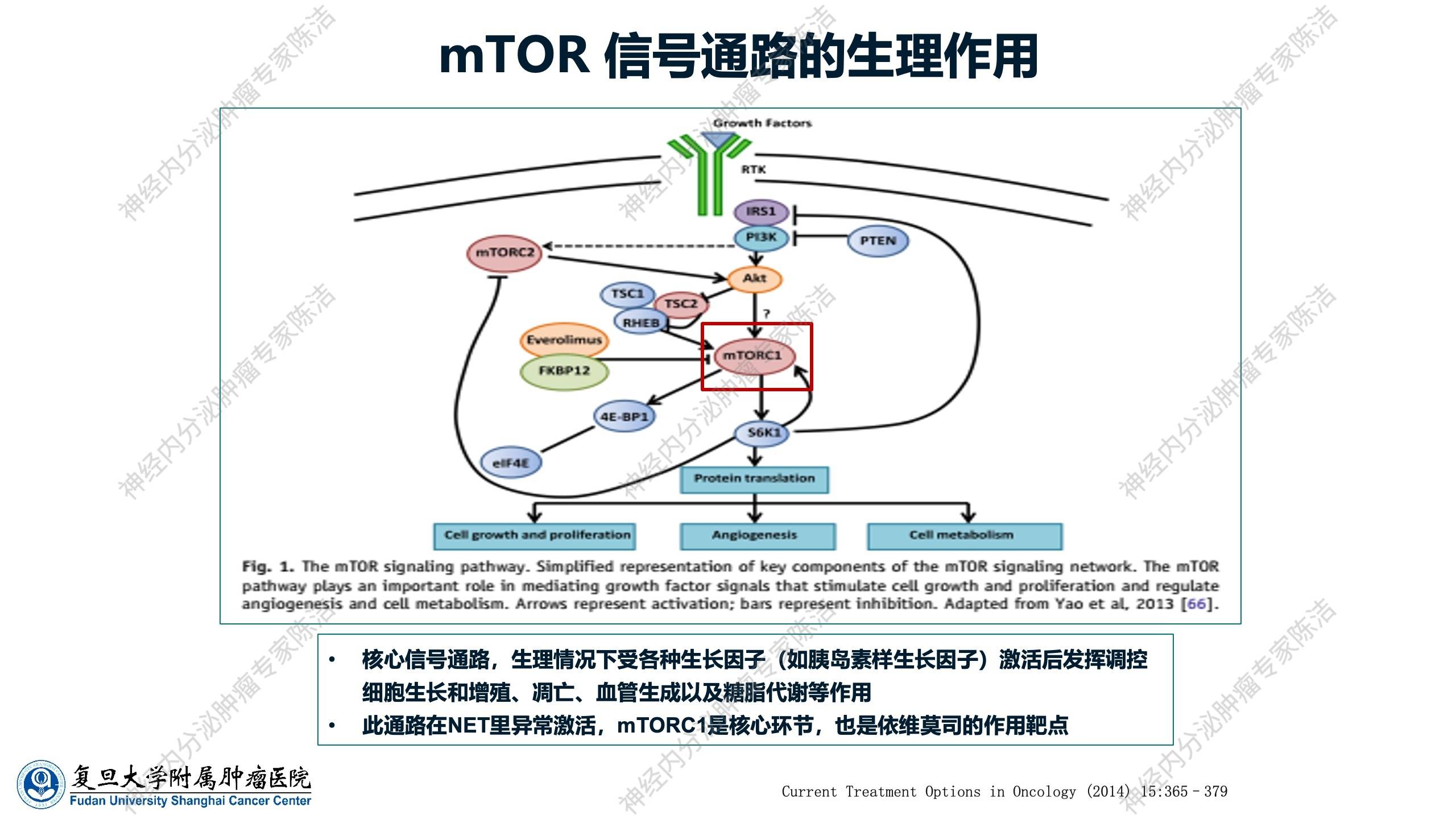
目前,针对mTOR通路各个分子靶点的药物研发众多,但在这众多靶向药物中,只有依维莫司在神经内分泌肿瘤领域成功完成了一系列Ⅱ期、Ⅲ期临床试验,并最终获批用于临床。而其他同类研发药物,或因在研发过程中发现毒性过大而终止,或因被证实无效而失败。因此,在任何肿瘤中,发现一个治疗靶点并成功研发出安全有效的靶向药物,过程均是十分艰辛的。
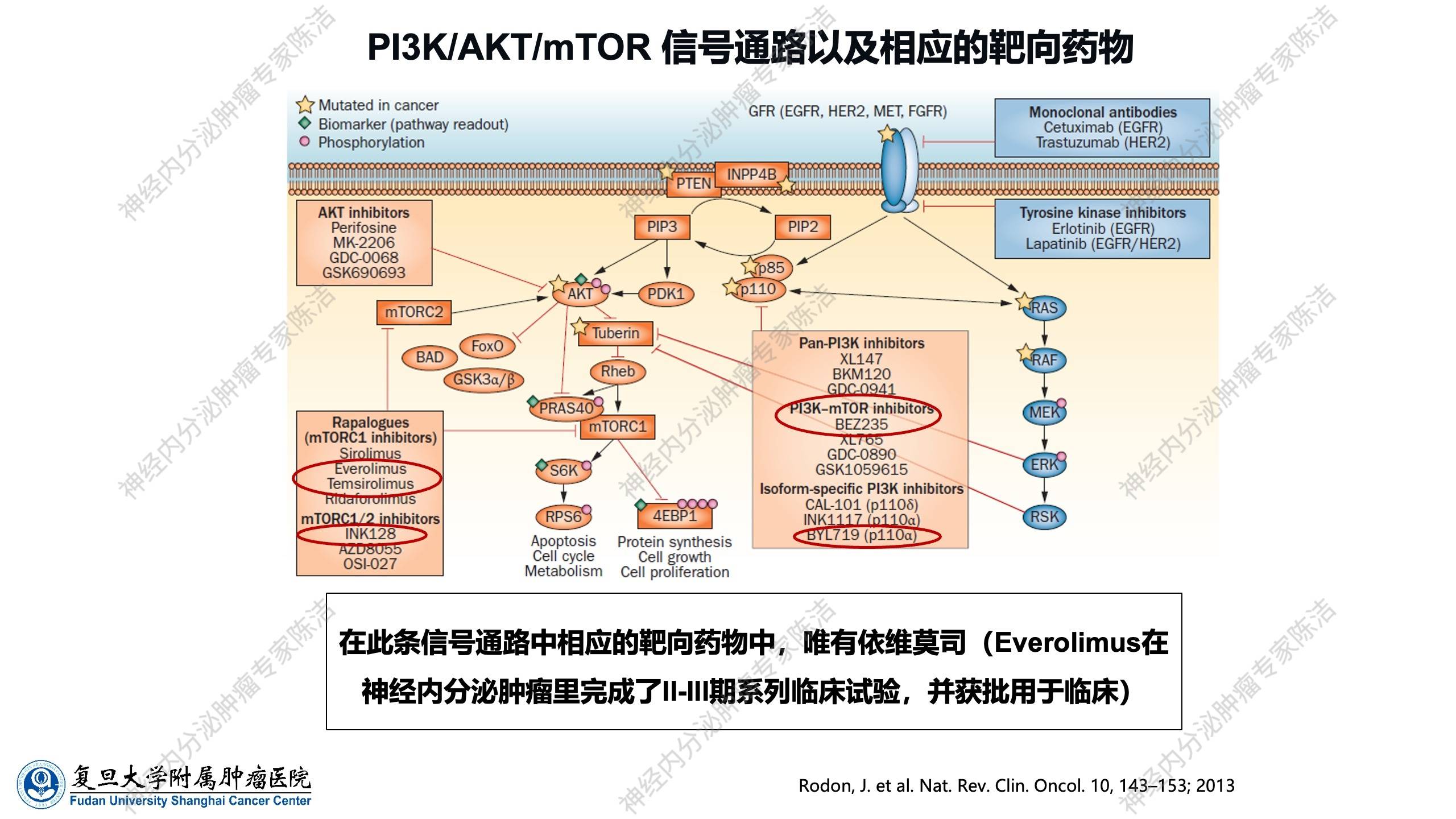
奠定依维莫司临床地位的关键临床试验
1. 依维莫司的早期临床探索
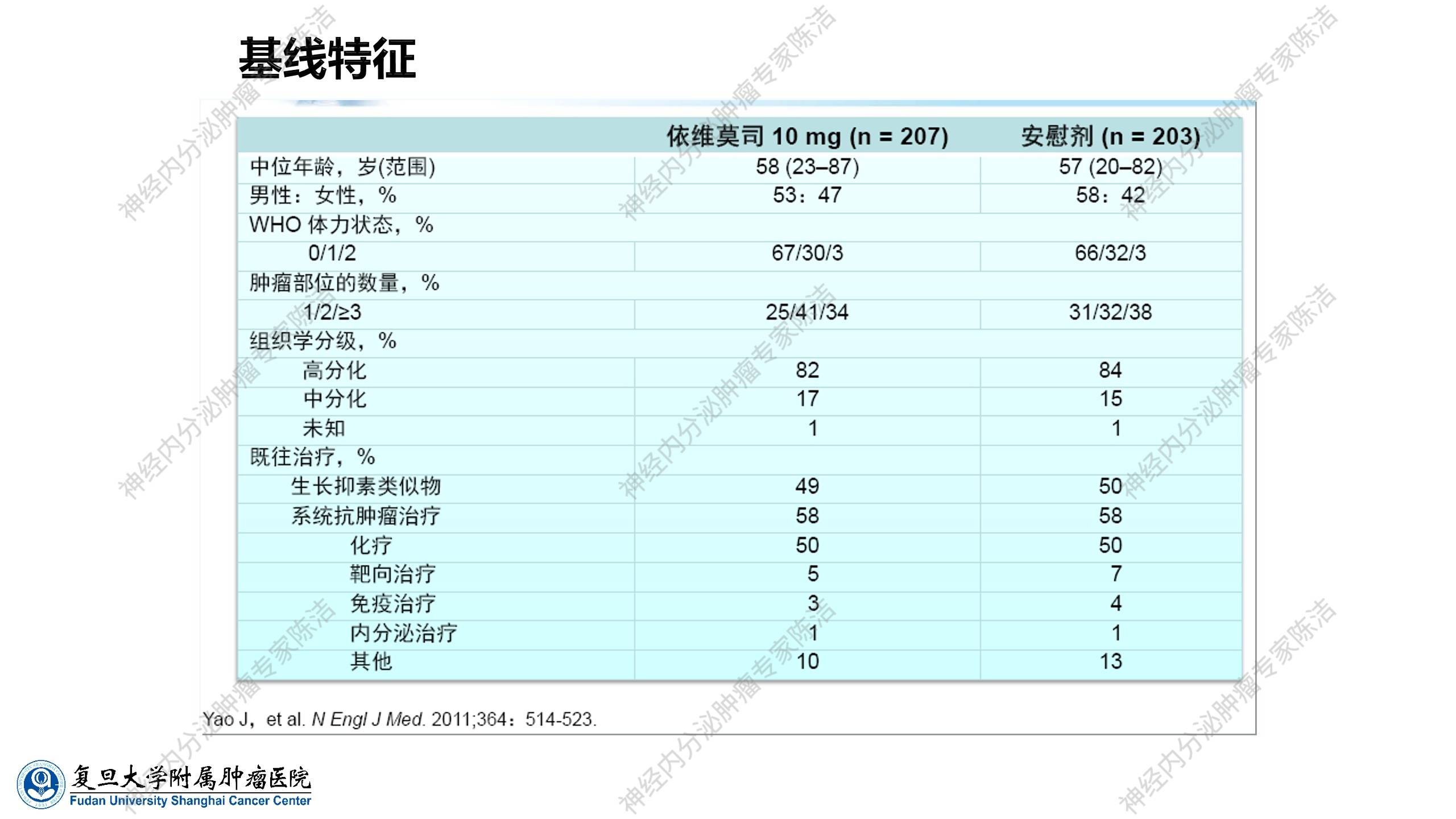
依维莫司作为这场“长跑”中的胜出者,其临床治疗地位是由“RADIANT”系列的关键临床试验奠定的。最早的一项Ⅱ期临床研究发表于2008年。该研究纳入了30例低至中级别(即分化良好)的胰岛细胞瘤(即胰腺神经内分泌肿瘤)和30例类癌(当时除胰岛细胞瘤外的神经内分泌肿瘤的统称)。研究采用了依维莫司口服5mg/日或10mg/日两个剂量,并联合30mg/4周的长效奥曲肽(因为许多患者伴有类癌综合征,需用奥曲肽控制症状)。结果显示:
● 类癌组:客观有效率为17%,中位无进展生存期(PFS)为63周。
● 胰岛细胞瘤组:客观有效率更高,达到了27%,中位PFS为50周。
● 剂量比较:在两个剂量组中,10mg剂量组的效果优于5mg剂量组。
基于这项Ⅱ期研究,后续的Ⅲ期临床试验中,依维莫司的剂量被确定为10mg/日。

基于早期研究中胰岛细胞瘤组显示出更高的客观有效率,RADIANT-1临床研究便聚焦于胰腺神经内分泌肿瘤。该研究纳入160例化疗失败后的胰腺神经内分泌肿瘤患者。其中115例患者入组后使用依维莫司单药治疗,45例患者因入组时无法停药(特别是一些功能性肿瘤),则在保留长效奥曲肽的基础上联合使用依维莫司(10mg/日)。结果发现:
● 单药组:对于化疗失败的胰腺神经内分泌肿瘤,客观有效率为9.6%,中位PFS为9.7个月,中位总生存期(OS)为24.9个月。
● 联合治疗组:客观有效率并未提升,但中位PFS有延长趋势,中位OS未达到。
该Ⅱ期研究进一步证实了依维莫司对胰腺神经内分泌肿瘤的抗肿瘤作用。研究同时提示,若治疗早期观察到生物标志物CgA和NSE水平下降较快,通常预示着更好的疗效和更长的PFS。

2. 依维莫司的里程碑研究:RADIANT-3研究
在两个临床试验奠定基础后,关键的Ⅲ期临床试验RADIANT-3开始进行。该研究针对分化良好的胰腺神经内分泌肿瘤患者,研究全文于2011年发表于《新英格兰医学杂志》,其OS数据于5年后发表在《临床肿瘤学杂志》。作为具有代表性的经典靶向药物,其Ⅲ期临床试验堪称本领域具有里程碑意义的临床研究。

RADIANT-3研究,是一项治疗晚期胰腺神经内分泌肿瘤的随机对照Ⅲ期研究,对比依维莫司与安慰剂的疗效,主要研究终点为无进展生存期(PFS)。
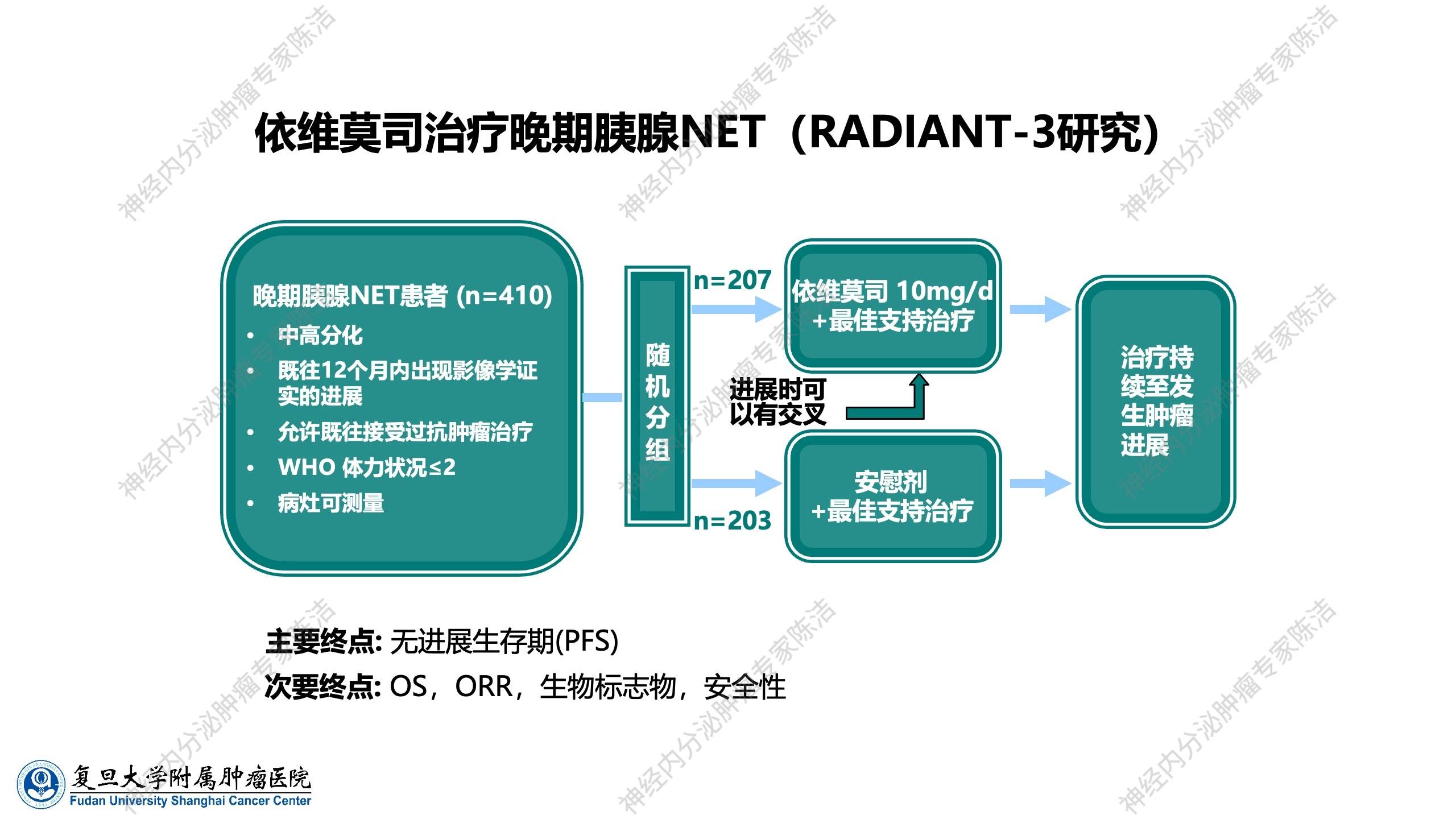
研究纳入的病例在组织学上均为高分化或中分化神经内分泌肿瘤,虽研究未明确划分病理级别,但大部分肿瘤应处于G1或G2级。
结果显示:
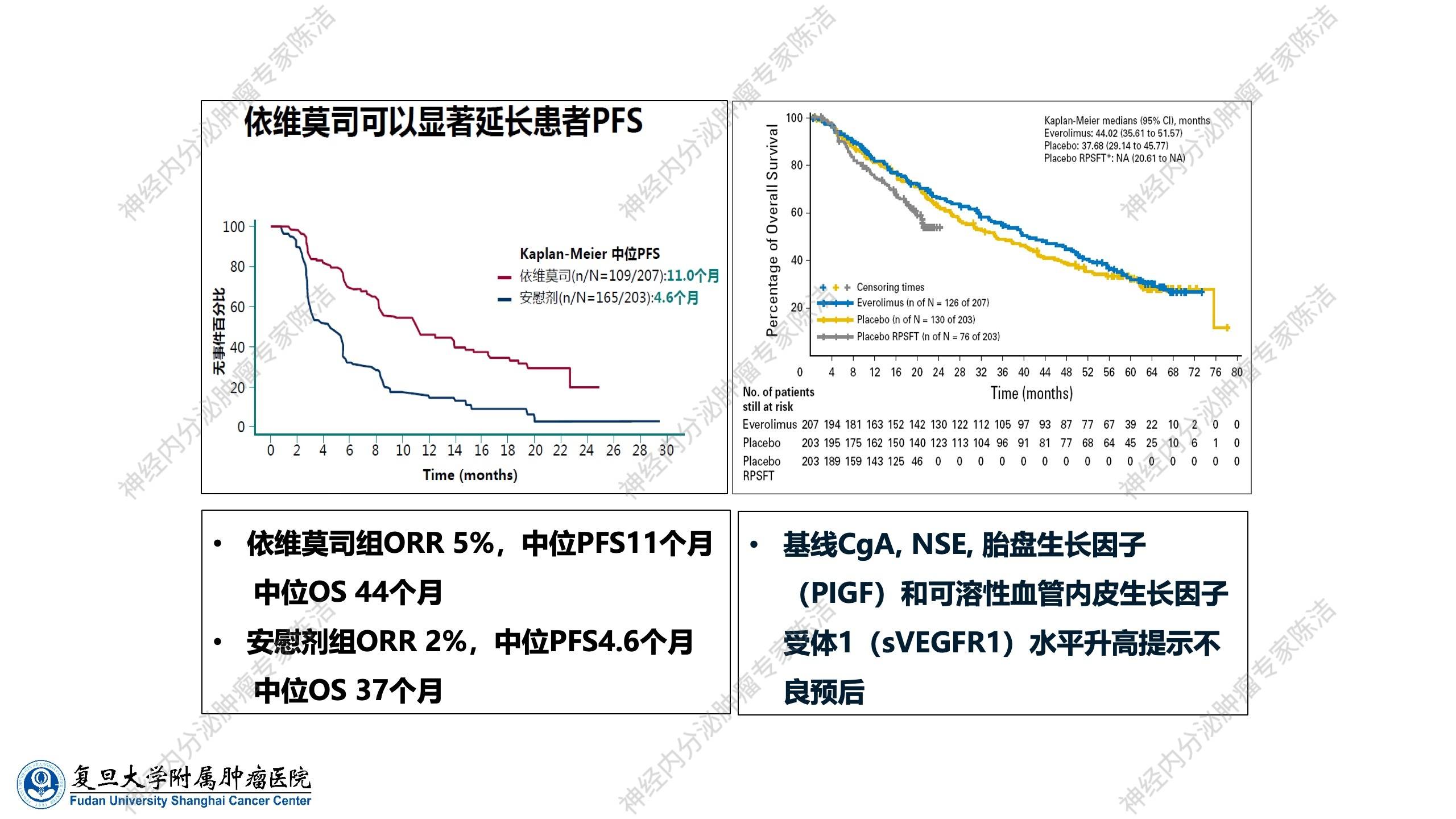
● PFS:与安慰剂组(4.6个月)相比,依维莫司组(11.0个月)显著延长了患者的PFS。
● ORR:依维莫司组为5%,安慰剂组为2%。
● OS:依维莫司组中位OS为44个月,安慰剂组为37个月。
该Ⅲ期临床试验充分证实了依维莫司的抗肿瘤效果。此外,该Ⅲ期临床研究还开展一系列生物标志物的研究,包括CgA、NSE、胎盘生长因子(PIGF)以及可溶性血管内皮生长因子受体1(sVEGFR1)等。研究发现,若这些生物标志物的基线水平升高,患者的预后通常较差。
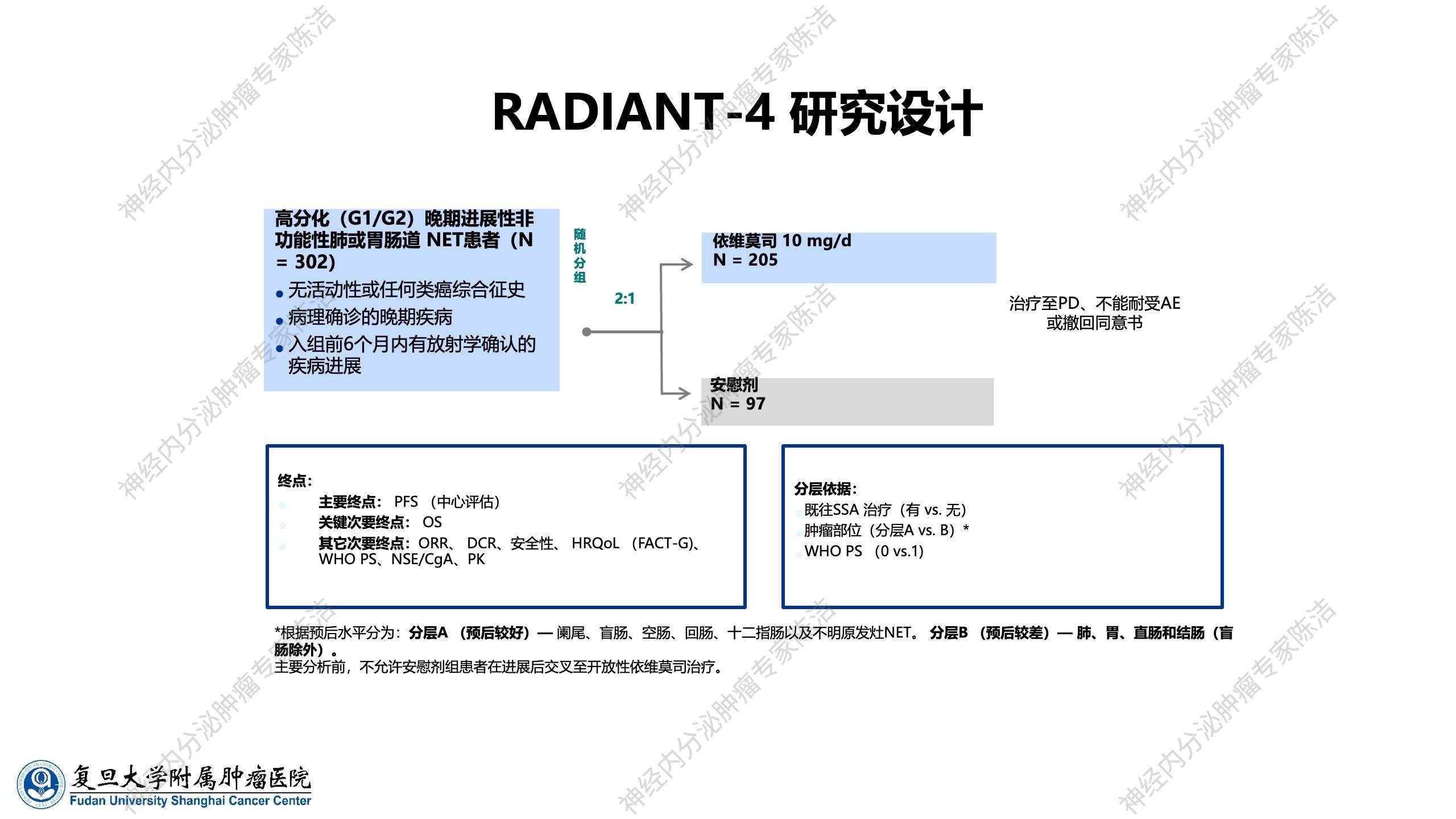
3. 依维莫司在胰腺以外NET的突破:RADIANT-4研究
依维莫司在胰腺神经内分泌肿瘤(约占神经内分泌肿瘤总人群30%)中取得成功后,研究者进而探索其在非胰腺神经内分泌肿瘤(占约60%~70%)中的疗效。RADIANT-4临床研究的设计与RADIANT-3相似,但纳入的是高分化(G1或G2)的进展性、非功能性的肺、胃肠道神经内分泌肿瘤患者,即非胰腺神经内分泌肿瘤。这同样是一项依维莫司对比安慰剂的随机对照研究。

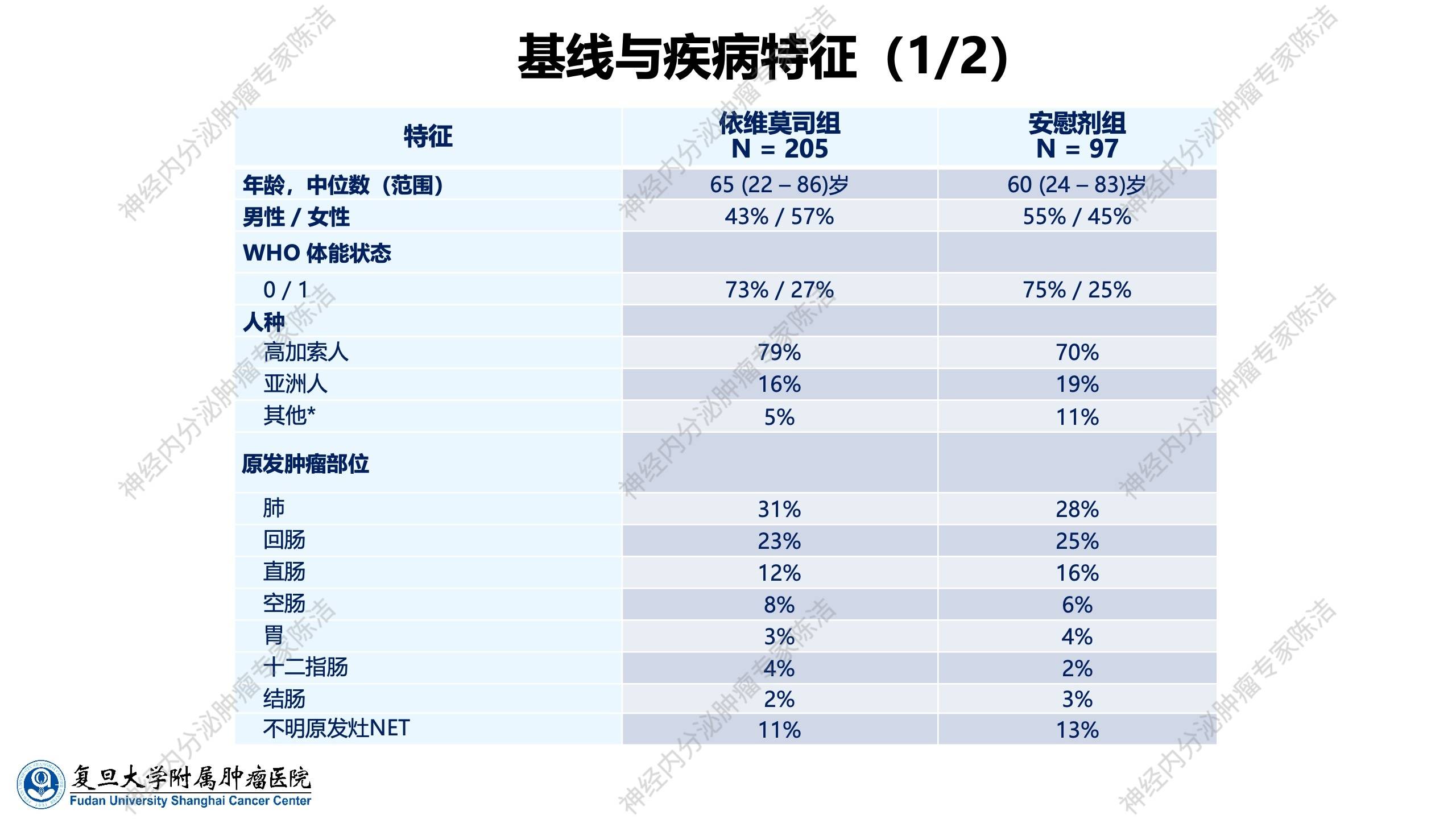
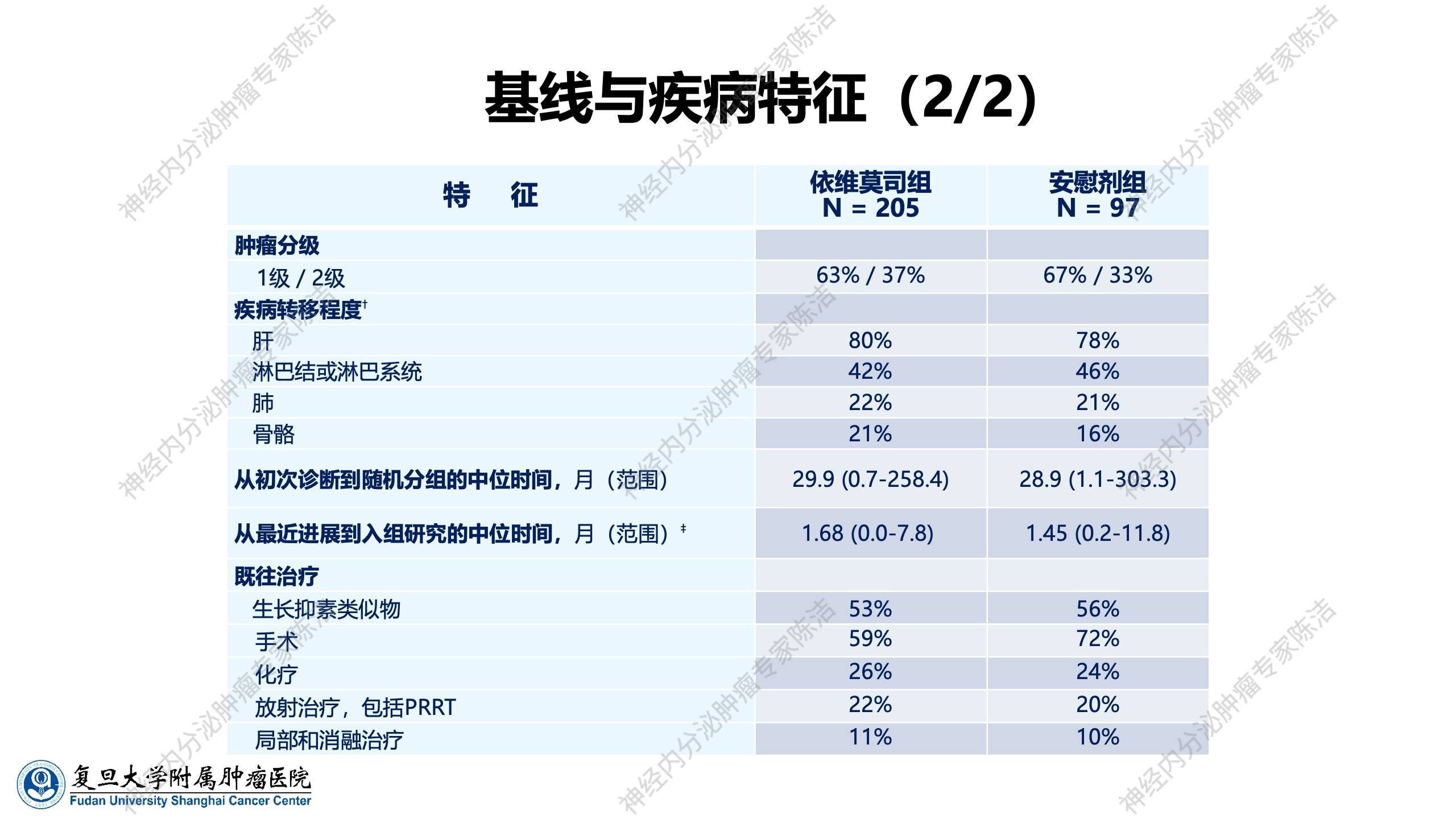
纳入的原发肿瘤部位除了包括肺及胃肠道,实际上还包括了不明原发灶的神经内分泌肿瘤。
研究结果显示:在非胰腺神经内分泌肿瘤中依然取得了与胰腺神经内分泌肿瘤相近的疗效,中位PFS达到了11.0个月(安慰剂组3.9个月)。RADIANT-3与RADIANT-4两项Ⅲ期研究,共同奠定了依维莫司作为神经内分泌肿瘤领域首个基本可以覆盖全部位治疗的靶向药物的临床地位。
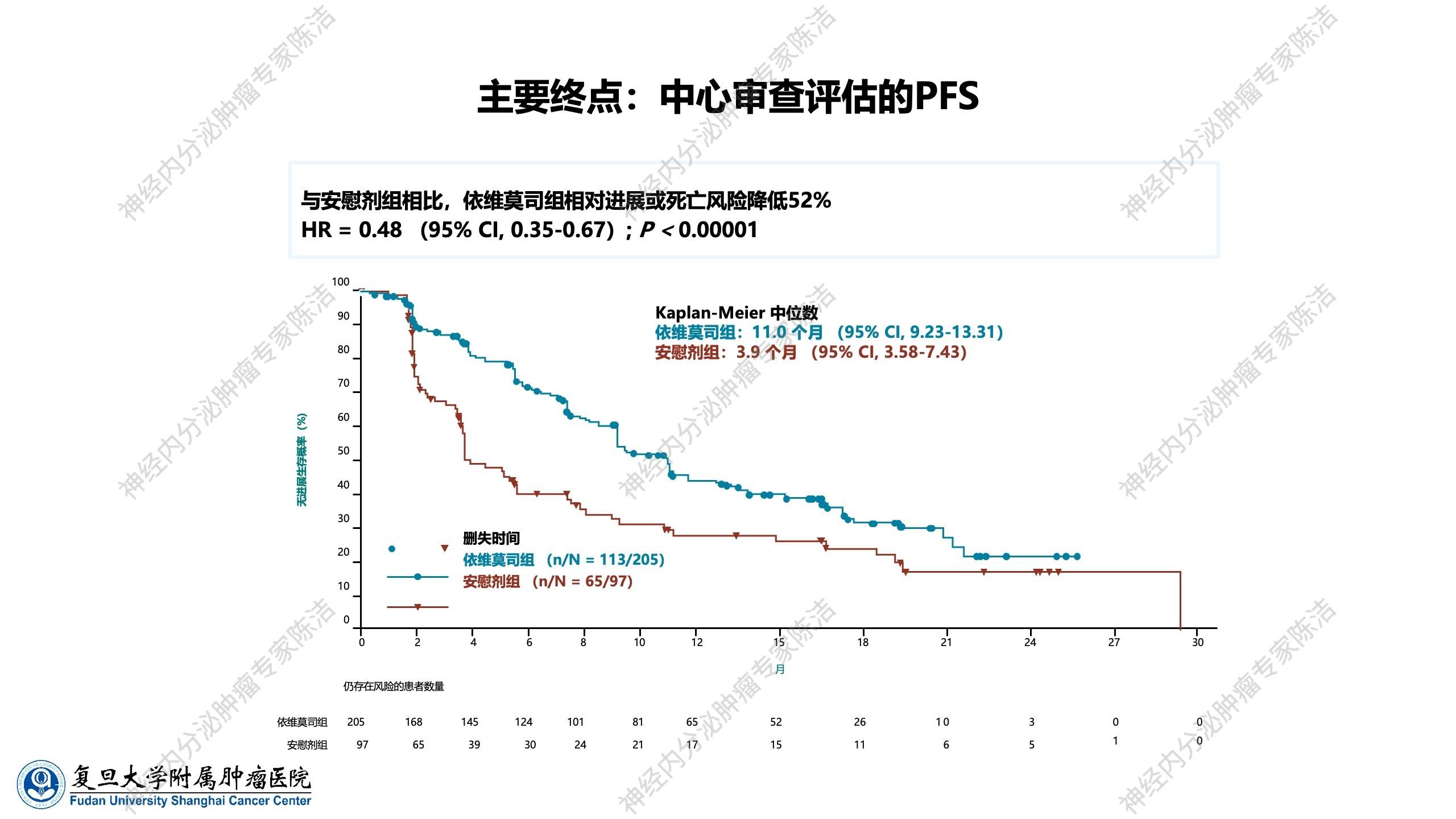
RADIANT-4研究后续还进行了一系列亚组分析,结果陆续发表于各大肿瘤专业杂志。结果显示,无论是肺亚组、胃肠和不明原发灶亚组、东亚患者亚组,还是既往接受过各种治疗的亚组,依维莫司相比安慰剂均显示出显著的PFS延长,奠定了依维莫司单药在各个部位神经内分泌肿瘤中抗肿瘤治疗的地位。

4. 依维莫司联合用药的探索:RADIANT-2和LUNA研究
在依维莫司单药取得成果的同时,研究者也在探索联合治疗的可能。早期研究中已有部分患者接受了依维莫司联合SSA的治疗,且似乎取得了“1+1>2”的疗效。RADIANT-2研究(Ⅲ期)即专门设计用于探讨依维莫司联合SSA(长效奥曲肽)是否能实现“1+1>2”的疗效。

该研究纳入了高/中分化肺、胃、肠道、不明原发灶伴有类癌综合征的神经内分泌肿瘤患者。试验组为依维莫司(10mg/日)+长效奥曲肽(30mg/4周),对照组为安慰剂+长效奥曲肽(30mg/4周)。主要终点为中位PFS。
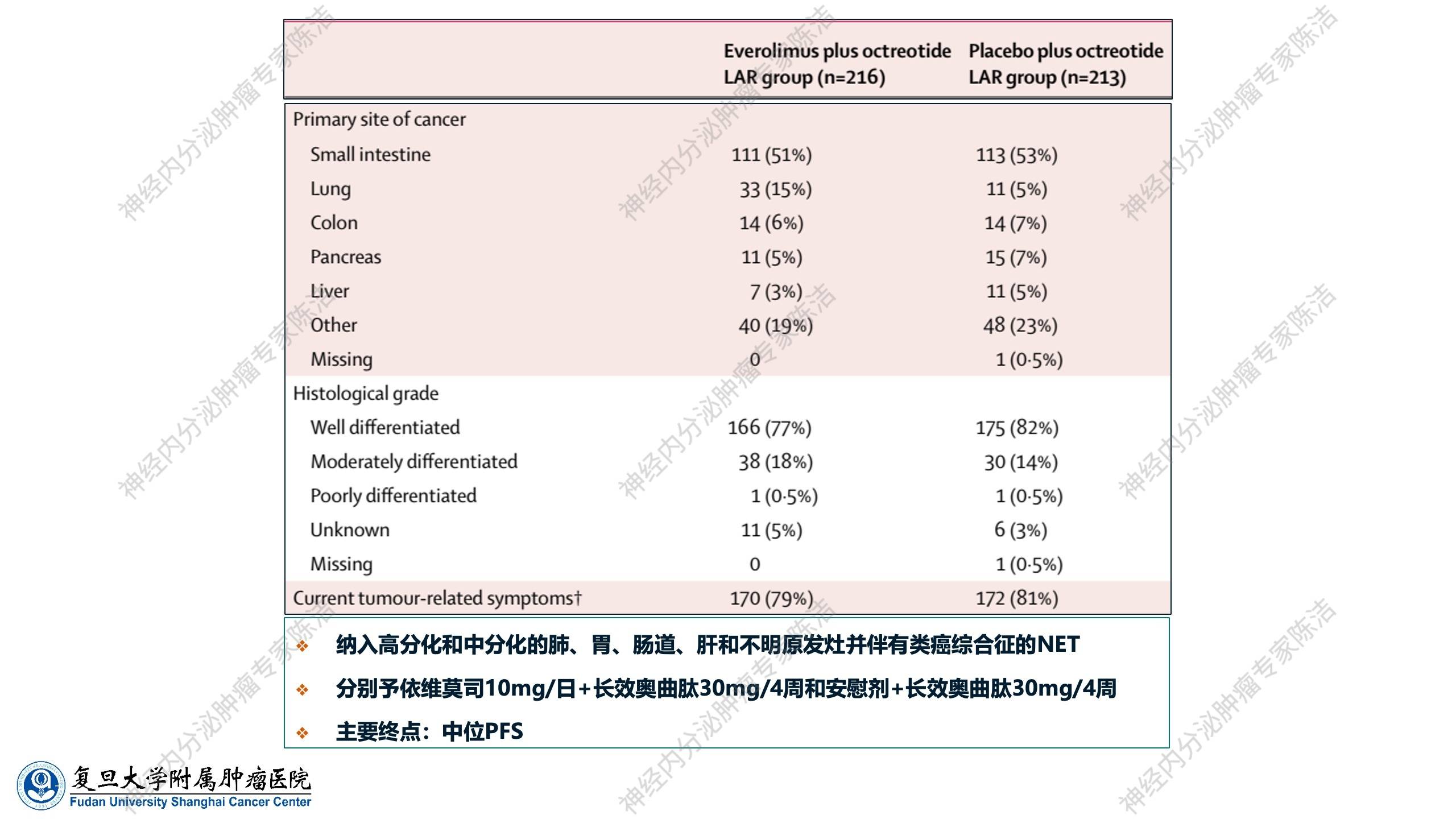
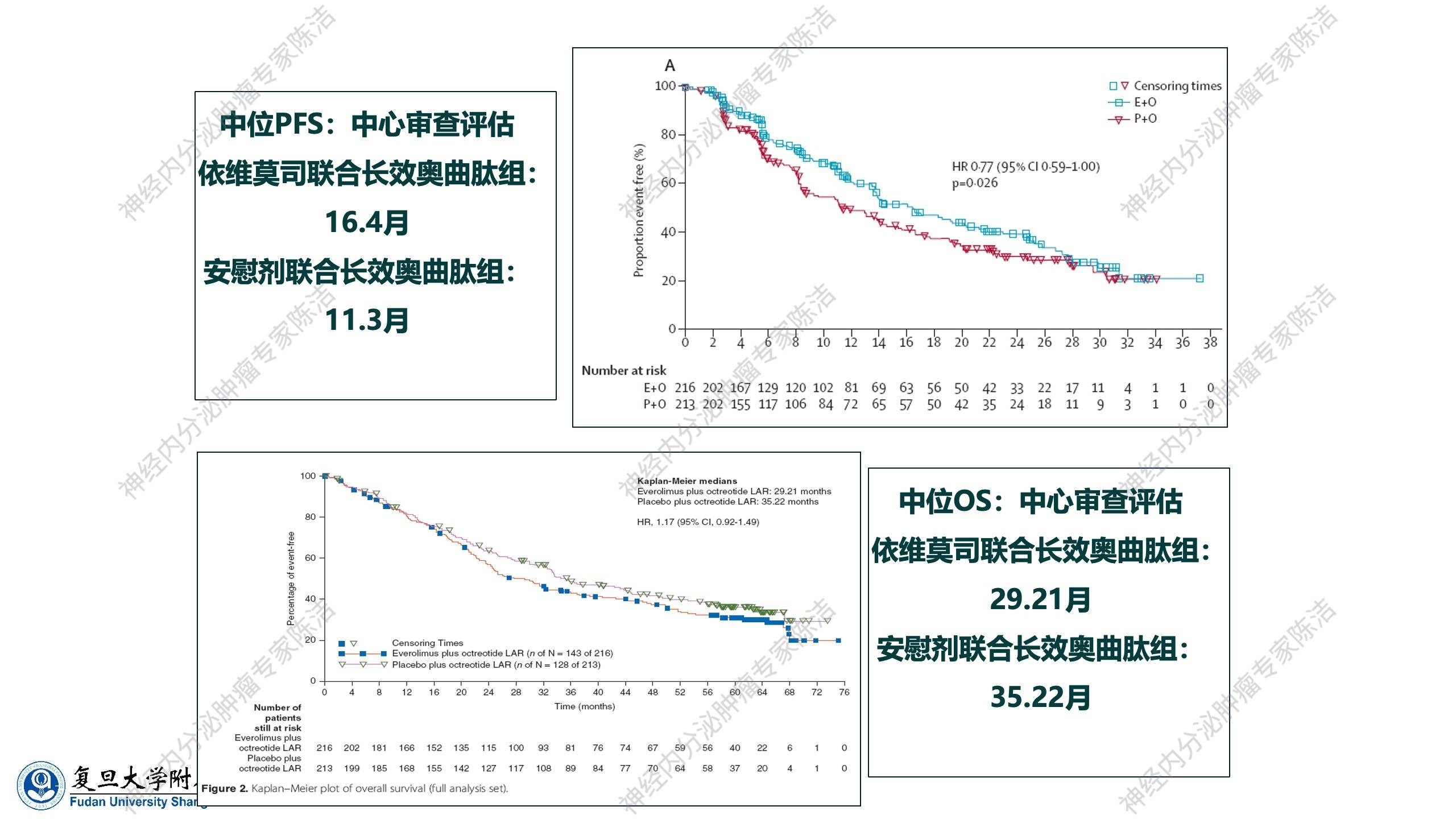
该研究的总结果是令人遗憾的,联合用药PFS仅轻微升高,而OS并未有显著延长。
在后续的亚组分析中,有一个重要的亚组结果值得重视:
● 肺亚组:试验组中位PFS为13.63个月,对照组为5.59个月(未达统计学意义)。
● 结直肠亚组:试验组PFS长达29.9个月,而对照组为6.6个月。
在结直肠亚组中,联合治疗获得了统计学意义上的“1+1>2”的PFS延长效果。鉴于中国神经内分泌肿瘤患者中,胰腺神经内分泌肿瘤最多,其次即为直肠神经内分泌肿瘤,因此,该亚组结果对于指导中国临床实践具有重要价值:当依维莫司或长效奥曲肽单药治疗失败后,部分患者可重新将这两种药物进行联合使用,仍可能获得一段时间的肿瘤稳定。此外,既往接受过奥曲肽治疗的患者对依维莫司联合长效奥曲肽组的PFS延长并无影响。

除了长效奥曲肽和依维莫司联合,SSA还包括兰瑞肽和帕瑞肽。帕瑞肽是最新一代SSA,与前两者不同。奥曲肽和兰瑞肽主要作用于SSTR2型和SSTR5型,而帕瑞肽除SSTR4型结合不佳外,对SSTR 1、2、3、5型均具有高亲和力。LUNA研究(Ⅱ期)针对胸部(肺和胸腺)神经内分泌肿瘤,探索帕瑞肽联合依维莫司的疗效。
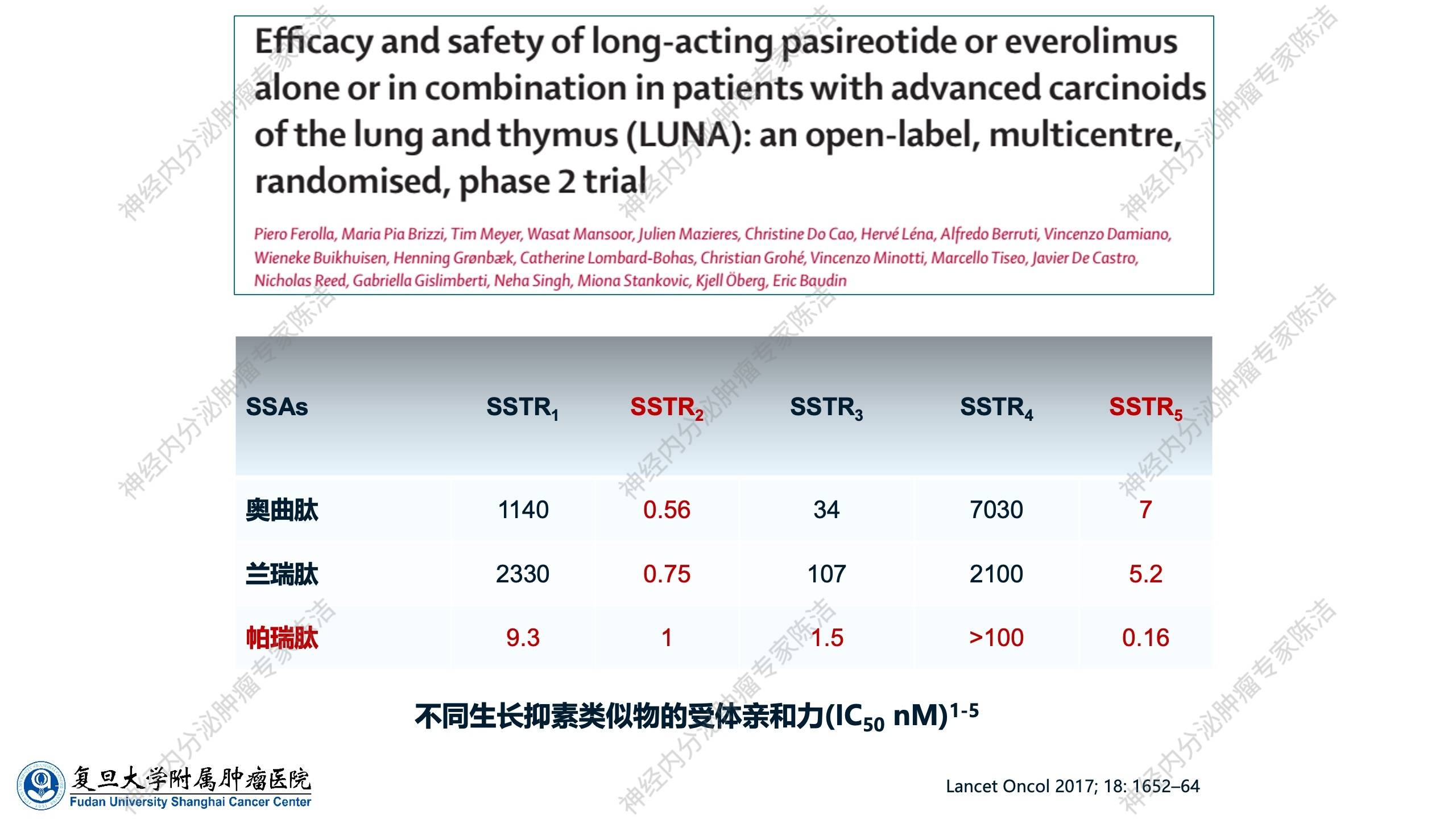
LUNA研究设计具有明确的目标性,设置了3个组:一组予以长效帕瑞肽单药组、一组予以依维莫司单药组、一组予以帕瑞肽联合依维莫司组,旨在探究联合用药是否能产生“1+1>2”的效果。
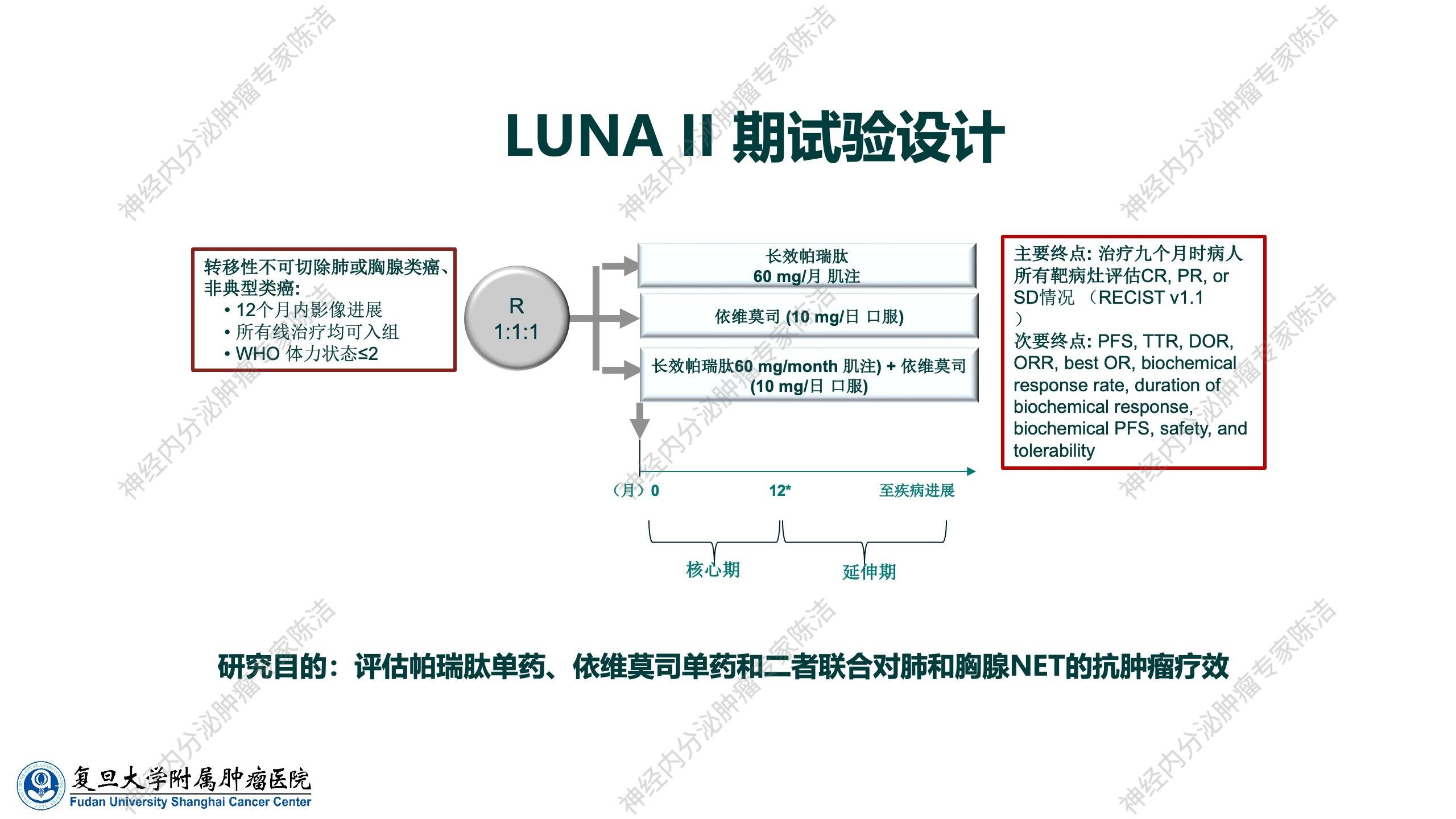
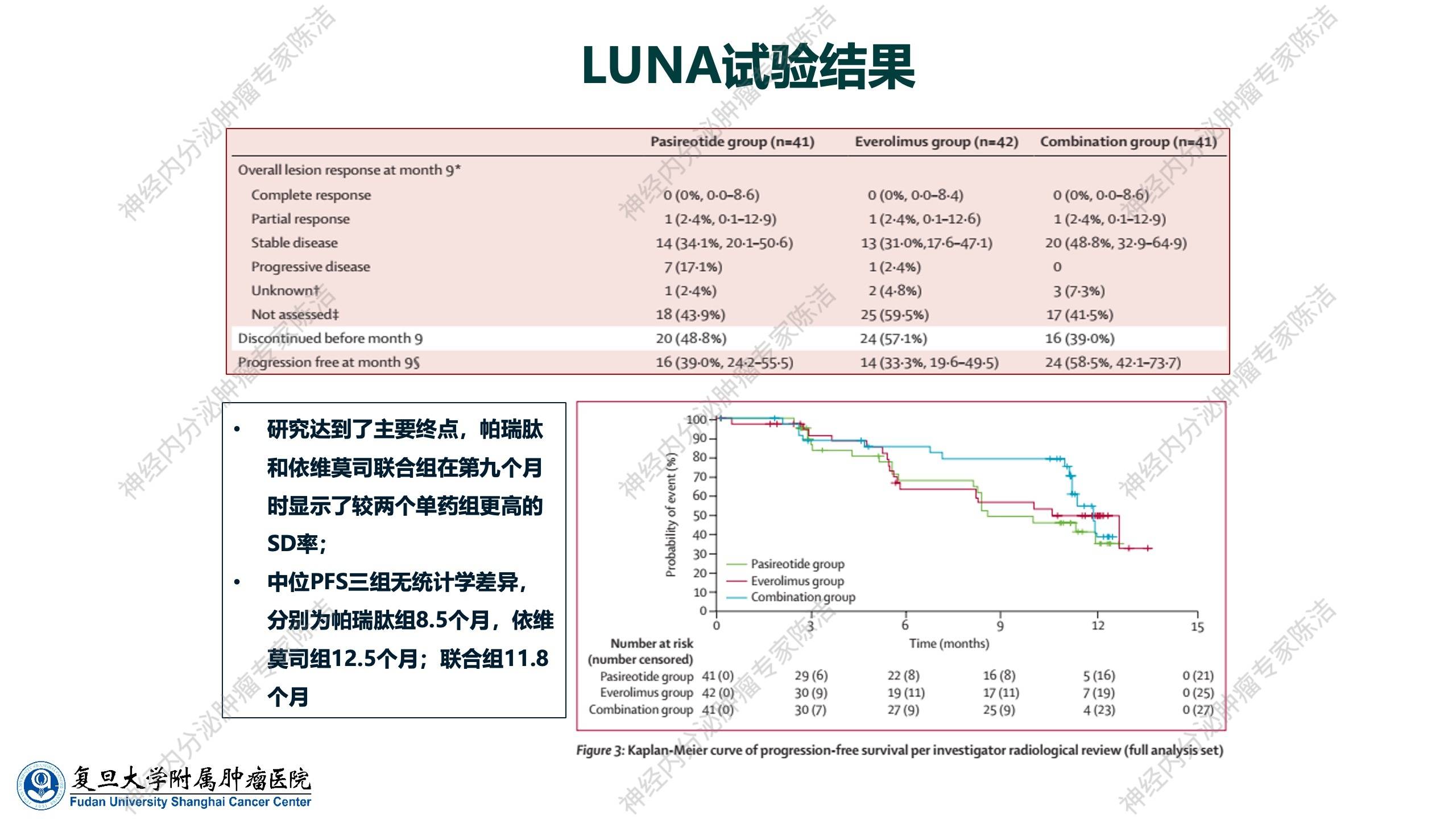
该研究的主要终点是治疗9个月时患者所有靶病灶评估CR、PR、SD情况。研究结果显示,该研究达到了主要终点:在第9个月时,帕瑞肽联合依维莫司组显示了比两个单药组更高的SD率。然而,在临床医生可能更关心的PFS方面,三组间并无统计学差异,联合组并未显示出显著的PFS延长。因此,该研究总体而言仍是一个阴性结果,未能在胸部神经内分泌肿瘤中证实1+1>2的效果。
依维莫司毒性管理
基于上述一系列临床试验,我们对依维莫司的作用靶点研发过程有了一定了解,同时明确了不同临床试验所解决的临床问题。这也有助于我们界定临床上适宜采用依维莫司进行治疗的患者群体。在临床实践中,除了关注其疗效(正作用),也需管理其副作用。作为mTOR受体抑制剂,依维莫司具有其靶点相关的特殊毒性。主要毒性包括:口腔炎(40%~60%)、感染(23%)、间质性肺炎(17%)、高血糖(5%),还有皮疹、腹泻、疲倦、高血脂等。

依维莫司主要毒性管理包括:
口腔炎:是依维莫司最常见的不良反应之一。通常在开始用药的4周内发生。约20%的患者会因此需要减量或无法继续用药。对于口腔炎,可采用含激素漱口水进行治疗,效果通常较好。
各种机会性感染:mTOR信号通路对免疫功能亦至关重要,依维莫司对该信号通路的抑制,会对人体免疫功能产生较为明显的抑制作用。在免疫抑制状态下,患者易出现各类机会性感染,或导致体内潜在感染激活。因此,在应用依维莫司时,需对机体内部各类潜在感染开展常规筛查。若患者为乙肝病毒携带者,则需进行全程预防性抗病毒治疗。并且,在治疗期间,患者出现的任何轻微不适症状均需予以高度重视,即使只是普通感冒,在这类患者群体中也可能引发严重后果。由此可见,依维莫司使用过程中,对于机会性感染的控制非常重要。
糖脂代谢紊乱:依维莫司对糖脂代谢均有影响。可引起高血糖和高血脂。在治疗过程中,一旦出现高血糖或高血脂,需要尽早使用降糖和降脂药物进行干预。
非感染性间质性肺炎:通常在治疗开始后两个月左右出现。因此,治疗前必须进行胸部CT、肺功能检查等筛查。轻度的间质性肺炎可以通过药物减量处理;但如果出现中到重度间质性肺炎,则需要立即停药,并采用激素进行治疗。
鉴于依维莫司不良反应发生率较高,推荐依维莫司以5 mg/天为起始剂量,每1~2周评估患者的不良反应,对可耐受者可考虑增量,每次增量为2.5 mg,直至可耐受的最大剂量进行维持(每天最多10 mg)。

靶向药物选择:依维莫司 vs 舒尼替尼
依维莫司在功能性神经内分泌肿瘤——胰岛素瘤的治疗中具有较为显著的作用。因为依维莫司不良反应即会引发高血糖。而胰岛素瘤作为一种功能性肿瘤,其主要问题在于低血糖,这是由于肿瘤分泌胰岛素会致使患者出现严重低血糖症状。因此,在胰岛素瘤的治疗中,若需选择靶向药物,建议优先考虑依维莫司。这是利用依维莫司升高血糖这一副作用,使其在胰岛素瘤治疗中发挥既抗肿瘤又升高血糖的双重效应。

下述表格所呈现的两类靶向药物中,一类是抗血管生成的靶向药物,以舒尼替尼为代表;另一类是以mTOR受体抑制剂依维莫司为代表的药物。在临床实践中,这两种药物针对胰腺神经内分泌肿瘤开展的Ⅲ期随机对照临床试验所展现出的疗效较为相近。因此,在临床应用时,需综合考量患者的基础状况以及药物的毒副作用进行优选。
如果患者合并高血压、心血管疾病、有出血倾向或存在胃肠道穿孔/瘘风险时,应倾向于优选依维莫司。反之,如果患者合并有糖尿病、肺功能不佳时,此时可考虑优选抗血管生成靶向药物。胰岛素瘤具有独特性,因其存在低血糖问题,故而在选择靶向药物时,依维莫司为优先考虑的药物。

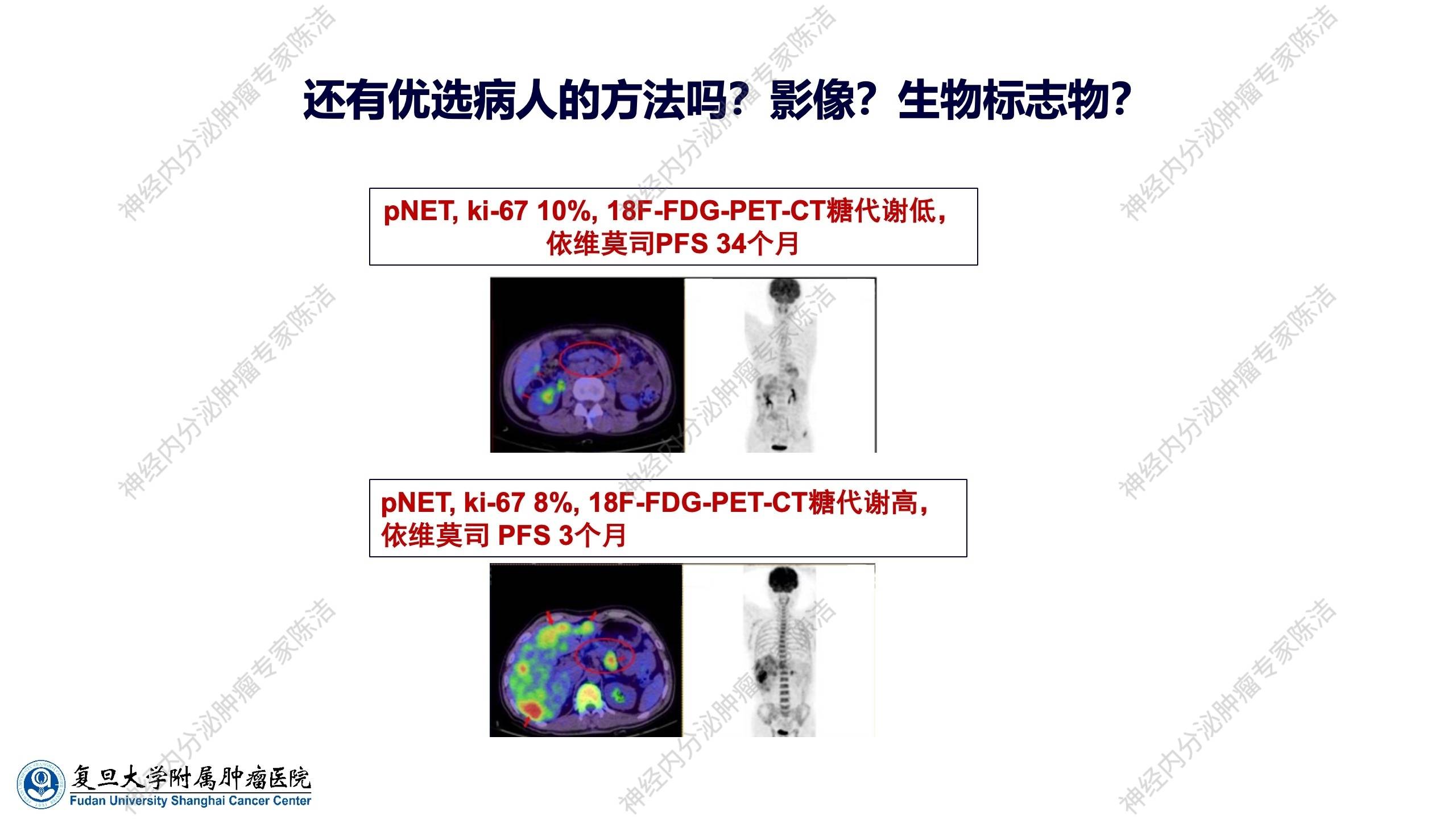
除了根据基础疾病进行优选,临床上仍在探索是否有其他方法(如影像学或生物标志物)来帮助优选病人。一些临床病例观察提示了功能影像学(如18F-FDG-PET-CT)的潜在价值。有两例均为胰腺神经内分泌肿瘤肝转移、病理分级G2(Ki-67 8%~10%)的患者:
● 患者A:其Ki-67为10%,18F-FDG PET-CT提示肿瘤的糖代谢低。该患者使用依维莫司治疗后,PFS时间长达34个月。
● 患者B:虽然Ki-67略低,但其肿瘤的糖代谢非常活跃。该患者使用依维莫司治疗后,PFS时间仅3个月。
这一对比提示,功能影像学或许可以辅助筛选那些能从依维莫司治疗中获得更长久获益的患者。这有待影像学科医生与临床医生共同深入探讨。在依维莫司的临床试验中,曾探讨过CgA、NSE等生物标记物。研究提示,这些标记物在治疗早期的水平下降,预示着可能更长的PFS。然而,目前仍缺乏更具靶点特异性的生物标记物,来指导临床精准优选适合依维莫司治疗的患者,这仍是未来的研究方向。
mTOR受体抑制剂未来研究方向
依维莫司作为临床使用已超10年的经典靶向药物,其靶点(mTOR)在神经内分泌肿瘤领域仍是研究热点。未来的研究方向主要包括:研发新型mTOR抑制剂,例如可同时靶向mTORC1和mTORC2的抑制剂(依维莫司主要靶向mTORC1),目前正在开展I期临床研究;或靶向mTOR上游关键靶点(如PI3K)的抑制剂,目前已有PI3K抑制剂正在进行I期临床;曾有研发同时阻断mTOR和PI3K的双靶点抑制剂,但该Ⅱ期临床试验中因毒性过大且疗效未超单靶点而被终止。
依维莫司应用拓展:探索依维莫司在神经内分泌癌中的应用。神经内分泌癌能否将其作为二线治疗方案并与化疗联合应用,值得深入探讨。鉴于神经内分泌癌的治疗难度大且缺乏创新性疗法,依维莫司与化疗联合治疗神经内分泌癌的可行性值得研究。此外,神经内分泌癌化疗后能否采用依维莫司进行维持治疗,以及依维莫司能否与抗血管生成靶向药物、PRRT等联合应用,均为临床上拓展其应用范围的研究思路。目前,上述研究均处于Ⅱ期临床试验阶段,有望在未来几年陆续获得相关研究报道。这也构成了mTOR受体抑制剂未来的研究方向。

依维莫司治疗病例分享
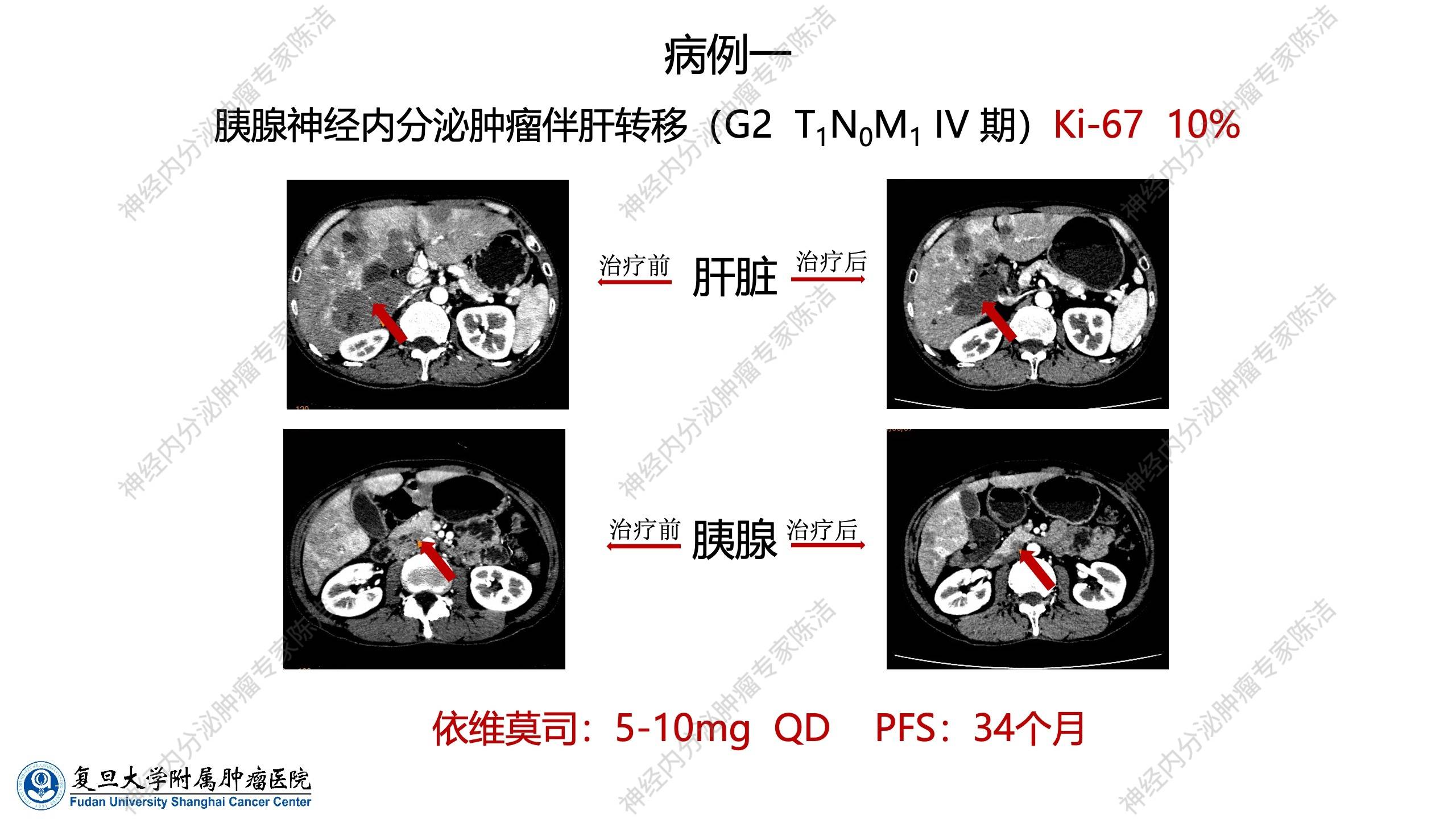
病例一:
该病例为胰腺神经内分泌肿瘤,Ki-67指数10%(G2),诊断时即伴有弥漫性肝转移,肝脏肿瘤负荷较高,而胰腺原发灶并不大。其18F-FDG-PET-CT提示肿瘤糖代谢不活跃。该患者接受依维莫司治疗后,取得了非常好的疗效,最佳疗效达到了部分缓解(PR),其PFS时间长达34个月。这是依维莫司单药治疗胰腺神经内分泌肿瘤中疗效极佳的个案。
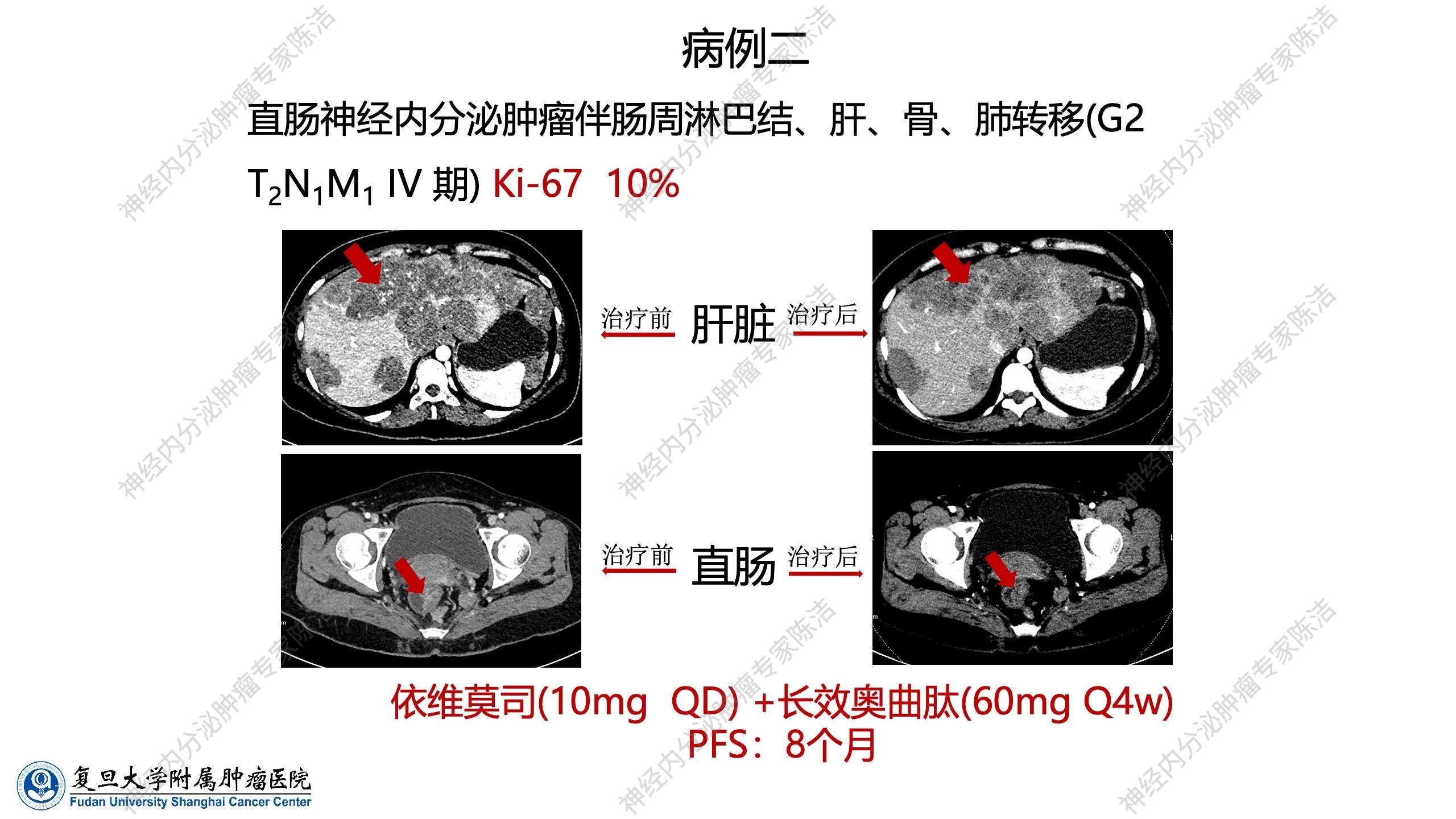
病例二:
患者为直肠神经内分泌肿瘤,Ki-67指数10%(G2),伴有广泛肝转移,肿瘤负荷非常高,同时伴有肠周淋巴结、骨、肺等多处转移。该患者在治疗过程中,先后经历了依维莫司单药治疗失败,以及增加长效奥曲肽剂量(60mg)治疗亦失败。依据RADIANT-2临床研究结直肠亚组的阳性结果提示,为其采用了依维莫司(10mg/日)联合长效奥曲肽(60mg/4周)的治疗方案。联合治疗后,该患者在重度肿瘤负荷情况下,仍获得了8个月的PFS,且在疗效最佳时,肿瘤较前亦有一定程度的缩小。该病例验证了RADIANT-2结直肠亚组结果的临床指导价值,即依维莫司联合SSA在直肠神经内分泌肿瘤中可作为一种有效的治疗选择。
总结与展望
依维莫司作为神经内分泌肿瘤两大代表性靶点的治疗药物之一,已被国内外主要临床治疗指南所推荐。推荐其用于晚期不可切除、分化良好(G1或G2)的胰腺、肺、小肠、不明原发灶的神经内分泌肿瘤,或胸部的类癌及非典型类癌。神经内分泌肿瘤虽是小瘤种,但学术领域发展活跃,目前国内外已有多个指南可供参考。在临床实践中,临床医生应在掌握指南规范的基础上,优化包括依维莫司在内的各种治疗药物的使用顺序并注重不良反应管理,使神经内分泌肿瘤患者得到更好的诊治。
更多精彩病例,可点击或复制以下链接,粘贴到浏览器查看依维莫司在神经内分泌肿瘤治疗中的合理应用及全程管理视频回放:
https://doctor.liangyihui.net/#/doc/79935

本文仅供健康科普使用,不能作为诊断、治疗的依据,请谨慎参阅。











 苏公网安备32059002004080号
苏公网安备32059002004080号


