多发性骨髓瘤(MM)是一种以恶性浆细胞克隆性增殖为特征的血液系统肿瘤。骨骼系统是MM最常累及的靶器官之一,由此引发的骨相关事件(SREs),如病理性骨折及脊髓压迫,不仅严重损害患者的生活质量,也对其总体生存结局构成显著不良影响。
地舒单抗作为一种靶向RANKL(核因子κB受体活化因子配体)的全人源化单克隆抗体,可特异性地与RANKL结合,进而阻断其介导的破骨细胞形成、活化与功能,从而有效抑制骨吸收,延缓SREs的发生。为进一步阐明以地舒单抗为代表的骨保护药物在临床实践中的应用价值,【肿瘤资讯】特邀上海市第六人民医院常春康教授,将通过一则真实世界的病例对此进行深度解析。
上海市第六人民医院血液科主任,上海血研所副所长。
中国老年血液学会副会长
MDS专委会主任委员
中国血液医师协会委员
中华血液学会红细胞学组委员
医促会血液学会委员
CACA MDS/MPN学组副组长
CSCO中国抗白血病联盟委员
中国免疫血液学会委员
中国罕见血液病工作组委员
上海血液学会副主任委员,红细胞学组组长
CACA上海抗癌协会理事
上海血液肿瘤副主任委员
上海市医学领军人才
中华血液杂志、中国实验血液学杂志编委。
在国内外核心期刊发表论文300余篇,其中SCI论文100余篇(Nature communication、Blood、Pnas、Hematologica、BJH等)。
病例基本信息及诊疗经过
患者基本信息
女性患者,51岁
主诉:胸壁疼痛1年,诊断“MM”11月,拟治疗。
现病史:2024年2月该患者活动后出现双侧胸壁疼痛,伴腰骶部胀痛,伴泡沫尿于当地中医院行胸部CT示,左侧肩胛骨、双侧多发肋骨、胸骨及多个胸椎椎体多发斑点状低密度影,MM?转移?2024年3月26日,该患者为进一步诊治来我院。
既往史:诊断“高血压”2年,血压控制可,无“糖尿病”等病史。
辅助检查
RBC:2.98x1012/L;Hb:95 g/L;PLT: 145x109/L;LDH:442 u/L;肌酐:74 umol/L;β2微球蛋白:24.35 mg/L;M蛋白:2.1 g/L;血钙:3.42mmol/L;白蛋白:44g/L;
免疫固定电泳:κ轻链 阳性;
影像学检查:该患者全身多骨弥漫斑片状骨质破坏伴部分病灶代谢稍增高(明显者位于胸骨,SUVmax约3.9),左侧胫骨上段髓腔病灶,均考虑多MM可能大,请结合病理除外其他;脊柱退行性变;双侧筛窦、上颌窦炎;左侧乳突炎。双侧颈部淋巴结反应性改变可能;颅骨、颈胸腰椎椎体及附件、骶椎内多发异常信号,考虑MM可能,请结合临床;C3/4、C4/5椎间盘轻度向后突出;

检查所示双侧肱骨、双侧肩胛骨、双侧肋骨、胸骨、胸腰椎椎体及附件、骶椎、骨盆诸骨、双侧股骨上段内多发斑片状低密度影,部分骨皮质不连续,考虑MM可能,请结合临床及实验室检查;
蛋白电泳+固定电泳+免球8项:κ轻链-CIT阳性;α1球蛋白5.20;
MM荧光原位杂交:1q21(1q):阳性;D13S319/CEP12:阳性;IGH-FGFR3[t(4;14)]:阳性;IGH(14q):阳性;
免疫组化结果:CD20(-),CD79a(+),CD3(散在+),CD38(+),CD138(+),MUM-1(+),K轻链(+),λ轻链(-),OCT-2(+),Bob.1(+),Ki-67(+10%)。
骨髓细胞检验:符合MM骨髓象;
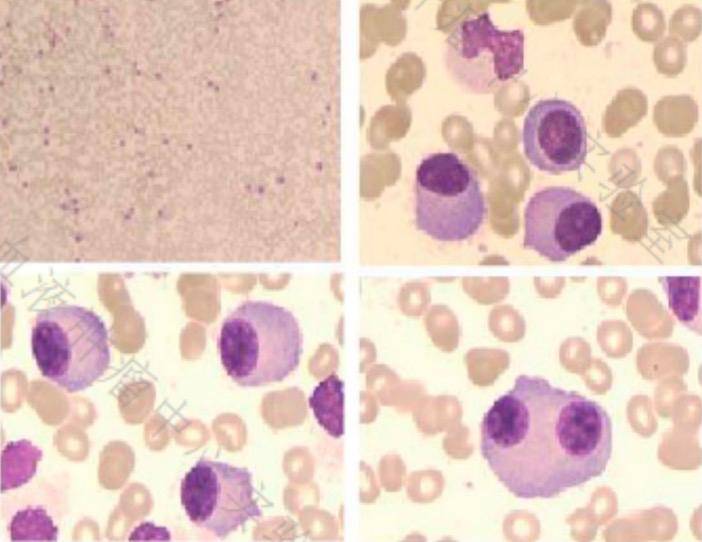
流式细胞检验:本次检测范围内,42.68%细胞(占有核细胞)为恶性单克隆浆细胞;
诊断
MM(轻链к型)(DS分期IIIB期,ISS分期III期,R-ISSIII期);高血压病1级(低危);骨质破坏;疼痛;
入院后治疗
2024.3.29-4.19:该患者接受VRD方案(硼替佐米、来那度胺、地塞米松 )+地舒单抗治疗2程后,达部分缓解(PR),但疼痛缓解不明显;
2024.5.23-6.28:该患者接受DPD方案(达雷妥尤单抗 、泊马度胺、地塞米松)+地舒单抗治疗2程后,达完全缓解(CR)。患者的κ轻链转阴,LDH及β2微球蛋白水平下降。另外,对比2024年5月20日旧片,患者的病灶较前减少,大部分范围较前缩小,余变化不明显;
2024.8.6:该患者进行干细胞采集。6.72x106/Kg;
2024.8.19:该患者接受DKPD方案(达雷妥尤单抗、卡非佐米、泊马度胺、地塞米松)+地舒单抗治疗1程;
2024.9.20:该患者接受美法仑+自体造血干细胞移植治疗;
2025.1.3:该患者接受DKPD方案+地舒单抗治疗1程。目前,治疗有效,该患者的全身疼痛较前明显缓解,可继续该方案维持治疗;
专家点评
常春康教授:这是一例典型且具有教学意义的年轻、高危、分期晚的MM病例。该患者的整个诊疗过程,从诊断、危险度分层到治疗方案的调整和整合,充分体现了当前MM领域的精准化、个体化以及全程管理的先进治疗理念。
该患者初诊时即表现出广泛的骨质破坏、贫血、高钙血症以及显著升高的β2微球蛋白和LDH,结合骨髓象、流式细胞及免疫分型结果,诊断明确。尤为关键的是,通过FISH检测明确了该患者存在1q21扩增和t(4;14)这两项高危细胞遗传学异常。这直接将患者精准地分层为R-ISS III期的高危MM患者,是后续制定强效、深度治疗策略的根本依据,对于预后判断至关重要。
该患者以VRD方案启动治疗,这是目前临床上常采用的标准诱导方案之一。然而,两程治疗后患者仅达PR且疼痛改善不明显,对于年轻、高危且意向进行自体干细胞移植的MM患者而言,这一缓解深度显然不足。
临床医生及时将方案更换为以达雷妥尤单抗为核心的DPD方案。对于高危MM,CD38单抗的早期介入能够显著提升缓解深度。更换方案后,该患者迅速达到了CR,各项指标好转,影像学也显示病灶缩小,为后续的ASCT巩固治疗创造了条件。在移植后,该患者则采用DKPD方案进行治疗,这是在CR基础上为追求更深层次缓解并延长无进展生存期开展的强化治疗策略,符合高危MM患者的治疗路径。
上述病例诊疗过程中一个值得称道且必须强调的亮点,即从诊断明确、启动VRD方案的第一时间起,就同步启动了以地舒单抗为代表的骨保护治疗,并将其贯穿于整个治疗过程。
MM的本质是恶性浆细胞在骨髓内异常增殖,直接或间接激活破骨细胞,导致严重的溶骨性破坏。该患者初诊时即有广泛的多发骨质破坏、高钙血症和严重疼痛,这是肿瘤负荷高、疾病活动性强的表现。因此,控制骨病与控制肿瘤本身同等重要,两者是治疗MM不可分割的两个方面。
尽管抗MM治疗旨在清除恶性浆细胞,是解决骨病的“治本”之策,即减少破骨细胞激活信号的来源。然而,这一过程需要时间,且未必能完全阻断已经激活的破骨细胞。而骨保护治疗,特别是地舒单抗,则是直接作用于骨破坏的最终“执行环节”,强效抑制破骨细胞的活性[1]。两者机制互补,协同作用,能够更快、更有效地阻断MM患者骨破坏的恶性循环。
另外,与抗MM治疗同步启动骨保护治疗的首要目标是预防并管理患者出现病理性骨折、脊髓压迫、高钙血症等SREs。一旦发生SREs,不仅会给MM患者带来巨大的痛苦,严重影响其生活质量,还可能导致治疗中断,甚至危及生命。该例患者虽然初期疼痛缓解不明显,但持续的地舒单抗治疗为其骨骼提供了基础性的保护,随着后续DPD/DKPD方案的应用将其肿瘤负荷降至较低水平,疼痛也得到了显著缓解,这正是双重治疗策略成功的体现。在既往的临床研究中,及时骨保护治疗对于肿瘤患者疼痛的改善作用也得到印证。一项III期研究显示,地舒单抗可延缓肿瘤患者疼痛的恶化,并可减少使用强阿片类药物。在基线无疼痛或轻度疼痛的患者中,地舒单抗可将中度或重度疼痛发生的中位时间缩短 1.8 个月(6.5 个月 vs 4.7 个月;P <0.001)。在高危患者中,使用地舒单抗后,患者至疼痛对身体功能干扰增加的中位时间延长了1.8个月(11.1 个月 vs 9.3 个月;P = 0.010)[2]。
上述案例的成功,生动地诠释了现代MM治疗的精髓。对于存在骨质破坏的MM患者,骨保护治疗绝不是辅助或次要措施,而是必须与抗MM治疗同步启动、长期坚持的基石治疗。
1.安加维(地舒单抗注射液)说明书
2. von Moos R., Body J.J., Egerdie B., Stopeck A., Brown J.E., Damyanov D., Fallowfield L.J., Marx G., Cleeland C.S., Patrick D.L., Palazzo F.G., Qian Y., Braun A., Chung K. Pain and health-related quality of life in patients with advanced solid tumours and bone metastases: integrated results from three randomized, double-blind studies of denosumab and zoledronic acid. Support. Care Cancer. 2013;21(12):3497–3507. doi: 10.1007/s00520-013-1932-2.
排版编辑:肿瘤资讯-LBJ











 苏公网安备32059002004080号
苏公网安备32059002004080号


