间变性淋巴瘤激酶(ALK)融合阳性是非小细胞肺癌(NSCLC)重要的驱动基因变异之一。随着多种ALK-酪氨酸激酶抑制剂(TKI)的临床应用,ALK阳性NSCLC患者的生存期显著延长。然而,对于少见ALK融合变异类型(如EML4-ALK v3以外的变异类型)或复杂耐药突变的患者,治疗方案仍面临挑战。伊鲁阿克作为我国自主研发的新型高选择性ALK抑制剂,凭借其广谱抑制ALK突变体和良好的血脑屏障穿透能力,在临床实践中展现出独特优势。
本文分享一例ALK阳性罕见融合位点晚期NSCLC患者,在多线治疗失败后接受伊鲁阿克治疗获得显著缓解的典型案例。该病例由广州医科大学附属第一医院张亚雷教授团队整理,已成功入选第66届日本肺癌协会年会(JLCS 2025)口头报告(Oral Presentation),于2025年11月8日在日本东京大会现场进行展示。这不仅体现了中国临床研究的国际影响力,也为携带ALK特殊融合类型患者的个体化治疗提供了宝贵经验。
【肿瘤资讯】特别邀请广州医科大学附属第一医院张亚雷教授分享上述病例,并邀请广州医科大学附属第一医院梁文华教授进行点评。现将病例及点评内容整理如下,供临床同仁参考与交流。

病例资料
患者信息:女性,53岁,无吸烟史,既往体健。
病史概述:
2022年6月16日因体检发现左肺上叶前段占位性病变;
2022年7月19日行“单孔裸眼3D胸腔镜下左肺上叶楔形切除术+肺门、纵隔淋巴结清扫术”;
术后病理诊断:(左上肺肿物)肺浸润性腺癌;
免疫组化:CK7(+),TTF-1(+),NapsinA(+),P40(–),ALK(D5F3)(+);
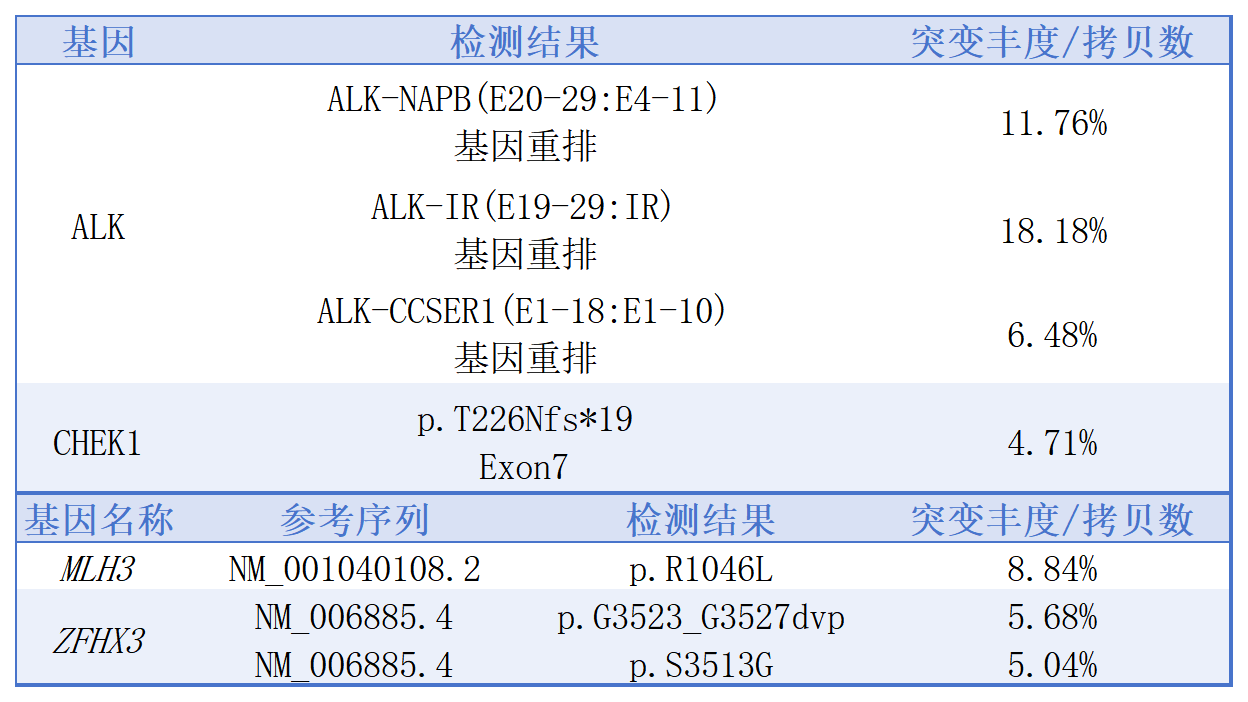
对手术切除组织分别进行2次NGS检测
(报告日期:2022年7月31日):ALK-FAM190A(E19:EX10)融合变异、MLH3和PIK3CB错义突变。
(报告日期:2022年11月19日):ALK-NAPB(E20-29:E4-11) 融合变异、ALK-IR(E19-29:IR) 融合变异、ALK-CCSER1(E1-18:E1-10) 融合变异,MLH3和ZFHX3错义突变、CHEK1移码突变。

初步术后诊断:(左上肺肿物)肺浸润性腺癌(pT2N2M0 IIIA期)(TNM 8th) 。
诊疗历程
该患者诊疗历程时间轴如下图所示:
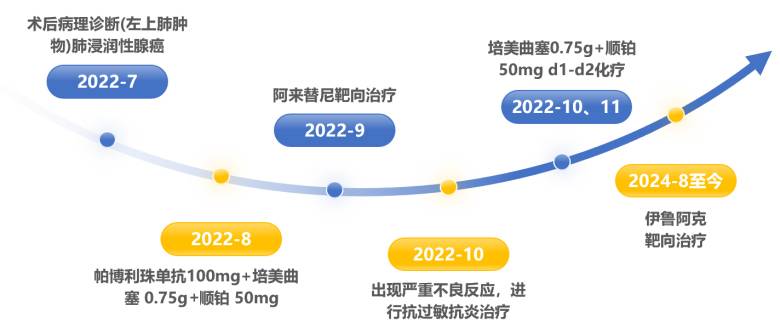
术后辅助治疗阶段(2022年8月–2022年11月)
2022年8月31日开始免疫化疗,帕博利珠单抗 100 mg + 培美曲塞 0.75 g + 顺铂 50 mg d1–d2 辅助治疗,过程顺利。
2022年9月21日后改用阿来替尼靶向治疗,但2022年10月3日,因出现全身红斑、丘疹等严重不良反应,住院治疗。
2022年10月25日和11月17日给予化疗:培美曲塞 0.75 g + 顺铂 50 mg d1–d2。
复发监测与肿瘤复发(2022年11月至2024年7月)
2022年11月13日,血液ctDNA检测为阴性。
2023年12月10日,血液ctDNA检测ALK-IR融合(E19-29:IR)丰度为1.44%。
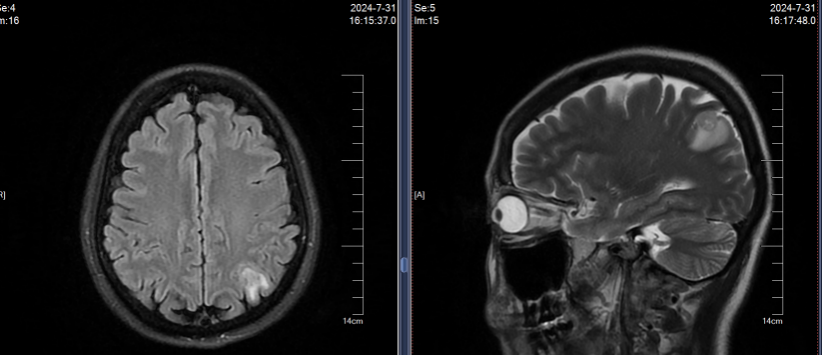
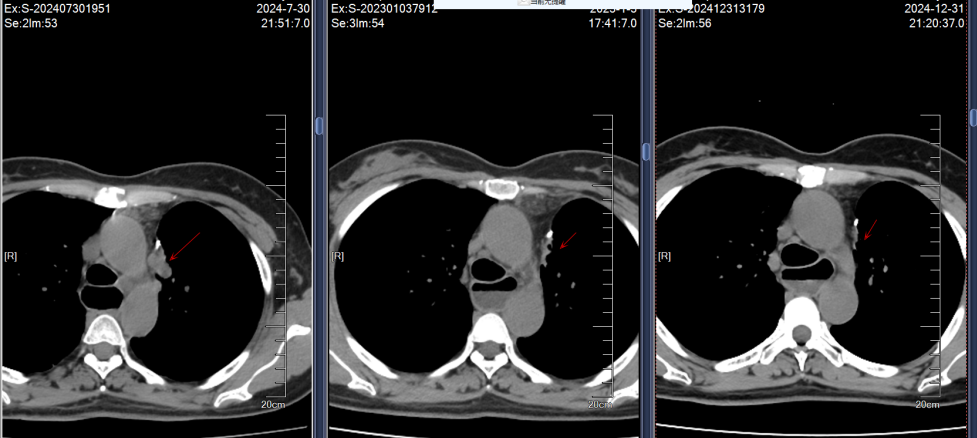
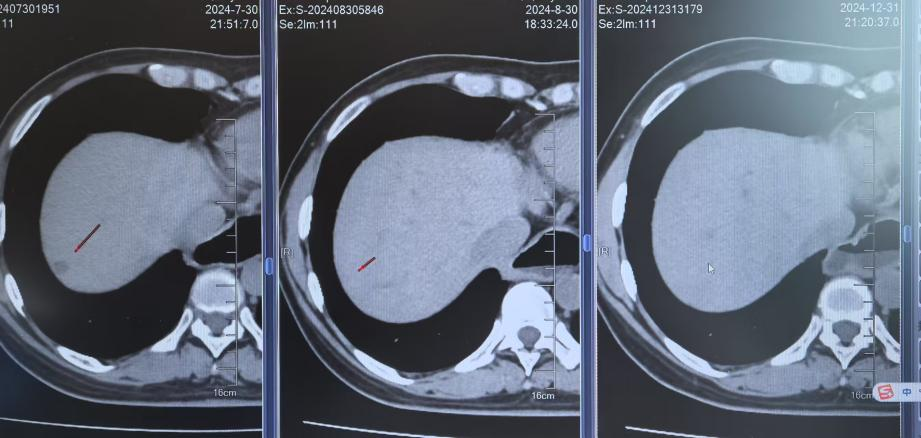
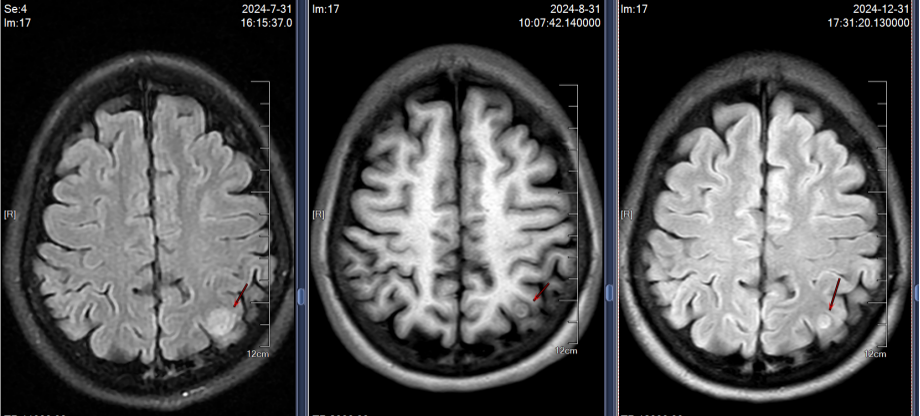
2024年7月30日胸部CT示:左上肺术区新增结节,两肺多发实性结节较前增多,肝S7新增结节;7月31日头颅MRI示左侧顶叶、小脑半球新增转移灶。结合影像及病史,确诊为ALK阳性晚期NSCLC复发伴多发转移(图1)。


伊鲁阿克治疗阶段(2024年8月至今)
2024年8月2日起,患者开始接受贝伐珠单抗 400mg + 伊鲁阿克靶向治疗,同时进行护骨治疗。治疗过程中未出现明显胃肠道或皮肤不良反应,患者耐受性良好。随访影像显示病灶持续控制,临床症状显著改善。
疗效评估
伊鲁阿克治疗启动后,患者未再出现严重皮疹或胃肠道反应,治疗依从性高;
影像学随访显示肺部、肝部的病灶完全消失,脑部的病灶缩小稳定;
据既往研究报道,伊鲁阿克相关不良反应发生率显著低于其他ALK-TKI,尤其便秘发生率仅为3.2%,疲乏、水肿、肌痛等发生率亦处于低位。因此,本案例考虑采用伊鲁阿克,发现治疗过程中患者耐受性良好。
张亚雷教授点评
广州呼吸健康研究院(何建行教授团队)
胸部肿瘤科副主任医师,医学博士
2024年第五届南方健康科普医生
2022年第八届“羊城好医生”&“最佳人气奖”称号
2021年广东十大科学传播达人
公众号“健康Talks”创始人
中国控制吸烟协会控烟与肺癌防治专业委员会委员
广东省精准医学应用学会肺癌分会常委
广东省胸部疾病学会肿瘤急危重症专业委员会常委
广东省保健协会肿瘤专业委员会委员
广州抗癌协会分子靶向治疗专业委员会委员
广州抗癌协会肿瘤微环境专业委员会委员
广东省临床医学学会肺癌精准治疗及临床研究专业委员会委员
南方护骨联盟成员
从临床困境到治疗突破:伊鲁阿克在真实世界中的个体化应用
Q1:为何在多重治疗失败后选择伊鲁阿克?
本例患者术后确诊为ALK阳性肺腺癌,但后续检测发现同时存在ALK-FAM190A、ALK-NAPB、ALK-IR和ALK-CCSER1多种罕见融合变异,属于临床罕见。更关键的是,患者对既往治疗耐受性较差:初期使用免疫化疗辅助治疗后转用阿来替尼后随即因全身红斑、丘疹无法继续治疗,后仅采用辅助化疗。这使得我们在后续治疗选择上面临“有效”与“可耐受”的双重挑战。
在充分评估患者分子特征和既往不良反应谱后,我们选择伊鲁阿克,主要基于以下考量:
一是其在ALK阳性人群中的广谱覆盖潜力:尤其对非EML4型融合已有初步临床证据支持;
二是其良好的安全性特征:伊鲁阿克整体安全性良好,既往临床数据显示其皮疹发生率较低,且便秘、疲乏、水肿等影响患者日常体感的不良反应发生率亦处于较低水平。这一安全性特征为既往因严重皮疹或体感不适而中断治疗的患者提供了可耐受且可持续的新治疗选择。
自2024年8月开始使用伊鲁阿克治疗以来,患者未再出现严重皮肤或消化道不良反应,依从性良好。随访影像显示肺部、肝脏及脑转移灶稳定或缩小,疾病得到有效控制。更重要的是,患者生活质量显著改善,ECOG评分维持在1分,能够正常生活。
该病例的成功不仅为ALK罕见融合患者提供了治疗范例,也验证了“以患者为中心”的个体化治疗理念——在确保疗效的同时,必须高度重视治疗耐受性。此次入选JLCS 2025口头报告,是对中国临床医生在复杂病例中精准决策能力的国际认可。
从个案到范式:伊鲁阿克病例的国际启示与精准治疗新方向
Q2:该病例入选JLCS 2025口头报告,对ALK罕见融合的国际研究有何启示?
本例ALK阳性晚期NSCLC患者同时携带多种罕见融合变异,且在多种治疗失败的复杂背景下,通过伊鲁阿克实现疾病有效控制,其成功经验不仅是个体化治疗的典范,更对全球ALK阳性肺癌的研究与临床实践具有深远启示。该病例在第66届日本肺癌协会年会(JLCS 2025)上作为口头报告亮相,标志着中国临床智慧获得国际权威学术平台的认可,其价值可从以下三个维度深入解读:
第一,肿瘤内部突变的异质性:该患者手术后的标本在2次NGS检测出不同的融合类型,提示原发病灶内部可能存在多种的变异类型。多克隆变异类型的存在,可能提示该患者肿瘤微环境中肿瘤细胞突变类型的多样性,可能会对抗肿瘤的后续治疗带来更严峻的挑战;
第二,验证中国原研药的全球价值:伊鲁阿克作为我国自主研发的高选择性ALK抑制剂,其在经典ALK融合中的疗效已获多项研究证实。而本例在极其复杂的罕见融合共存、多线耐药、既往严重不良反应等多重挑战下仍取得显著获益,充分展现了其广谱抗肿瘤活性与优异安全性。这一真实世界证据不仅增强了国际学术界对中国原研药物研发能力的信心,也为全球ALK阳性NSCLC治疗格局注入了“中国方案”。在全球肺癌治疗日益强调“药物可及性”与“个体化适配”的背景下,伊鲁阿克的国际亮相具有重要意义;
第三,倡导“融合亚型导向”的治疗策略:长期以来,ALK阳性NSCLC的治疗决策主要基于“是否ALK阳性”及“是否伴脑转移”等宏观指标,而忽视了ALK融合伴侣类型、激酶结构域完整性、潜在旁路激活机制等微观异质性。本例中三种融合变异分别代表了激酶域完整型(ALK-NAPB)、旁路激活型(ALK-IR)和非激酶依赖型(ALK-CCSER1),其对治疗的反应可能截然不同。伊鲁阿克在此复杂背景下取得成功,提示我们未来ALK阳性NSCLC的治疗策略应进一步细化,建立“融合亚型—信号通路特征—药物覆盖谱—耐受性谱”四位一体的个体化决策模型,真正实现从“靶向ALK”到“靶向ALK融合亚型”的跃迁。
综上,这一病例虽源于临床个案,却折射出ALK阳性NSCLC精准治疗的未来方向。它不仅是一次治疗的成功,更是一次理念的升级——推动全球肺癌诊疗从“粗放式靶向”走向“精细化分型”,从“药物轮换”走向“机制匹配”。随着更多类似病例的积累与机制研究的深入,ALK罕见融合病例的治疗将不再是临床“盲区”,而成为精准医学新前沿。
梁文华教授点评
教授、博导、主任医师
胸部肿瘤综合病区主任、横琴医院副院长
国家优青基金获得者(肿瘤学),青年珠江学者,广东杰出青年医学人才
广州呼吸健康研究院院长助理,国家呼吸医学中心办公室主任
呼吸疾病国家重点实验室肺癌学组副组长
广东胸部疾病学会免疫治疗分会主委
广东省医学会精准医学与分子诊断分会副主委
中国抗癌协会(CACA)肺癌专委会委员
中国临床肿瘤学会(CSCO)NSCLC专委会委员
Transl Lung Cancer Res副主编,《中华医学杂志》编委
ALK罕见融合的治疗新范式:从机制解析到个体化决策
Q1:针对ALK-NAPB、ALK-IR、ALK-CCSER1等罕见融合变异,伊鲁阿克是否具有独特优势?其作用机制如何?
梁文华教授:ALK罕见融合的临床挑战不仅在于其低频性,更在于其结构异质性导致的信号通路激活模式差异。传统ALK-TKI(如克唑替尼、阿来替尼)主要基于EML4-ALK v1/v3结构优化,对非经典融合的抑制效力可能受限。而伊鲁阿克的分子设计赋予其更广泛的适应性:
ALK-FAM190A(E19:EX10):FAM190A 基因参与细胞分裂(有丝分裂),其融合重排可能会破坏正常细胞功能,从而导致癌症。该重排可能与肿瘤的发生有一定联系;
ALK-NAPB(E20-29:E4-11):该融合保留了完整的ALK激酶结构域(exon 20–29),依赖ALK自身激酶活性驱动肿瘤。伊鲁阿克作为高选择性、高亲和力ALK抑制剂,可有效占据ATP结合口袋,阻断自磷酸化及下游MAPK/STAT3通路,从而实现强效抑制;
ALK-IR(E19-29:IR):融合伴侣胰岛素受体(IR)本身为酪氨酸激酶,可能通过IR同源或异源二聚化激活PI3K/AKT/mTOR等旁路通路,导致对单纯ALK抑制的抵抗。伊鲁阿克虽不直接靶向IR,但其更强的ALK抑制深度可能“压倒”旁路信号通量,或通过调节IR-ALK复合物稳定性间接削弱IR信号输出;
ALK-CCSER1(E1-10):该变异缺失ALK激酶域(仅保留exon 1–10),传统认为ALK-TKI无效。但近年研究发现,CCSER1可通过调控染色体分离、DNA修复或转录共激活网络促进肿瘤进展。伊鲁阿克可能通过调控ALK下游共激活因子(如SRC、FAK)或影响肿瘤微环境免疫状态,实现间接抗肿瘤效应——这提示我们,ALK-TKI的作用可能不仅限于激酶抑制。
综上,伊鲁阿克的优势不仅在于“广谱”,更在于其对不同融合结构所驱动的复杂信号网络具备多层次干预潜力。本例中多种罕见融合共存仍获良好疗效,为探索ALK-TKI在非激酶依赖型融合中的作用打开了新思路。
安全为先,精准匹配:ALK-TKI不耐受患者的个体化治疗新路径
Q2:对于ALK-TKI不耐受的患者,如何制定个体化治疗策略?伊鲁阿克在安全性方面的优势如何转化为临床获益?
梁文华教授:ALK-TKI相关不良反应是影响治疗依从性和长期生存的关键因素,其常见皮疹、水肿、胃肠道反应,部分患者因无法耐受而中断治疗。伊鲁阿克整体安全性良好,既往临床观察显示其皮疹发生率较低,同时便秘、疲乏、水肿、肌痛等影响患者日常体感的不良反应亦较少见,胃肠道相关不良反应总体可控。这一良好的耐受性有助于提升治疗依从性,为既往因不良反应中断治疗的患者提供了可持续的治疗新选择。这些安全性优势直接转化为更高的治疗依从性和更长的持续用药时间,从而延长PFS和OS。对于多线治疗失败、体能状态脆弱的晚期患者,选择低毒高效的药物尤为关键。
值得强调的是,伊鲁阿克不仅在安全性方面表现优异,其一线治疗的疗效也已获得高级别循证医学支持。在关键的III期INSPIRE研究中,伊鲁阿克对比克唑替尼显著延长了无进展生存期,中位PFS超过45个月,疾病进展或死亡风险降低逾70%,奠定了伊鲁阿克作为ALK阳性晚期NSCLC一线治疗优选的地位。
此外,伊鲁阿克的个体化应用还需结合:如融合类型(是否含激酶域)、既往不良反应谱(如皮疹、肝损)、CNS转移状态(伊鲁阿克具备良好血脑屏障穿透能力)、患者ECOG评分及合并症等。
本病例治疗的成功再次证明,精准识别ALK融合亚型、结合患者耐受特征选择药物,是实现ALK阳性NSCLC长期管理的核心。伊鲁阿克的国际亮相,不仅是中国原研ALK-TKI从“本土创新”迈向“全球认可”的重要里程碑,更标志着中国临床研究在罕见驱动基因变异治疗领域已具备引领国际讨论的能力。该病例入选JLCS 2025口头报告,向全球同行展示了中国医生在复杂真实世界场景中基于机制理解与患者需求所做出的精准决策,也为ALK罕见融合这一国际性难题提供了可借鉴的“中国范式”。未来,随着更多高质量中国数据登上国际舞台,全球肺癌精准治疗的版图将因中国智慧而更加完整与多元。

1.Zhang YL, et al. 2025 JLCS Abstract O64-4.
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


