针对BCMA的CAR-T细胞疗法已成为多发性骨髓瘤(MM)的重要治疗手段,但多数患者的缓解并不持久,且后续免疫治疗(如双特异性抗体)效果可能递减。近日,Leukemia杂志发表的一项研究,通过单细胞测序技术纵向追踪了MM患者CAR-T治疗前后的免疫微环境 [1]。研究发现,CAR-T治疗方案会重塑患者的内源性T细胞图景。一个新型的过渡性CD8+ T细胞亚群(T1)被发现与不良预后相关,这一发现对CAR-T和双抗等T细胞导向疗法均有提示意义。此外,研究提示TIM3/GAL9互作可能参与导致T细胞耗竭,靶向此通路或可为改善T细胞功能障碍提供新思路。

T细胞导向疗法后的“免疫耗竭”困境
近年来,以CAR-T细胞疗法和双特异性抗体(BiTEs)为代表的T细胞导向疗法,显著改善了血液系统恶性肿瘤的治疗格局。靶向BCMA的CAR-T细胞疗法在复发/难治性多发性骨髓瘤(RRMM)患者中显示出令人瞩目的缓解率。
然而,临床面临的严峻挑战是,大多数患者的缓解无法持久,复发率高。并且,在CAR-T治疗失败后,后续的其他T细胞导向疗法(尤其是依赖内源性T细胞的双特异性抗体)的疗效也往往随之降低。这种现象提示,T细胞导向治疗(特别是CAR-T)的过程可能对患者的整个免疫系统产生了深远的影响。因此,理解CAR-T治疗对内源性T细胞健康状态的长期影响,对于指导后续(包括双特异性抗体在内)的免疫治疗序列至关重要。
深度解析:CAR-T治疗如何重塑T细胞图景
为探究这一问题,近日Leukemia杂志发表了一项纵向分析研究 [1]。该研究纳入了来自KarMMa-2 (NCT03601078) 和 KarMMa-3 (NCT03651128) 临床试验的24名接受Ide-cel(bb2121)治疗的MM患者。研究团队通过结合FACS分选、全长scRNA-seq (Smart-Seq2)、10x Genomics scRNA-seq、CITE-seq及scTCR-seq等多维单细胞技术,在治疗前(基线)、输注后1个月(M2D1)和6个月(M7D1)三个时间点,深度描绘了CAR-T细胞与内源性T细胞的动态演变图谱。
关键发现一:内源性T细胞库的“代价”——短暂活化与持续耗竭
研究首先揭示了CAR-T治疗方案(淋巴细胞清除+CAR-T输注)对患者免疫系统的双重影响。
在输注后1个月(M2D1),CAR-T细胞呈现出比内源性T细胞更强的活化和耗竭特征,其耗竭标志物(如HAVCR2/TIM3)的表达水平显著更高。而内源性T细胞的活化水平此时达到峰值,但这种激活是短暂的,在6个月时(M7D1)已回落至基线水平。
更重要的是,一个关键变化在于内源性T细胞的“储备库”。幼稚样T细胞在M2D1时显著减少,并且直到M7D1仍未恢复。这提示CAR-T治疗方案可能导致了T细胞储备库的持续性损耗 。这一发现对于依赖内源性T细胞的双抗疗法具有高度警示意义。
关键发现二:预测预后之“钥”——基线T1亚群与T细胞多样性
本研究的一项重要成果是发现了与临床结局相关的T细胞特征。研究者根据中位无进展生存期(PFS)(20.14个月)将患者分为长期响应者(LTR)和短期响应者(STR)。
分析发现,一个新型的过渡性T细胞亚群(T1, cluster 3)是一个具有潜力的预测性生物标志物。在治疗前(Screening),那些未来将成为STR的患者,其基线T细胞中“T1过渡性T细胞”标志物的表达水平已经显著更高。而在治疗后(M7D1),T1细胞亚群在STR患者中的丰度也显著高于LTR患者。
此外,T细胞克隆演变分析显示,LTR患者拥有更高多样性的内源性T细胞库,而STR患者则拥有更高多样性的CAR-T细胞库。这提示,一个健康、多样化的内源性免疫系统,以及一个精准、优势克隆扩增的CAR-T细胞反应(即低多样性),可能与实现长期缓解相关。
关键发现三:机制深潜——TIM3/GAL9互作或参与T细胞耗竭
鉴于CAR-T细胞和内源性T细胞的耗竭水平存在相关性,研究者进一步探索了协同驱动T细胞功能障碍的细胞外在机制。
通过配体-受体互作分析,研究聚焦于一个潜在的信号通路:T细胞(尤其是CAR-T细胞)上高表达的TIM3 (HAVCR2)与微环境中(可能由多种细胞分泌)的Galectin-9 (GAL9, LGALS9)之间的互作。
CITE-seq和ELISA检测证实,患者血清中高水平的GAL9与更低的CAR-T细胞持久性评分显著相关。体外功能验证也显示,加入GAL9会导致CAR-T细胞和健康CD8+ T细胞的活力显著下降(诱导凋亡)。这提示,TIM3/GAL9信号通路可能是导致T细胞功能障碍、持久性差的重要机制之一 。
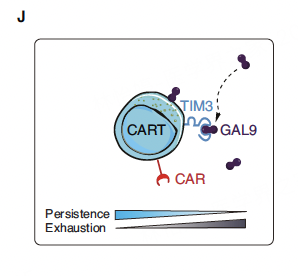
本研究通过单细胞多组学技术,深入揭示了BCMA CAR-T治疗方案对MM患者内源性T细胞图景的重塑过程。研究的核心结论认为,CAR-T治疗方案(包括淋巴细胞清除)虽然能短暂激活免疫系统,但其长期效应可能是导致内源性T细胞库(特别是幼稚T细胞)的持续耗竭和功能分化走向终端。这可能消耗了患者免疫系统的潜能,或可解释为何后续的免疫治疗(包括T细胞衔接器)效果会随之降低。
本研究具有潜在的临床转化价值。其一,T1过渡性T细胞亚群在治疗前的高丰度与不良预后相关,这为临床筛选高风险患者提供了线索。其二,研究指出了TIM3/GAL9互作可能是驱动T细胞耗竭与凋亡的机制之一,这为开发联合治疗策略(如CAR-T联合TIM3或GAL9抑制剂)以提高T细胞的持久性和疗效,提供了新的理论依据。
尽管研究存在样本量较小(n=24)等局限性,但其为理解CAR-T耐药和免疫系统演变提供了新的视角。
编者按:CAR-T研究对双抗治疗的启示
这项研究,虽然聚焦于CAR-T治疗,但其对内源性T细胞图景的深刻洞察,为当前火热的骨髓瘤双特异性抗体(双抗)治疗领域提供了极具价值的参考与警示。
首先,T细胞健康状态是所有T细胞导向疗法(包括双抗)的基石。 本研究发现的“T1过渡性T细胞”亚群作为不良预后标志物,具有重要价值。这一发现对双特异性抗体治疗尤为关键,因为双抗完全依赖患者自身的T细胞。如果基线T1细胞水平高、或幼稚T细胞储备不足,是否预示着该患者对双抗的反应同样不佳?这值得未来在双抗队列中进行前瞻性验证。
其次,T细胞耗竭机制(如TIM3/GAL9)是双抗与CAR-T面临的共同挑战。 在双抗治疗中,T细胞同样会因持续激活而耗竭。本研究提示,TIM3/GAL9通路可能也是导致双抗治疗后T细胞功能障碍的机制之一。因此,探索TIM3抑制剂联合双抗,或许也是未来改善双抗疗效持久性的一个潜在方向。
最后,T细胞导向疗法的合理布局值得深思。 本研究提出的“免疫潜能”概念,对MM治疗的序列安排提出了新思考。在RRMM患者的治疗序列中,目前拥有CAR-T、双特异性抗体等多种T细胞导向疗法。如果CAR-T方案(特别是其前置的清淋)会损耗内源性T细胞库,这是否提示BiTEs(更依赖内源性T细胞)的更佳使用时机是在CAR-T之前?或者,是否需要开发更为温和的清淋方案,以保护患者的T细胞储备?
总之,本研究虽着眼于CAR-T,但其对T细胞“免疫潜能”的揭示,为CAR-T和双特异性抗体两大T细胞导向疗法的临床应用、耐药机制探索和未来布局,都提供了重要的科学依据。
[1] Frede J, Poller JC, Shi K, et al. The endogenous T cell landscape is reshaped by CAR-T cell therapy and predicts treatment response in multiple myeloma. Leukemia. Published online September 19, 2025. doi: 10.1038/s41375-025-02766-5.
责任编辑:Ashelin
排版编辑:Ashelin











 苏公网安备32059002004080号
苏公网安备32059002004080号


