欧洲肿瘤内科学会(ESMO)年会是全球最具影响力的肿瘤学会议之一,每年都汇集了来自世界各地的顶尖专家,展示和讨论最新的临床研究成果与前沿科学进展。近年来,随着精准医学的飞速发展,非小细胞肺癌(NSCLC)的治疗模式发生了革命性的变化。除了EGFR、ALK等常见驱动基因外,针对BRAF、MET等少见靶点的靶向治疗也取得了显著突破,极大地改善了相关患者的预后。深入探讨肺癌少见靶点的诊疗进展,对于推动肺癌个体化治疗的“长尾效应”,让更多患者从精准医疗中获益,具有至关重要的意义。基于此,【肿瘤资讯】特邀四川大学华西医院的周清华教授,四川省肿瘤医院的李娟教授,以及四川大学华西医院的田攀文教授,深度剖析本次ESMO会议中驱动基因阳性的早/局晚期NSCLC、BRAF靶点以及MET靶点的治疗新进展,旨在为临床医生提供前沿、实用的学术参考。
驱动基因阳性早期/局晚期NSCLC治疗进展
周清华教授采访
周清华教授:随着精准诊疗理念的深入,驱动基因阳性NSCLC的治疗战线已从晚期患者显著前移至早中期NSCLC患者。本次大会也更新了相关研究进展:ELEVATE研究显示, 恩沙替尼作为肺癌R0切除术后的IB-IIIB期ALK阳性NSCLC患者的辅助治疗显示出显著的无病生存期(DFS)改善,主要研究人群中(II-IIIB) DFS HR为0.20(p <0.0001),2年DFS率86.4% vs 53.5% ,在各亚组中均观察到一致的DFS获益,且安全性特征与恩沙替尼的已知安全性特征一致[1]。
在LAURA研究中,用高敏感微小残留病灶(MRD)检测预测LAURA研究患者疾病进展(PD)的结果显示,MRD检测具有63%的临床敏感度和86%的特异性来检测PFS事件,且79%的病例中分子进展较影像学进展提前出现,中位领先时间达5.1个月。结论认为奥希替尼可有效清除放化疗后存在的分子残留病灶;MRD状态有望作为预测III期EGFR突变NSCLC疾病进展的有效生物标志物[2]。
继EGFR-TKI和ALK-TKI分别在EGFR和ALK阳性NSCLC辅助治疗中取得成功后[3-4],如何进一步优化新辅助/辅助治疗策略,使更多患者获益,成为当前的研究热点。一方面,分子图谱的全面解析是优化治疗决策的基石。随着精准检测与治疗技术的进步,除EGFR和ALK之外,越来越多的少见突变型肺癌患者也有了更多精准治疗选择。这类患者往往预后较差,尤其在术后早期阶段复发风险较高,存在显著的未被满足的临床需求。2024年ASCO大会公布的LCMC4研究更新数据[5]提示,不论分期或吸烟史如何,约33%的患者可通过精准检测发现具有临床意义的驱动基因变异;经NGS可检出的癌症驱动基因变异可达到48%。这一发现凸显了基因检测在临床实践中的关键性作用,其检测结果有可能为接近半数的患者重新定义治疗路径。与此呼应,最新版《中国临床肿瘤学会(CSCO)非小细胞肺癌诊疗指南》亦强化了对早期NSCLC患者进行精准分子分型的推荐,彰显了精准诊疗已成为该领域不可逆转的发展趋势。目前,BRAF/MET/RET等少见靶点的新辅助/辅助靶向治疗临床研究正在进行中,BRAFi、MET-TKI等靶向药为晚期少见突变NSCLC患者带来长期生存获益,是否也能为早期少见突变患者带来更好的生存获益以及更优的治疗模式,期待更多研究的数据公布能给我们带来惊喜。另一方面,如何通过MRD等分子检测工具来筛选高危复发人群,指导辅助治疗的启停,以及探索新辅助靶向治疗(单药或联合化疗)模式的价值,是当前及未来重要的研究方向[6]。这些探索将共同推动NSCLC治疗进入更“精益求精”的时代。
BRAF靶点治疗进展
李娟教授采访视频
李娟教授:BRAF突变是NSCLC中一类重要的驱动基因,其中V600E突变是最常见的亚型,约占所有BRAF突变的30%~50%[7]。达拉非尼联合曲美替尼(D+T)作为首个在中国获批用于治疗BRAF V600突变转移性NSCLC的靶向方案,其疗效和安全性已得到广泛验证[8, 9]。
D+T的中国桥接试验研究结果[9]显示,中国人群的疗效数据更为出色,客观缓解率(ORR)高达75%,疾病控制率(DCR)达到95%;在安全性方面,双靶方案在中国人群中安全性优,3级以上发热的发生率仅5%(1/20),优于全球人群11%的3级以上发热发生率[8]。
本次大会上也更新了D+T的中国桥接试验研究的最终分析[10],为国内临床实践提供了更为成熟和坚实的本土化循证医学证据。研究结果显示,经研究者评估,接受D+T一线治疗(n=22)患者的ORR高达95.5%,经中央独立评审的ORR亦高达90.9%(表1)。D+T一线治疗的中位PFS达到了22.1个月,一线治疗的中位持续缓解时间(DoR)长达18.0个月。全线治疗(一线和后线,n=40)的中位无进展生存期(PFS)为13.9个月,中位DoR为14.9个月(表2)。此次中国人群的总生存期(OS)数据也备受关注,研究结果显示,尽管一线治疗队列的OS数据仍未成熟,但48个月OS率以达到52.1%,也就是意味着超过半数的一线治疗患者可以存活4年,全线治疗中位OS达到了25.3 个月(表2)。
表1. 使用 RECIST 1.1 标准基于中央独立和地方审查评估的ORR结果(全分析集)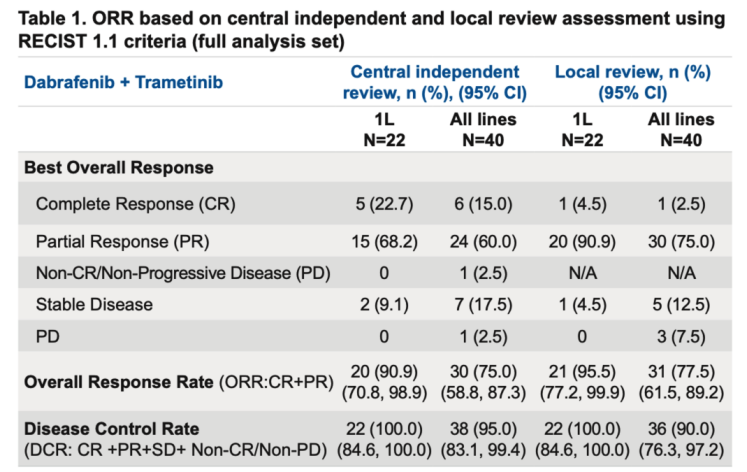
表2. 基于研究者评估的 PFS、DoR、OS(全分析集)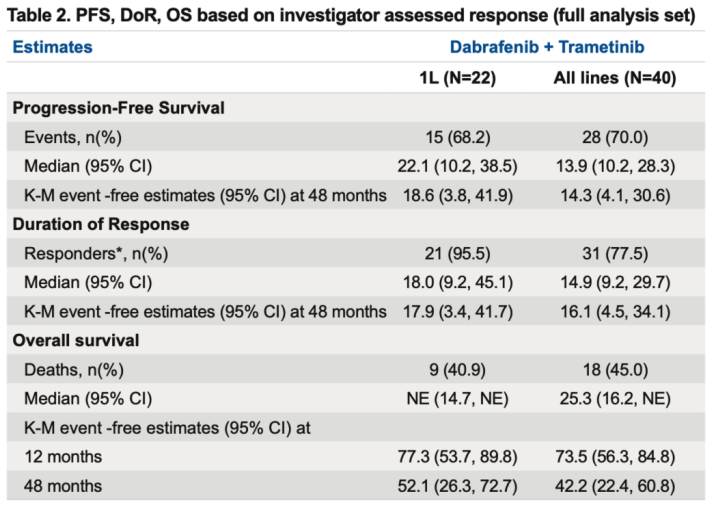
在安全性方面,此次D+T的最新数据表明,最常见的治疗相关不良事件(TRAEs)是发热,发生率为45.0%,与已发表的中国桥接研究数据(45%)一致,并低于全球注册研究中一线治疗的发热发生率(64%)。由于AEs导致的永久停药率为12.5%(5/40),并且本次最终分析中报告无致死性AE(表3),这体现了D+T方案的整体安全性高和耐受性良好。这些数据再次无可辩驳地证明,D+T双靶方案无论是作为一线还是后线治疗,均能为BRAF V600突变患者提供更深度、更持久的临床获益,作为一线治疗,患者生存获益更优,也进一步证实了D+T方案在我国患者中的优越疗效和可控的安全性。
表3. 安全性结果(全分析集)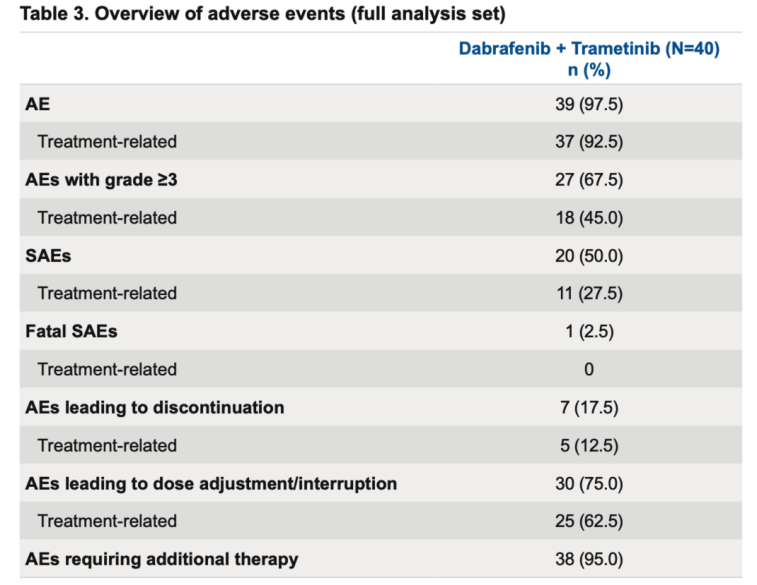
除了标准的D+T双靶治疗方案,目前针对BRAF突变NSCLC的治疗策略还有许多值得关注的新探索方向。例如,探索D+T耐药机制并制定后续治疗策略,以及探索D+T联合免疫方案能否进一步提升BRAF V600E突变患者的疗效。期待更多的研究结果为指导临床实践提供依据。
MET靶点治疗进展
田攀文教授采访
田攀文教授:MET基因异常是NSCLC中一类多样化的驱动因素,主要包括METex14跳跃突变、MET扩增和MET蛋白过表达[11]。要实现有效的靶向治疗,首先就要做好精准检测。对于METex14跳跃突变,临床上主要采用DNA-NGS来检测,为有效提高检出率,建议可以采用DNA-NGS联合RNA-NGS的互补策略。而对于MET扩增,FISH是目前公认的“金标准”。因为NGS方法在检测MET扩增时可能会出现假阴性,导致一部分阳性患者被漏掉。所以,如果我们临床上高度怀疑MET扩增,或者NGS结果是阴性但仍有疑问,通常会建议用FISH做验证或补充检测,来确保诊断的准确性。
在治疗方面,高选择性MET抑制剂卡马替尼凭借GEOMETRY mono-1等关键研究的卓越数据,已成为METex14跳跃突变晚期NSCLC的标准治疗[12,13]。研究显示,卡马替尼一线治疗的ORR高达68.3%,mPFS达12.5个月,且对脑转移患者同样显示优异疗效,同时水肿、肝毒性等AE的发生率更低,安全性更优[13]。基于充分的循证证据,卡马替尼已在中国获批用于METex14跳跃突变NSCLC的全线治疗,并被国内外多项权威指南列为I级或优先推荐。本届ESMO大会上,还有一些MET-TKI、MET-ADC等新型药物的探索也展示了广阔前景,为MET异常患者带来了更多治疗希望。
一项I期研究评估了MET抑制剂ASKC202联合第三代EGFR-TKI利厄替尼,用于EGFR-TKI治疗后进展、伴MET扩增或MET蛋白过表达的晚期NSCLC患者。结果显示[14],在53例可评估疗效的患者中,ORR达到56%,mPFS 9.7个月。尤其在ASKC202 200mg qd联合利厄替尼160mg bid的剂量组,患者的ORR提升到68.8%。安全性方面,≥3级的AE发生率为22.6%,最常见的是贫血。该联合方案显示出了优异的抗肿瘤效果和可控的安全性,相比以往类似研究大约50%的ORR有了明显提升,我们也期待后续II/III期研究能继续验证这些结果。
另一项I期研究则探索了MET-ADC药物ABBV-400,用于治疗MET扩增的晚期实体瘤患者[15]。研究共入组100例患者,既往治疗的中位线数为2,涵盖NSCLC、结直肠癌、胃食管腺癌等不同肿瘤类型。在所有剂量和瘤种中,ORR达到46%,尤其在NSCLC和胃食管腺癌中缓解率较高,分别为69%和71%。在总体人群中,mPFS为8.5个月,mOS 19.6个月。这说明ABBV-400单药在多种MET扩增的晚期实体瘤中表现出令人鼓舞的疗效,且安全性可管可控。
这些新型的MET-TKI、MET-ADC药物针对MET异常的患者显示出了优异的疗效和安全性,期待未来临床上能有更多的MET药物可以用于治疗这类患者。
总结与展望
本次ESMO大会的最新研究成果,再次彰显了肺癌精准治疗的活力与潜力。在驱动基因阳性的早/局晚期NSCLC领域,治疗模式正从“一刀切”向基于分子标志物的个体化风险分层和精准干预转变。在BRAF和MET等少见靶点领域,D+T方案和卡马替尼等靶向治疗策略已凭借卓越疗效成为临床的标准治疗方案。MET-ADC等新型药物的出现,为罕见靶点肺癌的治疗带来了更多潜力,有望为更多患者带来治愈希望。未来,随着检测技术的不断革新、更多创新药物的涌现以及对耐药机制的深入理解,肺癌少见靶点的诊疗将进入一个更加精准、多元和全程管理的时代,患者也将从中切实获得更多生存获益。
四川大学华西医院肺癌中心学术主任、肺癌研究所所长
天津医科大学原副校长、天津医科大学总医院原院长
天津市肺癌研究所原所长、天津市肺癌转移重点实验室原主任
中国临床肿瘤学会常务理事
中国抗癌协会常务理事
中央干保委员会保健会诊专家
中国卫生部肺癌早诊早治专家组组长
国际肺癌筛查和早诊专家组专家
国际肿瘤转移学会学术委员会委员
美国NIH肺癌早诊标志物专家组专家
《Thoracic Cancer》主编、《中国肺癌杂志》主编
中国“十大医学泰斗”获得者
四川省肿瘤医院肿瘤内科副主任/胸部肿瘤内科二病区主任
美国梅奥诊所 访问学者
中国临床肿瘤学会(CSCO)理事会 理事
中国抗癌协会老年肿瘤专委会 常务委员 秘书长
四川省抗癌协会老年肿瘤治疗专委会 主任委员
四川省抗癌协会小细胞肺癌专委会 候任主任委员
四川省医学会循证医学专委会 副主任委员
四川省预防医学会老年疾病预防与控制分会 副主任委员
四川省医师协会药物临床试验研究者分会 副会长
四川省女医师协会肿瘤学专委会 副主任委员
四川省抗癌协会肺癌专委会 常务委员
四川大学华西医院 肺癌中心 副主任
四川省学术和技术带头人
四川省国际医学交流促进会 肺癌MDT专委会 主任委员
中国抗癌协会(CACA)个案管理专委会 常委,CACA非小细胞肺癌专委会 委员,CACA免疫治疗专委会 委员
参与获“国家科技进步奖二等奖”
[1] Dongsheng Yue et al. Ensartinib as adjuvant therapy in patients (pts) with stage IB–IIIB ALK-positive (ALK+) non-small cell lung cancer (NSCLC) after complete tumor resection: the phase III randomized ELEVATE trial. 2025 ESMO LBA66.
[2] Arriola Aperribay E, et al. Molecular residual disease (MRD) analysis from the LAURA study of osimertinib (osi) in unresectable (UR) stage III EGFR-mutated (EGFRm) NSCLC. 2025 ESMO 1817MO.
[3] Tsuboi M, et al. N Engl J Med. 2023 Jul 13;389(2):137-147.
[4] Wu YL, et al. N Engl J Med. 2024 Apr 11;390(14):1265-1276.
[5] Jamie E. Chaft, et al. Preliminary results of the Lung Cancer Mutation Consortium LCMC4 eval-uation of actionable drivers in early stage lung cancer (LEADER) screening. 2024 ASCO. Abstract 8068.
[6] 何建行 梁文华. 基于分子标志的非小细胞肺癌术后复发预测专家共识[J]. 中国肺癌杂志, 2022, 25(10):701-714.
[7] 中国抗癌协会肺癌专业委员会. 中国晚期非小细胞肺癌BRAF突变诊疗专家共识[J]. 中华肿瘤杂志, 2023, 45(4):279-290.
[8] Planchard D, et al. Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022 Jan;17(1):103-115.
[9] Fan Y, et al. Efficacy, safety, and quality of life of dabrafenib plus trametinib treatment in Chinese patients with BRAFV600E mutation-positive metastatic non-small cell lung cancer. Transl Lung Cancer Res. 2024 Dec 31;13(12):3382-3391.
[10] Zhou J, et al. Final analysis of open-label single-arm study on dabrafenib-trametinib (Dab/Tra) in Chinese patients with BRAF V600E+ metastatic non-small cell lung cancer (NSCLC). 2025 ESMO 2004P.
[11] Park J, et al. MET Alterations in Cancer and MET-Targeted Therapy: Detection Strategies, Treatment Efficacy, and Emerging Technologies. Target Oncol. 2025 Jul 18.
[12] Wolf J, et al. N Engl J Med 2020;383:944-57.
[13] Wolf J, et al. Lancet Oncol. 2024 Oct;25(10):1357-1370.
[14] Cai Z, et al. ASKC202 plus Limertinib in EGFR-mutated advanced or metastatic NSCLC patients with MET amplification or MET overexpression Following EGFR-TKI. 2025 ESMO 1959P.
[15] Yonina R, et al. Telisotuzumab adizutecan (ABBV-400; Temab-A) in patients with MET-amplified (MET-amp) advanced solid tumors: Results from a phase 1 study. 2025 ESMO 918O.
审批码TML0055957-116048,有效期为2025-10-26至2026-10-25,资料过期,视同作废
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


