2025年10月19日,由我国学者牵头、全部在中国完成的III期临床研究OptiTROP-Lung04在线发表于全球顶级医学期刊《新英格兰医学杂志》(NEJM),并同步在2025年欧洲肿瘤内科学会(ESMO)大会主席论坛进行全球口头报告。该研究首次证实:TROP2抗体偶联药物(ADC)芦康沙妥珠单抗在EGFR突变、经EGFR-TKI治疗失败但尚未接受含铂化疗的晚期非鳞状非小细胞肺癌(NSCLC)中,不仅显著延长无进展生存期(PFS),更实现具有统计学意义的总生存期(OS)延长,成为全球首个在该人群中带来明确OS获益的TROP2 ADC单药治疗方案,标志着中国原研创新药正式引领肺癌耐药治疗新范式。
中山大学附属肿瘤医院主任医师、教授、中肿国家重点实验室PI、博士研究生导师
国家高层次人才项目青年人才
广东省特支计划百千万工程青年拔尖人才
广东省杰出青年医学人才
广州市珠江科技新星
CSCO非小细胞肺癌专业委员会委员
CSCO鼻咽癌专业委员会委员
中国抗癌协会肺癌专业委员会委员
广东省抗癌协会鼻咽癌专业青年委员会副主任委员
广东省医学会精准医学与分子诊断专业委员会副主任委员
广东省临床医学会真实世界临床研究专业委员会副主任委员
研究方向:肺癌及鼻咽癌的靶向治疗及免疫治疗的临床及转化研究
主要课题:主持国家重大研发计划(子课题)、国自然(6项)
代表论著:Cancer Cell、JCO、Lancet Oncology(2篇,2021,2018)、STTT、 Molecular Cancer、 Nature Communications、J Thorac Oncol、Clinical Cancer Research、JITC等
点击观看视频
突破耐药困局:单药ADC实现PFS与OS双重获益
Q1:方教授您好,恭喜由您作为第一作者的OptiTROP-Lung04研究荣登《新英格兰医学杂志》,并同步在ESMO主席论坛公布。首先请您解析该研究为EGFR突变TKI耐药治疗领域带来的临床价值。
方文峰教授:过去二十余年,针对EGFR突变晚期非小细胞肺癌的靶向治疗已形成以三代EGFR-TKI为主导的治疗格局。然而,靶向治疗并非根治性手段,患者最终均会进展耐药。耐药后,临床治疗回归以含铂双药化疗为基础的策略,可联合或不联合抗血管生成药物,部分方案进一步叠加免疫治疗。尽管治疗选择多样,患者整体预后仍不理想,OS获益不显著,亟需开发更高效、更安全的新药与新方案。
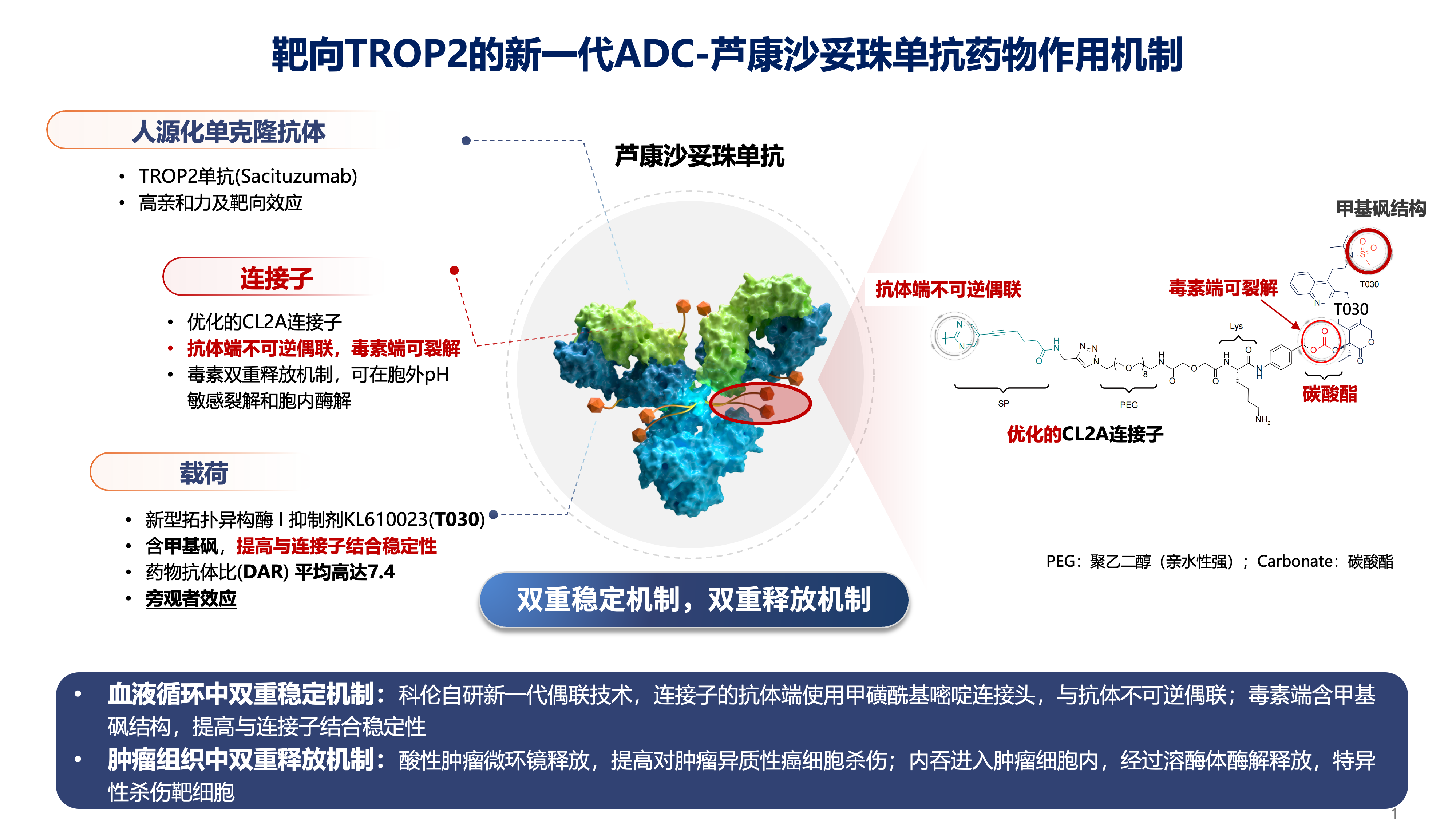
在此背景下,我们聚焦新一代抗体偶联药物(ADC)——芦康沙妥珠单抗。芦康沙妥珠单抗通过双重稳定机制、双重释放机制和三重抗肿瘤作用(细胞内杀伤、旁观者效应、瘤周释放),实现了疗效与安全性的优化平衡。
早期I/II期研究显示,在EGFR突变晚期非小细胞肺癌患者中,其单药客观缓解率超过50%,中位无进展生存期达9-10个月。更为关键的是,基础与转化研究发现,EGFR突变肿瘤对TROP2 ADC的内吞活性显著高于EGFR野生型肿瘤,提示该人群是TROP2 ADC的优势群体。
基于上述发现,我们首先在三线治疗人群中开展OptiTROP-Lung03研究,证实芦康沙妥珠单抗相较于多西他赛显著延长PFS(6.9个月 vs 2.8个月,HR 0.30,P<0.0001),并观察到总生存获益(P=0.0070)。该结果支持其于2025年3月在中国率先获批用于EGFR-TKI及含铂化疗双重失败后的三线治疗。
随后,我们将治疗线数前移,启动OptiTROP-Lung04研究,聚焦EGFR-TKI治疗失败但尚未接受含铂化疗的二线人群。该全国多中心、随机、开放标签III期研究显示:芦康沙妥珠单抗组中位PFS为8.3个月,显著优于含铂化疗组的4.3个月(HR=0.49,P<0.001),疾病进展或死亡风险降低51%;同时,总生存期亦呈现显著获益(HR=0.60,双侧P=0.001),死亡风险降低40%。尽管OS数据尚未成熟,但模型预测其绝对生存获益有望超过12个月。
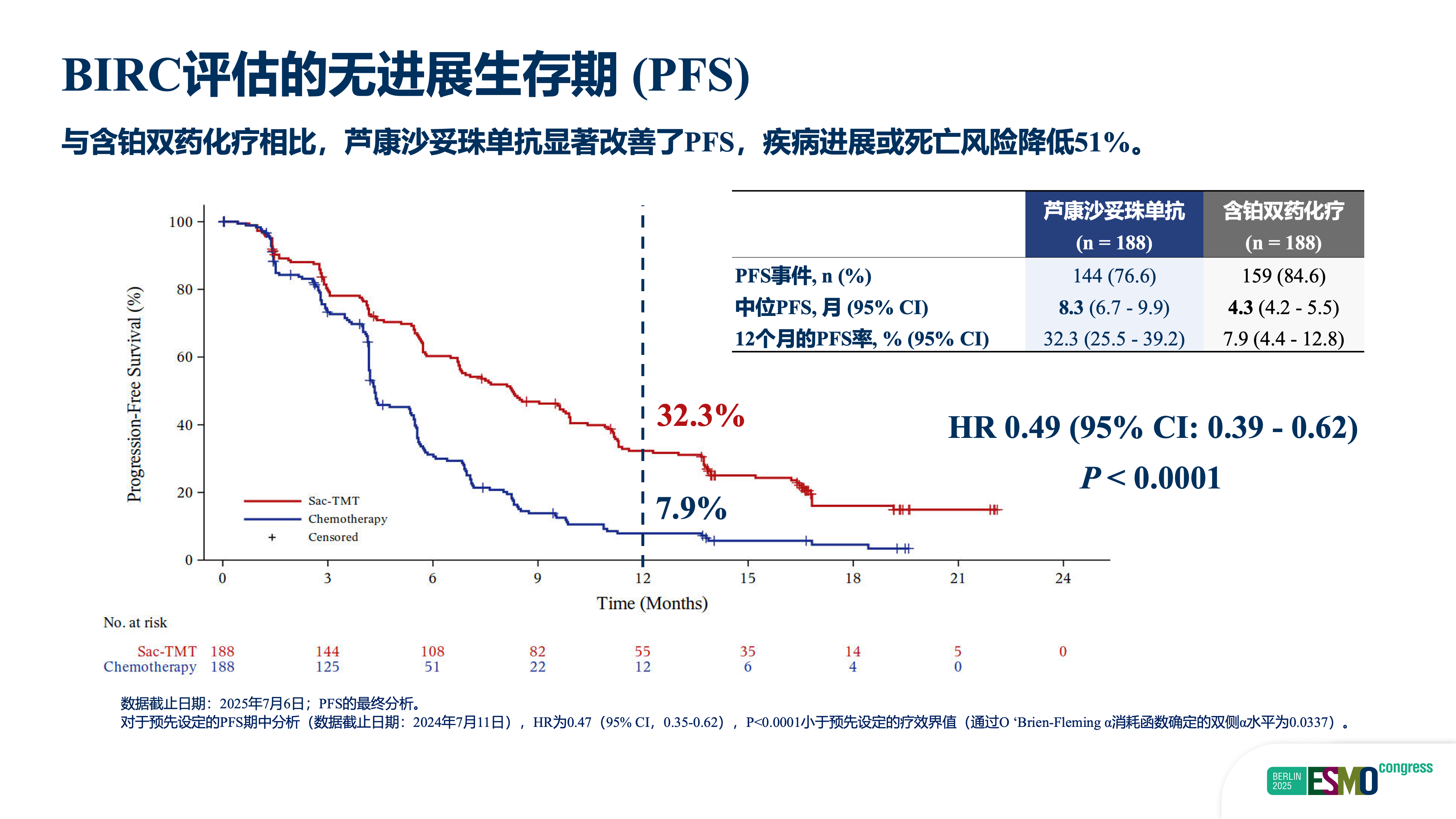
图2. BIRC评估的无进展生存期(PFS)
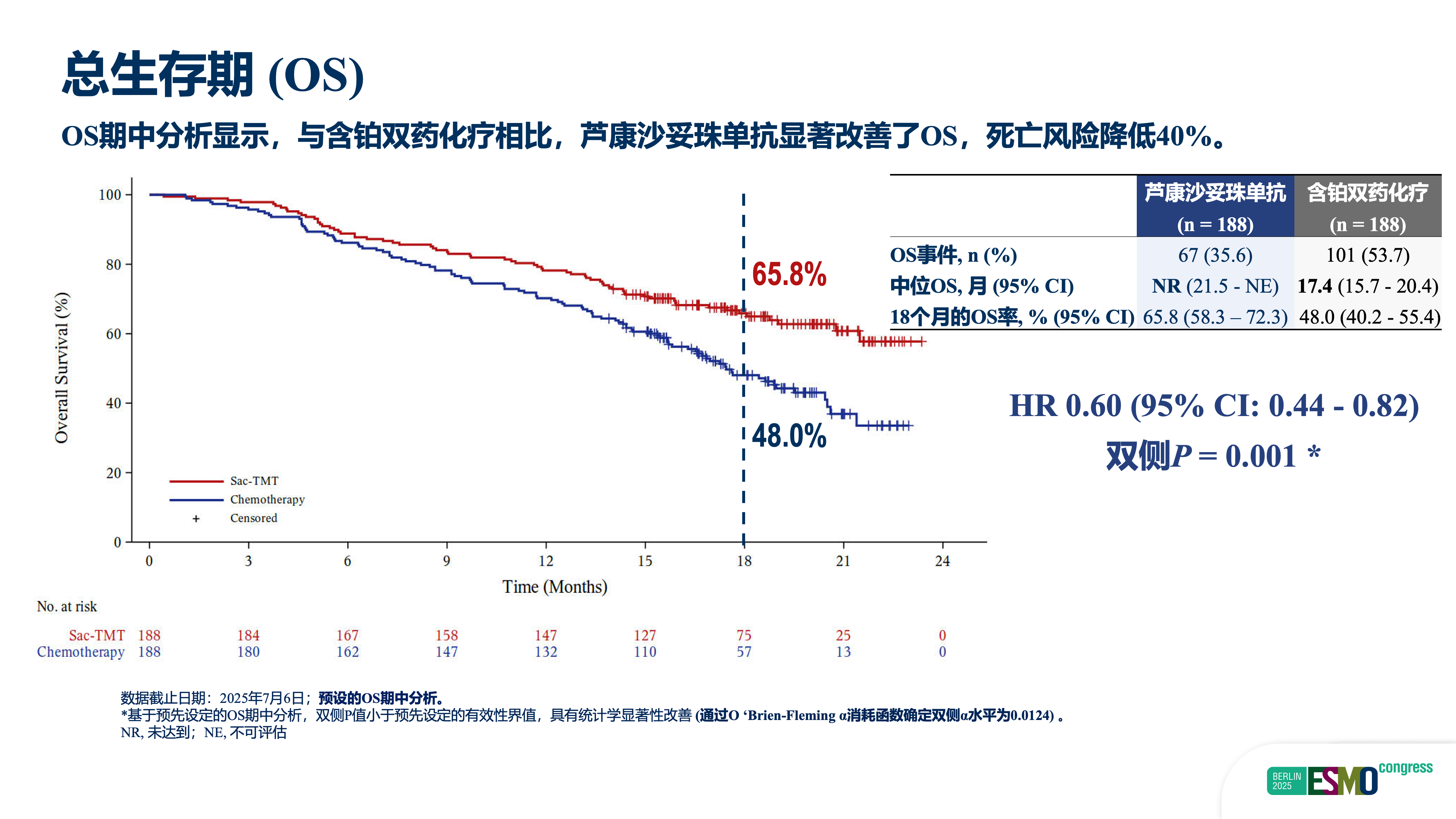
该研究的临床价值体现在三方面:第一,首次在EGFR-TKI耐药二线人群中证实单药ADC优于标准含铂双药化疗,打破“必须联合多药”的传统模式;第二,实现PFS与OS双重显著获益,为患者带来确切的长期生存延长;第三,单药方案使用便捷、毒性可控,显著提升治疗可及性与患者依从性。该药已于9月30日正式获批用于该适应症,标志着临床实践的重大进步。
从机制洞察到全球引领:中国创新药的精准突围之路
Q2:芦康沙妥珠单抗作为全球首款获批肺癌适应症的TROP2 ADC,如今又成为首款获批EGFR TKI耐药治疗的ADC药物。您作为核心研究者之一,能否谈一谈中国学者、中国创新药物是如何一步步做到国际认可、引领全球的。
方文峰教授:国际上已有两款TROP2 ADC(Dato-DXd与Sacituzumab Govitecan)在非小细胞肺癌领域开展III期研究,但均以失败告终。其共同策略是面向包含鳞癌与非鳞癌、驱动基因阳性与阴性在内的广泛人群,在一线免疫联合化疗失败后挑战多西他赛。然而,由于整体疗效优势有限,未能达到主要终点。
相比之下,我们的研发路径强调精准人群选择与机制驱动。早期临床观察提示,EGFR突变患者对芦康沙妥珠单抗单药的疗效显著优于野生型人群;随后的机制研究进一步证实,EGFR信号通路激活可增强TROP2介导的网格蛋白依赖性内吞(CME),从而促进药物高效内化并释放细胞毒素载荷。这一发现为适应症开发提供了坚实的科学依据。
基于此,我们果断将研发聚焦于EGFR突变这一高度敏感亚群,从三线验证到二线突破,形成清晰的证据链。OptiTROP-Lung04不仅成为该领域全球首个在该人群中实现OS显著获益的III期研究,更同步发表于《新英格兰医学杂志》并入选ESMO主席论坛——后者每年仅遴选约8–10项最具突破性的研究。
这一成功并非偶然,而是中国研究团队立足本土临床需求、以机制研究为先导、以精准开发为策略、以高质量临床研究为支撑的系统性成果,标志着中国创新药研发已从“跟随”走向“引领”。
多策略并存下的最优解:如何为EGFR耐药患者精准排兵布阵
目前EGFR TKI耐药治疗领域主要有以下几种诊疗模式:芦康沙妥珠单抗单药治疗模式,免疫&抗血管生成联合化疗模式,EGFR/c-MET双抗联合化疗模式以及化疗联合抗血管生成模式。相比其他治疗模式,您如何看待芦康沙妥珠单抗治疗的优势?针对EGFR TKI耐药患者后续治疗,您会如何排兵布阵?
方文峰教授:当前EGFR-TKI耐药后的治疗策略日益多元化,包括芦康沙妥珠单抗单药、免疫联合抗血管生成+化疗、EGFR/c-MET双特异性抗体联合化疗,以及传统化疗联合抗血管生成等。在多种选择中,芦康沙妥珠单抗展现出独特优势。
首先,疗效明确:OptiTROP-Lung04研究显示,其ORR达60.6%,中位PFS为8.3个月,OS HR为0.60,显著优于含铂化疗。其次,安全性良好:严重治疗相关不良事件(TRAE)发生率仅为9%,未观察到间质性肺病(ILD)、免疫相关不良反应(irAE)、高血压或蛋白尿等典型毒性,且无治疗相关死亡。第三,用药便捷:单药静脉输注,无需复杂联合,便于基层实施,提升患者依从性。
在临床排兵布阵方面,我建议采取个体化策略:
对于无明确耐药机制、体能状态良好的患者,优先推荐芦康沙妥珠单抗单药,因其疗效确切、安全性高、使用简便;
若检测到MET扩增,则EGFR-TKI联合MET抑制剂应作为首选,实现精准靶向干预;
对于PD-L1高表达或肿瘤突变负荷(TMB-high),可考虑免疫联合方案,如化疗+贝伐珠单抗+PD-1抑制剂,以期获得免疫治疗获益。
总体而言,治疗决策应综合评估患者的耐药机制、肿瘤生物学特征、体能状态、药物可及性及经济负担,以实现长期、稳定的临床获益。
拓展至KRAS突变人群:TROP2 ADC的泛适应潜力初现
Q4:当前KRAS突变NSCLC的治疗尚处于早期探索,而本次ESMO大会上公布的SKB264-II-08研究KRAS突变队列,不仅纳入了常见的KRAS G12C突变患者,也覆盖了G12D等罕见突变类型。请您谈谈,该研究为这类患者的治疗带来了哪些重要提示?
方文峰教授:KRAS突变是非小细胞肺癌中最常见的驱动基因变异之一,其中KRAS G12C已有靶向药物获批,但非G12C亚型(如G12D、G12V等)仍缺乏有效治疗手段。目前,此类患者一线标准治疗为化疗联合免疫,后线选择极为有限。
SKB264-II-08研究纳入了既往接受标准治疗失败的KRAS突变晚期NSCLC患者,其中非G12C突变占比达56%。结果显示,芦康沙妥珠单抗单药治疗的客观缓解率为25%,中位无进展生存期达到9.6个月,数值上优于多西他赛,且G12C与非G12C亚型疗效相当。
该研究的重要启示在于:TROP2在KRAS突变肿瘤中普遍高表达,芦康沙妥珠单抗通过靶向TROP2蛋白而非KRAS突变本身,成功规避了不同亚型间的异质性,为整个KRAS突变人群提供了一种泛适应性的治疗新选择。这对于尚无标准靶向治疗的非G12C患者而言,具有重要的临床意义,有望填补当前治疗空白。
破解免疫单药瓶颈:“ADC+免疫”联合开启一线新可能
Q5:我们知道,当前PD-L1高表达(TPS≥50%)患者的一线标准治疗是PD-1单药免疫治疗,但仍有相当一部分患者无效或很快耐药,存在巨大未满足的临床需求。研究探索的“ADC+免疫”新模式,是否有望攻克这个难题?
方文峰教授:PD-1单药在PD-L1高表达(TPS≥50%)患者中的客观缓解率约为30%–40%,中位无进展生存期仅5–6个月,提示大量患者存在原发或继发耐药。如何提升疗效,延缓耐药,是当前免疫治疗面临的核心挑战。
我们在ESMO公布的SKB264-II-04研究显示,芦康沙妥珠单抗联合帕博利珠单抗(pembrolizumab)在PD-L1阳性患者中展现出卓越疗效:整体客观缓解率达70%;其中,PD-L1 1%–49%患者ORR为68%,PD-L1≥50%患者ORR高达76%,肿瘤缓解显著优于历史单药数据。
协同机制在于:芦康沙妥珠单抗可诱导免疫原性细胞死亡(ICD),释放肿瘤相关抗原,激活树突状细胞,促进T细胞浸润,将“免疫冷肿瘤”转化为“免疫热肿瘤”,从而增强PD-1抑制剂的抗肿瘤免疫应答。
目前,我们已在全球启动多项III期临床研究:在PD-L1阳性人群中,评估“芦康沙妥珠单抗+帕博利珠单抗”对比“帕博利珠单抗单药”;在PD-L1阴性人群中,对比“芦康沙妥珠单抗+帕博利珠单抗”与“化疗+帕博利珠单抗”。我们期待这些研究能够验证“ADC+免疫”联合策略的优越性,并推动其成为一线治疗新标准,为更多患者带来深度且持久的临床获益。
1. Zhang L, et al. OptiTROP-Lung04: A phase III study of sacituzumab govitecan versus platinum-pemetrexed chemotherapy in EGFR-mutant NSCLC after TKI failure. ESMO Presidential Symposium 2025.
排版编辑:Crystal











 苏公网安备32059002004080号
苏公网安备32059002004080号


