ERBB2(编码HER2)基因突变发生在2%至4%的非小细胞肺癌 (NSCLC) 患者中,可导致患者预后不良[1]。部分泛ERBB酪氨酸激酶抑制剂(TKI)在HER2突变NSCLC患者中具有一定活性,但由于同时抑制野生型(WT)表皮生长因子受体(EGFR),常导致腹泻、皮疹等EGFR相关毒性,限制了其临床应用[1, 2]。虽然以T-DXd为代表的ADC药物为HER2突变NSCLC患者带来了新的治疗选择,但其治疗相关不良事件,如间质性肺疾病或肺炎给患者带来了极大的困扰[1]。因此,迫切需要一种能够有效靶向HER2突变同时保留EGFRWT活性的高选择性、口服、耐受性良好的HER2 TKI,以满足临床需求。
宗艾替尼作为一种新型、口服、高选择性的不可逆HER2抑制剂,凭借其独特的作用机制和临床前及临床研究证据,为这一患者群体带来了新的希望。本文将从临床前研究结果出发,全面梳理宗艾替尼的药学特性,并结合临床数据,探讨其在HER2突变NSCLC治疗中的独特优势。
宗艾替尼:独特分子结构,铸就HER2高选择性和强效抑制活性
为突破传统泛ERBB抑制剂的局限性,改善HER2驱动肿瘤患者的治疗结局,科学家筛选并优化了一些新型TKI,能够有效抑制HER2致癌变异,且对HER2的选择性远高于野生型EGFR。在此过程中,化合物BI-4142和BI-1622虽展现出预期的活性和选择性,但并不适合临床开发。最终发现了性能更佳的临床候选药物宗艾替尼(BI 1810631),这是一款共价HER2抑制剂,可保留EGFRWT功能[1],有望满足HER2突变NSCLC患者当前尚未被满足的治疗需求。
宗艾替尼分子结构中疏水区引入[1,2,4]三唑并[1,5 - a]吡啶的4号位的氮原子,可与HER2的Ser783形成氢键,同时难以与EGFR的Cys775形成氢键,从而实现对HER2的高选择性[3]。此外,宗艾替尼的亲水区引入丙烯酰胺基团,能够与HER2半胱氨酸805(Cys805)位点不可逆共价结合,这一特性进一步增强了其对HER2的持久抑制作用[1]。
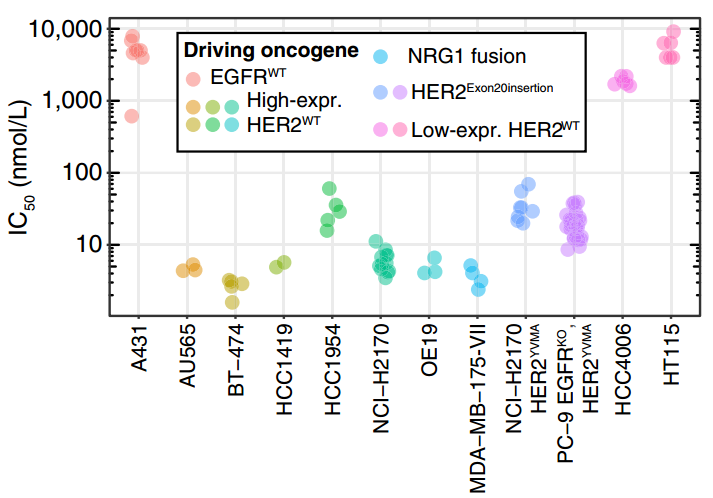
在使用HEK细胞进行的磷酸化实验中,宗艾替尼对HER2YVMA展现出高活性,同时避免对EGFRWT的干扰[1]。这些发现在使用EGFRWT或HER2YVMA依赖性Ba/F3细胞进行的抗增殖实验中得到进一步验证,结果显示,宗艾替尼对HER2YVMA的抑制活性(IC50低至16 nmol/L)是对EGFRWT的约100倍(IC50为1540 nmol/L)[1]。
为了验证共价结合与宗艾替尼活性的关系,在HER2YVMA,C805S依赖性Ba/F3工程细胞系中,半胱氨酸805被丝氨酸取代,因此不再与宗艾替尼形成共价键,观察到宗艾替尼的抗增殖IC50从HER2YVMA Ba/F3细胞系中的16 nmol/L增加到HER2YVMA,C805S Ba/F3细胞系中的554 nmol/L。此外,BI-3999是宗艾替尼的乙酰胺配对化合物(指结构相似但特定性质,如活性不同的对比化合物),无法与HER2形成共价键,观察到BI-3999在HER2YVMA Ba/F3细胞系中的效力(IC50为483 nmol/L)与宗艾替尼在HER2YVMA,C805S Ba/F3细胞系中的效力相当(IC50为554 nmol/L)[1]。BI-3999的效力降低进一步证实共价结合在宗艾替尼抗增殖活性中的重要性。
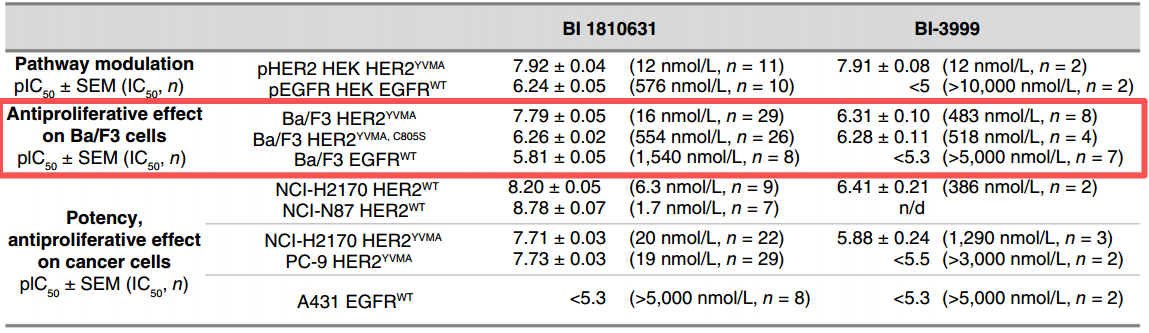 图1. 宗艾替尼与非共价配对化合物BI-3999的效力[1]
图1. 宗艾替尼与非共价配对化合物BI-3999的效力[1]
宗艾替尼对多种激酶表现出高选择性。在体外激酶抑制实验中,研究者发现,1 μmol/L浓度下宗艾替尼仅对397种激酶中的HER2、HER4和BMX的抑制率达到80%以上。此外,针对1 μmol/L浓度下抑制率>50%的激酶,以及具有与HER2 C805同源的半胱氨酸激酶进行了激酶抑制试验,结果证实宗艾替尼对HER2具有高选择性,IC₅₀超过对EGFR选择性的25倍[1]。
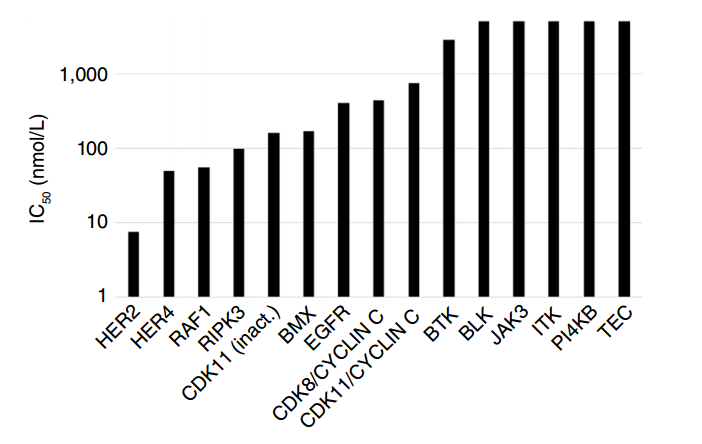
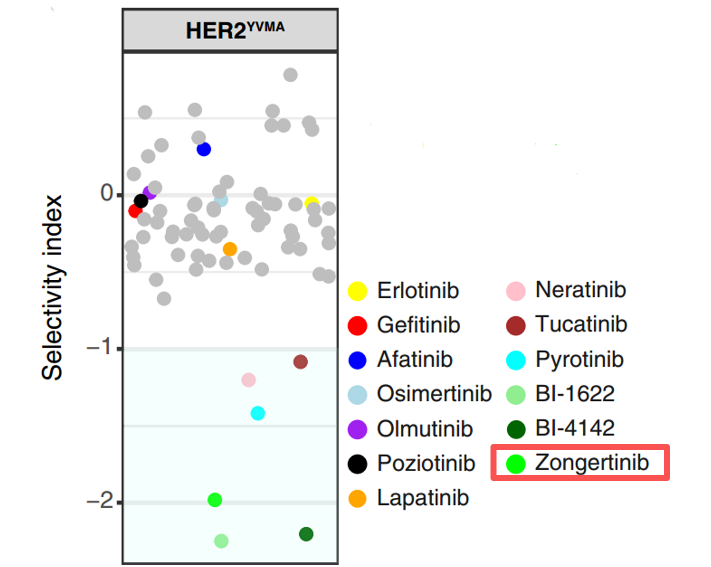
在70多种TKI中,宗艾替尼在细胞模型中展现对HER2的高选择性优势
在Ba/F3抗增殖实验中,研究者将宗艾替尼对HER2YVMA而非EGFRWT的选择性活性与70 多种TKI(包括EGFR抑制剂和泛ERBB抑制剂)进行了比较,并采用选择性指数量化这些抑制剂对HER2YVMA和EGFRWT的效力差异,结果显示: 宗艾替尼表现出对于HER2YVMA的高选择性,并保留了EGFRWT活性[1,3]。
在HER2YVMA、EGFRWT或EGFR致癌突变(EGFRdel19或EGFRdel19,T790M)依赖性Ba/F3细胞模型中,研究者对宗艾替尼与泛ERBB抑制剂波齐替尼的选择性进行了比较,结果发现与筛选结果一致,宗艾替尼在抑制HER2YVMA方面显示出比波齐替尼更好的选择性,而对EGFRWT、EGFRdel19的抑制作用显著低于波齐替尼[1]。
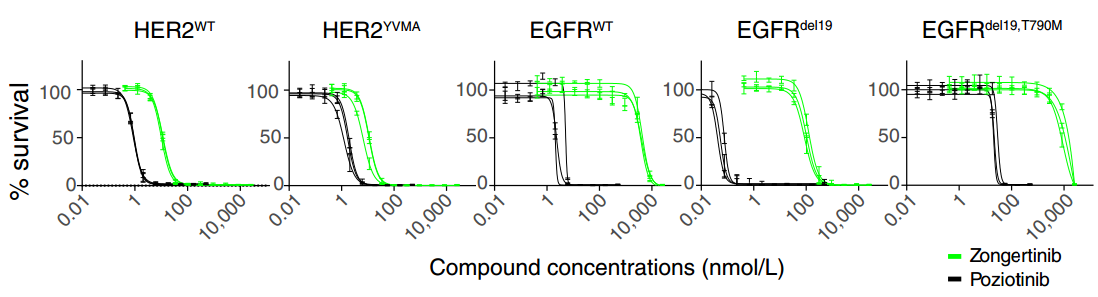
之后,研究者进一步在EGFR或HER2依赖性人类癌细胞模型中评估宗艾替尼的抗增殖效力。结果发现,宗艾替尼对所有依赖HER2的细胞系均表现出高效力(IC50<100nmol/L),宗艾替尼在表达HER2YVMA的NCI-H2170人肺鳞癌细胞系中的IC50为20 nmol/L,在表达EGFRKO,HER2YVMA的PC-9人肺腺癌细胞系中的IC50为19 nmol/L,而在依赖EGFRWT的A431人表皮癌细胞系中的抑制作用极低,IC50 >5000 nmol/L[1]。
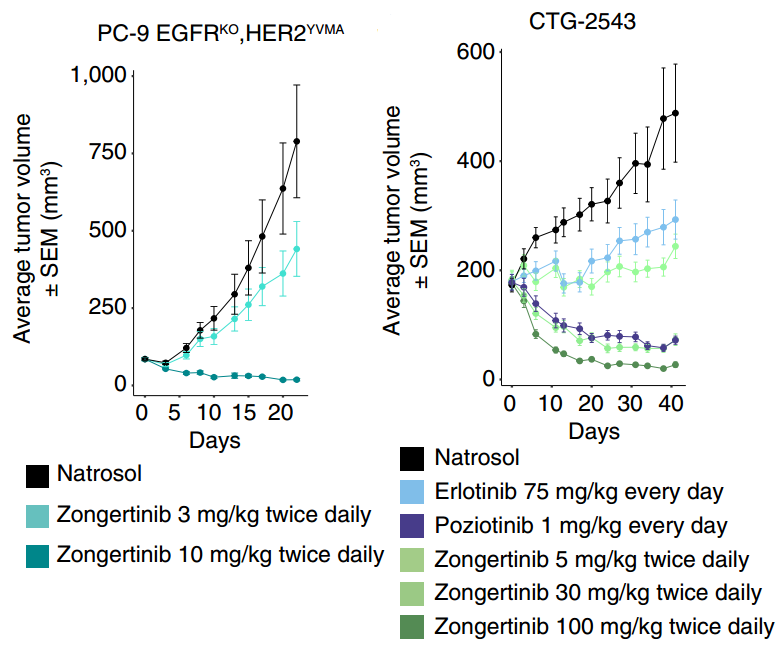
宗艾替尼在小鼠异种移植模型体内活性表现出色,显著抑制肿瘤生长
研究者利用小鼠异种移植模型评估了宗艾替尼的体内活性。在PC-9 EGFRKO、HER2 YVMA 异种移植模型中,研究者发现,宗艾替尼对PC-9 EGFRKO、HER2 YVMA细胞形成的肿瘤具有剂量依赖性抑制作用。3 mg/kg每日两次可抑制肿瘤生长,10 mg/kg每日两次可缩小肿瘤[1]。
在表达HER2 YVMA的NSCLC患者来源异种移植(PDX)小鼠模型CTG-2543中,评估了宗艾替尼、波齐替尼和EGFR抑制剂厄洛替尼的体内活性。厄洛替尼75 mg/kg显示出中度的肿瘤生长抑制,但无肿瘤缩小。宗艾替尼30 mg/kg每日两次可使肿瘤缩小至与波齐替尼1 mg/kg(最大耐受剂量)相似的程度,而宗艾替尼100 mg/kg可诱导更深的缩瘤效果,同时耐受性良好(通过体重变化进行评估),为后续的临床研究奠定了坚实基础[1]。
宗艾替尼治疗HER2突变NSCLC临床获益显著
Beamion LUNG-1研究是一项备受瞩目的多中心、多队列Ia/Ib期首次人体试验,为宗艾替尼的临床价值提供了有力佐证。Ia期(剂量递增)研究旨在评估宗艾替尼在HER2变异晚期或转移性实体瘤患者中的安全性、耐受性、药代动力学和初步疗效,并确定最大耐受剂量(MTD)和/或Ib期的推荐扩展剂量(RDE);Ib期(剂量扩展)研究则重点评估宗艾替尼在HER2突变晚期或转移性NSCLC患者中的有效性和安全性[4]。
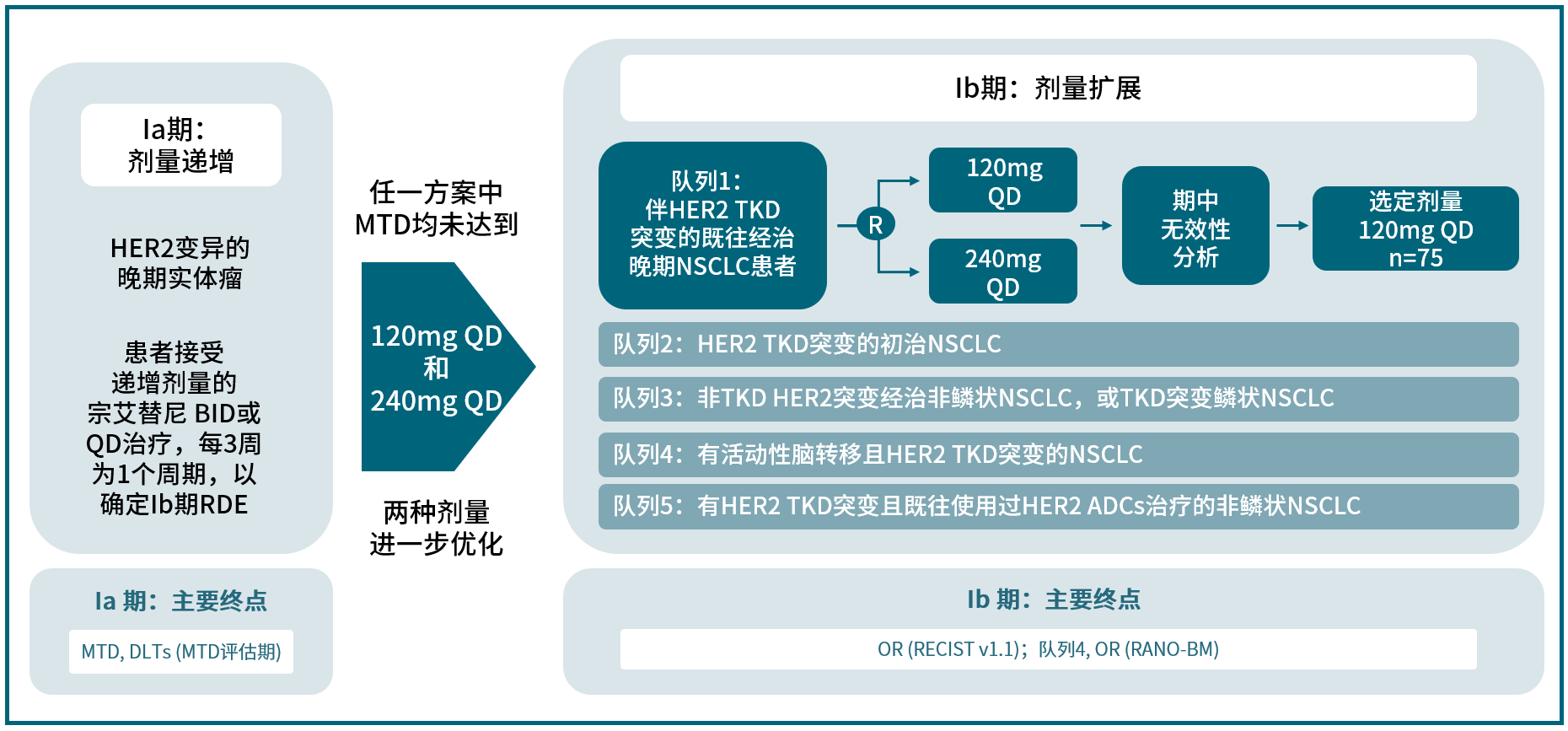
2025年3月,Beamion LUNG-1研究Ia期剂量递增研究数据发表于Journal of Clinical Oncology杂志(IF=42.1)[4]。结果表明,宗艾替尼安全性良好,MTD未达到,并在HER2变异的实体瘤患者中表现出令人鼓舞的抗肿瘤活性,尤其是HER2突变NSCLC患者群体。
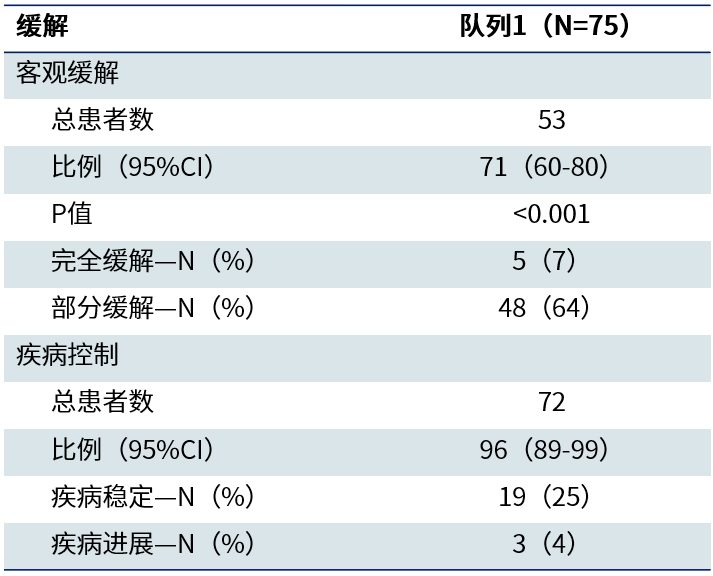
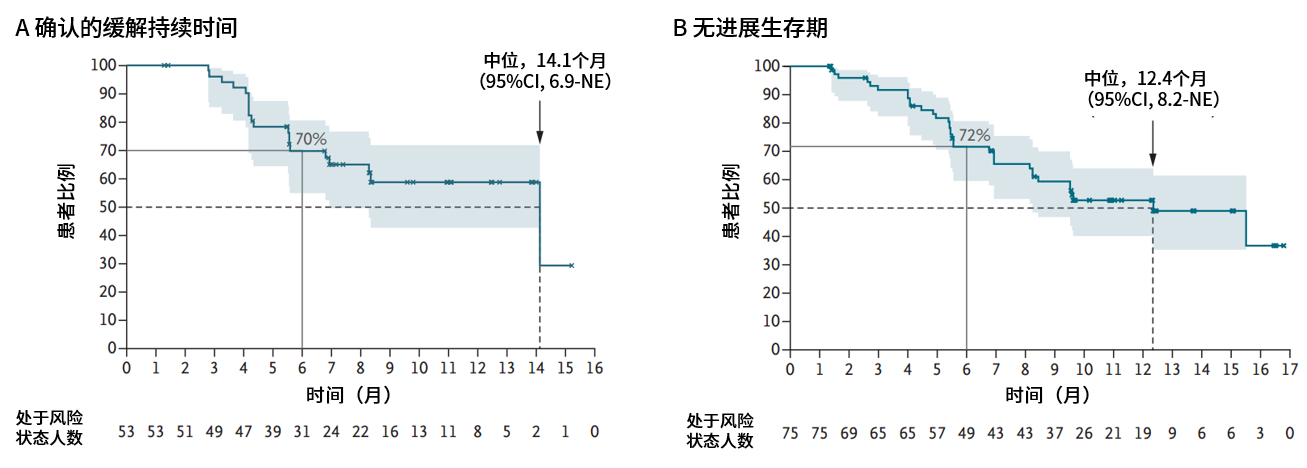
紧随其后,NEJM杂志重磅发布了Beamion LUNG-1研究Ib期研究结果[2]。在HER2酪氨酸激酶结构域(TKD)突变经治患者(队列1)的中期剂量选择分析中,基于获益-风险特征和暴露-反应分析,最终选定120mg剂量。截至2024年11月29日,队列1中共75例患者接受120mg剂量宗艾替尼治疗,结果显示,经盲态独立中心评审(IRC)确认的客观缓解率(ORR)高达71%(95%CI 60-80),其中7%达到完全缓解(CR),64%达部分缓解(PR),疾病控制率(DCR)达96%。中位缓解持续时间(DoR)达14.1个月(95%CI 6.9-NE),中位无进展生存期(PFS)为12.4个月(95%CI 8.2-NE),缓解持久且稳定。
表1. 队列1患者接受120mg宗艾替尼治疗的缓解结果[2]
安全性方面,宗艾替尼表现出良好的耐受性和可控的安全性。队列1中≥3级治疗相关不良事件(TRAEs)发生率为17%,只有2例(3%)患者因不良事件而停止治疗。EGFR相关不良事件(如腹泻和皮疹)多为1-2级,未发现药物相关间质性肺疾病事件。这一优异的安全性特征与临床前研究中宗艾替尼高选择性抑制HER2、保留EGFRWT功能的特性高度契合。
今年的世界肺癌大会(2025 WCLC)最新公布了Beamion LUNG-1研究基线伴稳定/无症状脑转移(队列1)或伴活动性脑转移(队列4)的HER2突变NSCLC患者的数据[7]。在对队列1伴稳定/无症状脑转移(28例)和队列4伴活动性脑转移(30例)的58例患者进行的汇总分析中,根据神经肿瘤脑转移瘤(RANO-BM)标准评估的颅内ORR为41%,DCR达83%,PFS为8.2个月,充分展现出宗艾替尼对颅内病灶的治疗潜力。
凭借Beamion LUNG-1卓越的研究成果,宗艾替尼成功写入2025 CSCO和NCCN NSCLC诊疗指南[8, 9],为临床治疗提供了权威指导,并于2025年8月26日获得中国国家药品监督管理局(NMPA)附条件批准,单药适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性NSCLC成人患者。
写在最后
宗艾替尼凭借其独特的分子结构赋予其超越传统泛ERBB抑制剂的HER2高选择性和强效抗肿瘤活性,同时最大程度保留EGFRWT功能。这一卓越的药学特性在关键临床研究Beamion LUNG-1中成功转化为显著且持久的临床获益和良好的安全性。宗艾替尼不仅为HER2突变NSCLC患者提供了一种全新、高效且更可控的口服靶向治疗选择,更是在重新定义这一难治性肺癌亚型的治疗格局。随着更多临床数据的不断积累与深入研究,我们期待宗艾替尼能为HER2突变NSCLC患者带来更优的生存获益与生活质量。
专家介绍
天津医科大学肿瘤医院(天津市肿瘤医院)
天津市肺癌诊治中心
主任医师 博士和博士后导师
国家恶性肿瘤临床医学研究中心(NCRCC)二级 PI
药物成药性评价与系统转化全国重点实验室 PI
主持新药研发入选天津市科技计划成果库
主持国家及省部级科研基金3项
第一及通讯作者发表SCI论文59篇
[1] Wilding B, Woelflingseder L, Baum A, et al. Zongertinib (BI 1810631), an Irreversible HER2 TKI, Spares EGFR Signaling and Improves Therapeutic Response in Preclinical Models and Patients with HER2-Driven Cancers. Cancer Discov. 2025. 15(1): 119-138.
[2] Heymach JV, Ruiter G, Ahn MJ, et al. Zongertinib in Previously Treated HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2025. 392(23): 2321-2333.
[3] Wilding B, Scharn D, Böse D, et al. Discovery of potent and selective HER2 inhibitors with efficacy against HER2 exon 20 insertion-driven tumors, which preserve wild-type EGFR signaling. Nat Cancer. 2022. 3(7): 821-836.
[4] Heymach JV, Opdam F, Barve M, et al. HER2-Selective Tyrosine Kinase Inhibitor, Zongertinib (BI 1810631), in Patients With Advanced/Metastatic Solid Tumors With HER2 Alterations: A Phase Ia Dose-Escalation Study. J Clin Oncol. 2025. 43(11): 1337-1347.
[5] Noboru Yamamoto, Haiyan Tu, Myung-Ju Ahn, et al. Zongertinib in patients with HER2-mutant NSCLC: Updated analysis of beamion LUNG-1.2024 ESMO Asia Congress.LBA5 .
[6] John Heymach, Frans Opdam, Minal A. Barve, et al. Phase Ia/Ib trial of zongertinib (BI 1810631), a HER2-specific tyrosine kinase inhibitor (TKI), in patients (pts) with HER2 aberration-positive solid tumors: Updated Phase Ia data from Beamion LUNG-1, including progression-free survival (PFS) data. 2024 ASCO. 8514 .
[7] G. Ruiter, E.F. Smit, R.A. Soo, et al. Zongertinib in Patients With Previously Treated HER2-Mutant NSCLC and Brain Metastases at Baseline: Beamion LUNG-1. 2025 WCLC. PT2.12.03 .
[8] 中国临床肿瘤学会(CSCO). CSCO非小细胞肺癌诊疗指南2025 .
[9] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Non Small Cell Lung Cancer. Version 5. 2025 .
审批号:SC-CN-18158,有效期至:10/20/2026
排版编辑:肿瘤资讯-zly











 苏公网安备32059002004080号
苏公网安备32059002004080号


