HER2突变非小细胞肺癌(NSCLC)患者脑转移发生率较高,约20%的患者在确诊时即出现脑转移,50%的患者在整个病程中会经历脑转移,这类患者预后和生活质量较差,且有效治疗选择十分有限,因此开发一种具有中枢神经系统活性的新型HER2靶向药物至关重要[1, 2]。然而,绝大多数新药临床试验排除了活动性脑转移的患者[1, 3],这导致了药物在这类患者中的疗效和安全性数据的缺失,从而限制了对这类患者的治疗选择和治疗策略的制定。
今年世界肺癌大会(2025 WCLC)报告了来自Beamion LUNG-1临床试验的新数据和更新数据,重点分析了宗艾替尼在稳定/无症状和活动性脑转移患者中的疗效和安全性。宗艾替尼在脑转移患者中展现出具有临床意义的全身及颅内抗肿瘤活性,为脑转移患者带来了新的曙光[1]。本文特邀上海市肺科医院任胜祥教授深入解读和点评该研究,并探讨宗艾替尼在HER2突变NSCLC治疗中的未来应用前景。
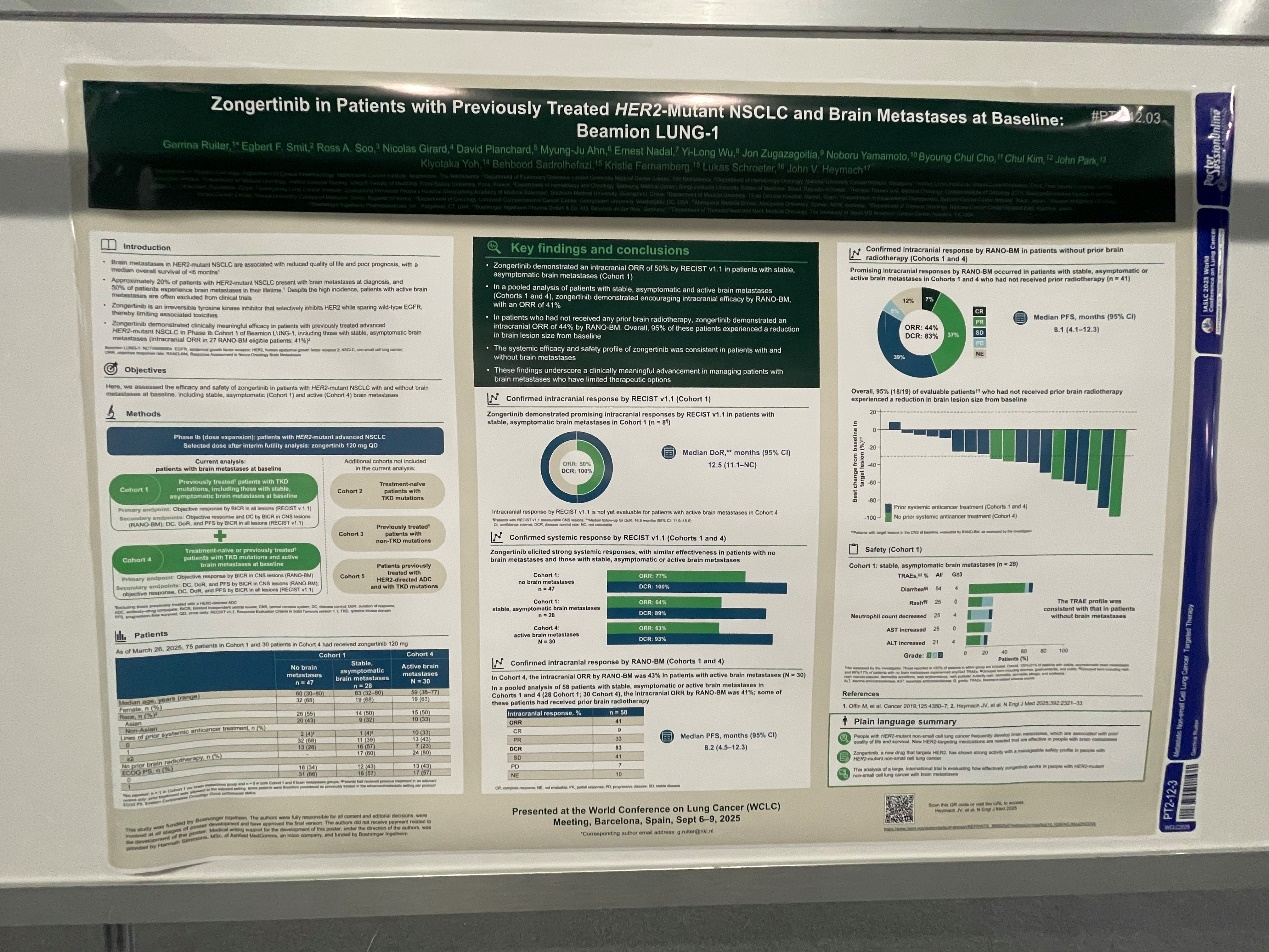
Beamion LUNG-1研究设计:包含活动性脑转移患者,评估维度全面
Beamion LUNG-1(NCT04886804)Ib期研究旨在评估宗艾替尼在HER2突变晚期/转移性NSCLC患者中的疗效与安全性。WCLC 2025上公布的数据评估了Beamion LUNG-1 Ib期研究中两个队列基线时伴有脑转移的晚期HER2突变NSCLC患者的结局[1]。
队列1纳入了既往接受过治疗的酪氨酸激酶结构域(TKD)突变患者(包括基线时稳定/无症状的脑转移患者),主要终点为盲态独立中心评审(BICR)根据实体瘤疗效评价标准1.1(RECIST v1.1)评估的所有病灶的客观缓解率(ORR)。次要终点包括BICR根据神经肿瘤脑转移瘤(RANO-BM)标准评估的中枢神经系统(CNS)病灶的颅内ORR和疾病控制率(DCR);BICR根据RECIST v1.1评估的所有病灶的DCR, 缓解持续时间(DoR)和无进展生存期(PFS)。
队列4纳入了基线伴活动性脑转移的初治或经治TKD突变患者,活动性脑转移是指大脑中正在生长、扩散或引起症状(如头痛或头晕)的病灶,通常需要治疗。主要终点为BICR根据RANO-BM评估的CNS病灶的颅内ORR。次要终点包括BICR根据RANO-BM评估的CNS病灶的DCR, DoR和PFS; BICR根据RECIST v1.1评估的所有病灶的ORR、DCR、DoR和PFS。
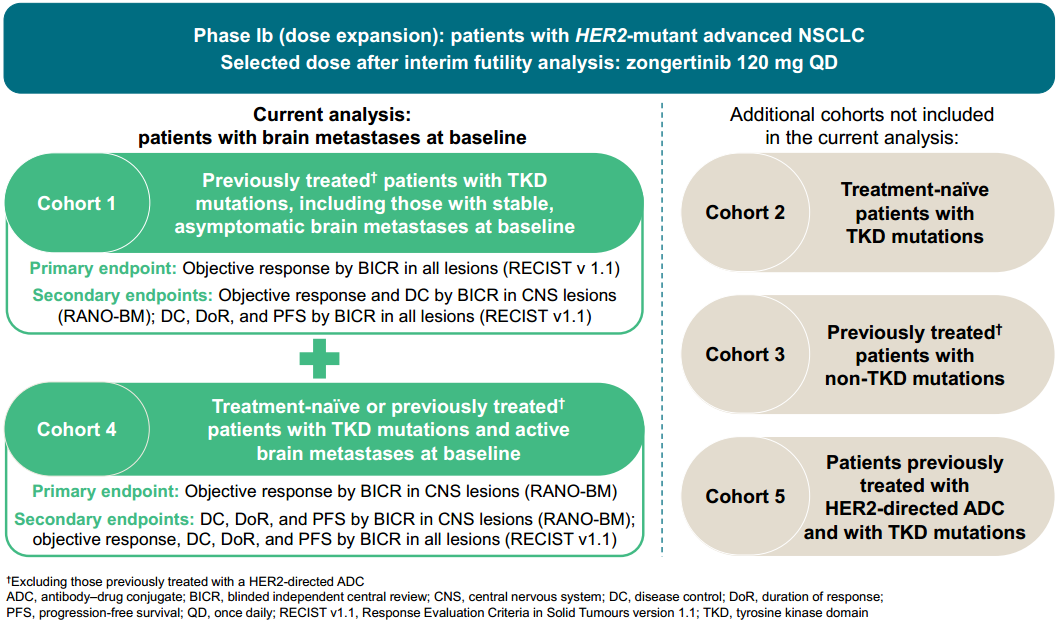
无论基线是否伴脑转移,宗艾替尼表现出一致的全身疗效
截至2025年3月26日,队列1中75例患者和队列4中30例患者接受宗艾替尼120mg每日一次治疗。
在基线无脑转移患者(n=47,队列1)、伴稳定/无症状脑转移患者(n=28,队列1),以及活动性脑转移患者(n=30,队列4)中,宗艾替尼治疗展现出强有力的、相似的全身缓解疗效,根据RECIST v1.1标准确认的ORR分别为77%、64%和63%,DCR分别为100%、89%和93%。

无论是否接受过放疗或前线抗肿瘤治疗,宗艾替尼在脑转移患者中表现出具有临床意义的疗效
在队列1中,根据RECIST v1.1评估具有可测量CNS病灶的8例基线伴稳定/无症状脑转移患者中,经确认的颅内ORR为50%,DCR为100%,中位DoR为12.5个月(95% CI:11.1-NC)。
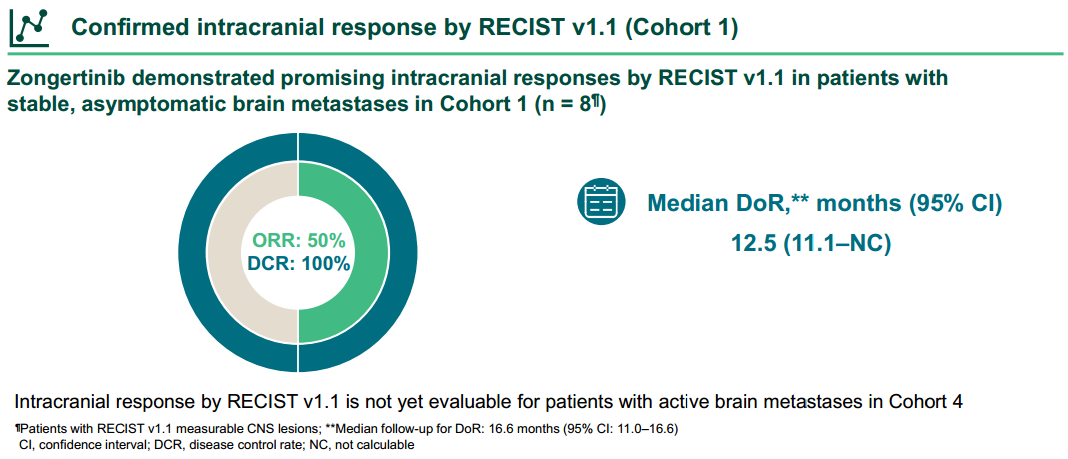
在队列4的活动性脑转移患者(n=30)中,根据RANO-BM评估的颅内ORR为43%。队列1和队列4中共58例基线伴稳定/无症状脑转移(n=28,队列1)和活动性脑转移的患者(n=30,队列4)被纳入汇总分析,其中部分患者既往接受过脑部放疗,根据RANO-BM评估确认的颅内ORR为41%,其中9%达到完全缓解(CR),33%为部分缓解(PR),DCR达83%,中位PFS为8.2个月(95% CI:4.5-12.3)。
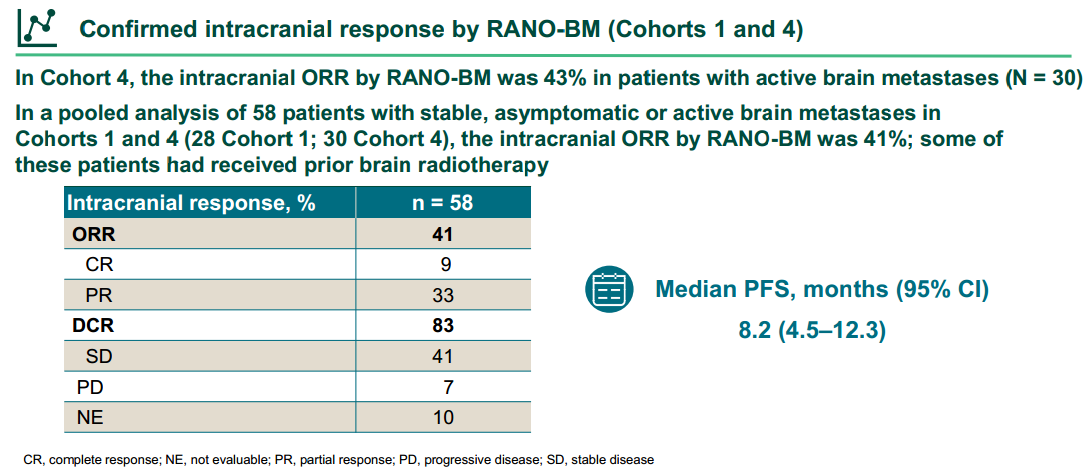
在队列1和队列4中,共有41例既往未接受过脑部放疗的伴稳定/无症状脑转移(n=17,队列1)和活动性脑转移(n=24,队列4)的患者,根据RANO-BM评估确认的颅内ORR为44%,DCR为83%,中位PFS为8.1个月(95% CI:4.1-12.3)。
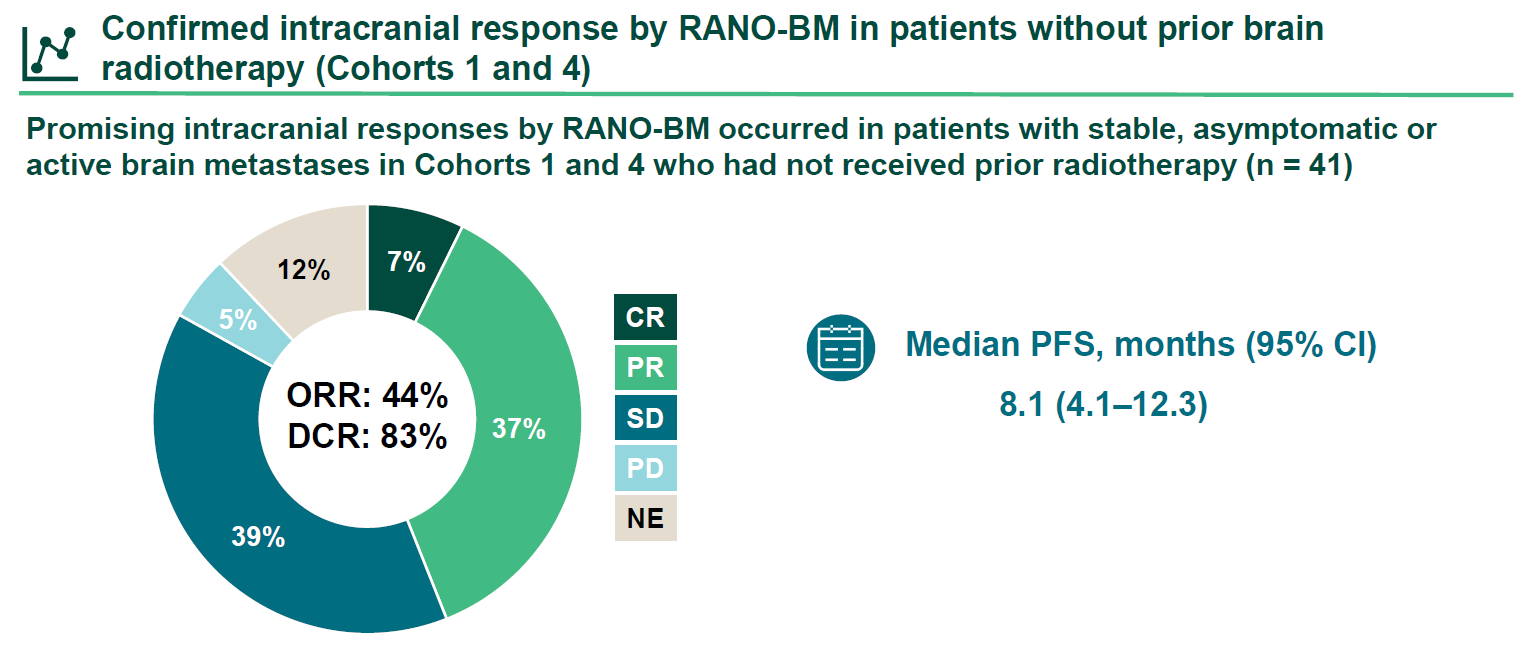
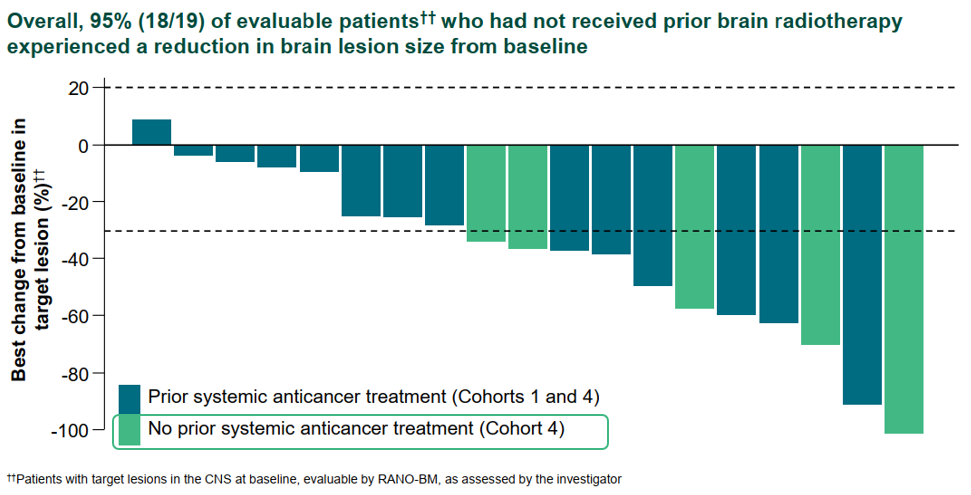
在19例既往未接受过脑部放疗,由研究者通过RANO-BM评估的基线存在CNS靶病灶的脑转移患者中,18例(95%)患者的脑部病灶较基线有所缩小。值得关注的是,在队列4中有5例未经系统性抗肿瘤治疗的基线伴活动性脑转移的患者的颅内病灶获得具有临床意义的缩小。
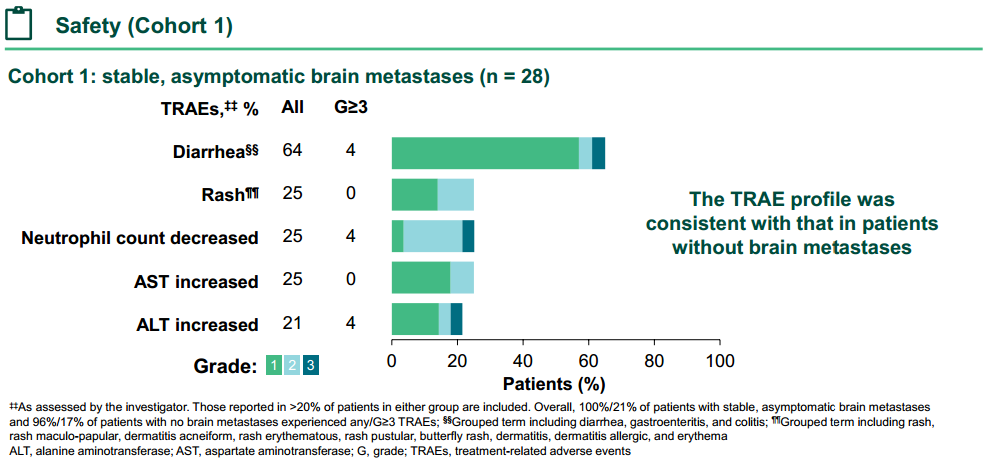
无论基线是否伴有脑转移,宗艾替尼表现出一致的安全性特征
安全性方面,在队列1中,100%/21%的脑转移患者和96%/15%的无脑转移患者报告了治疗相关的不良事件(TRAE)(全部/≥3 级)。在基线伴稳定/无症状脑转移患者(n=28)中,最常见的TRAE为腹泻(64%),绝大多数为1级,≥3级腹泻仅占4%。
专家点评:宗艾替尼实现“全身+颅内”双重获益
HER2突变NSCLC约占所有NSCLC病例的2%-4%,常与预后不良及较高的脑转移发生率相关[4, 5]。约20%的HER2突变NSCLC患者在初诊时便已存在脑转移,而高达50%的患者在疾病进程中最终会发生脑转移[2]。与无脑转移患者相比,发生脑转移的HER2突变NSCLC患者预后和生活质量更差,中位生存期仅4-6个月[2]。目前,针对HER2突变NSCLC的治疗选择有限,虽然部分泛HER酪氨酸激酶抑制剂(TKI)和抗体偶联药物(ADC)在HER2突变NSCLC的研究已取得一定进展,但其疗效和安全性尚不能充分满足临床需求,尤其是在脑转移患者中,亟需更优的治疗方案[4, 6, 7]。然而,传统临床试验通常将活动性脑转移患者排除在外,导致这类患者的治疗证据相对匮乏[1, 3]。
宗艾替尼是一种新型口服、不可逆TKI,高选择性抑制HER2,同时保留野生型EGFR活性,从而减少EGFR相关毒性[4]。其核心临床研究Beamion LUNG-1(NCT04886804)Ib期研究正在系统评估宗艾替尼在HER2突变NSCLC患者中的疗效与安全性,该研究特别纳入了基线存在稳定/无症状脑转移以及活动性脑转移的患者,充分体现了以患者为中心的研究理念,旨在为脑转移患者提供更具针对性的治疗证据。此前已披露的Ib期研究结果已经显示,宗艾替尼在既往经治HER2突变NSCLC患者中具有持久的临床益处和可控的安全性, 在75例HER2 TKD突变经治非鳞状NSCLC患者(队列1)中,接受宗艾替尼治疗的ORR高达71%,中位DoR长达14.1个月,中位PFS为12.4个月[4]。
本次WCLC大会全面公布了Beamion LUNG-1研究基线伴脑转移患者的数据,研究表明,在基线伴脑转移的晚期/转移性HER2突变NSCLC患者中,宗艾替尼不仅表现出了与基线无脑转移患者相似的全身疗效,还展现出卓越的颅内病灶控制能力,队列1中CNS病灶可测量的稳定/无症状脑转移患者(n=8)经RECIST v1.1确认的颅内ORR高达50%,DCR达到100%,队列4中活动性脑转移患者(n=30)经RANO-BM评估的颅内ORR达到43%。在队列1和队列4的汇总分析(n=58)中,根据RANO-BM评估确认的颅内ORR为41%,DCR达83%,中位PFS为8.2个月,其中既往未接受过脑部放疗患者(n=41)的颅内ORR为44%,DCR为83%,中位PFS为8.1个月。伴有脑转移患者的安全性良好,与无脑转移患者的安全性一致[1]。这些结果强调了宗艾替尼在治疗选择有限的脑转移患者中取得了具有临床意义的进展。
宗艾替尼作为一款高选择性HER2抑制剂,在既往经治HER2突变NSCLC治疗中具有强大的应用价值,有望为HER2突变NSCLC患者,尤其是那些备受脑转移困扰的患者,提供一种兼顾全身和颅内双重疗效以及安全性的全新治疗选择。目前,宗艾替尼已被写入国内外NSCLC诊疗权威指南[8, 9],并获得中国国家药品监督管理局(NMPA)附条件批准,单药适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性NSCLC成人患者。随着更多数据的积累与药物的加速可及,宗艾替尼有望重塑HER2突变NSCLC的治疗格局,真正实现“全身+颅内”双重获益,为更多患者带来更长的生存时间和更高的生活质量,推动NSCLC精准治疗迈向新的高度。
专家介绍
同济大学附属上海市肺科医院肿瘤科行政主任、博士生导师、主任医师、教授
IASLC 教育委员会委员、中国医促会胸部肿瘤分会秘书长
中国抗癌协会肿瘤药物临床研究专委会青委会副主委
上海市医师协会肿瘤分会副主委、上海市抗癌协会肿瘤呼吸内镜学专业委员会常务委员
上海市抗癌协会肺癌分子靶向免疫治疗委员会副主委
上海市抗癌协会转化研究委员会副主委
上海市医学会肿瘤靶分子专科分会青委会副主委
CSCO 非小细胞肺癌委员会副主委
CSCO 免疫专家委员会常委
审批号:SC-CN-18121,有效期至:9/19/2026
[1]G. Ruiter, E.F. Smit, R.A. Soo, et al. Zongertinib in Patients With Previously Treated HER2-Mutant NSCLC and Brain Metastases at Baseline: Beamion LUNG-1. 2025 WCLC. PT2.12.03 .
[2] Offin M, Feldman D, Ni A, et al. Frequency and outcomes of brain metastases in patients with HER2-mutant lung cancers. Cancer. 2019. 125(24): 4380-4387.
[3] Lin JJ, Gainor JF. Time to tackle the blood-brain barrier in HER2-mutant lung cancer. Cancer. 2019. 125(24): 4363-4366.
[4] Heymach JV, Ruiter G, Ahn MJ, et al. Zongertinib in Previously Treated HER2-Mutant Non-Small-Cell Lung Cancer. N Engl J Med. 2025. 392(23): 2321-2333.
[5] Heymach JV, Opdam F, Barve M, et al. HER2-Selective Tyrosine Kinase Inhibitor, Zongertinib (BI 1810631), in Patients With Advanced/Metastatic Solid Tumors With HER2 Alterations: A Phase Ia Dose-Escalation Study. J Clin Oncol. 2025. 43(11): 1337-1347.
[6] Zhang Q, Yang Y, Xie M, et al. Survival and prognostic factors of HER2-mutant advanced non-small cell lung cancer with brain metastases. Lung Cancer. 2025. 205: 108616.
[7] Trillo Aliaga P, Spitaleri G, Attili I, et al. HER2 in Non-Small Cell Lung Cancer (NSCLC): Evolution of the Therapeutic Landscape and Emerging Drugs-A Long Way to the Top. Molecules. 2025. 30(12): 2645.
[8] 中国临床肿瘤学会(CSCO). CSCO非小细胞肺癌诊疗指南2025 .
[9] NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®). Non Small Cell Lung Cancer. Version 8. 2025 .
排版编辑:肿瘤资讯-Delia











 苏公网安备32059002004080号
苏公网安备32059002004080号


