金秋九月,备受瞩目的第 28 届中国临床肿瘤学会(CSCO)学术年会于泉城济南成功举办。本届年会以“规范诊疗,创新引领”为主题,大会汇聚全球肿瘤领域知名专家学者,交流最新研究与实践。其中于大会首日上午全体大会环节,中山大学肿瘤防治中心马竣院士以鼻咽癌的免疫治疗为题作主旨报道,并对该团队于相关领域的工作成果展开分享。【肿瘤资讯】特此对相关内容进行整理,以飨读者。


首先,马竣院士围绕鼻咽癌(NPC)的起源与生物学特征展开了介绍。指出NPC是一种位于鼻腔后方、颅脑中央的恶性肿瘤,起源于鼻咽上皮。其生物学特性表现为:向上易侵犯颅脑神经,向下则易早期发生颈部淋巴结及远处器官转移。
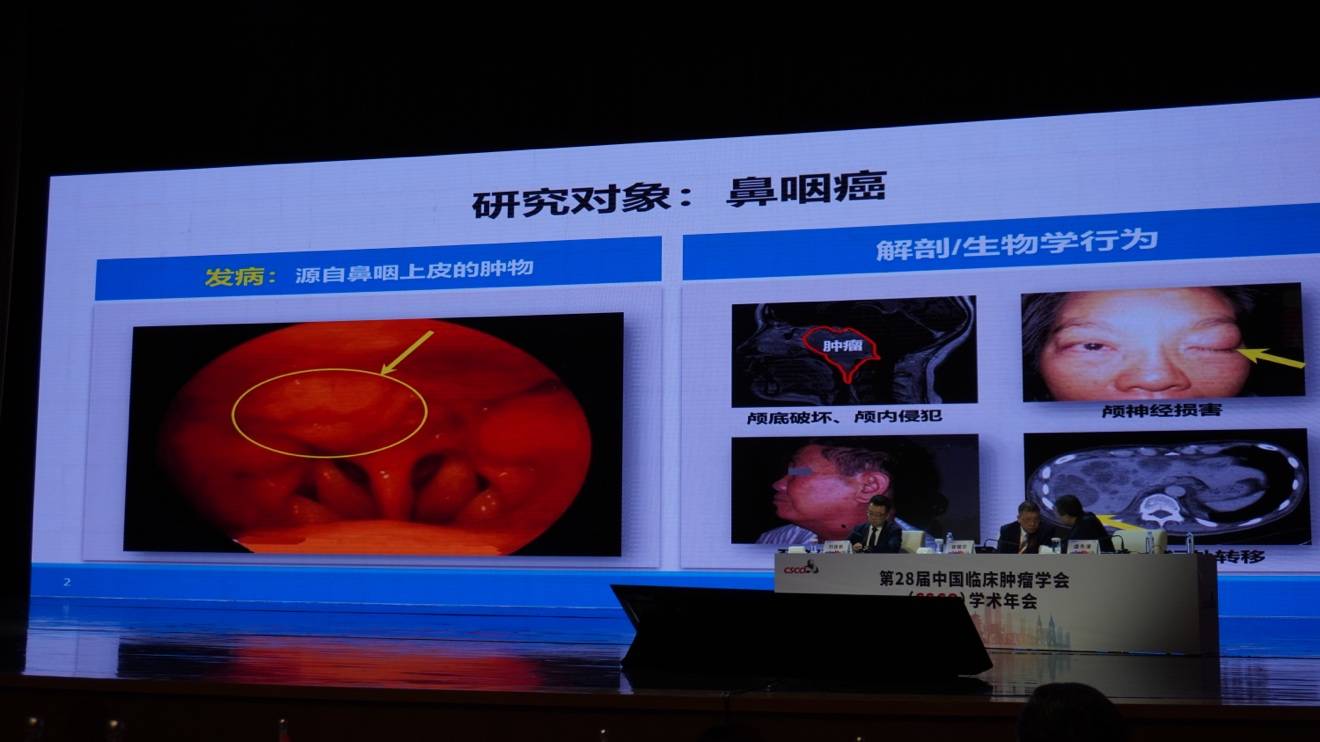 鼻咽癌在中国高发,病例数占全球总数的47%。中位发病年龄为47岁,这一年龄段的患者往往是家庭的支柱,因此疾病对社会和家庭均带来巨大冲击。例如公开报道中的表演艺术家李雪健先生及马来西亚运动员李宗伟先生,均于青壮年时期发病。
鼻咽癌在中国高发,病例数占全球总数的47%。中位发病年龄为47岁,这一年龄段的患者往往是家庭的支柱,因此疾病对社会和家庭均带来巨大冲击。例如公开报道中的表演艺术家李雪健先生及马来西亚运动员李宗伟先生,均于青壮年时期发病。
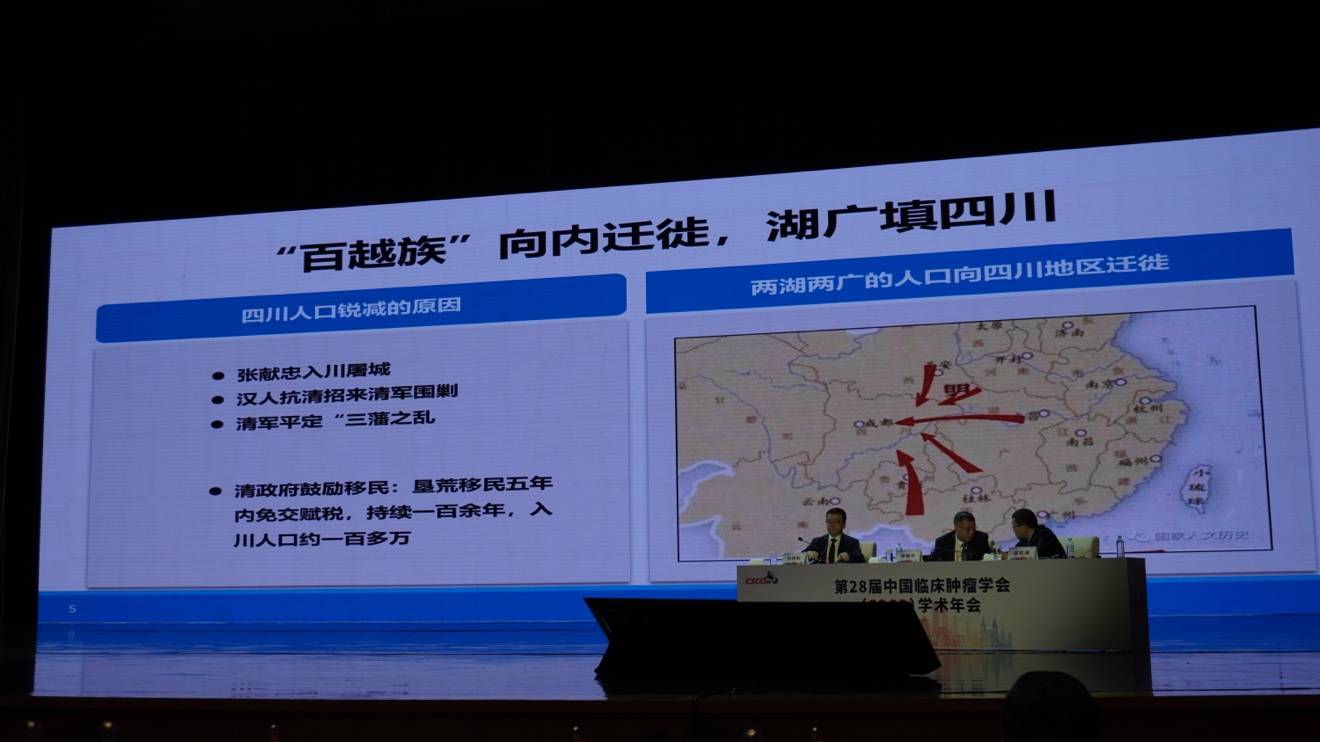
 关于鼻咽癌的起源,人类学研究提供了一个大致轮廓。据《汉书》记载,广东省区域曾是“百越”部族的聚居地。百越由东南及南方地区的土著居民构成,包括现今的壮族、黎族、土家族等少数民族,许多“两广”(广东、广西)居民即为其后裔。百越族的内陆迁徙,可能导致了四川等地区鼻咽癌的高发。部分西部地区的医生曾提及,早年在于病理科工作时,观察到许多鼻咽癌新发病例,经询问发现,多为从广东移居西部的客家人后裔。
关于鼻咽癌的起源,人类学研究提供了一个大致轮廓。据《汉书》记载,广东省区域曾是“百越”部族的聚居地。百越由东南及南方地区的土著居民构成,包括现今的壮族、黎族、土家族等少数民族,许多“两广”(广东、广西)居民即为其后裔。百越族的内陆迁徙,可能导致了四川等地区鼻咽癌的高发。部分西部地区的医生曾提及,早年在于病理科工作时,观察到许多鼻咽癌新发病例,经询问发现,多为从广东移居西部的客家人后裔。
 这与历史上“湖广填四川”的人口迁徙事件相吻合。明末清初,由于战乱(如张献忠起义、清军围剿及平定三藩)与饥荒,四川人口锐减。清政府随即鼓励移民,此过程持续百年,逾百万人入川,这也可能将鼻咽癌的遗传易感性带到了西部地区。
这与历史上“湖广填四川”的人口迁徙事件相吻合。明末清初,由于战乱(如张献忠起义、清军围剿及平定三藩)与饥荒,四川人口锐减。清政府随即鼓励移民,此过程持续百年,逾百万人入川,这也可能将鼻咽癌的遗传易感性带到了西部地区。
鼻咽癌亦有“广东瘤”之称,这源于其独特的历史。19世纪中叶,美国西部开发(如开采金矿、修建铁路),大量来自广东五邑地区的华工前往加州并将鼻咽癌带到了美国。鼻咽癌也被命名为“广东瘤”。这是唯一一个以地名命名并被写入西方教科书的恶性肿瘤。

早期赴美的华侨(被称为“金山伯”)及其后代不忘桑梓,在家乡(如广东开平)修建了大量中西合璧的“碉楼”,现已成为著名的旅游景点,电影《让子弹飞》亦在此取景。然而,鼻咽癌不仅限于广东,在整个华南地区均呈高发态势。中国历史上的多次人口迁徙,如“走西口”、“闯关东”以及福建、广东等地的“下南洋”习惯,都促进了人群的流动。目前东南亚华侨超过3000万,其中亦不乏鼻咽癌患者,如李宗伟先生(其父辈即从福建泉州“下南洋”)。
 在治疗策略上,由于鼻咽癌的解剖位置特殊,与重要血管、神经毗邻,手术难以实现整块切除且易造成巨大损伤,因此初诊患者不适合手术治疗。幸运的是,99%的鼻咽癌病理类型为非角化性癌,对放射线高度敏感。因此,放射治疗(放疗)是其主要的根治性治疗手段,通常使用直线加速器产生高能射线,从体外对肿瘤进行照射。
在治疗策略上,由于鼻咽癌的解剖位置特殊,与重要血管、神经毗邻,手术难以实现整块切除且易造成巨大损伤,因此初诊患者不适合手术治疗。幸运的是,99%的鼻咽癌病理类型为非角化性癌,对放射线高度敏感。因此,放射治疗(放疗)是其主要的根治性治疗手段,通常使用直线加速器产生高能射线,从体外对肿瘤进行照射。
 放疗过程精细而复杂,包括CT定位、面罩固定、图像采集、放疗计划系统设计(医生勾画靶区、物理师调优剂量)以及治疗技师的精确执行。
放疗过程精细而复杂,包括CT定位、面罩固定、图像采集、放疗计划系统设计(医生勾画靶区、物理师调优剂量)以及治疗技师的精确执行。
 放射治疗技术的进步已大幅改善了鼻咽癌的局部控制率,目前可达90%以上。然而,远处转移仍是导致治疗失败的主要原因,占死亡原因的80%。这表明单纯的局部放疗已达瓶颈,必须联合全身治疗以提高疗效。
放射治疗技术的进步已大幅改善了鼻咽癌的局部控制率,目前可达90%以上。然而,远处转移仍是导致治疗失败的主要原因,占死亡原因的80%。这表明单纯的局部放疗已达瓶颈,必须联合全身治疗以提高疗效。

但在20年前,关于化疗的最佳时机与方案尚无定论。1998年的“美国方案”推荐在放疗后使用氟尿嘧啶(5-FU)联合顺铂进行辅助化疗,并被广泛推广。然而,临床实践证实该方案执行困难:患者在经历7周的根治性放疗后,普遍出现严重的口腔黏膜炎,导致进食困难、体重显著下降(平均5-10公斤),体质虚弱,难以耐受后续的辅助化疗。
 马骏院士团队开展的临床研究进一步证实,该方案未能提高中国患者的疗效,反而增加了严重的毒副反应,并额外延长了3个月的治疗周期。为此,马骏院士探索了新的治疗策略:使用吉西他滨取代5-FU,形成了吉西他滨联合顺铂(GP)的新方案;并将治疗时机从放疗后(辅助)调整为放疗前(诱导)。
马骏院士团队开展的临床研究进一步证实,该方案未能提高中国患者的疗效,反而增加了严重的毒副反应,并额外延长了3个月的治疗周期。为此,马骏院士探索了新的治疗策略:使用吉西他滨取代5-FU,形成了吉西他滨联合顺铂(GP)的新方案;并将治疗时机从放疗后(辅助)调整为放疗前(诱导)。
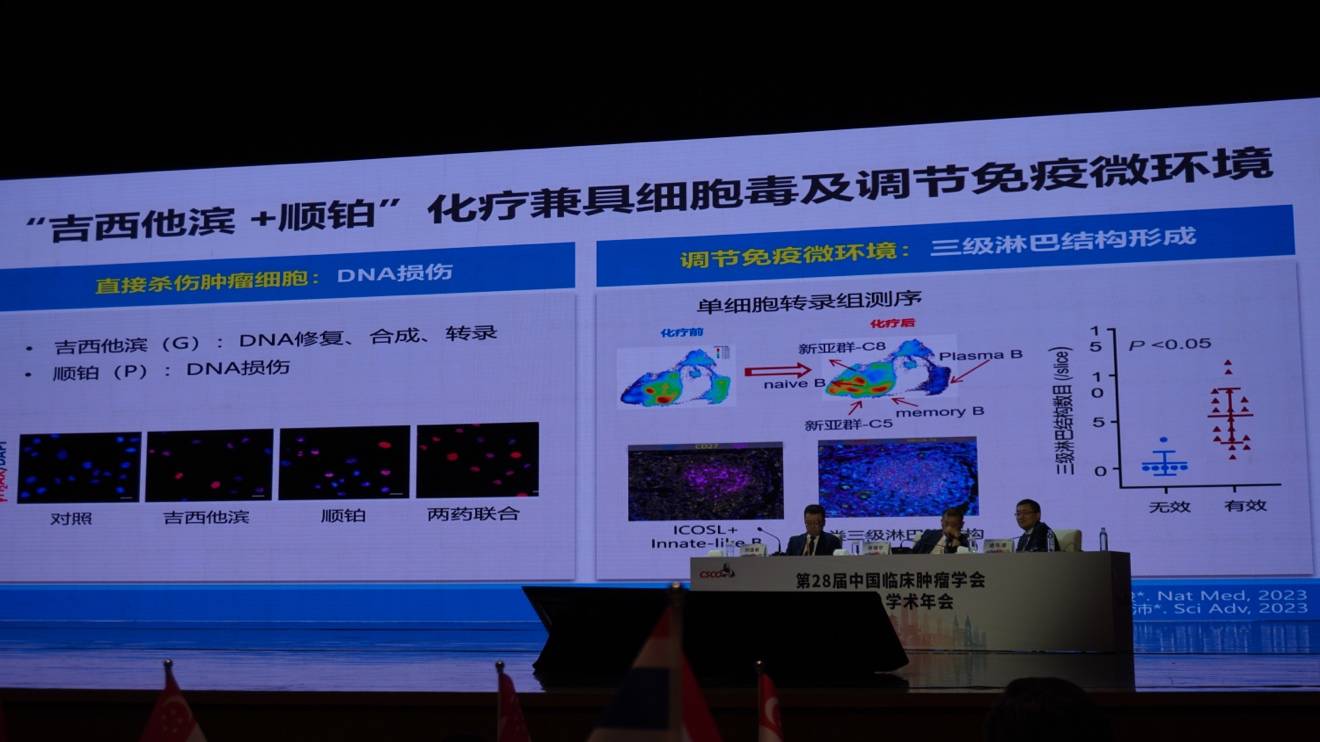 该团队发现,GP诱导化疗可重塑肿瘤免疫微环境,并基于此提出了“GP方案通过激活免疫来杀灭全身微小转移灶”的新理论,研究成果发表于《Nature Medicine》。
该团队发现,GP诱导化疗可重塑肿瘤免疫微环境,并基于此提出了“GP方案通过激活免疫来杀灭全身微小转移灶”的新理论,研究成果发表于《Nature Medicine》。
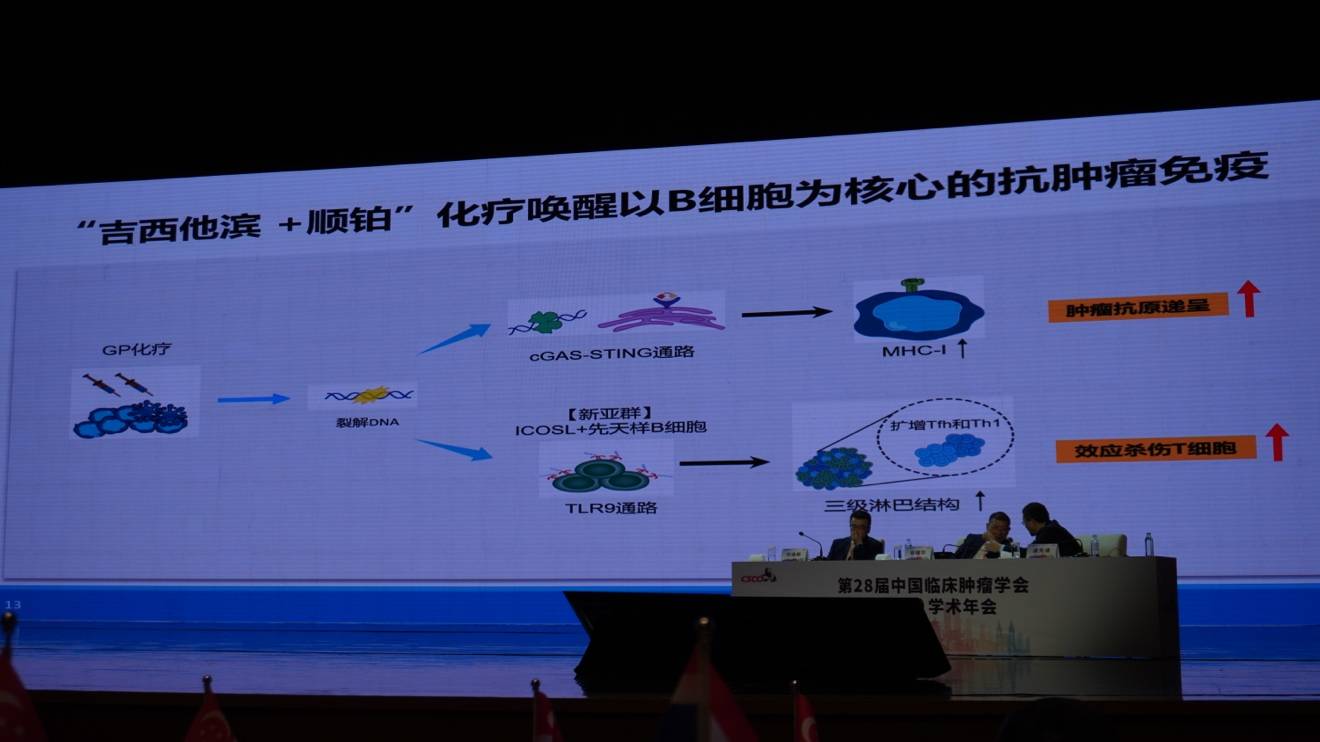

为了验证该方案的临床疗效,该团队进一步牵头开展了一项全国大型临床研究。

结果显示,GP诱导化疗方案将患者的3年无失败生存率(FFS)提高了8.8%,而严重毒副反应发生率仅为5%,真正实现了“高效低毒”的目标。
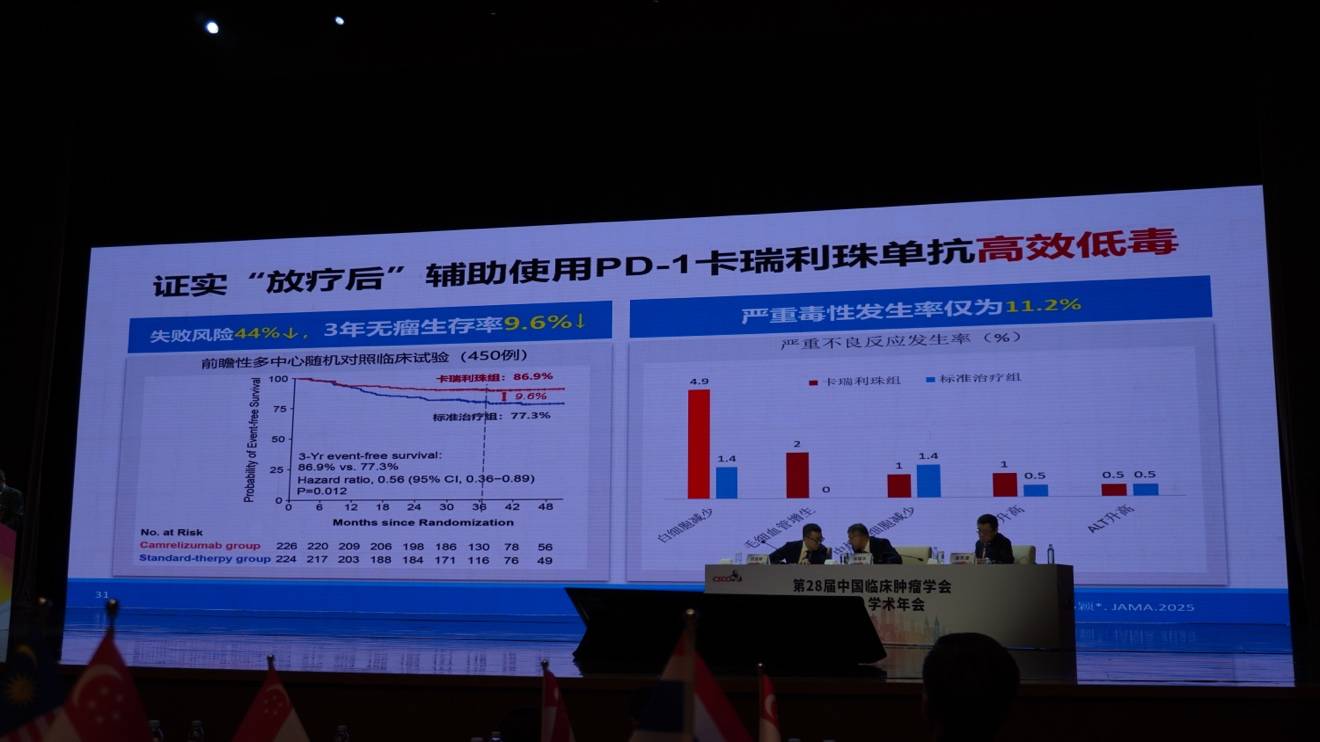
该研究发表于《新英格兰医学杂志》(NEJM),被国际同行誉为鼻咽癌治疗的“新标准”和“里程碑”。此方案随后被中国、美国(NCCN)及欧洲(ESMO)指南采纳为最高等级推荐,成为全球中晚期鼻咽癌的标准治疗方案。


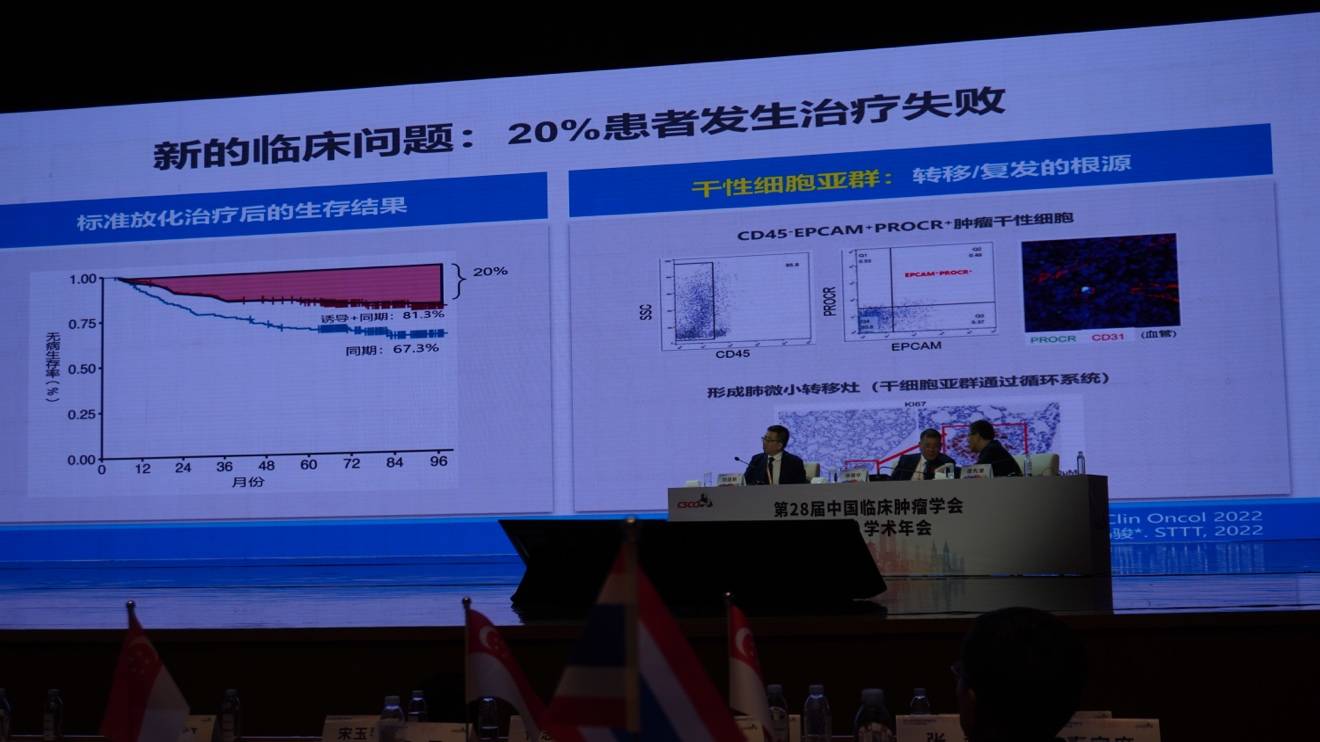
然而,仍有20%的患者治疗失败。团队发现,这与一种PIK3CA阳性的肿瘤干细胞亚群相关,该亚群是复发转移的根源。因此,必须探索新的治疗方法。
鼻咽癌在病理学上被称为“淋巴上皮瘤样癌”,位于咽淋巴环上,其特征之一是肿瘤组织内有大量淋巴细胞浸润(以T细胞为主),但这些细胞多处于免疫抑制状态。
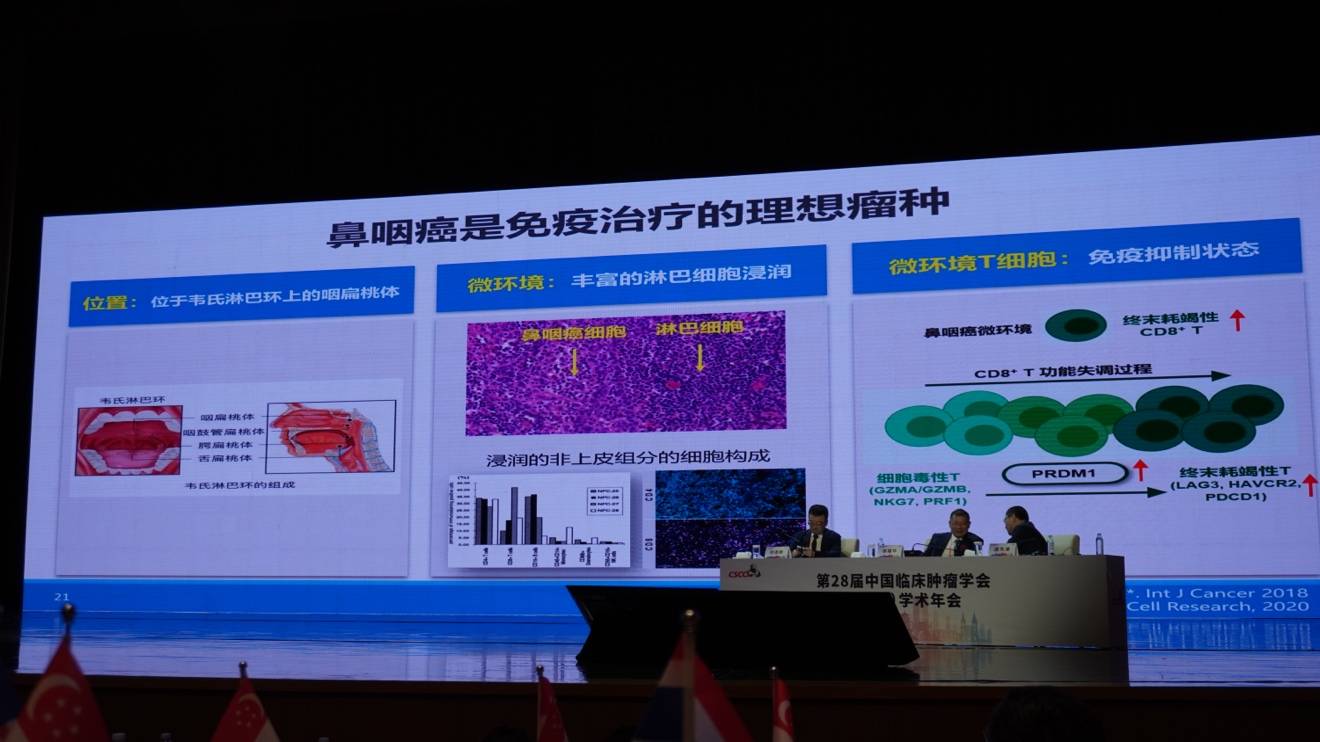
研究发现,鼻咽癌肿瘤细胞的PD-L1表达率高达90%左右。这主要源于两方面原因:一是EB病毒(EBV)感染,其膜蛋白LMP1可通过信号通路激活并上调PD-L1;二是机体自身的抗病毒免疫反应所产生的嘎马干扰素(IFN-γ),也会进一步诱导PD-L1的高表达。因此,从理论上讲,使用PD-1单抗阻断PD-1/PD-L1轴,是解除T细胞免疫抑制、治疗鼻咽癌的有效策略。

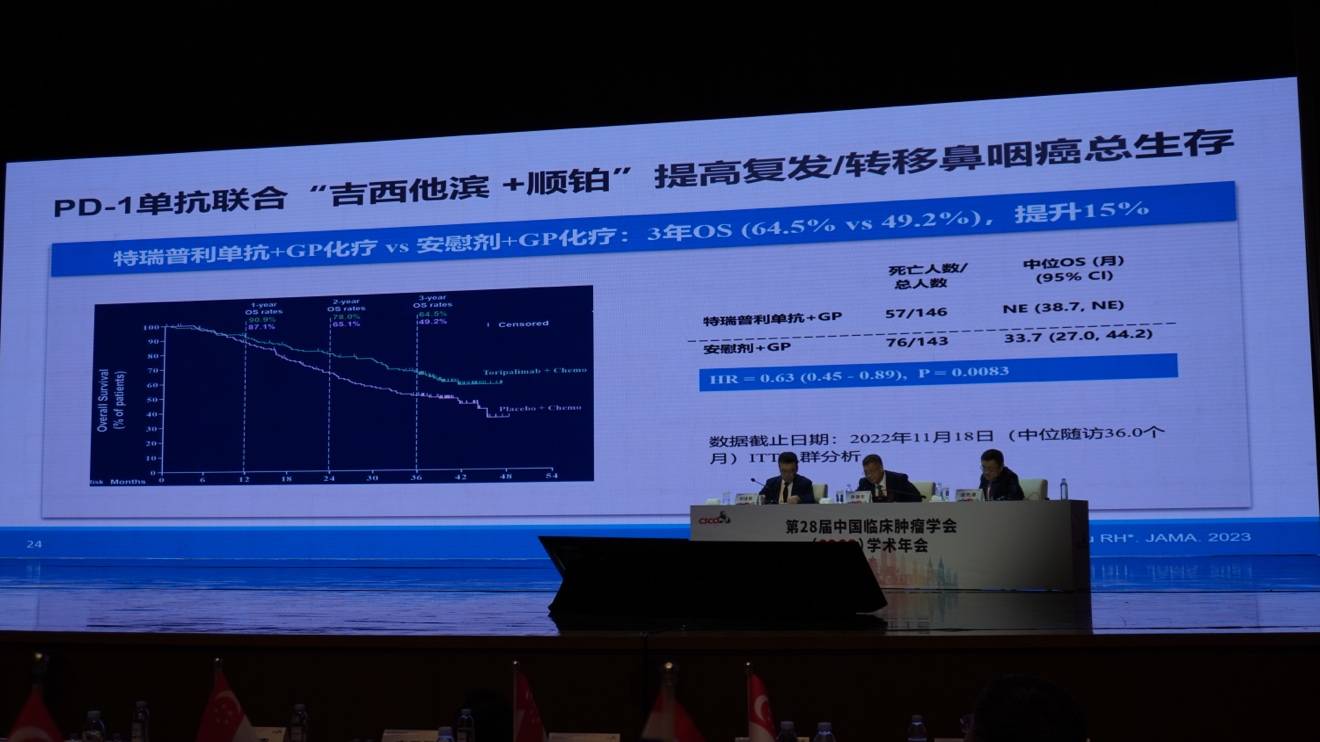
在复发/转移性鼻咽癌(R/M NPC)的治疗中,由张力教授、徐瑞华教授等牵人头的多项临床研究(涉及卡瑞利珠单抗、特瑞普利单抗及替雷利珠单抗)取得了突破。三项III期临床试验均证实,在一线治疗中,GP方案联合PD-1单抗,可显著提高R/M NPC患者的无进展生存期(PFS)。
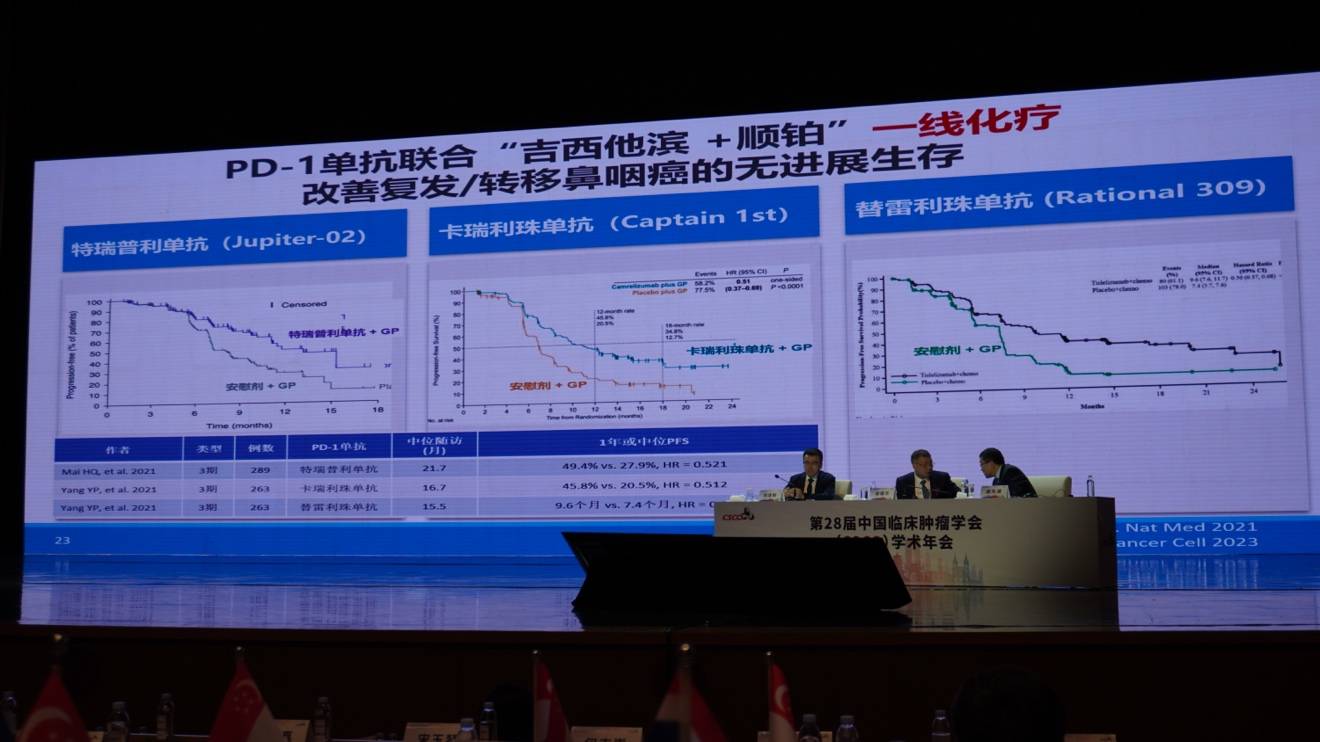
特瑞普利单抗的长期随访数据进一步证实了其总生存期(OS)的获益。目前,该联合方案已被中国(CSCO)和美国(NCCN)指南纳为一线标准治疗,并全球推广。
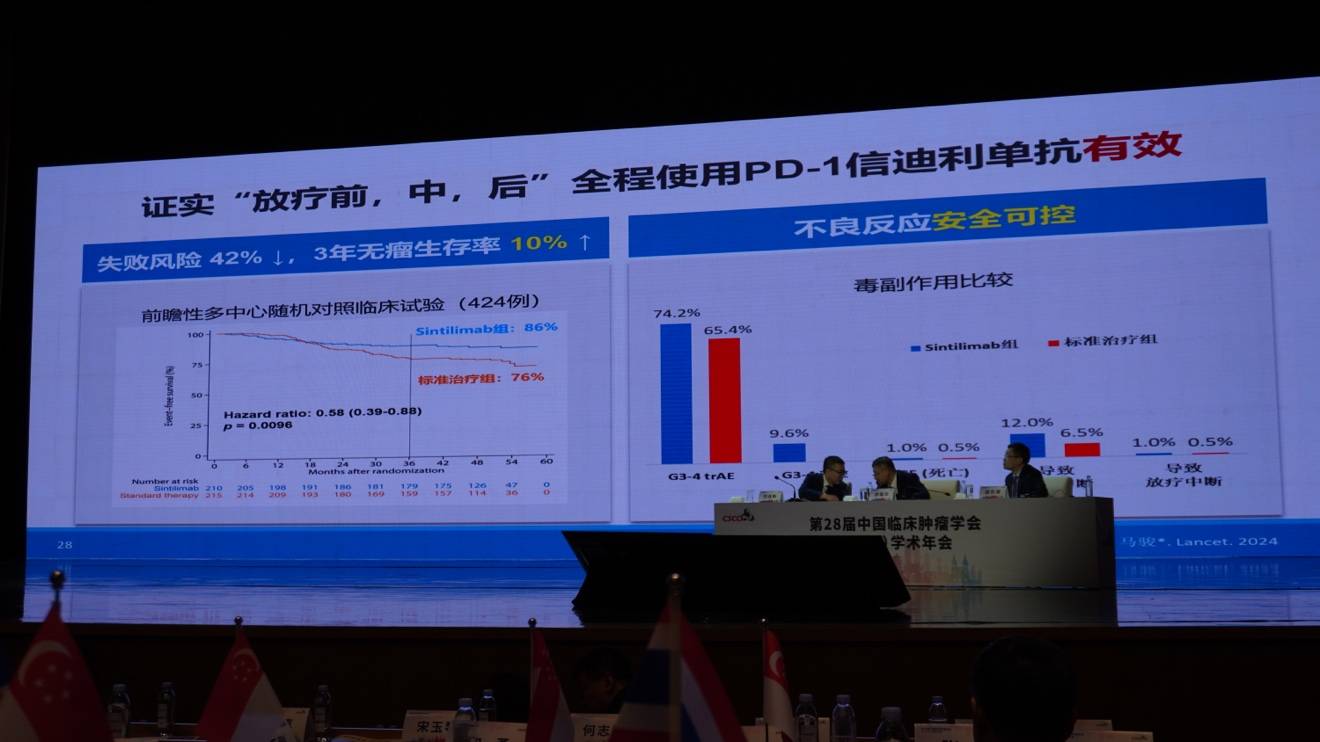
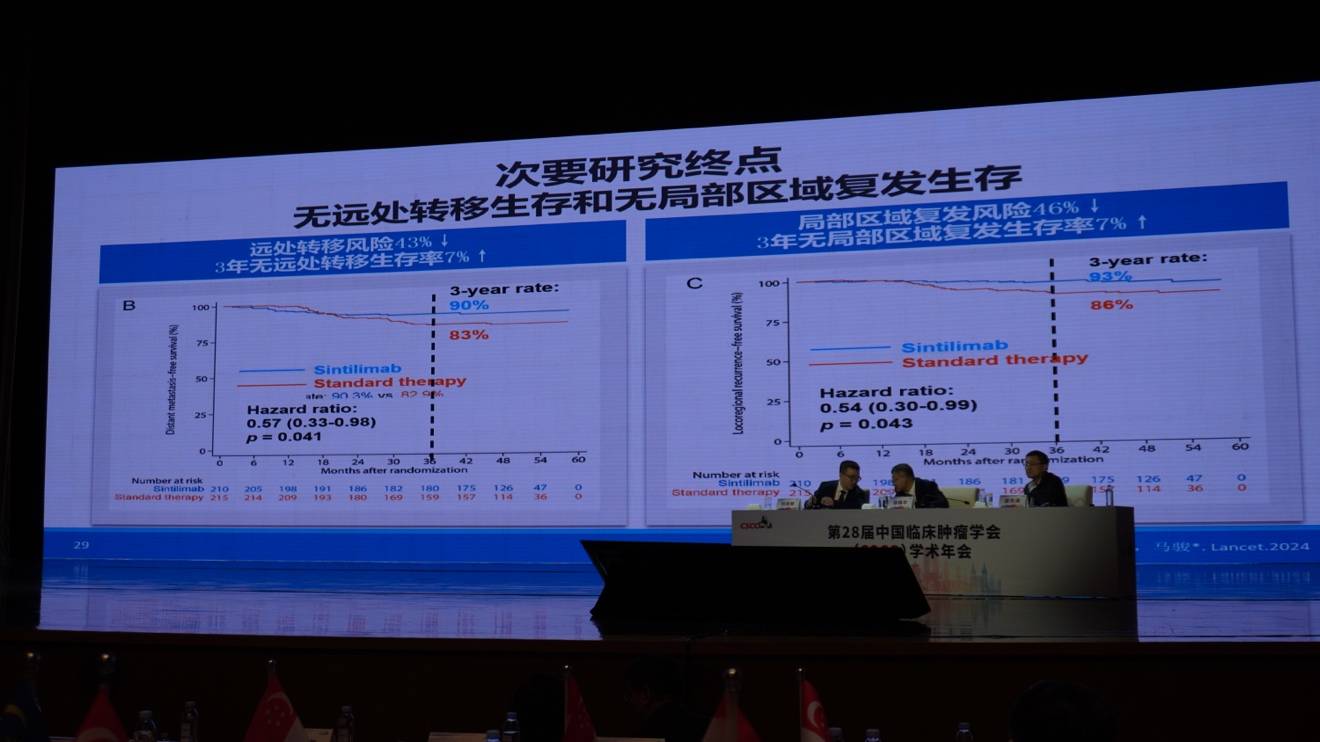
在局部晚期(根治性)鼻咽癌的治疗中,马骏院士团队同样进行了探索,并重点筛选了高危患者(T4, N1, 或 N2-3)作为研究对象。首先,CONTINUUM研究评估了放化疗联合“全程”信迪利单抗(含诱导、同期及辅助共12个疗程)的疗效。结果显示,全程联合PD-1单抗可将事件发生风险降低42%,3年无瘤生存率提高10%,且生存曲线随时间延长而持续分离,毒副反应安全可控。在次要终点方面,远处转移率和局部控制率均有获益。

与此同时,DIPPER研究则探索了“辅助”PD-1单抗(卡瑞利珠单抗,12个疗程)的模式。结果发现,单纯辅助治疗取得了与全程治疗相似的疗效,且毒副反应更轻微。


这两项研究成果分别发表于《Lancet》和《JAMA》正刊,并被CSCO指南采纳。

免疫治疗的加入为“减毒治疗”提供了契机。马骏院士团队观察到,经过诱导化疗联合PD-1单抗治疗后,90%患者的肿瘤体积显著缩小。

这就提出了一个关键问题:后续放疗的照射范围(靶区)应基于化疗前体积,还是化疗后的残留肿瘤体积?
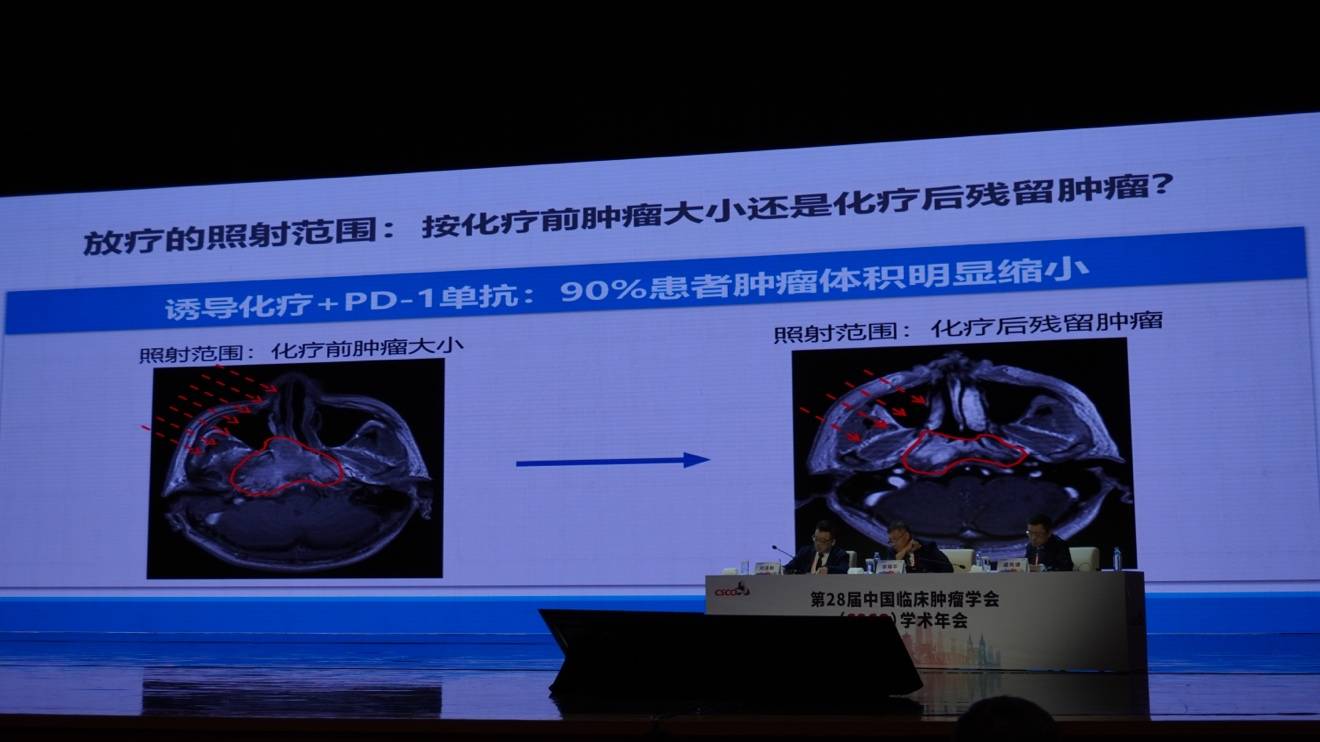
该团队开展的临床研究证实:放疗范围仅包括化疗后残留肿瘤,并未降低患者的生存率,反而显著降低了放射性黏膜炎、口干等毒副反应。高剂量照射范围缩小了17%,内耳、腮腺等重要器官的受照剂量也明显下降,患者的总体健康状况、体力状况、食欲及吞咽功能等生活质量指标得到显著改善。

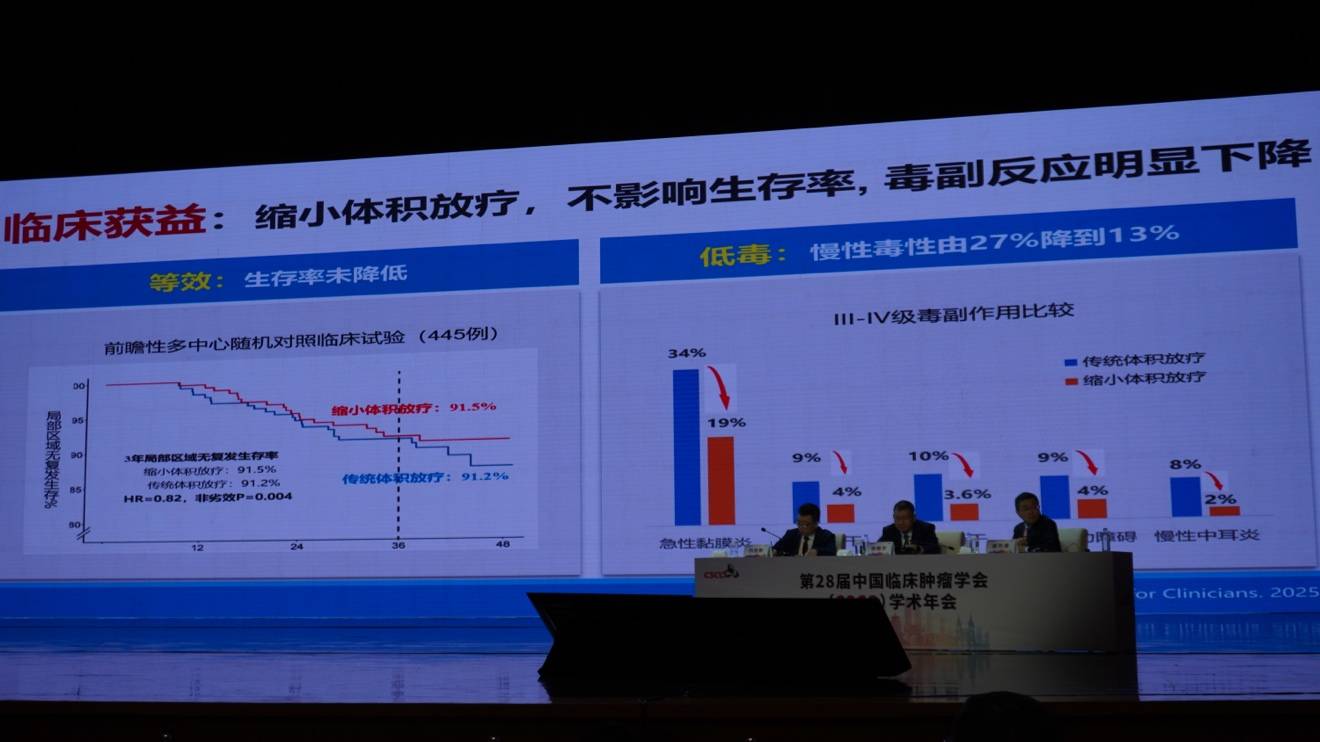
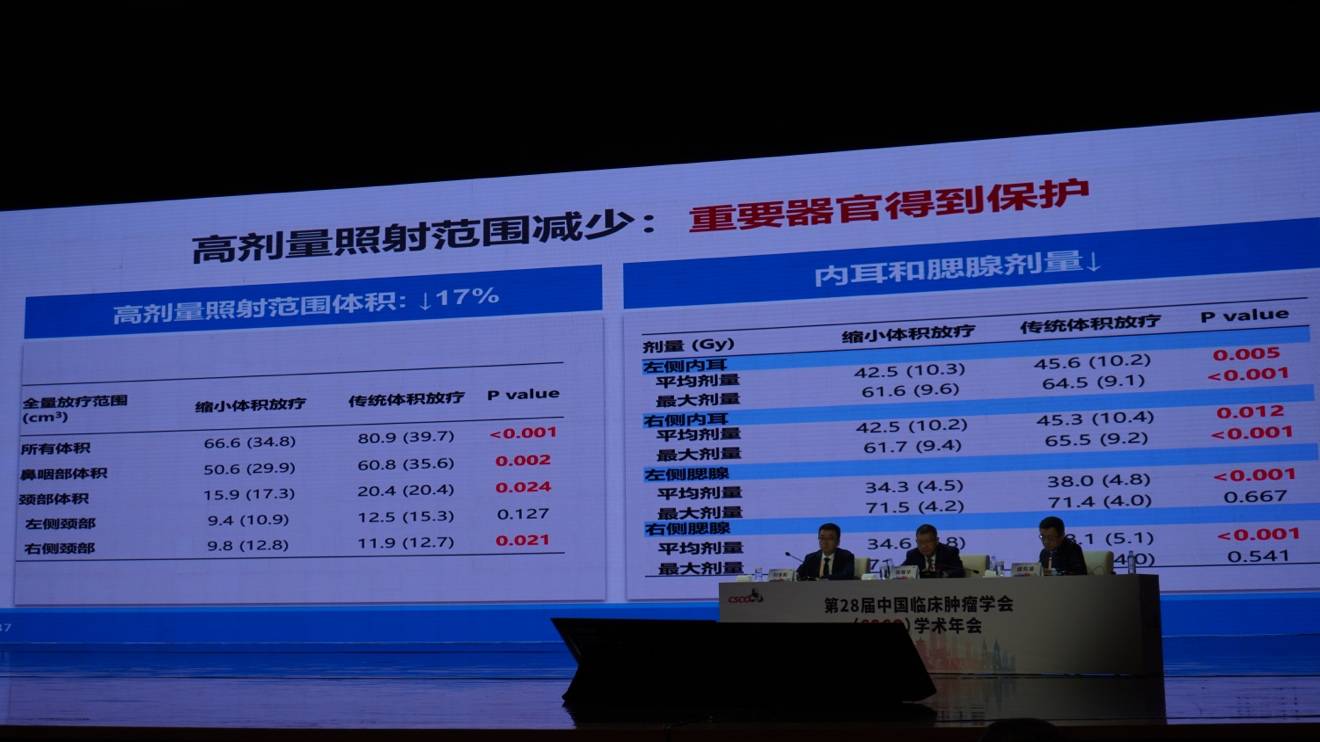
该研究作为《CA: A Cancer Journal for Clinicians》创刊以来首篇临床试验论著发表,获得国际同行的高度评价。

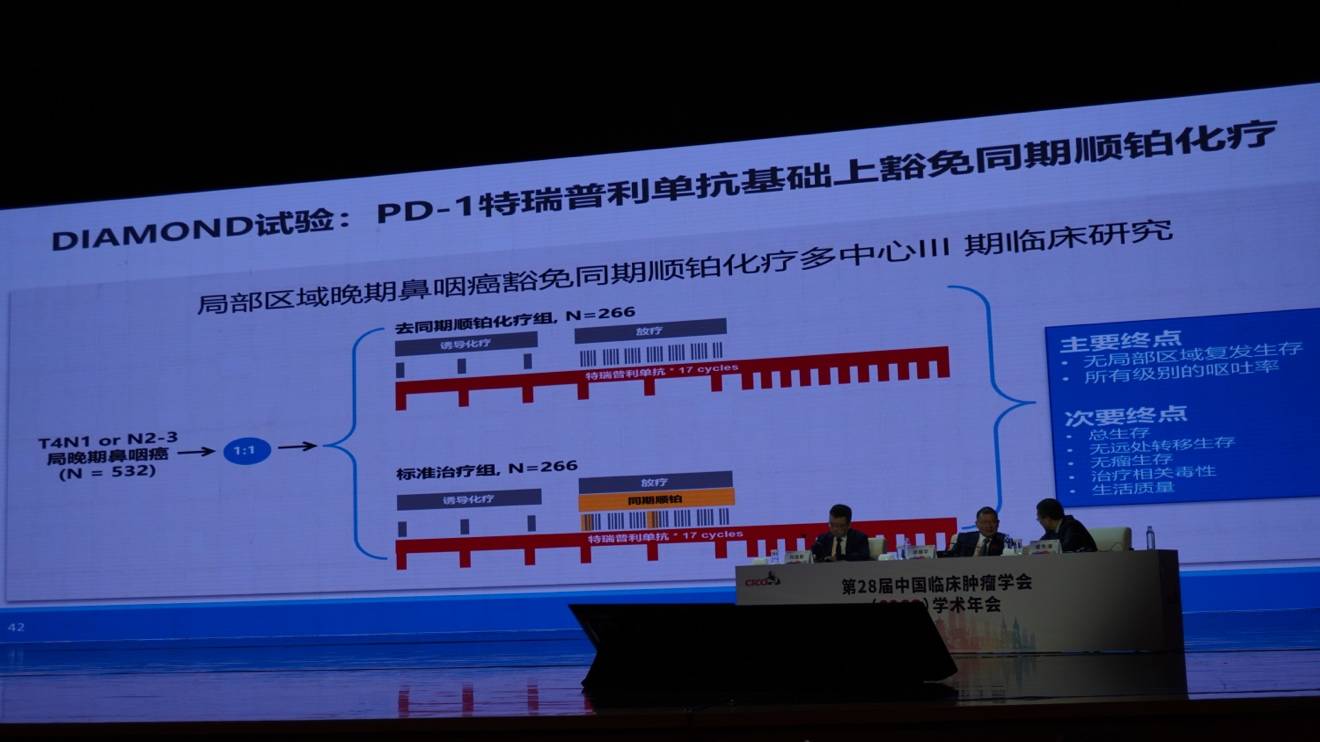
然而,与此同时马骏院士留意到,标准方案中的同期顺铂化疗(放疗期间使用3个疗程)是导致严重急性和远期毒副反应(如肾功能不全、听力障碍)的主要原因。因此,提出了在联合PD-1治疗的基础上,能否安全地“豁免”同期顺铂化疗的问题。
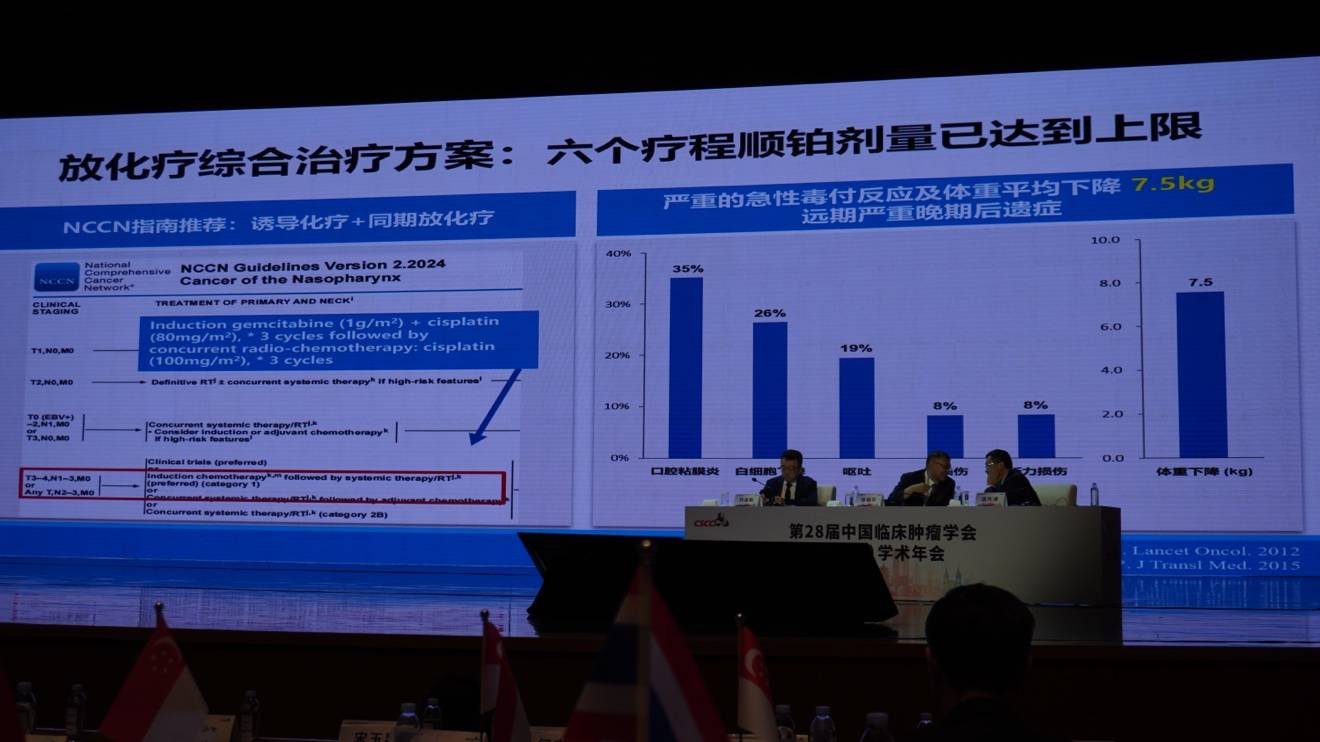
该团队首先开展了一项II期临床试验,采用全程纳武利尤单抗联合放化疗,但豁免了同期顺铂。结果显示,3年无失败生存率高达88.5%,而严重急性毒副反应发生率降至40.2%。该成果作为封面文章发表于《Cancer Cell》。其封面设计(京剧“末角小丑”鞠躬退场)象征着同期顺铂在免疫治疗时代正逐渐退出历史舞台。
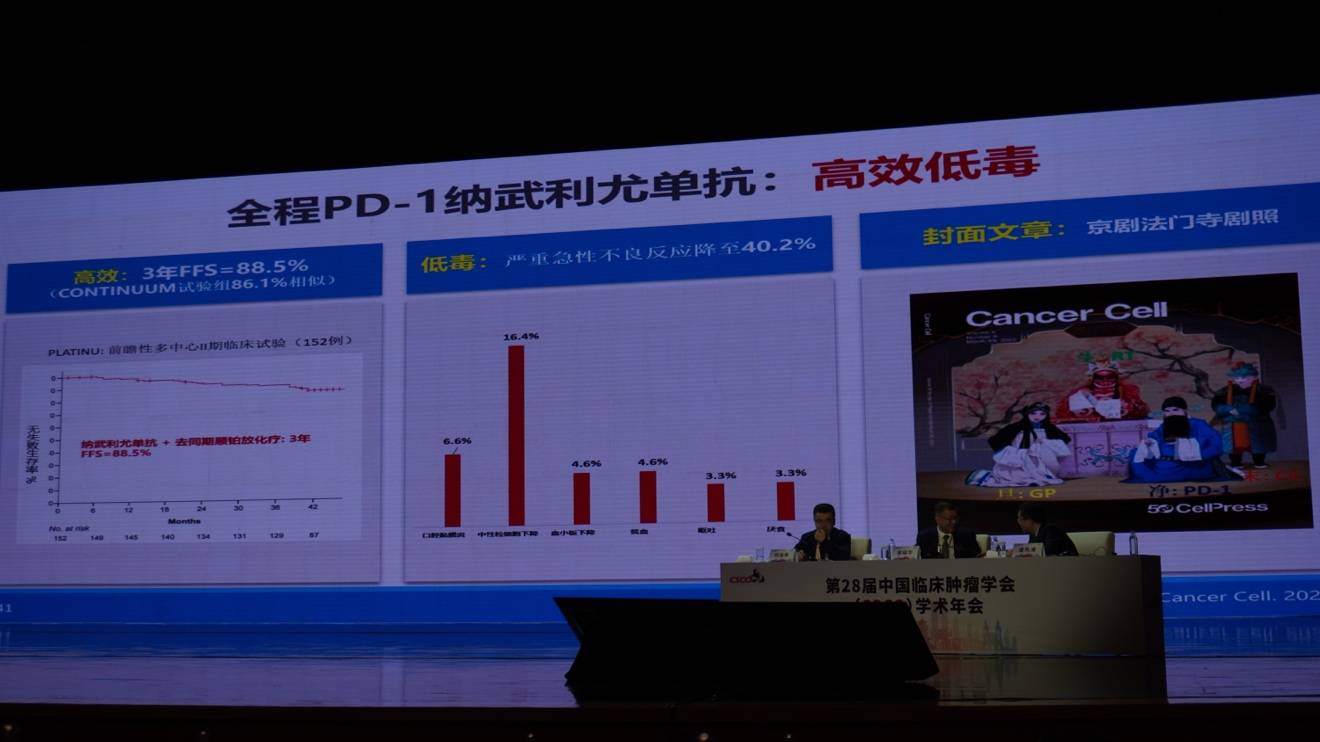
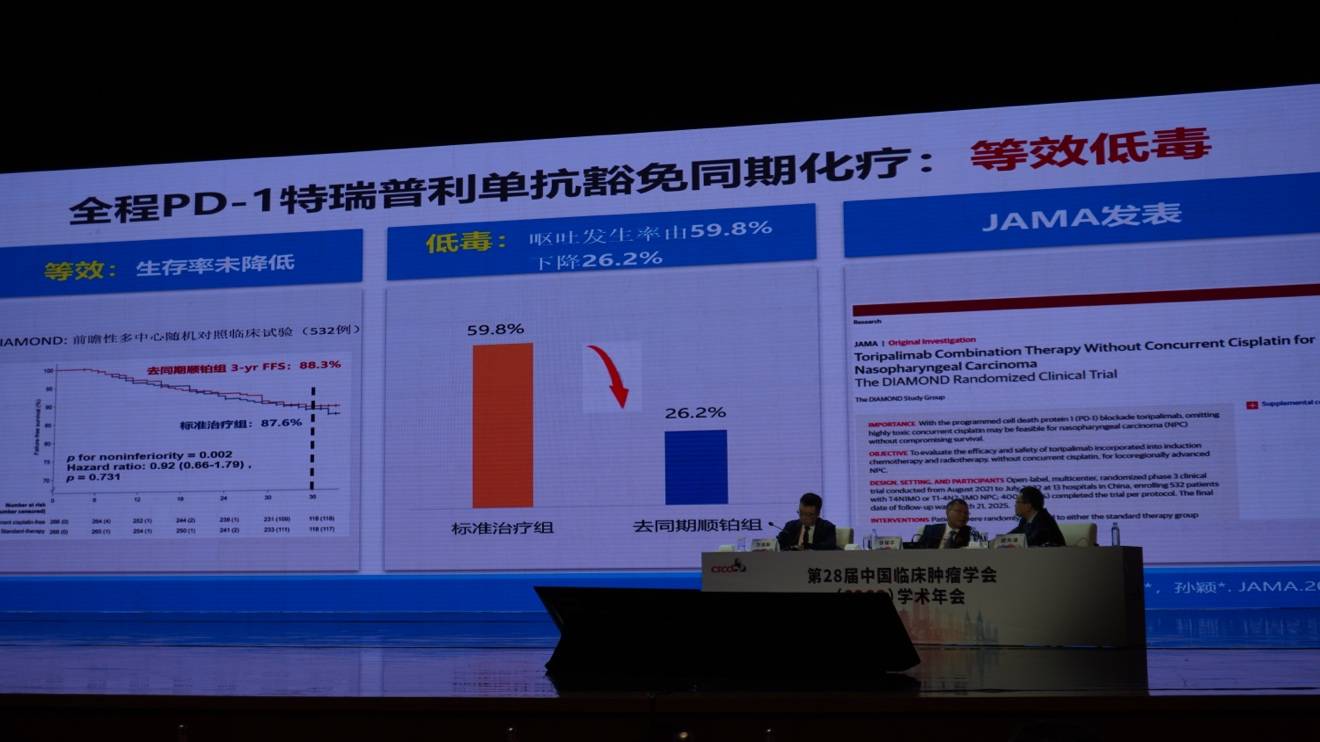
为进一步验证,团队开展了另一项III期临床试验(联合特瑞普利单抗),同样豁免了同期顺铂化疗。结果再次证实,豁免同期的生存率没有降低,但呕吐发生率从近60%显著下降至26.2%。该研究发表于《JAMA》正刊,最终确立了此“解毒”方案的有效性。
总结而言,在增效方面,过去27年间美国NCCN指南的6项重大调整中,有5项是基于该团队的研究成果进行了修订。目前,鼻咽癌正迈入“免疫治疗的新时代”。在减毒方面,团队也建立了“减毒治疗”的新体系(包括缩小照射范围和豁免同期化疗),推动鼻咽癌治疗从“好生存”向“优生存”的理念转变。

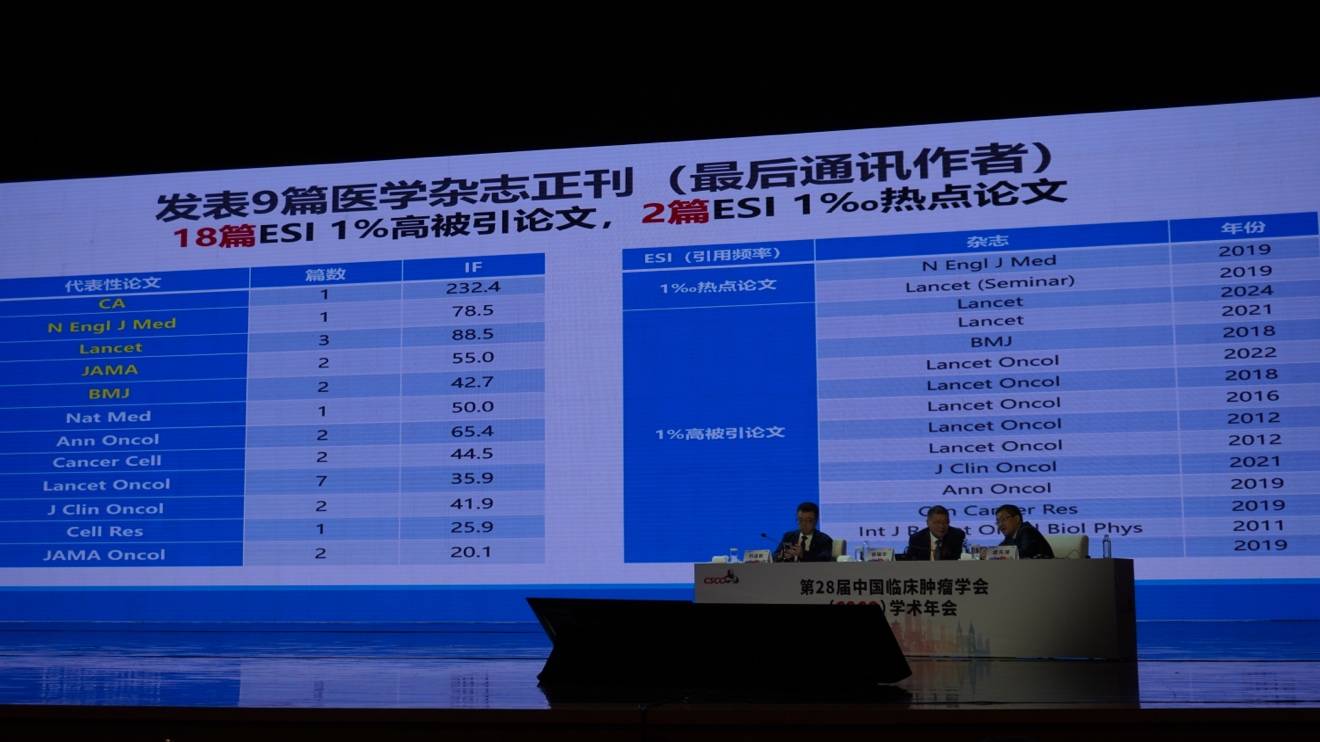
以上成果由马骏院士作为通讯作者已发表在9篇顶级医学期刊(包括CA, NEJM, Lancet, JAMA等)正刊上,共发表高被引论文18篇,其中2篇为ESI千分之一热点论文。团队作为第一完成单位/第一完成人,先后获得了3项国家科技进步二等奖(2003年获接见并合影)、3项中华医学一等奖及2项教育部一等奖,并入选7项中国生命科学/医学重大进展。马骏院士个人也荣获何梁何利奖、吴阶平奖、谈家桢奖及广东省贡献奖等。

在指南制定方面,马骏院士团队牵头制定了中国CSCO指南,并联合美国ASCO制定了首部中美鼻咽癌国际诊治指南。同时,联合CSCO、CACA、CISCO、ESTRO、ASTRO等国际专业学会,制定了鼻咽癌放疗勾画的国际指南(发表于JCO及Lancet Oncology),实现了中国鼻咽癌临床研究从“跟跑”到“领跑”的跨越。

在平台与人才建设方面,团队依托教育部“111”创新引智基地,连续举办8届国际头颈肿瘤研讨会,邀请88位国际顶尖专家来访交流。团队也培养了包括长江学者、杰青、优青、青年长江、青拔在内的多名高层次人才,并建成了国家级创新团队。

目前,中山大学肿瘤防治中心是全球收治鼻咽癌最多的机构(去年新发病例7236例,预计今年将突破8000例),在鼻咽癌学术排名中位列第一。中心放疗服务能力全球领先,拥有17台直线加速器(质子/重离子中心在建),去年放疗病例达18565例,今年有望突破2万例。


团队中的年轻成员(多在30岁左右)已在大项目中担当重任,成为发表高水平研究成果的第一作者,为团队注入了新的动力。


历经20余年的努力,马骏院士作团队已将鼻咽癌的5年生存率从90年代的60%提高至目前的86%。最后,马骏院士展望道,期待通过免疫治疗的进一步优化,能将5年生存率提高至90%左右,使鼻咽癌成为一种慢性病,并最终将其攻克。

*图片资料源于2025 CSCO年会现场采集或CSCO官方照片墙。
本文内容来源于现场素材综合整理,我们力求其发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
排版编辑:肿瘤资讯-zxy











 苏公网安备32059002004080号
苏公网安备32059002004080号


