在非小细胞肺癌(NSCLC)中,间质上皮细胞转化因子(MET)扩增已被确认为一种独立的致癌驱动因素。其既可表现为原发性驱动基因突变,约见于1%-5%未经治疗的NSCLC中,且与吸烟史存在密切关联;亦可作为酪氨酸激酶抑制剂(TKIs)治疗后获得性耐药的重要机制之一1。卡马替尼是一种口服、ATP竞争性、强效且高选择性的Ib型MET-TKI,于2025年9月10日获NMPA批准用于全线治疗携带MET外显子14跳跃突变的NSCLC成人患者2。值得注意的是,早在2022版NCCN指南已将卡马替尼等MET-TKI列为高MET扩增(GCN≥10)NSCLC的标准治疗推荐3。2025世界肺癌大会(WCLC)上公布了中国首个卡马替尼治疗MET扩增的真实世界研究,为该靶向药物在中国人群中的临床应用提供了重要循证依据。
值此之际,【肿瘤资讯】特邀郑州大学第一附属医院的李醒亚教授及中国医学科学院肿瘤医院深圳医院金时教授,就MET扩增治疗现状、中国真实世界研究的临床意义与实践启示进行深入剖析。同时,邀请到六位来自国内多家中心的权威专家——郑州大学第一附属医院闫宁宁教授、河南省肿瘤医院何振教授、广东省人民医院孙月丽教授、中国医学科学院肿瘤医院深圳医院蓝东媚教授、山西省中医院汪欣文教授及郑州大学第二附属医院张中冕教授,共同对MET扩增的诊疗进展进行专业解读,分别从发生率、检测方法、判读标准、治疗策略及未来挑战等多维度展开系统阐述。
中国真实世界研究:卡马替尼对MET扩增NSCLC有效且安全,MET GCN具预测潜力
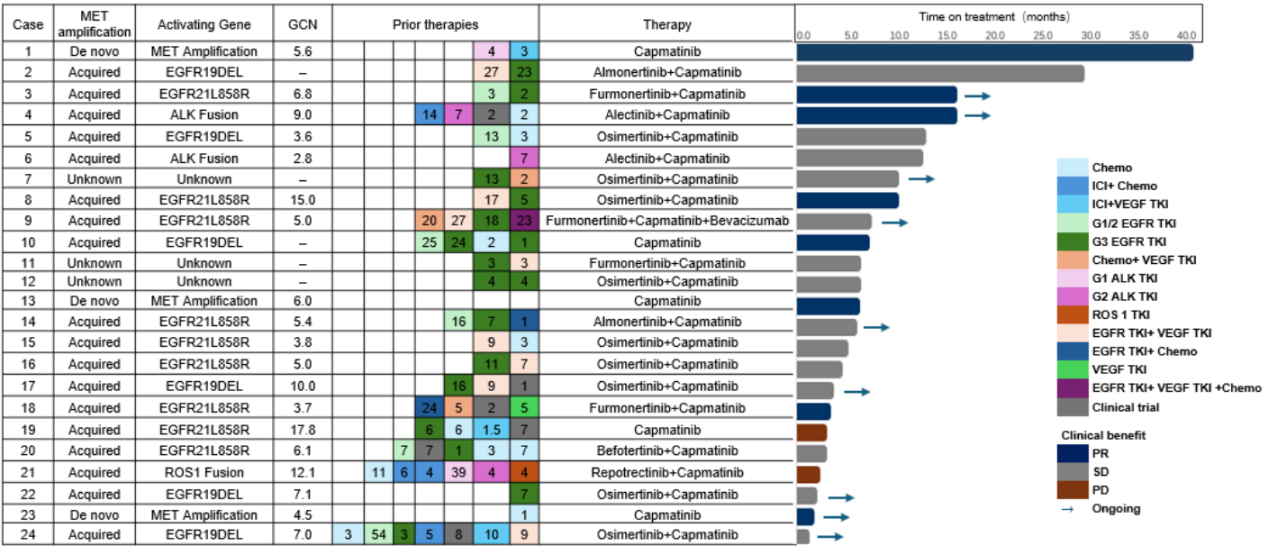
2025WCLC大会上公布的此项基于真实世界数据的多中心回顾性研究,纳入了2020年1月至2024年6月期间接受卡马替尼治疗的原发性MET扩增患者,以及经TKI治疗后出现获得性耐药的患者。研究数据均来源于医院病历系统,收集内容包括患者疾病相关信息、治疗方案、各线治疗起始时间及疾病进展时间。研究采用描述性统计方法进行数据分析,通过Kaplan - Meier分析评估至少接受过一剂次卡马替尼治疗患者的真实世界无进展生存期(rwPFS),同时还对客观缓解率(ORR)、疾病控制率(DCR)、总生存期(OS)及安全性特征进行分析。共纳入来自中国7个中心的24例患者,中位年龄为55岁;男性11例(45.8%),女性13例(54.2%);23例腺癌,1例鳞癌;33.3%(8/24)的患者存在脑转移4。
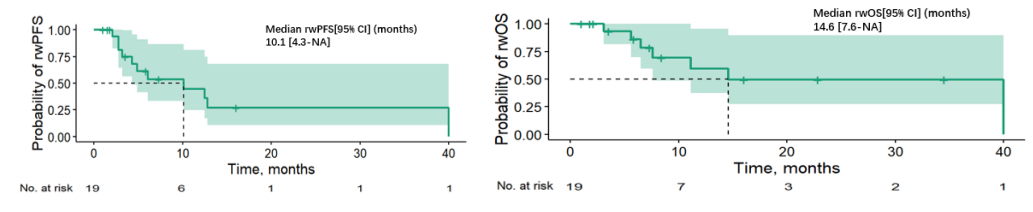
在所有患者中,接受卡马替尼治疗的中位线数为3线(范围1-8线)。就MET状态而言,3例患者为原发性扩增,18例患者为继发性扩增,另有3例患者MET状态信息不详。中位观察期为8.9个月(95%CI:1.6-37.5)。结果显示,所有患者的中位rwPFS为7.1个月(95% CI:6.1-未达到 [NA]),中位rwOS为40.0个月(95% CI:14.6-NA)。在19例MET GCN已知的患者中,中位rwPFS为10.1个月(95% CI:4.3-NA),中位rwOS为14.6个月(95% CI:7.6-NA)(图1)4。
所有患者ORR为33.3%(95% CI:14.5%-52.2%)(图2),原发性与继发性扩增患者的ORR为42.1%(95% CI:20.1%-64.1%)。所有患者与MET扩增已知GCN组患者的DCR分别为91.7%和89.5%4。
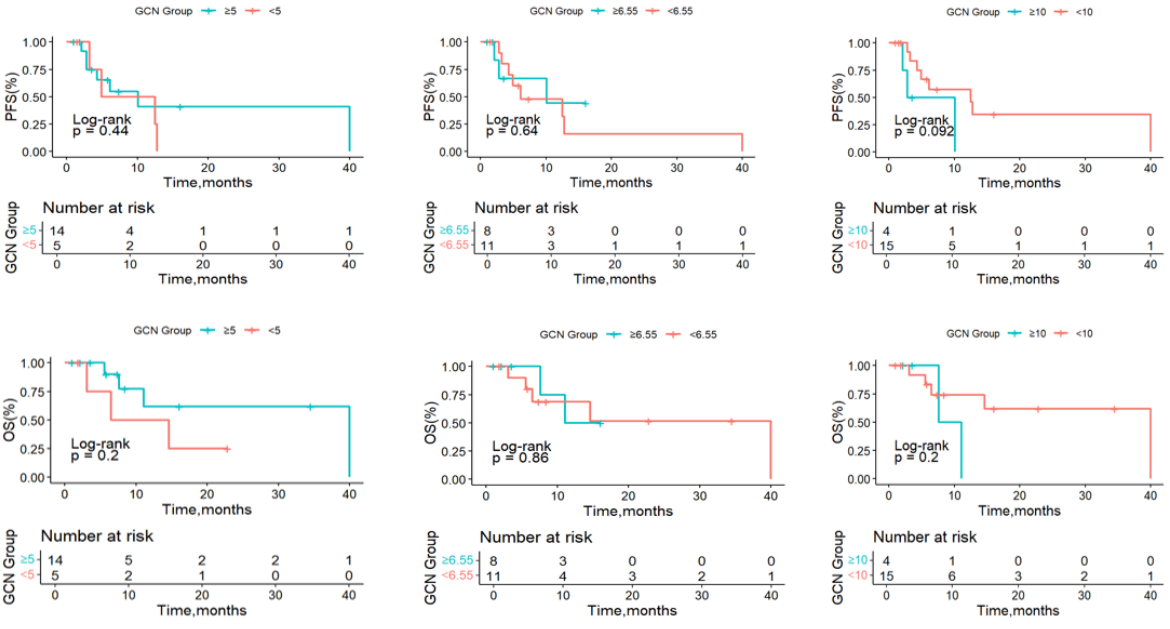
当按不同GCN临界值(5、6.55、10)分层时,未观察到中位PFS或OS的显著差异(图3)4。
安全性数据显示,31.6%的患者未报告不良事件;周围性水肿(36.8%)与低白蛋白血症(15.8%)为最常见的不良事件;仅2例患者发生了3级及以上不良事件,包括1例间质性肺炎,经治疗后好转;未报告治疗相关死亡4。
这是中国首个针对卡马替尼治疗MET扩增NSCLC患者的真实世界研究,结果表明卡马替尼单药或与其他TKIs联合使用,为该类患者提供了一种有前景的治疗选择。MET GCN有望成为预测MET抑制剂疗效的生物标志物。此外,卡马替尼良好的安全性特征进一步支持了其在临床实践中的应用4。
基于本项研究的重要临床意义与创新性发现,我们特邀李醒亚教授与金时教授进行深度点评。
突破治疗困境:卡马替尼为MET扩增NSCLC提供高效精准治疗选择
李醒亚教授:MET通路是调控细胞生命活动的关键信号轴,其作用机制依赖于肝细胞生长因子(HGF)与MET受体胞外SEMA结构域的特异性结合,进而引发受体二聚化、酪氨酸激酶结构域自身磷酸化,并有序激活下游RAS-RAF-MEK-ERK、PI3K-AKT及SRC-FAK等多条信号通路,精密调控细胞的增殖、存活、迁移与血管生成等生理过程5。然而,该通路的异常活化可通过多种机制驱动肿瘤发生,包括HGF自分泌或旁分泌增加所致的配体依赖性激活,以及常见的非HGF依赖性机制,如MET基因扩增、转录上调、激酶区活性突变及第14号外显子跳跃突变等。这些变异导致MET通路异常激活,最终促进肿瘤细胞增殖、侵袭、抗凋亡及治疗抵抗6。
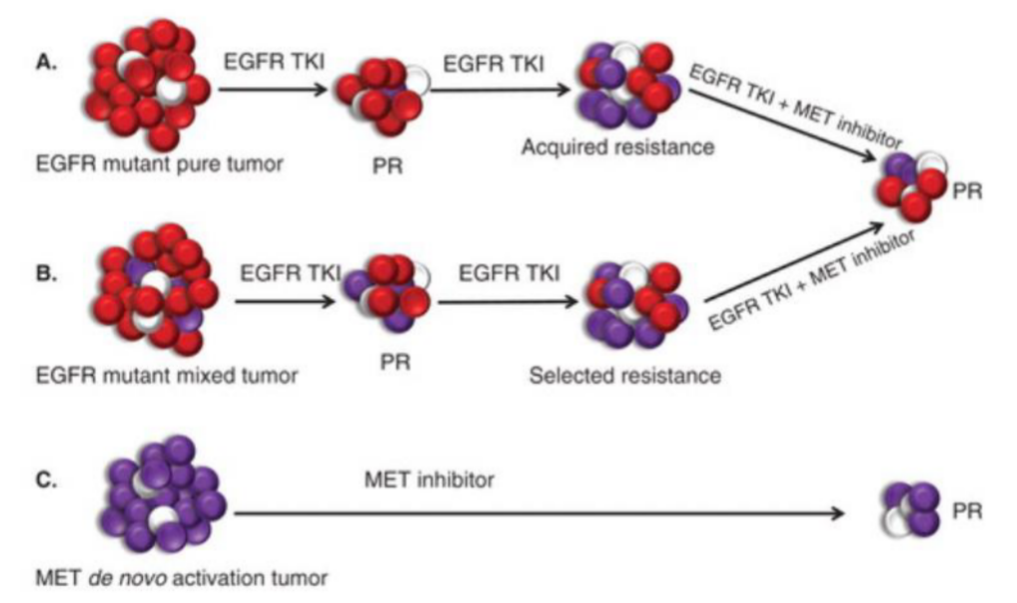
基于上述机制,MET扩增NSCLC的治疗策略主要围绕靶向抑制MET信号通路展开,既包括高选择性MET-TKI单药治疗,也涵盖MET-TKI与EGFR-TKI联合策略,以协同阻断原发性驱动或克服继发性耐药(如图4所示)。依据我国首个《MET 异常 NSCLC 诊疗专家共识》7EGFR突变伴MET扩增的晚期NSCLC患者可使用EGFR-TKI联合MET-TKI进行治疗;EGFR阴性、MET扩增患者可使用卡马替尼等单药进行治疗(2B)。MET继发扩增的晚期 NSCLC 患者可使用 EGFR-TKIs联合MET-TKIs进行治疗(2A)。现有临床研究已证实,卡马替尼单药或联合治疗策略在高拷贝数MET原发扩增8-10、EGFR突变合并MET原发扩增11及EGFR-TKI耐药后继发MET扩增11,12等不同临床场景中,均能带来具有显著临床意义的生存获益。
本次中国真实世界研究为MET扩增相关治疗提供了极具价值的“本土化”验证。研究显示,卡马替尼治疗的24例中国NSCLC患者中表现出稳健疗效,中位rwPFS达7.1个月,ORR为33.3%,DCR超90%,且安全性可控。该结果不仅与全球关键研究一致,更首次系统证实卡马替尼在中国人群在真实世界中的实际疗效与耐受性,为推进MET精准检测与治疗策略落地临床提供了关键循证依据,具有重要的实践指导价值4。不仅如此,该研究还发现,在已知MET GCN的19例患者群体中(含原发性与继发性),卡马替尼取得了更优的疗效(中位rwPFS 10.1个月)。虽然不同 GCN cutoff(5、6.55、10)下的中位PFS和OS无显著统计学差异,但基于本研究局限性,即样本量相对有限且采用回顾性设计,这些因素可能引入潜在偏倚。因此,该结论有待未来基于更大样本规模的前瞻性研究进一步验证。然而,SAVANNAH研究中MET扩增患者主要疗效人群为GCN≥10,研究者评估的PFS为7.4个月13;SACHI研究中三代 EGFR-TKIs 耐药后MET扩增患者主要疗效人群则为GCN≥10,PFS达6.9个月14。此外,一项多中心联合研究显示与 MET GCN< 6.55的患者相比,MET GCN≥ 6.55的患者具有更长PFS15。综上,基于目前已有循证提示 MET GCN 有望作为预测MET扩增相关治疗疗效的生物标志物。因此对MET GCN进行精准检测,或将有助于筛选潜在获益人群,推动NSCLC的精准治疗策略优化,期待未来更大样本量及前瞻性研究进一步验证。
实证支撑:卡马替尼为MET扩增NSCLC患者带来希望
金时教授:MET扩增指基因拷贝数增加,包括局部扩增和多倍体两种形式。耐药机制方面,MET扩增分为原发性扩增和继发性扩增16。对于高MET扩增(GCN≥10)的NSCLC患者可能从克唑替尼及卡马替尼等靶向药物治疗中获益3。当前,越来越多MET-TKI的相关临床研究逐步证实除MET外显子14跳跃突变外,其在MET扩增的NSCLC患者同样疗效显著。遗憾的是,基于AcSé及PROFILE 1001等研究发现,克唑替尼治疗MET扩增疗效有限。关键注册研究GeoMETry mono1显示,卡马替尼单药治疗在GCN≥10的初治MET扩增患者中ORR达40%,且局部扩增亚组疗效尤为突出(ORR达57.1%);亚裔亚组更是取得ORR为66.7%的显著获益,奠定了其成为高拷贝数MET原发扩增有效的可选治疗方案。尤为值得肯定的是,这一数据不仅凸显了卡马替尼对亚裔人群卓越的治疗优势,更预示提示着中国MET扩增患者有望从中获得超越全球人群的显著生存获益8-10。
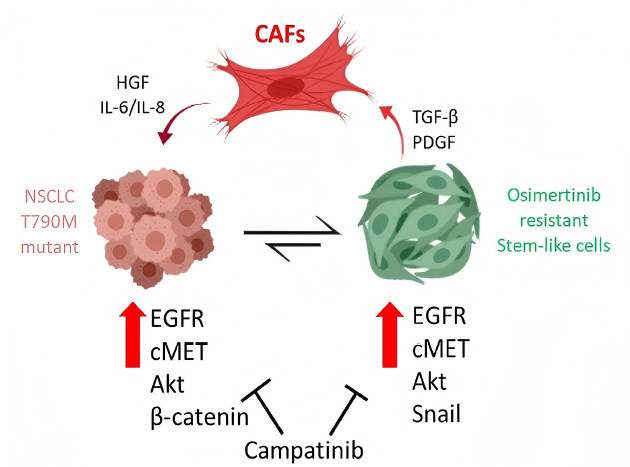
此外,继发性MET扩增作为EGFR-TKI的重要耐药机制,已得到充分证实。在接受第一、二代EGFR-TKI一线治疗NSCLC患者中,MET扩增的发生率为5%-22%;而在奥希替尼一线治疗进展的患者群体中,其发生率达15%-20%,凸显了MET扩增在EGFR靶向治疗耐药过程中的重要作用与广泛性17。现多项研究如INSIGHT 218、SAVANNAH19及SACHI研究20等已证实,MET-TKI联合EGFR-TKI可有效逆转耐药,这标志着“双靶共抑制”策略的成功实践,为耐药后患者提供了高效且具针对性的治疗选择。从机制上来看,肿瘤相关成纤维细胞(CAFs)通过分泌HGF、IL - 6/IL - 8 等特定因子激活NSCLC细胞中的cMET、Akt等信号通路,导致奥希替尼耐药,而卡马替尼通过抑制这些信号通路,可重新恢复NSCLC细胞对奥希替尼的敏感性(如图5所示)。在研究实践方面,发布在J Clin Oncol杂志的一项Ib/II期研究探讨了卡马替尼联合吉非替尼在继发性MET扩增患者中的安全性和疗效,结果显示MET GCN≥6 的患者ORR为47%,且安全性良好。此外,回顾性研究显示卡马替尼联合奥希替尼在该类患者中已实现ORR 50%, mPFS达 18.1个月的临床获益21-23。
本次研究在真实临床场景中验证了卡马替尼单药/联合对中国一线及多线治疗MET扩增患者的显著生存获益(中位rwPFS为10.1个月,中位rwOS为14.6个月)与可靠安全性,为临床决策提供了扎实依据。其结果强化了MET扩增作为可操作靶点的临床意义,并凸显了在我国推进MET检测标准化与精准分层的迫切性,对提升我国肺癌精准诊疗水平具有前瞻性引导价值4。更值得一提的是,作为中国首个聚焦卡马替尼治疗MET扩增的真实世界研究,本研究创新性地纳入了ALK-TKI及ROS1-TKI耐药后继发MET扩增的患者,研究整体良好的疗效与安全性提示卡马替尼有望为这类耐药人群提供新的治疗路径,期待未来前瞻性研究进一步验证这一潜力。
为了更好地帮助大家理解MET扩增NSCLC的诊疗策略,为该类患者带来的临床获益,欢迎点击观看相关科普解读。
专家简介(向左滑动查看更多)








1. Remon J, et al. MET alterations in NSCLC—Current Perspectives and Future Challenges. J Thorac Oncol. 2023 Apr;18(4):419-435.
2. Dhillon S. Capmatinib: First Approval. Drugs. 2020 Jul;80(11):1125-1131.
3. Non-small cell lung cancer. NCCN Guidelines Version 2. 2025.
4. EP.12.44.The Efficacy of Capmatinib in Treating NSCLC Patients with MET Amplification
in a Multi-Center Real-World Setting.2025WCLC.
5. Wang Q, et al. J Hematol Oncol. 2019 Jun 21;12(1):63.
6. WU YL et al. Cancer Treat Rev. 2017 Dec;61:70-81.
7. 陈军, 韩宝惠, 胡毅, 等. MET异常NSCLC诊疗专家共识(2025版)[J/OL]. 中国肺癌杂志,1-13.、
8. Wolf J et al. New Engl J Med 2020;383:944‒57.
9. Wolf J, et al. Lancet Oncol. 2024 Oct;25(10):1357-1370.
10. Wolf et al, Eur J Cancer, 174 (2022), p. S21.
11. Wu YL, et al. J Clin Oncol. 2018;36:3101-9.
12. Wu YL, et al. J Clin Oncol. 2021;39(15 Suppl):abstract 9048.
13. Myung-Ju Ahn,et al.SAVANNAH: Savolitinib (savo) + osimertinib (osi) in patients (pts) with EGFRm advanced NSCLC and METoverexpression (OverExp) and/or amplification (Amp) following progressive disease (PD) on osi.2025 ELCC.2O
14. Shun Lu, et al. Savolitinib (Savo) combined with osimertinib (osi) versus chemotherapy (chemo) in EGFR-mutant (EGFRm) and MET-amplification (METamp) advanced NSCLC after disease progression (PD) on EGFR tyrosine kinase inhibitor (TKI): Results from a randomized phase 3 SACHI study. 2025 ASCO Abstract # LBA8505.
15. S-Y.M. Liu, et al. Optimal Cut-Off with NGS for Metamplification Andclinical Relevance to MET Inhibitor in Non-Small-Cell Lung Cancer. 2024 WCLC P1.06B.14.
16. 中华医学会病理学分会, 等.中华病理学杂志,2022,51(11):1094-1103.
17. Johnson M, et al.Lung Cancer,2022, 170:41-51.
18. T.M. Kiml,et al.WCLC, OA21.05, 2023.
19. 2022 WCLC, EP08.02-140 ,Benjiemin Levy, et al.
20. Shun Lu, et al. 2025 ASCO LBA8505 (Oral session).
21. Wu YL, Zhang L, Kim DW, et al. Phase Ib/II study of capmatinib (INC280) plus gefitinib after failure of epidermal growth factor receptor (EGFR) inhibitor therapy in patients with EGFR-mutated, MET factor-dysregulated non-small-cell lung cancer. J Clin Oncol, 2018, 36(31): 3101-3109.
22. Zhu K, Lv Z, Xiong J, Zheng H, Zhang S, Jin H, Yu L, Li Z, Zhang J, Li C, Liang P. MET inhibitor, capmatinib overcomes osimertinib resistance via suppression of MET/Akt/snail signaling in non-small cell lung cancer and decreased generation of cancer-associated fibroblasts. Aging (Albany NY). 2021 Feb 17;13(5):6890-6903.
Omar Elghawy, et al. clin lung cancer.2025 Mar;26(2):158-163.e2.
排版编辑:肿瘤资讯-CYX











 苏公网安备32059002004080号
苏公网安备32059002004080号


