近年来,免疫检查点抑制剂(ICIs)已彻底改变了错配修复缺陷(dMMR)或微卫星不稳定(MSI)晚期结直肠癌的治疗格局。然而,如何将这一革命性疗法应用于局部晚期患者,通过新辅助治疗模式在降低肿瘤分期、增加手术切除率的同时,最大限度保留患者器官功能并改善长期预后,是临床医生面临的重要课题。针对这一未竟的临床需求,一项前沿研究为我们揭示了新的方向。近期,由北京大学肿瘤医院沈琳教授团队牵头开展的一项评估特瑞普利单抗联合伊立替康和贝伐珠单抗用于dMMR/MSI局部晚期结直肠癌新辅助治疗的Ib/II期临床研究,其阶段性成果荣登国际权威医学期刊《细胞报告医学》(Cell Reports Medicine)[1]。研究结果振奋人心,显示这一创新性治疗方案不仅取得了极高的病理完全缓解(pCR)率和喜人的长期生存获益,更通过引入“医患共同决策”模式,根据患者的具体情况与意愿动态调整治疗策略,为实现个体化精准治疗、选择最佳手术时机,乃至实现器官保留提供了一条极具潜力的治疗新路径。【肿瘤资讯】特整理研究内容如下,以飨读者。

专家简介
本研究由北京大学肿瘤医院沈琳教授和李健教授共同担任通讯作者,北京大学肿瘤医院的王正航医生、王晰程医生、张晓燕医生和冷家骅医生为共同第一作者。
【核心要点速览】
实现深度病理学缓解:特瑞普利单抗为基础的新辅助治疗方案展现出卓越的疗效。在符合方案集(PPS)中,结肠癌队列的pCR率达到66.7%,直肠癌队列的pCR率更是高达100.0%。
长期生存获益显著:经过中位35.6个月的随访,所有接受根治性手术的18例患者均未出现疾病复发或进展。两个队列的2年总生存(OS)率均为100%。
“医患共同决策”+“观察等待”策略成功:研究采用“医患共同决策”模式,个性化调整治疗。4例达到临床完全缓解(cCR)的患者成功采用“观察等待”策略,避免了手术创伤。
更长的特瑞普利单抗治疗周期或与更高pCR率有关:探索性分析发现,接受≥9个周期治疗的患者pCR率达到100%,高于接受≤8个周期治疗的患者(63.6%)。而联合伊立替康和贝伐珠单抗可能带来更高的客观缓解率(ORR)。
安全性可控可管理:治疗相关的3-4级不良事件(TRAEs)仅在联合治疗组中出现,主要为可逆的血液学毒性(如中性粒细胞减少等),未观察到非预期的或5级药物相关不良事件。
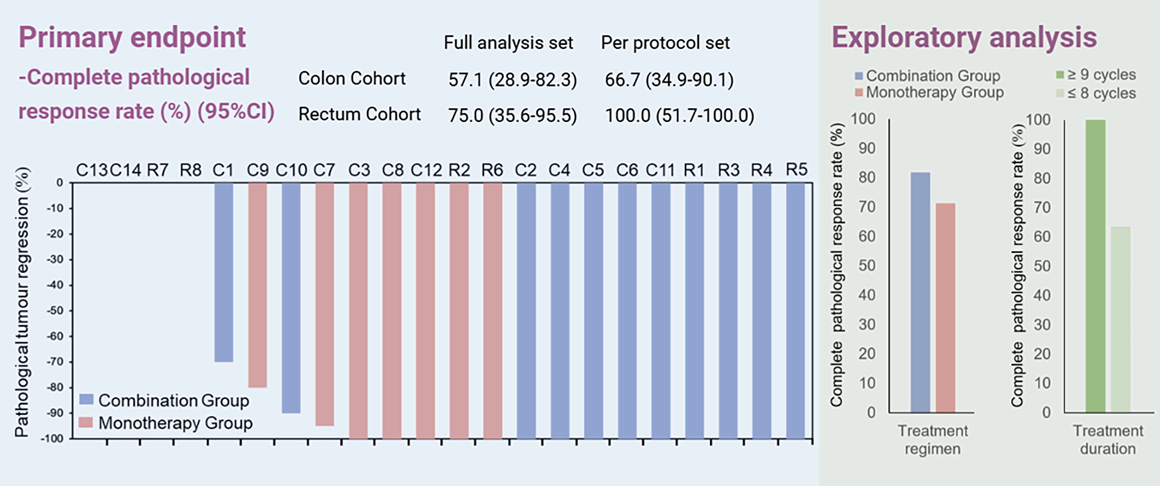 图1. 研究主要结果
图1. 研究主要结果
研究背景
结直肠癌(CRC)是全球第三大常见癌症,也是第二大癌症死亡原因。在dMMR/MSI亚型中,ICIs已成为晚期患者的标准治疗。然而,在局部晚期阶段,传统新辅助治疗对dMMR/MSI肿瘤效果不佳。同时,约29.4%的转移性dMMR/MSI患者对PD-1单药存在原发性耐药;研究设计初期,缺乏PD1单抗新辅助治疗的临床数据,为避免新辅助治疗期间的免疫耐药,本研究基于伊立替康和贝伐珠单抗在肿瘤免疫微环境中的潜在调节作用,创新性地将三者结合,旨在为dMMR/MSI局部晚期结直肠癌患者探索更高效、更安全的治疗新范式。
研究设计
该研究是一项在中国两家中心(北京大学肿瘤医院和吉林大学第一医院)开展的开放标签、单臂、Ib/II期临床研究。研究纳入了dMMR/MSI局部晚期结直肠癌患者,分为结肠癌队列(T4NanyM0)和直肠癌队列(T3-T4期或拒绝直接手术或放疗的T1-T2期)。
所有患者接受以特瑞普利单抗为核心的治疗,并通过基于多学科团队(MDT)的“医患共同决策”模式,与患者共同决定是否在基线时联合伊立替康和贝伐珠单抗,并在每3个周期的影像学评估后,决定是进行手术,还是继续治疗直至达到cCR后进入“观察等待”。主要研究终点为经盲态独立中心审查(BICR)评估的pCR率,次要终点包括ORR、R0切除率、肿瘤退缩分级(TRG)等。
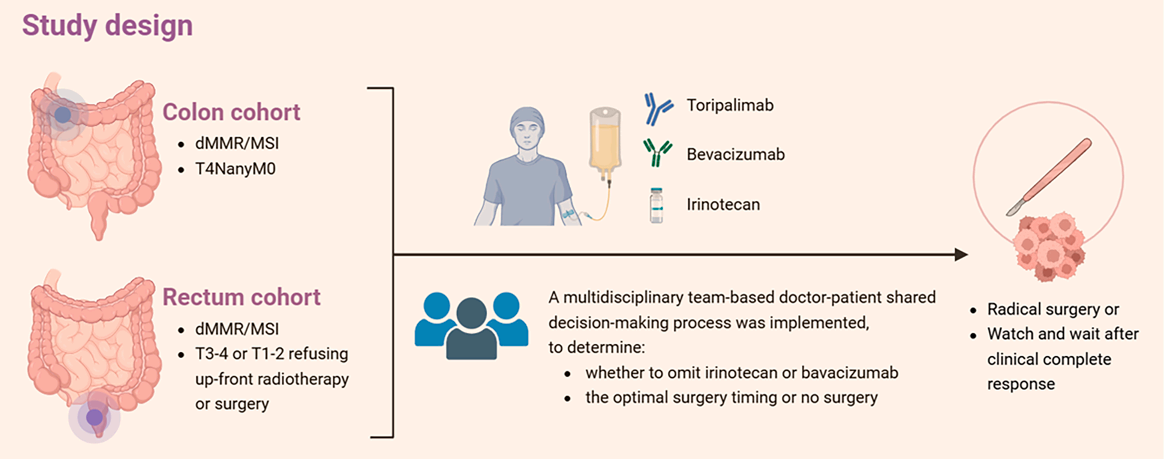 图2. 研究设计
图2. 研究设计
研究结果
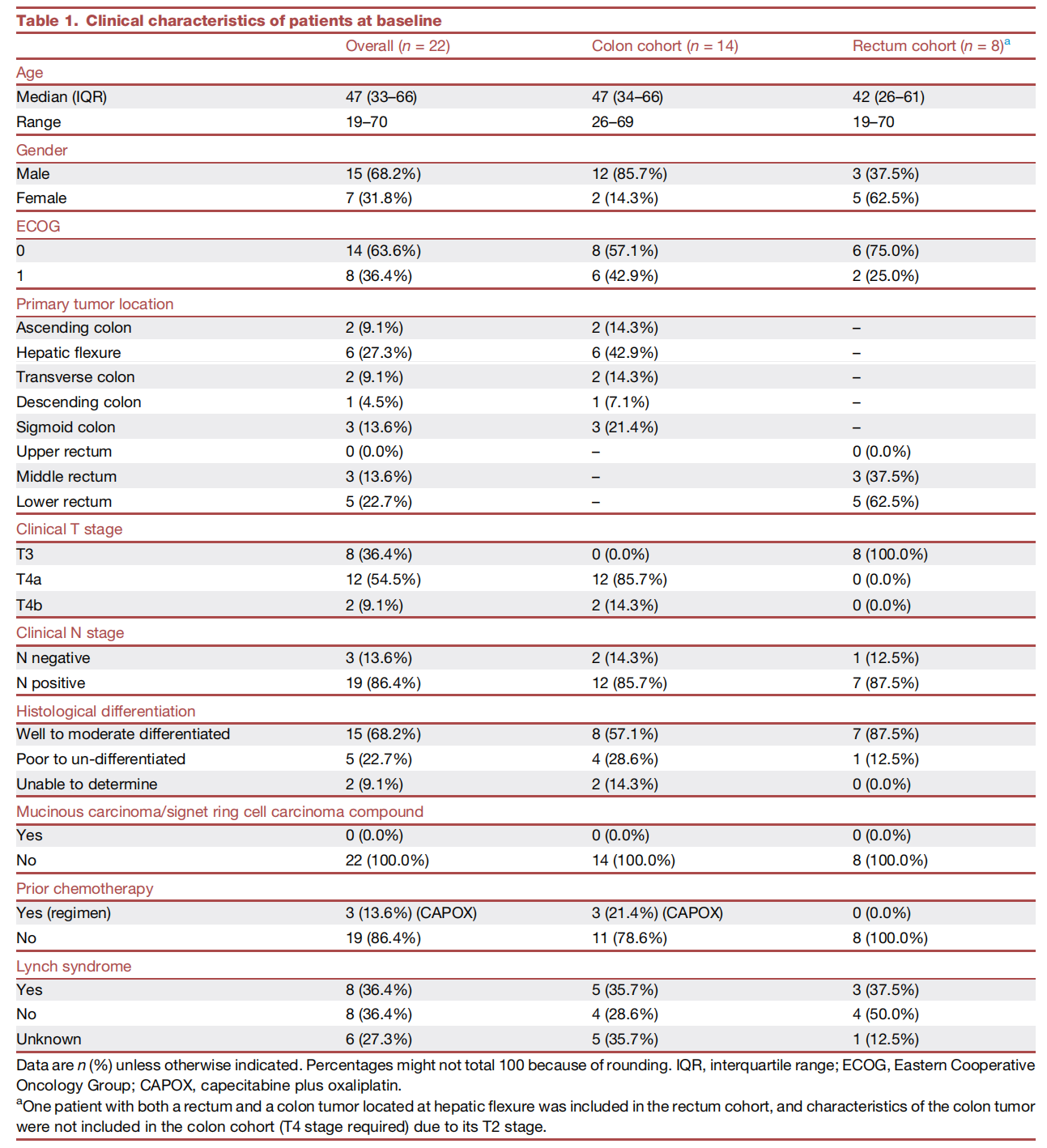
自2020年12月至2023年2月,研究共纳入22例患者。中位年龄47岁,16例为女性。基于“医患共同决策”,12例患者在新辅助治疗中接受了特瑞普利单抗联合伊立替康和贝伐珠单抗联合治疗,10例患者接受了特瑞普利单抗单药治疗。
表1. 患者基线特征
深度缓解,结肠癌队列pCR率达66.7%,直肠癌队列pCR率达100%
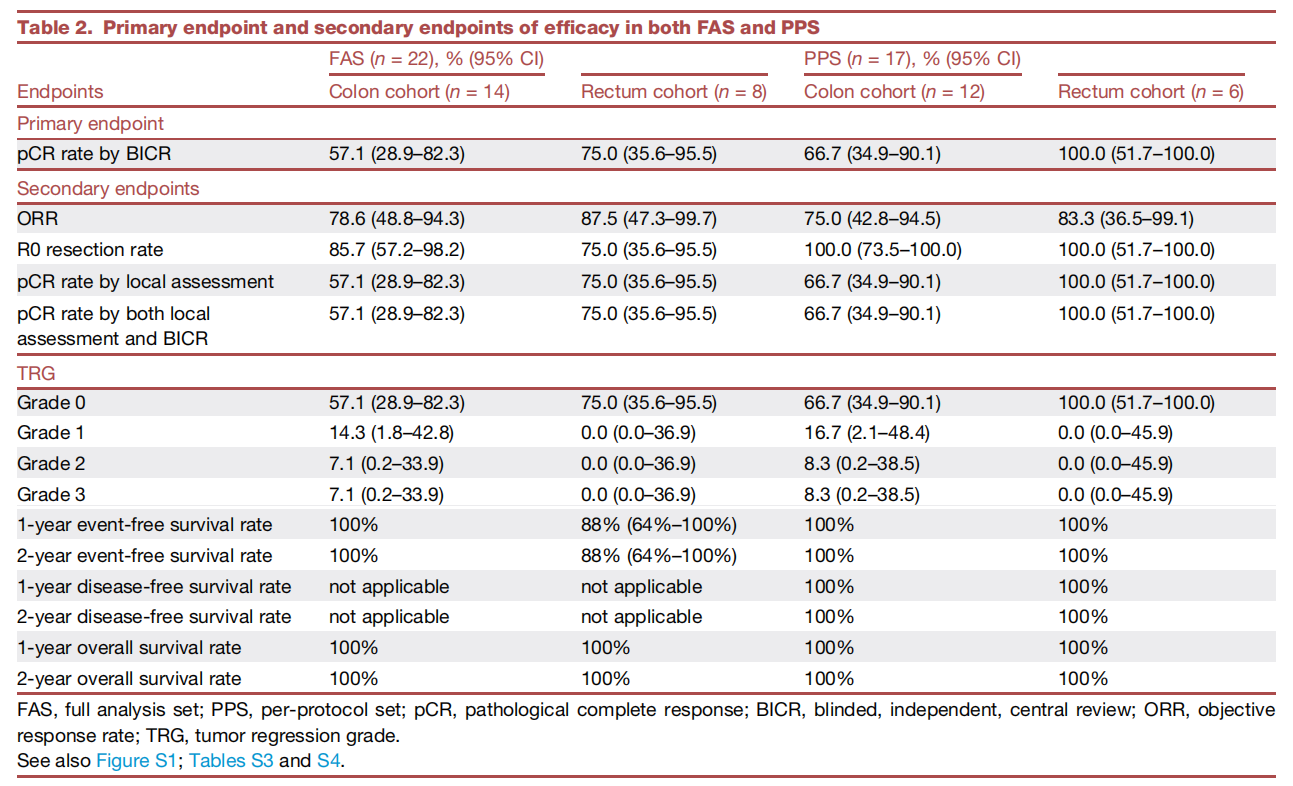
结肠癌队列中(n=14):在PPS集中(12例接受手术),8例患者达到pCR,pCR率为66.7%。在FAS集中,pCR率为57.1%。另有2例患者达到cCR并选择“观察等待”。
直肠癌队列中(n=8):在PPS集中(6例接受手术),所有患者均达到pCR,pCR率高达100.0%。在FAS集中,pCR率为75.0%。同样有2例患者达到cCR并进入“观察等待”。
需要补充统计学假设相关描述。在第一阶段中,两个队列均成功达到预设的主要终点。基于贝叶斯分层模型,预计研究继续进入第二阶段后取得成功的概率超99%。此外,在FAS集中,结肠队列与直肠队列的ORR分别为78.6%和87.5%,R0切除率分别为85.7%和75.0%,研究者评估的pCR率分别为57.1%和75.0%。
表2. FAS集和PPS集中的主要终点和次要疗效终点
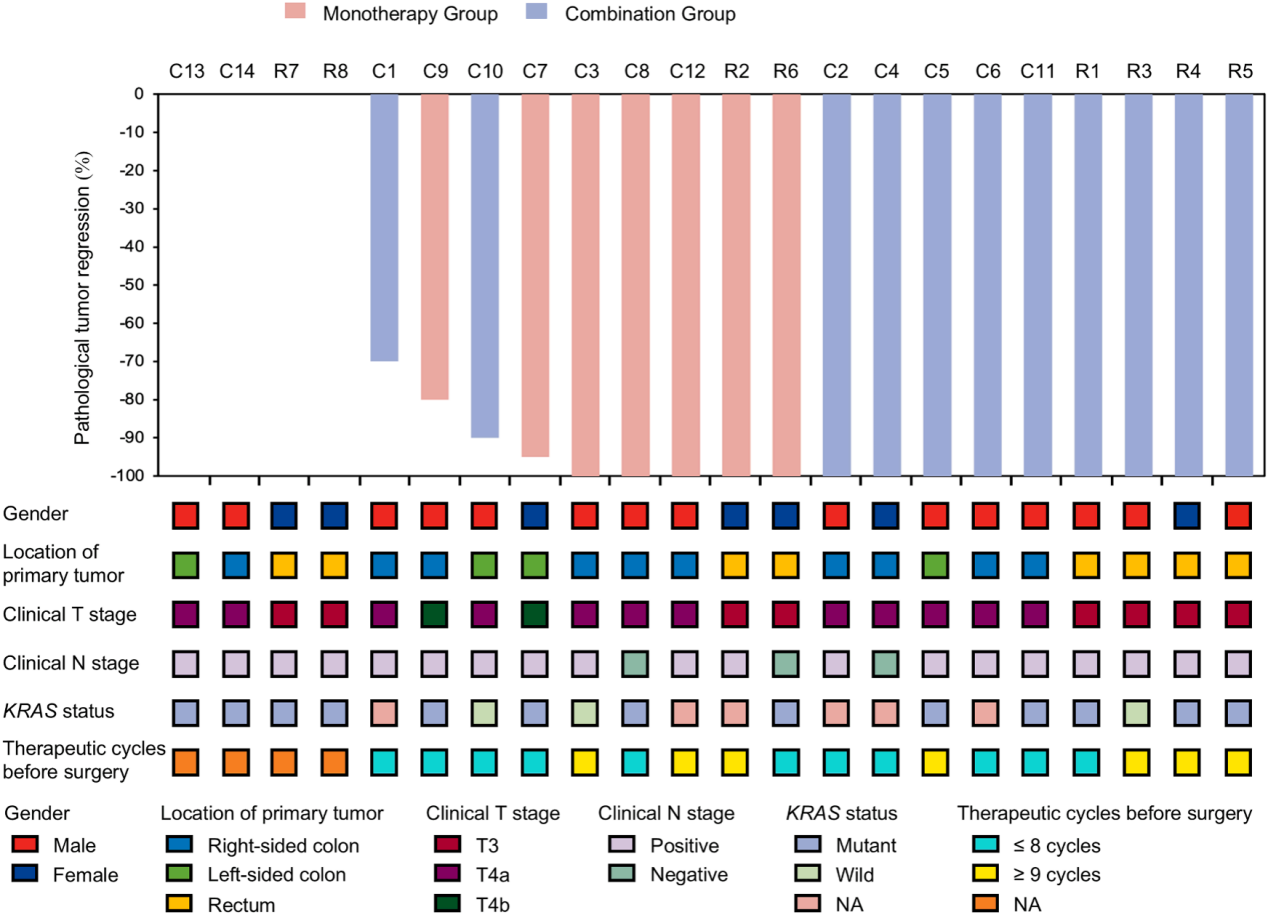
长期生存获益,2年OS率达100%
在中位随访35.6个月后,所有接受根治性手术的患者均未出现复发或疾病进展。两个队列的1年和2年EFS及OS率均为100%(PPS集)。
在4例进入“观察等待”的cCR患者中,仅1例出现区域淋巴结进展,但在接受PD-1抗体再挑战治疗后再次达到cCR,显示出良好的挽救治疗效果。
安全性可控可管理
整体安全性良好,未出现新的安全信号。3-4级TRAEs仅见于联合治疗组,主要为中性粒细胞减少(25%)、白细胞减少(8.3%)和贫血(8.3%),均为临床可控的血液学毒性。
探索性分析提示更长的特瑞普利单抗治疗周期或与更高pCR率有关
探索性分析结果显示,接受≥9个治疗周期患者相较于接受≤8个周期的患者表现出更高的pCR率(100% vs. 63.6%),提示足够的治疗时长对于实现深度缓解至关重要。
联合治疗或能提升ORR:尽管pCR率相似,但联合治疗组的ORR(91.7%)高于单药组(60.0%),提示对于需要快速缩小肿瘤体积以降低手术难度的患者,联合治疗可能是更优选择。
KRAS突变不影响疗效:尽管本研究中KRAS突变率(81.3%)较高,但突变状态与pCR率无明显关联,表明该方案对KRAS突变患者同样有效。
研究结论
本研究的初步结果有力证明,特瑞普利单抗联合或不联合伊立替康与贝伐珠单抗的新辅助治疗方案,在dMMR/MSI局部晚期结直肠癌中展现出令人鼓舞的高pCR率和优异的长期生存潜力,且安全性可管理。研究中应用的“医患共同决策”模式,为实现个体化治疗和器官功能保留提供了创新思路。这些发现为临床实践提供了重要参考,后续研究将进一步验证该联合方案的长期获益,并探索最佳治疗周期与联合模式,以期为更多患者带来治愈希望。
专家点评
该研究的主要研究者、北京大学肿瘤医院消化肿瘤内科李健教授表示,对于dMMR/MSI局部晚期结直肠癌患者,传统新辅助放化疗的疗效有限,甚至可能出现疾病进展。我们的研究直面这一挑战,探索了以特瑞普利单抗为核心的联合免疫疗法。研究结果令人鼓舞,特别是在直肠癌队列中观察到100%的pCR率,以及所有手术患者在长达近三年的随访中均未出现复发,这充分证明了新辅助免疫治疗的巨大潜力。更重要的是,我们采用的“医患共同决策”模式,使得治疗不再是“一刀切”,而是可以根据肿瘤退缩情况和患者意愿,灵活选择延长治疗以争取临床完全缓解和“观察等待”的机会,这对于改善患者生活质量、保留器官功能具有里程碑式的意义。这些发现为优化此类患者的治疗策略提供了强有力的循证医学证据,也为未来的个体化、精准化治疗指明了方向。
近些年,免疫治疗迅速更改了dMMR/MSI结直肠癌的治疗格局,因此对于精准诊断、增强疗效和逆转免疫耐药方面的要求越来越高。团队在沈琳教授的带领下,开发了基于血液检测MSI的原创性手段,并使用新型淋巴结特征进一步提高了对于淋巴结转移的鉴别能力[2];目前正着重进行多项新型治疗策略的探索[3-8],优化dMMR/MSI结直肠癌的全程管理流程,以期为更多的患者带来最大程度的治愈可能以及生活质量的显著提高。
主任医师、博导,GCP中心副主任
致力于消化道恶性肿瘤精准药物治疗、多学科综合治疗与抗肿瘤新药新技术研发
兼任CSCO胃肠间质瘤专委会主委
CSCO临床研究专委会副主委
CSCO大肠癌专委会常委
中国抗癌协会肿瘤药物临床研究专委会副主委
中国抗癌协会胃肠间质瘤专委会常委
中国医师协会外科分会胃肠间质瘤学组副组长
主持或作为课题骨干负责科技部重大专项“结直肠癌精准治疗”子课题、科技部2030肠癌免疫治疗课题、科技部重大新药创制平台建设课题、国自然面上项目。获得中华医学会科技奖一等奖与中国抗癌协会科技奖一等奖。在Nature Medicine、JHO、CCR等期刊发表SCI论文70余篇。
[1] Wang Z, Wang X, Zhang X, et al. Toripalimab, bevacizumab, and irinotecan in dMMR/MSI locally advanced colorectal cancer: First-stage results from a phase 1b/2 trial. Cell Rep Med. Published online August 12, 2025. doi:10.1016/j.xcrm.2025.102296
[2] Guan Z, Wang ZH, Zhang XY, et al. Predicting Regional Lymph Node Metastases at CT in Microsatellite Instability-High Colon Cancer. Radiology. 2025;315(1):e242122. doi:10.1148/radiol.242122
[3] Wang Z, Cheng S, Yao Y, et al. Long-term survivals of immune checkpoint inhibitors as neoadjuvant and adjuvant therapy in dMMR/MSI-H colorectal and gastric cancers. Cancer Immunol Immunother. 2024;73(9):182. Published 2024 Jul 5. doi:10.1007/s00262-024-03764-9
[4] Chen M, Wang Z, Liu Z, et al. PD-1/PD-L1 Inhibitor Plus Chemotherapy Versus PD-1/PD-L1 Inhibitor in Microsatellite Instability Gastrointestinal Cancers: A Multicenter Retrospective Study. JCO Precis Oncol. 2023;7:e2200463. doi:10.1200/PO.22.00463
[5] Wang Z, Zhang Q, Qi C, et al. Combination of AKT1 and CDH1 mutations predicts primary resistance to immunotherapy in dMMR/MSI-H gastrointestinal cancer. J Immunother Cancer. 2022;10(6):e004703. doi:10.1136/jitc-2022-004703
[6] Wang Z, Wang X, Xu Y, et al. Mutations of PI3K-AKT-mTOR pathway as predictors for immune cell infiltration and immunotherapy efficacy in dMMR/MSI-H gastric adenocarcinoma. BMC Med. 2022;20(1):133. Published 2022 Apr 21. doi:10.1186/s12916-022-02327-y
[7] Li J, Deng Y, Zhang W, et al. Subcutaneous envafolimab monotherapy in patients with advanced defective mismatch repair/microsatellite instability high solid tumors. J Hematol Oncol. 2021;14(1):95. Published 2021 Jun 21. doi:10.1186/s13045-021-01095-1
[8] Wang Z, Zhao X, Gao C, et al. Plasma-based microsatellite instability detection strategy to guide immune checkpoint blockade treatment. J Immunother Cancer. 2020;8(2):e001297. doi:10.1136/jitc-2020-001297
排版编辑:肿瘤资讯-王俊澔











 苏公网安备32059002004080号
苏公网安备32059002004080号


