

背景:NRG Oncology/RTOG 9802是一项里程碑式的临床试验,它首次证实了在放疗(RT)后加入辅助化疗(PCV方案)能够为高危低级别胶质瘤(LGG)患者带来总生存(OS)获益。本研究旨在对该试验的样本进行事后综合基因组分析,以评估2016年WHO分子分型(基于IDH突变和1p/19q共缺失状态)的预后和预测价值。
方法:研究者对RTOG 9802试验中106例有可用组织样本的患者进行了全面的分子分析。通过测序和免疫组化确定IDH1/2突变状态,通过拷贝数阵列确定1p/19q共缺失状态,并将患者分为三个WHO分子亚组:IDH野生型(IDHwt)、IDH突变/非共缺失型(IDHmut/non-codel)和IDH突变/共缺失型(IDHmut/codel)。采用Cox比例风险模型评估分子分型对预后(生存差异)和预测(治疗获益差异)的影响。
结果:关于预后价值,WHO分子分型是PFS和OS的强大独立预后因素。IDHmut/codel亚组的预后最佳,IDHmut/non-codel亚组居中,而IDHwt亚组的预后最差,其生存曲线接近胶质母细胞瘤。
关于预测价值,在调整了临床变量后,分析显示:
在IDH突变/非共缺失亚组中,加用PCV化疗显著改善了PFS(HR: 0.32, P=.003)和OS(HR: 0.38, P=.013)。
在IDH突变/共缺失亚组中,加用PCV化疗同样显著改善了PFS(HR: 0.13, P<.001)和OS(HR: 0.21, P=.029)。
相比之下,在IDH野生型亚组中,加用PCV化疗并未带来任何PFS或OS的显著获益。
结论:本研究首次在一项改变临床实践的随机试验中,证实了WHO分子分型对于高危LGG患者具有强大的预测价值。重要的是,研究结果表明,无论1p/19q共缺失状态如何,所有IDH突变的高危LGG患者都能从放疗后的PCV辅助化疗中获益,而IDH野生型患者则不能。
引言
弥漫性低级别胶质瘤(LGG, WHO II级)的治疗长期存在争议。NRG Oncology/RTOG 9802是一项里程碑式的III期临床试验,该试验将高危LGG患者(定义为年龄≥40岁或次全切除/活检)随机分配至单纯放疗(RT)组或RT后接受PCV(丙卡巴肼、洛莫司汀、长春新碱)辅助化疗组。其长期随访结果首次证实,增加PCV辅助化疗能显著延长患者的总生存期(OS),从而改变了临床实践。
自该试验设计以来,领域内对胶质瘤的分子生物学认识取得了巨大进步。特别是IDH1/2突变和1p/19q共缺失状态的发现,重塑了胶质瘤的诊断体系,并形成了2016年WHO中枢神经系统肿瘤分类的基础。该分类将弥漫性胶质瘤主要分为三个分子亚组:IDH突变且1p/19q共缺失的少突胶质细胞瘤(IDHmut/codel)、IDH突变但1p/19q完整的星形细胞瘤(IDHmut/non-codel)以及IDH野生型的星形细胞瘤(IDHwt)。
尽管这些分子标志物的预后价值已在大量回顾性研究中得到证实,但它们对特定治疗(如PCV化疗)的预测价值,尤其是在前瞻性随机试验的背景下,尚不完全清楚。本研究旨在利用RTOG 9802试验宝贵的临床数据和生物样本,进行全面的事后基因组学分析,以阐明WHO分子分型在高危LGG治疗中的预后和预测意义。
方法
组织队列与分子分析
研究者从参与RTOG 9802试验的251名患者中,收集了116例(46%)有足够组织样本的病例进行分析。采用多平台技术进行综合基因组分析:
IDH1/2突变:通过IDH1-R132H特异性抗体免疫组化(IHC)和定制化的Ion AmpliSeq靶向测序进行检测。
1p/19q共缺失:通过Affymetrix Oncoscan或Illumina 450K甲基化阵列进行拷贝数变异分析。
其他基因:同时检测了ATRX, CIC, FUBP1, TERT启动子等与胶质瘤相关的基因突变。
MGMT启动子甲基化:通过甲基化阵列进行评估。
统计分析
本研究的主要目的是评估WHO分子分型(IDHwt, IDHmut/non-codel, IDHmut/codel)的预后和预测价值。OS和PFS通过Kaplan-Meier法进行估计。使用Cox比例风险模型进行单变量和多变量分析,以评估各分子标志物的独立预后价值。通过检验治疗与分子亚组之间的交互作用,来评估其预测价值。
结果
分子图谱
在106例可进行完整分子分型的患者中,26例(24%)为IDHwt,43例(41%)为IDHmut/non-codel,37例(35%)为IDHmut/codel。
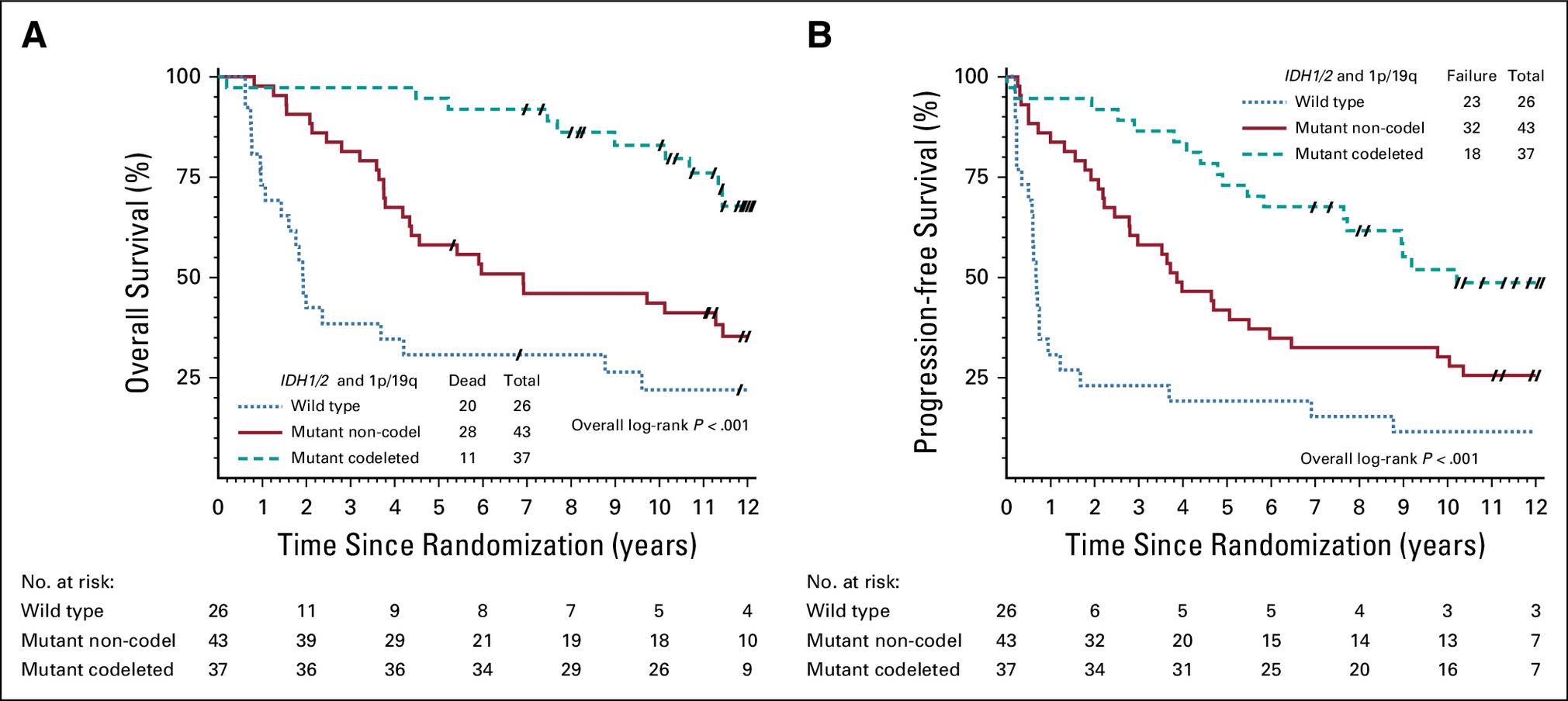
WHO分子分型的预后价值
多变量分析证实,在校正了年龄、手术范围、治疗等临床因素后,WHO分子分型是OS和PFS的独立、强大的预后因素(P<.001)。三个亚组的生存曲线呈现出清晰的分层:
IDHmut/codel亚组预后最佳(中位OS: 13.9年)。
IDHmut/non-codel亚组预后居中(中位OS: 6.9年)。
IDHwt亚组预后最差(中位OS: 1.9年),其生存曲线与胶质母细胞瘤(GBM)相似。
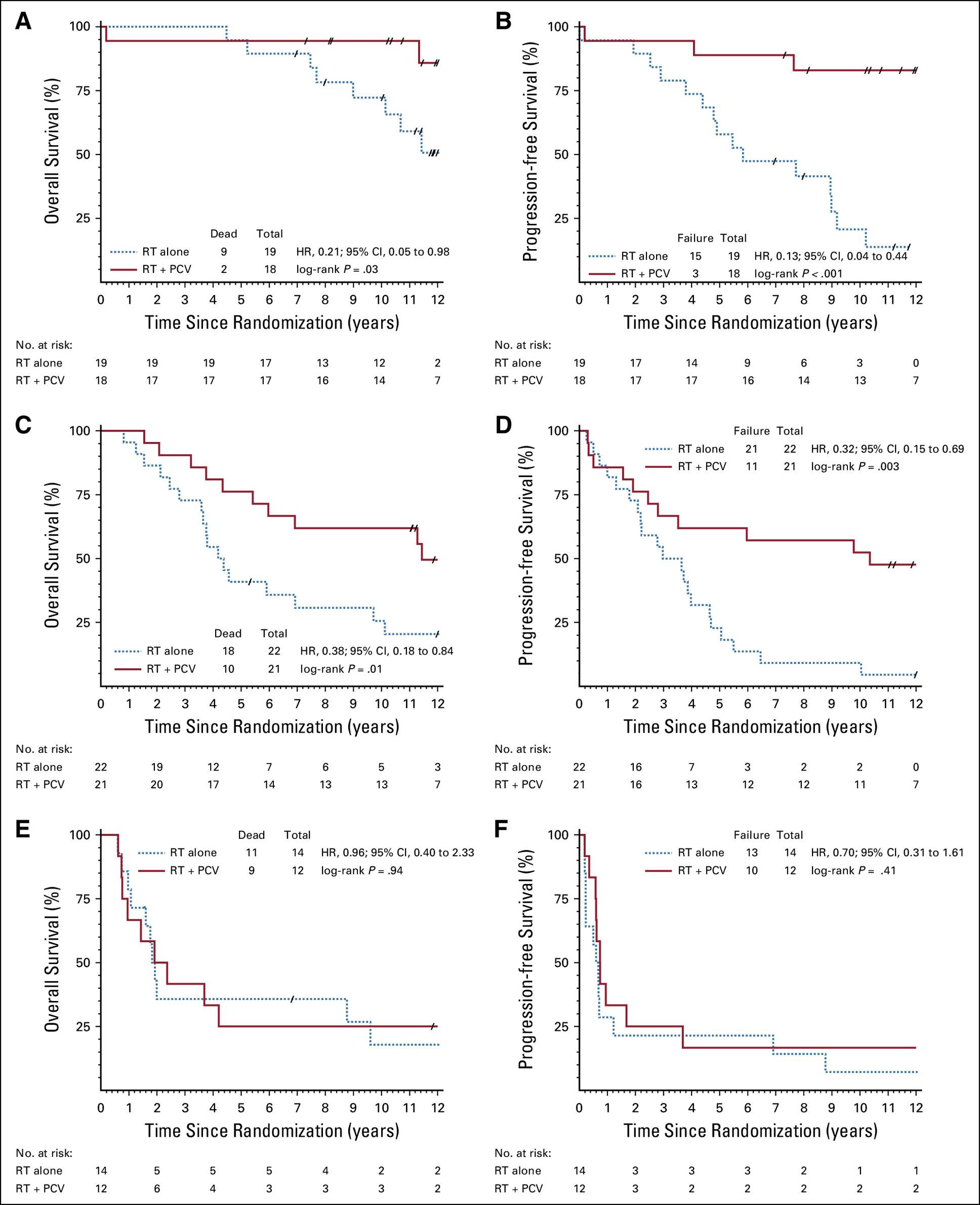
WHO分子分型的预测价值
这是本研究最重要的发现。研究者分析了在不同分子亚组中,增加PCV化疗相对于单纯放疗的获益情况:
在IDHmut亚组中(下图A, B),RT+PCV组相比单纯RT组,显著改善了OS(HR: 0.21, P=.029)和PFS(HR: 0.13, P<.001)。
在IDHmut/non-codel亚组中(下图C, D),RT+PCV组相比单纯RT组,同样显著改善了OS(HR: 0.38, P=.013)和PFS(HR: 0.32, P=.003)。
然而,在IDHwt亚组中(下图E, F),两组间的OS和PFS无显著差异,表明增加PCV化疗并未给该亚组患者带来生存获益。
讨论与结论
本研究首次在一项具有长期随访数据且改变了临床实践的III期随机试验中,系统地验证了2016 WHO分子分型的预后和预测价值。其结果强有力地证实,WHO分子分型不仅是一个强大的预后工具,能够将高危LGG患者清晰地分层为三个预后迥异的群体;更重要的是,它还是一个关键的预测工具,能够预测患者能否从PCV辅助化疗中获益。
本研究的核心结论是,对于高危LGG,PCV辅助化疗的获益人群是IDH突变的患者,而与1p/19q共缺失状态无关。无论是IDH突变的少突胶质细胞瘤(共缺失)还是星形细胞瘤(非共缺失),都能从PCV治疗中获得显著的生存延长。这一发现为临床决策提供了最高级别的证据支持。
与此同时,本研究也揭示了IDH野生型LGG的独特性质。这类肿瘤患者不仅预后极差,其生存曲线与GBM高度重合,而且他们不能从PCV化疗中获益。这提示IDH野生型LGG在生物学行为和治疗反应上更接近于GBM,应考虑采用针对GBM的治疗策略,而非传统的LGG治疗方案。
总之,NRG Oncology/RTOG 9802的这项事后分子分析,为我们理解高危LGG的治疗提供了全新的视角,并为实现基于分子标志物的精准治疗奠定了坚实的基础。
Bell E H, Zhang P, Shaw E G, et al. Comprehensive genomic analysis in NRG oncology/RTOG 9802: a phase III trial of radiation versus radiation plus procarbazine, lomustine (CCNU), and vincristine in high-risk low-grade glioma[J]. Journal of Clinical Oncology, 2020, 38(29): 3407-3417.
排版编辑:肿瘤资讯-丹忱











 苏公网安备32059002004080号
苏公网安备32059002004080号


