在我国,肺癌仍然是癌症死亡的主要原因之一。随着免疫检查点抑制剂的问世,肺癌治疗策略发生了巨大的演变,极大改善了肺癌患者的生存预后。III期临床试验GEMSTONE-302证实了舒格利单抗在Ⅳ期非小细胞肺癌(NSCLC)中卓越的临床疗效[1, 2],且在不同PD-L1表达人群均可实现全面获益,同时安全性可控。本期,中国医学科学院肿瘤医院山西医院马丽医生分享了一例高龄老年晚期肺癌患者在一线去化疗治疗应用PD-L1抑制剂舒格利单抗联合抗血管生成药物贝伐珠单抗后获得了良好的肿瘤缓解,且后续单药维持治疗中取得长期疾病控制,目前无进展生存期(PFS)已达13月余。现将病例诊疗过程整理如下,并邀请中国医学科学院肿瘤医院山西医院崔灵芝教授对病例进行点评,以飨读者。
综合内科一病区/乳腺内科病区
中国医学科学院肿瘤医院山西医院/山西省肿瘤医院
主治医师
病例介绍
基本情况
基本信息:患者女,81岁。
主诉:肺癌免疫治疗后6天。
现病史:2022年1月体检发现右肺占位,2022年1月17日就诊我院胸外科,胸部CT:双肺下叶后基底段囊腔样结构,右侧大小约1.7x1.6cm,左侧大小约2.7x2.2cm,考虑恶性不除外。颈部彩超:右颈VI区淋巴结肿大,较大者0.69x1.14cm,癌转移可能。患者未进行治疗。2024年4月7日就诊我科,影像学检查显示肿瘤明显增大且出现转移,遂进行系统治疗。
既往史:2012年1月因胆结石行胆囊切除术。
个人史:无烟酒史及特殊嗜好。
婚育月经史:已婚已育。
家族史:有肺癌家族史。
辅助检查
胸部CT(2024年4月)右肺下叶背段及后基底段见结节影,最大径约3.3x2.6cm,其边缘见囊腔样结构,囊腔大小约2.9x2.4cm;左肺下叶后基底段亦见囊腔影,大小为3.0x2.2cm,双肺囊腔考虑恶性;余肺野新增散在结节影,最大径约1.1cm,考虑转移。纵隔及双肺门可见多发肿大淋巴结影,较大者短经约1.8cm,考虑转移。
彩超(2024年4月):右颈IV、VI区多发淋巴结肿大,大小约0.387x0.494cm-2.02x2.02cm,考虑转移。
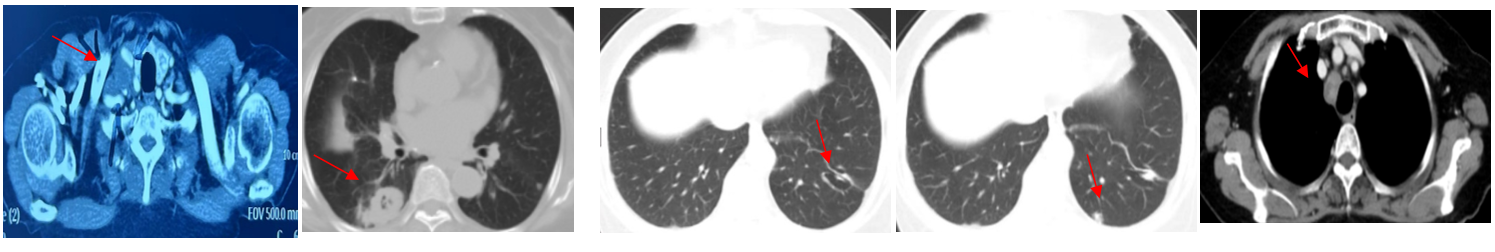
头颅CT、骨扫描(2024年4月):未见转移。
病理检查(2024年4月):(右颈淋巴结)穿刺:少许转移性癌,结合免疫组化结果:AB1/AB3(+),P63(散在+),P40(-),CK5(一),CKT(+),TTF-1(+),Napsin-A(+),Syn (-),CBA(-),CD56(一),CD117(-),Ki67(约80%+),符合转移性腺癌,考虑来源于肺。PD-L1(CPS)表达<1。
基因检测(2024年4月):TP53 错义突变,KRAS 错义突变,RBM10移码突变,STK11错义突变。血液微卫星不稳定性(bMSI): 低表达(6.68%),血液肿瘤突变负荷(bTMB): 高表达(10.0 Muts/Mb)。
临床诊断
1.肺腺癌(cT4N3M1a,IVA期),肺内转移,纵隔及双肺门、右颈部淋巴结转移。驱动基因阴性,PD-L1阴性。2.胆囊切除术后 PS评分:1分。
治疗经过
一线治疗:2024年05月09日-2024年07月31日:贝伐珠单抗400mg x5 ,舒格利单抗1200mg x5 。
不良反应:一线治疗5周期后出现下肢血栓,行下腔静脉滤器置入术,停用贝伐珠单抗。
疗效评价:3周期后部分缓解(PR)。
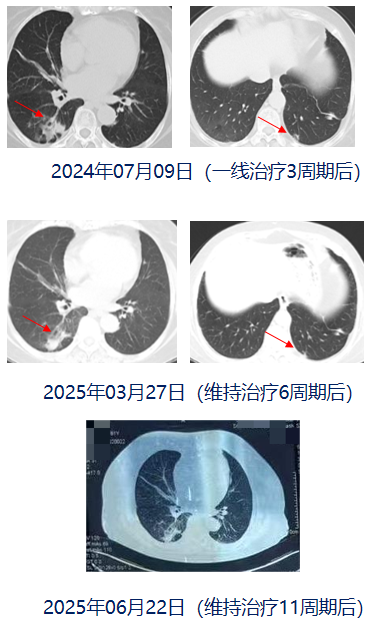
胸部CT(2024年07月09日,3周期后):右肺下叶背段及后基底段结节最大径约2.8x2.5cm,其边缘囊腔大小约3.7x2.6cm,较前肿块缩小,实性成分减少;左肺下叶病灶同前;双肺散在结节影最大径约1.0cm,较前缩小、密度减低。纵隔及双肺门肿大淋巴结影,较大者短经约1.0cm,考虑转移,较前缩小。
彩超(2024年07月09日,3周期后):右颈IV区淋巴结肿大,大小约0.88x0.64cm,考虑转移,较前缩小。
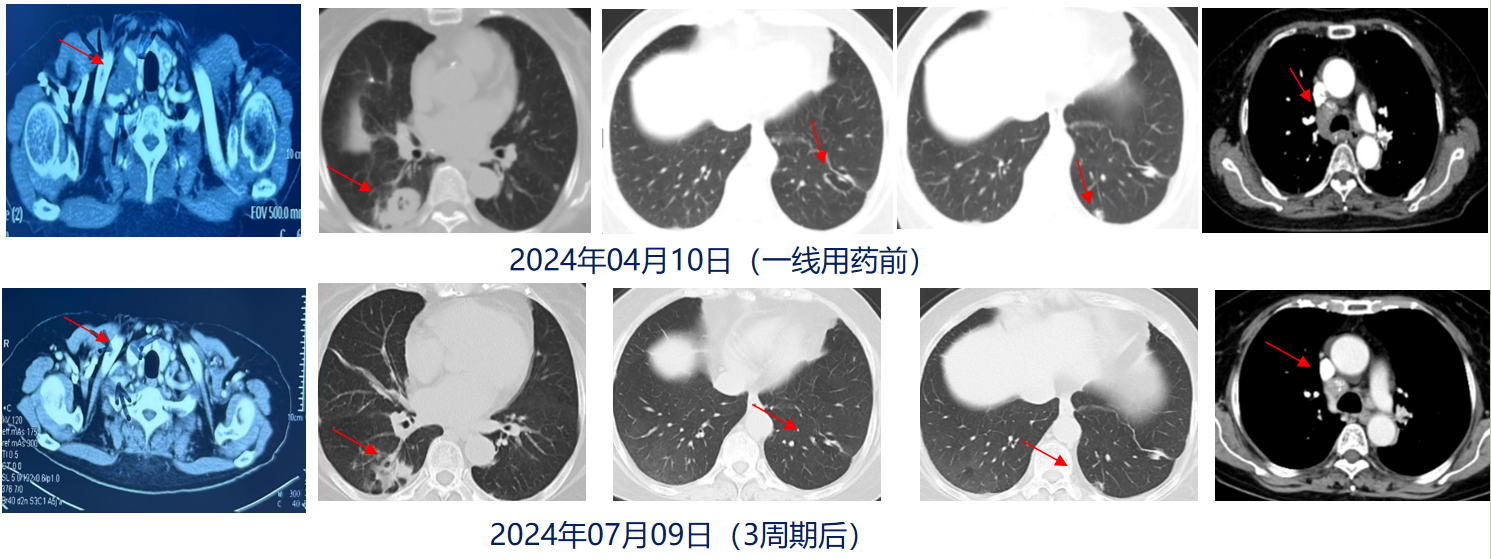
一线维持治疗:2024年08月20日-2025年7月22日:舒格利单抗1200mg x12周期维持治疗。
疗效评价:维持治疗6周期,后于当地医院规律用药并定期复查,疗效评价为PR基础上疾病稳定(SD)。
胸部CT(2025年03月27日,维持治疗6周期后):右肺下叶背段及后基底段见结节影最大径约2.5x1.5cm,其边缘见囊腔样大小约4.1x2.6cm,较前肿块缩小,实性成分减少,囊腔增大;左肺下叶病灶同前;双肺散在结节影,最大径约1.0cm,考虑转移,部分较前缩小、密度减低。纵隔及双肺门可见大淋巴结影较大者短经约1.0cm,考虑转移,较前变化不大。
彩超(2025年03月27日,维持治疗6周期后):右颈IV区淋巴结肿大,大小约0.509x0.412cm,密切观察。
胸部CT(2025年06月22日,维持治疗11周期后):右肺下叶囊腔样大小约3.8x3.0x2.8cm,余同前。
综合内科一病区/乳腺内科病区
中国医学科学院肿瘤医院山西医院/山西省肿瘤医院
主任医师
山西省肿瘤医院综合内科一病区/乳腺内科病区主任
专家点评
肺癌是全球癌症相关死亡的主要原因,造成了极大的社会负担。最近十几年,免疫治疗为肺癌治疗领域带来了革命性突破,显著延长了患者的生存期。其中以舒格利单抗为代表的免疫检查点抑制剂,因其具有双重抗肿瘤机制而取得了良好的抗肿瘤活性[3]。其一是通过抗体Fab段结合肿瘤细胞表面的PD-L1,阻断PD-1/PD-L1信号通路,增强T细胞的抗肿瘤活性。其二是通过抗体Fc段与巨噬细胞表面的FcγR结合,激发抗体依赖的细胞介导吞噬作用(ADCP),诱导巨噬细胞进一步杀伤肿瘤,最终带来了更强免疫疗效[3]。
III期临床试验GEMSTONE-302研究有力印证了其疗效及安全性,为此类患者应用提供了循证医学证据。其中期分析结果显示[1],舒格利单抗联合化疗可延长晚期非鳞状NSCLC患者的生存期,中位总生存期(OS)达26.9个月,优于对照组的19.8个月。其4年随访结果显示[2],在非鳞状NSCLC中,舒格利单抗联合化疗组4年OS率达35.5%,较对照组的20.2%提升15.3%。另外,值得关注的是,舒格利单抗联合化疗在不同的肿瘤PD−L1表达水平亚组中,OS数据表现出一致性[2]。即使在PD−L1表达水平<1%的患者亚组中,舒格利单抗联合化疗组4年OS率达23.2%,较对照组的16.6%仍有获益趋势。综上所述,舒格利单抗为驱动基因阴性和非鳞癌患者带来了长期生存的希望。
而“血管—免疫交联”这一策略在治疗肿瘤的过程中形成了一个正反馈循环,通过使用免疫检查点抑制剂激活T细胞,再运用抗血管生成药物使肿瘤血管正常化,从而导致免疫抑制的肿瘤微环境进入免疫支持的状态,又会促进血管和肿瘤微环境重塑,提高了肿瘤内效应T细胞的浸润,最终产生长期的治疗效果,达到抑制肿瘤生长的目的。
本例患者特点:
1)肺腺癌,晚期多发转移,不适合局部治疗,无法治愈,治疗目标为应用系统治疗控制病情发展、提高生活质量、延长生存期。
2)无敏感驱动基因突变,PD-LI表达阴性,TMB高表达,标准一线治疗为含铂双药化疗±贝伐珠单抗±免疫治疗。
3)患者81岁高龄,难以耐受化疗。结合患者自身特点及本人与家属意愿,一线选择免疫联合抗血管生成药物的去化疗方案个体化治疗。
一线选择免疫检查点抑制剂联合抗血管生成药物治疗,具备理论基础。抗血管生成药物可以促进肿瘤血管正常化,促进肿瘤组织中免疫细胞浸润,同时促进其他药物在肿瘤组织中的分布,进而提高免疫、化疗、靶向治疗疗效。本案例最终表现出良好的疗效和可控的安全性。病灶快速缓解,疗效达到PR,后期应用单药舒格利单抗维持治疗,疗效持久,目前整体PFS>13个月,且安全性好,生存质量高,在整个治疗期间,全程未报告免疫相关不良反应。这一成功的临床实际案例,或可为此类高龄肺腺癌患者提供治疗新思路。
[1] Zhou C, Wang Z, Sun M, et al. 1318P Four-year outcomes from GEMSTONE-302 study: First-line sugemalimab plus platinum-based chemotherapy in metastatic non-small cell lung cancer (NSCLC). Ann Oncol. 2024;35:S839.
[2] Zhou C, Wang Z, Sun M, et al. Interim survival analysis of the randomized phase III GEMSTONE-302 trial: sugemalimab or placebo plus chemotherapy as first-line treatment for metastatic NSCLC. Nat Cancer. 2023;4(6):860-871. doi:10.1038/s43018-023-00578-z
[3] Gül N, van Egmond M. Antibody-Dependent Phagocytosis of Tumor Cells by Macrophages: A Potent Effector Mechanism of Monoclonal Antibody Therapy of Cancer. Cancer Res. 2015;75(23):5008-5013. doi:10.1158/0008-5472.CAN-15-1330.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


