Keynote-689研究最早是在今年的AACR年会上公布结果,全文发表于《新英格兰医学杂志》。
《新英格兰医学杂志》同期发表了关于Keynote-689研究的评论。
在这篇评论中,作者探讨了很多问题,比如“随着治疗的延长,时间、经济、毒性也增加”、“哪些患者需要17个周期的免疫治疗,哪些患者可以减少治疗量”、“围术期免疫治疗的获益究竟是来自术前的给药还是术后的给药”,等等……
所以我们可以发现,这些老生常谈的问题,直至今天仍然被大家关注、仍然没有答案、仍然值得探讨;而且很关键的一点是:不单单是Keynote-689研究中的头颈部肿瘤面临这些问题,事实上整个实体肿瘤的免疫治疗都面临这些问题。
接下来,我将展开讨论这篇评论中提到的几个问题。我想,这些问题,除了头颈部肿瘤学的老师需要关注,其他领域的老师同样可以关注;因为如前所述,大家同样面临这些问题。
今天先讨论其中的第一个问题:围术期免疫治疗应该用多久?
在讨论之前,我们需要先简单回顾一下Keynote-689研究的内容。
本研究的对象为局部晚期、可切除的头颈部鳞状细胞癌患者(HNSCC),包括:①III/IVA期喉部、下咽部或口腔肿瘤 (与p16状态无关) ,②III/IVA期口咽部肿瘤且p16阴性,③III期口咽部肿瘤,p16阳性且肿瘤大小为T4,淋巴结分期为N0至N2。
714例符合条件的患者按1:1随机分为两组:
对照组 接受标准治疗方案,即 直接进行手术治疗,术后高危患者 (切缘阳性(<1mm)或淋巴结胞膜外侵犯) 接受同步放化疗,低危患者接受放疗。
试验组 在标准治疗方案的基础上加用17个周期 (1年) 的帕博利珠单抗,包括术前2个周期、术后放(化)疗期间同时给药3个周期,之后继续治疗12个周期。
研究的主要终点为无事件生存期(EFS),定义为:从随机分组至新辅助治疗阶段出现影像学证实的导致无法手术的疾病进展的时间、或至影像学/活检证实的局部或远处进展或复发的时间、或至死亡的时间。
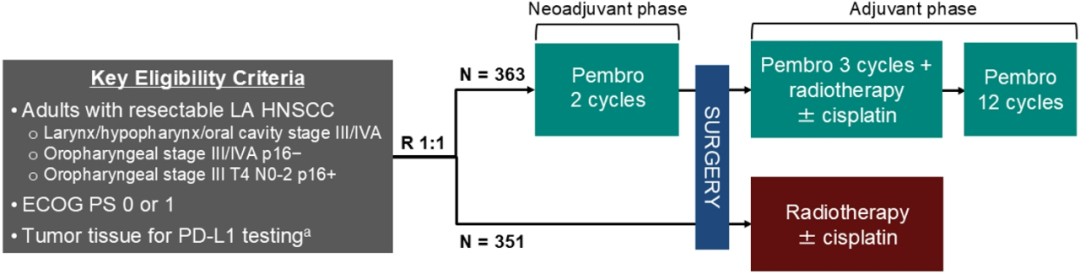
图1.Keynote-689研究的设计
结果:在PD-L1 CPS≥10的人群中、CPS≥1的人群中 和 全人群中,试验组的EFS均取得显著提高,OS也有获益趋势。
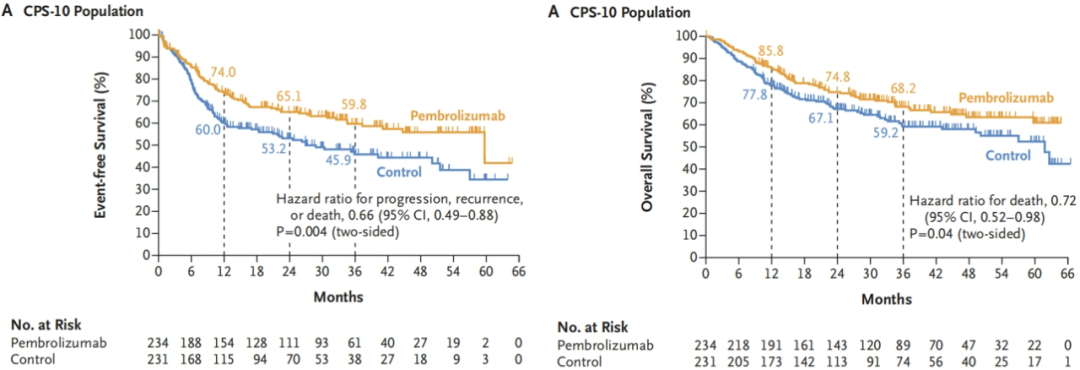
图2.PD-L1 CPS≥10人群的EFS和OS
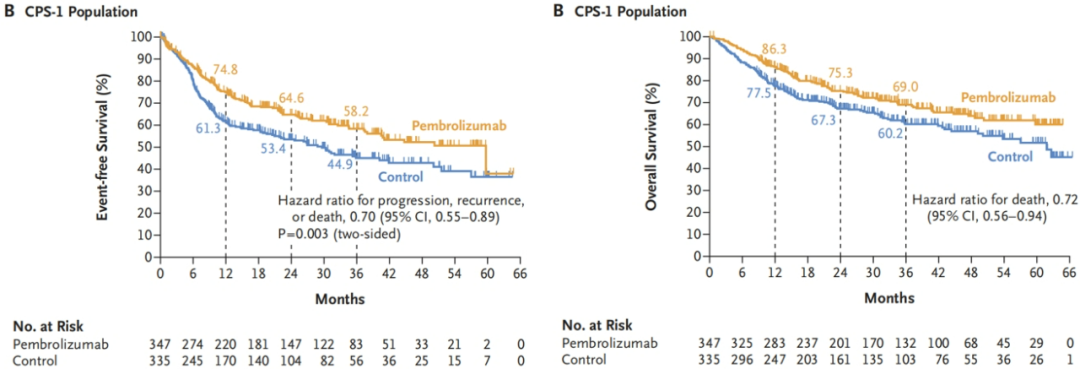
图3.PD-L1 CPS≥1人群的EFS和OS
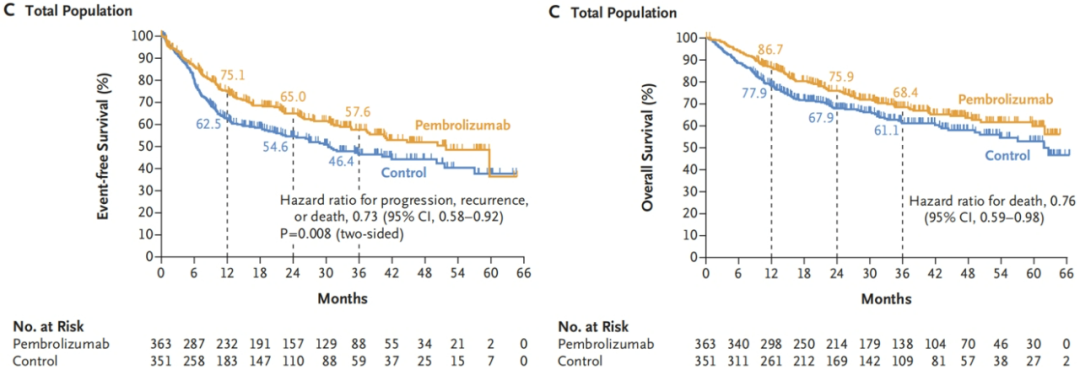
图4.全人群的EFS和OS
好。现在我们来讨论一下今天的话题:围术期免疫治疗应该用多久?
这个问题应该是这篇评论中最主要、最重要的问题。在这篇评论中,作者前后3次提到了相同的内容:
研究者评估了长达 17 个周期的免疫疗法,涉及巨大的经济成本、受试者及支持团队的时间投入,以及所有三个治疗环节 (新辅助、术后放疗期间和放疗后) 增加的毒性。 (原文: The investigators evaluated immunotherapy for 17 cycles involving great financial cost, time spent by participants and support teams, and added toxicity across all three components of treatment (neoadjuvant and postoperatively during and after radiotherapy).)
这项重要的 KEYNOTE-689 试验为我们的治疗手段增添了一种新的选择,尽管代价巨大(就患者和护理支持团队的时间投入、毒性以及经济支持而言)。 (原文:this important KEYNOTE-689 trial adds to our arsenal a new treatment option, albeit at substantial cost (in terms of time investment for patients and care support teams, toxicity, and financial support).)
尽管当前试验在改善无事件生存方面取得了实质性进展,但它也指出了增加的治疗相关成本、治疗持续时间和毒性。 (原文:Even as the current trial makes substantial progress in improving event-free survival, it also points to increased treatment-related cost, duration of treatment, and toxicity.)
我在之前讲课的时候也讲过:理论上而言,药并不是用的越久越好;用的越久,累积的AE风险就越大,耐药率也会越高。
所以这就涉及到一个问题:免疫治疗应该用多久?什么时候停药?
正如我之前讲课的时候所说:这是所有肿瘤免疫治疗面临的一个共同问题,这个问题自免疫治疗诞生以来就一直存在、且到目前为止都没有确切答案。
2024年11月,中山大学肿瘤防治中心胸科 傅剑华教授团队 在《柳叶刀》上发表了一篇关于食管癌的综述 (参考文献:Lancet. 2024 Nov 16;404(10466):1991-2005) ,里面总结了食管癌领域有待进一步探索的一些问题,其中就包括了:对于经新辅助治疗和手术后达到病理完全反应的患者,最佳治疗方案是什么?是应该进行观察还是辅助免疫治疗?
辅助免疫治疗在手术后应持续多长时间?
在根治性放化疗中加用1年或更长的免疫治疗能否改善疾病控制?

图5.《柳叶刀》食管癌综述
2024年5月,广东省人民医院 吴一龙教授团队 在《Cancer Cell》发表一篇关于可切除非小细胞肺癌免疫治疗的综述 (参考文献:Cancer Cell. 2024 May 13;42(5):727-731) ,里面也专门讨论了一个问题:
新辅助或/和辅助治疗阶段免疫治疗的最佳疗程是多少? (原文:What is the optimal duration of neoadjuvant or/and adjuvant phase?)
文章中写道:
尽管免疫治疗代表了可切除非小细胞肺癌(NSCLC)领域一个充满希望的突破性进展,但其具体疗程时长仍未明确。 (原文:Despite immunotherapy representing a hopeful breaking point for resectable NSCLC, the specific duration remains unclear.)
对于辅助治疗阶段,同样尚无定论。 (原文:As for the adjuvant phase, there are no definite answers either.)
关于免疫治疗应该用多久的问题,正如我之前讲课的时候所说的:这绝不是拍脑袋想的半年、一年或两年,每个患者的实际情况都不一样,有的患者肿瘤直径可能是2cm、有的可能是4cm,有的患者术后达到了pCR、有的可能没有达到pCR,所以你不可能要求不同病情的患者在相同的时间内停药,而应该个性化治疗。
事实上,NEJM上的这篇评论和我是一样的观点;在文章中,作者没有直接提到免疫治疗应该用多久的问题,而是这么说的:
展望未来,确定哪些患者需要全部17个周期治疗,而哪些患者需要减少治疗量,这将非常重要。 (原文:Moving forward, it will be important to identify those patients who need all 17 cycles as compared with those who need substantially less therapy.)
是吧,作者的观点也是个性化治疗,并不强调所有患者一样地缩短治疗疗程;而是探索什么样的患者可以缩短治疗。
从我的角度来说,这个个性化治疗的本质是探索免疫治疗的停药标准;当达到这样的标准,就可以考虑停药。有的患者可能治疗3个月后就能达到这个停药标准,而有的患者可能需要持续治疗半年或一年才能达到这个停药标准;这就是前面所说的,病情不一样,治疗的持续时间可能就不一样。
那么,这个停药标准,可能是什么?
我想,我们要从免疫治疗的机制本质上找答案。
免疫治疗发挥疗效的最关键一个步骤在于:需要患者体内存在免疫细胞可识别的肿瘤抗原,才能激活免疫细胞,才能发挥抗肿瘤活性。也正是免疫循环中的第一个和第二个环节:
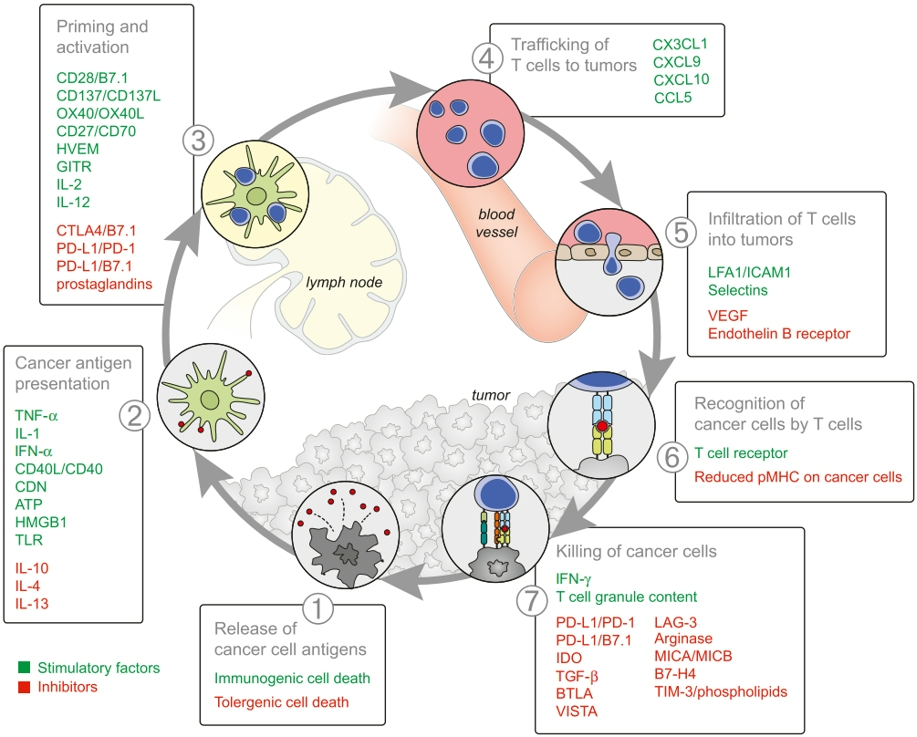
图6.免疫循环
如果患者体内没有可识别的肿瘤抗原,那免疫就起不了作用,那用或不用免疫检查点抑制剂也就基本一样了。
所以,关于免疫治疗的停药标准,可能是一直用、用到体内没有可识别的肿瘤抗原时,就可以考虑停药了。
那,如何判断体内有没有肿瘤抗原?
我想,分两个方面,一个是宏观的,一个是微观的。
宏观的,很好理解:复查时影像学证实了完全缓解,从影像学上找不到任何病灶。
但是因为CT或MRI都有一定的分辨率,微小的病灶可能不一定能看出来;所以还要结合微观的指标。
术后的病理检查,从显微镜底下证明了完全缓解,这是其中一个微观的指标;如果不是围术期的患者,那么,类似内膜癌的刮宫、食管癌/胃癌的胃镜、肠癌的肠镜等等,能取到组织活检的情况下,pCR都可以作为一个停药的微观指标。
除了病理,外周血的肿瘤标志物也是一个指标,比如宫颈鳞癌的SCC、肝癌的AFP,等等。
除此之外,外周循环中的肿瘤DNA(ctDNA)可能也是一个非常重要的指标;此处不得不再讲一下IMvigor010研究。
IMvigor010研究是关于阿替利珠单抗用于辅助治疗术后高复发风险的肌层浸润性尿路上皮癌的三期研究,结果显示:对于术后高复发风险的肌层浸润性尿路上皮癌患者,与术后随访观察相比,加用阿替利珠单抗辅助治疗后并不能改善DFS和OS,且经亚组分析,无论是PD-L1阳性还是阴性、高表达还是低表达,阿替利珠单抗均不能带来生存获益。 (参考文献:Lancet Oncol. 2021 Apr;22(4):525-537. )
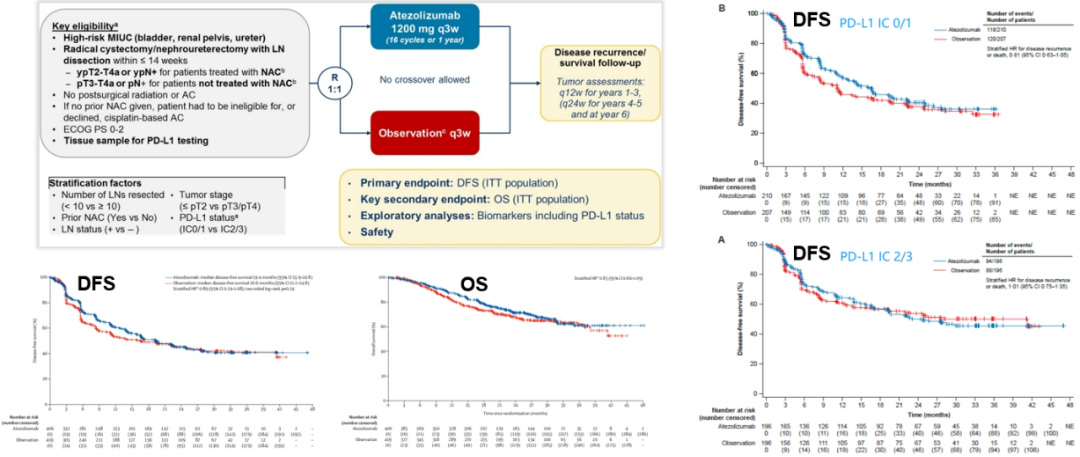
图7.IMvigor010研究的主要结果
而在探索性分析中:对于术后ctDNA阳性患者,阿替利珠单抗辅助治疗可明显改善DFS和OS;对于ctDNA(-)患者,试验组和对照组的预后无差异。 (参考文献:Nature. 2021 Jul;595(7867):432-437.)
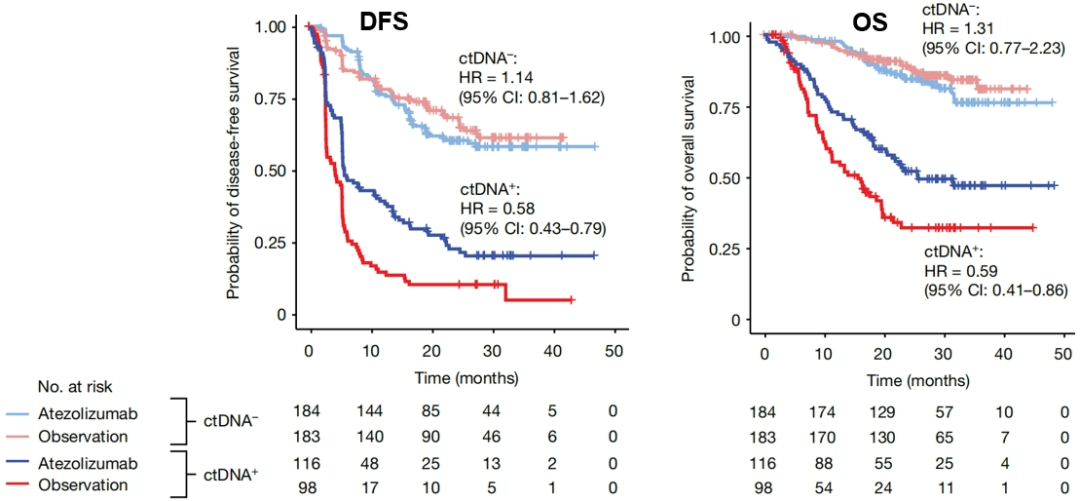
图8.IMvigor010研究的探索性分析结果
所以,ctDNA阳性可能意味着体内有免疫可识别的肿瘤抗原,ctDNA阴性可能意味着体内没有可识别的肿瘤抗原。
在上述提到的吴一龙教授团队发表的那篇综述中,作者这么写:
由于最佳疗程时长仍未明确,我们当前需要聚焦于如何评估新辅助免疫化疗的治疗反应,并及时识别出那些注定会复发的患者,以避免治疗不足或过度治疗。我们认为,循环肿瘤DNA (ctDNA) 微小残留病 (MRD) 分析代表了最有前景的手段。 (原文:As the optimal duration remains unknown, we now need to focus on how to acknowledge treatment responses to neoadjuvant immunochemotherapy and identify patients who are destined to recur in time to avoid undertreatment or overtreatment. We consider circulating tumor DNA (ctDNA) minimal residual disease (MRD) analysis represents the most promising way.)
综上,免疫治疗可能的一个停药标准是:同时满足影像学上的完全缓解 且 血清标志物阴性 且 ctDNA阴性;在可获取组织活检的情况下,需同时满足病理完全缓解(pCR)。当同时满足这些条件时,我个人认为患者体内应该是没有可识别的肿瘤抗原,此时继续使用免疫的获益可能不会太大。
回到NEJM上的这篇评论文章,作者的观点和我们是一致的。作者写道:
后续的术后治疗是否应基于影像学和病理学反应或循环肿瘤标志物进行调整? (原文:Should subsequent postoperative treatment be adapted on the basis of radiographic and pathological response or circulating tumor markers?)
总结今天的内容:
关于免疫治疗应该用多久的问题,至今仍没有答案、但至今仍备受关注。
理论上而言,药用的越久,需要花费的时间、经济成本都会增加,累积的毒性风险和耐药风险也会增加。
因为每个患者的情况都不一样,所以治疗疗程绝不是千篇一律、统一的一口价 半年、一年或两年;我们需要做的是探索一个可能可行的停药标准,基于这个停药标准进行个体化治疗。
这个可能的停药标准或许可以考虑为:需要同时满足影像学上的完全缓解 且 血清标志物阴性 且 ctDNA阴性;在可获取组织活检的情况下,需同时满足病理完全缓解(pCR)。当同时满足这些条件时,可以认为患者体内没有可识别的肿瘤抗原,此时继续使用免疫的获益可能不会太大。
鉴于目前暂无充分的循证医学证据,这个停药标准只能在临床试验中探索,绝不建议在临床实践中直接应用。
今天的内容就到此,后续继续讨论NEJM上这篇评论文章中提到的与免疫治疗有关的其他问题,请保持关注。











 苏公网安备32059002004080号
苏公网安备32059002004080号


