如今,三代EGFR-TKI已经成为EGFR突变阳性晚期非小细胞肺癌(NSCLC)治疗的基石,但患者的耐药问题仍然难以避免。明确耐药机制是制定一线联合方案或后线治疗方案,为患者延长生存获益的前提。近年来,研究者正在深入探索三代EGFR-TKI的耐药机制,以及导致患者预后变差的分子特征。
神经调节蛋白1(NRG1)是神经调节蛋白家族中的主要成员。NRG1可通过参与调控PI3K-AKT、MAPK等信号通路,促进细胞生长、存活和增殖。一些研究指出,涉及NRG1基因的特定基因异常可能是肺腺癌或其他实体瘤的潜在驱动基因,但缺少更多的资料。近期发表的一项研究[1],在一个接受全基因组分析(CGP)的晚期 NSCLC 患者的大型队列中进行了回顾性分析,评估了NRG1的流行病学特征与其在接受三代EGFR-TKI奥希替尼治疗的患者中的预后价值。
研究设计
这项研究(NCT06020625)纳入了意大利Agostino Gemelli大学综合医院基金会 IRCCS FPG500项目的肺癌队列数据,对其中2022年1月至2024年10月期间的患者进行了回顾性分析。所有患者均经组织学确诊为IV期NSCLC(AJCC 8th),研究者使用电子病例报告表收集了所有的临床和分子数据。临床和人口统计学数据包括性别、诊断时年龄、吸烟习惯、肿瘤病理特征和转移部位数量。记录治疗史则包括诊断日期、接受治疗方案、进展日期和生存状态等信息。此外,研究者对组织样本进行分析和测序,评估肿瘤细胞(TC)比例。
研究结果
临床特征和分子图谱
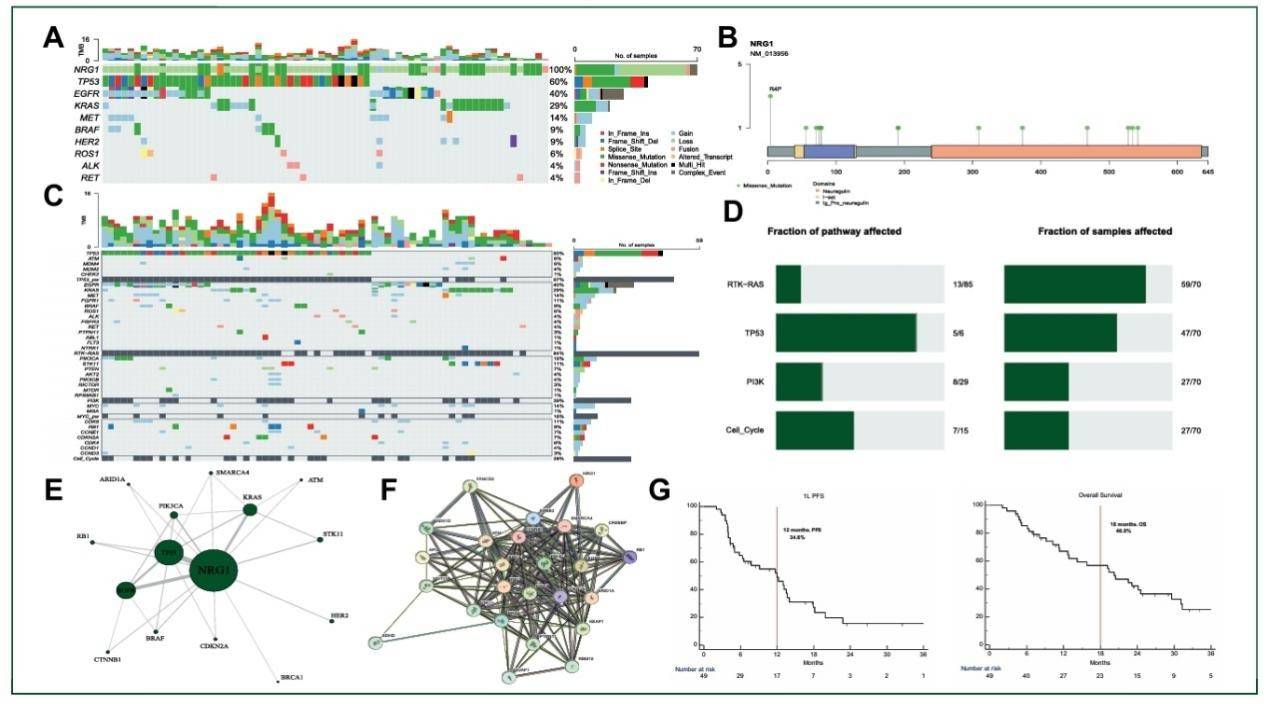
截至数据截止日期(2024年10月31日),研究共回顾性纳入了878例转移性NSCLC患者。其中,在70个样本(8.0%)中发现了NRG1基因中任何形式的改变。NRG1突变患者中男性和女性各占一半(50%),中位年龄为69岁,最常见的组织学类型为腺癌(88.7%),并且有吸烟史的患者占多数(67.1%)。NRG1 改变的存在与更高的疾病负荷有关,有22例患者(31.4%)的转移部位超过3个(中位转移部位=2.1)。
70例NRG1突变患者中发现了68个NRG1意义不明变异(VUS),包括45个缺失(64.2%)、23个序列变异(单核苷酸变异,SNVs)(32.7%)和2个扩增(2.9%)。值得一提的是,2例患者(2.9%)存在NRG1融合,均为SLC3A2–NRG1融合。4例患者(5.8%)存在NRG1双打击变异(1个缺失+1个序列变异)。
值得关注的是,40例NRG1突变患者(57.1%)存在1个驱动基因改变(AGA),包括19个EGFR突变(19del:6例,L858R:10例,20ins:3例)、2个HER2突变、12个KRAS突变(包括7个KRAS G12c)和6个基因融合(2个ROS-1、2个RET、2个ALK)以及1个MET外显子14跳跃突变。NRG1异常在肿瘤突变负荷(TMB)高(>10 mut/Mb)和低(<10 mut/Mb)人群之间分布均匀,且在53个肿瘤样本(75.8%)中PD-L1表达(TPS≥1%)。研究队列中,NRG1异常与调节RTK/KRAS通路的关键基因突变在59个样本(84%)中共存,与TP53通路在47个样本(67%)中共存,与PI3K通路在27个样本(39%)中共存,与细胞周期调节基因在27个样本(39%)中共存。
在NRG1 VUS共存图中,研究观察到两个主要的共存亚网络:一个包含EGFR-TP53-PIK3CA,另一个包含KRAS-STK11。研究者指出,队列中25个最常突变基因的相互作用网络中,NRG1与中心枢纽如ERBB2和EGFR相连,支持其作为RTK信号通路调节因子的假设。
总体人群的生存分析
根据临床评估,只有49例携带NRG1 VUS的患者(70.0%)因疾病负荷较高和临床状况交叉而符合至少接受一线晚期系统治疗的条件。总体而言,21例患者接受了一线靶向治疗,24例患者接受了一线免疫治疗(8例免疫单药治疗,16例免疫联合化疗)或单独化疗(4例患者)。在这组具有较高异质性的人群中,一线中位无进展生存期(PFS)为11.99个月(95% CI 6.35-13.63个月),12个月PFS率为34.6%,中位总生存期(OS)为20.26个月(95% CI 12.87-29.59个月),18个月OS率为46.9%。
对关键分子变异亚组(PD-L1表达、NRG1 VUS类型、PD-L1表达、TMB和TP53状态)进行的探索性分析未显示出统计学意义。
NRG1共突变在EGFR突变NSCLC中的预后作用
考虑到NRG1在生物学上参与ERBB信号传导,且研究中发现NRG1与EGFR共突变的发生率较高,因此,研究者对携带EGFR敏感突变(EGFR M+)并接受一线奥希替尼(每天80 mg,口服)治疗的患者队列中NRG1 VUS的预后作用进行了探索性单变量和多变量Cox回归分析。
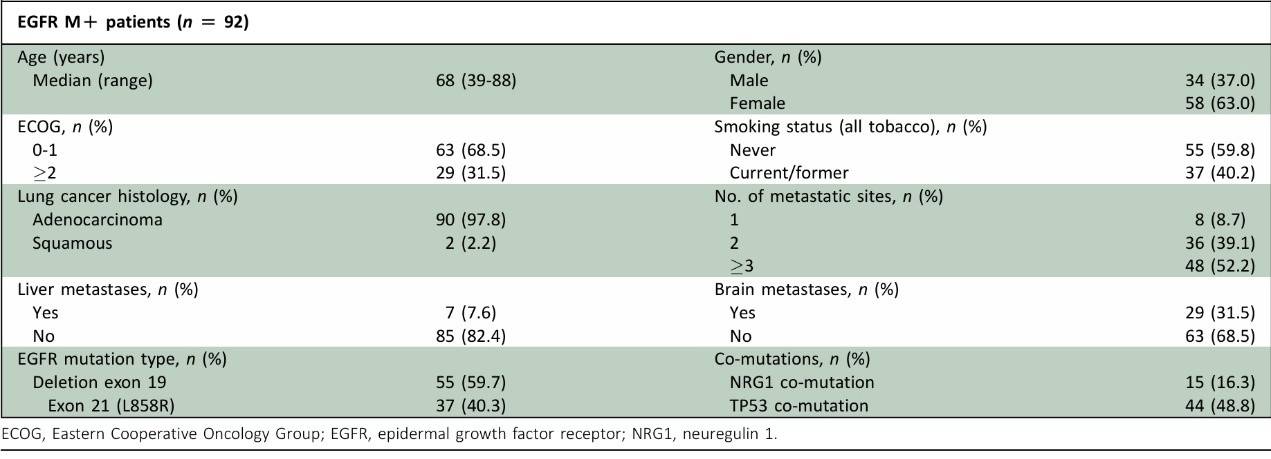
在878例接受了CGP的患者中,107例患者存在EGFR突变(12.2%),包括92例EGFR M+患者。其中,在18个样本中检测到了NRG1共突变(NRG1 M+),而在44个样本中检测到了TP53共突变。
在中位随访19.66个月后,43例EGFR M+患者经历了疾病进展(46.7%),34例患者死亡(34.78%)。中位PFS为25.55个月(95% CI 16.54-29.98个月),中位OS为30.71个月(95% CI 24.10-40.34个月)。
在亚组单变量分析中,临床变量如吸烟史和肝脏转移的存在被证实与预后不良相关,而基线脑转移与生存结果无统计学显著相关性。
19del患者对比L858R患者的PFS[29.98个月 vs. 13.61个月(HR 0.47,95% CI 0.25-0.88,P = 0.0098)]和OS[40.34个月vs. 24.85个月(HR 0.45,95% CI 0.17-0.73,P = 0.0035)]的预后更好。
而在EGFR M+患者中,存在TP53共突变患者的PFS[29.98个月 vs. 18.28个月(HR 0.58,95% CI 0.31-1.08,P = 0.0624)]和OS[NR vs. 24.62个月(HR 0.55,95% CI 0.271-1.12,P = 0.0900)]更短,但该结果未达到统计学意义的显著性。
值得关注的是,对比EGFRM+/NRG1 M+患者,EGFRM+/NRG1-wt患者的PFS和OS更长[中位PFS:26.07个月 vs. 12.07个月(HR 0.34,95% CI 0.12-0.95,P = 0.0015);中位OS:34.06个月 vs. 20.45个月(HR 0.45,95% CI 0.22-0.93,P = 0.0230)]。
研究者指出,NRG1突变状态是唯一一个对PFS具有显著预后价值(P = 0.0104)的分子变量,并且对OS达到了边缘显著关联(P = 0.0719)。在包括关键临床变量和基因组不稳定性标志物的敏感性分析中,结果保持一致。
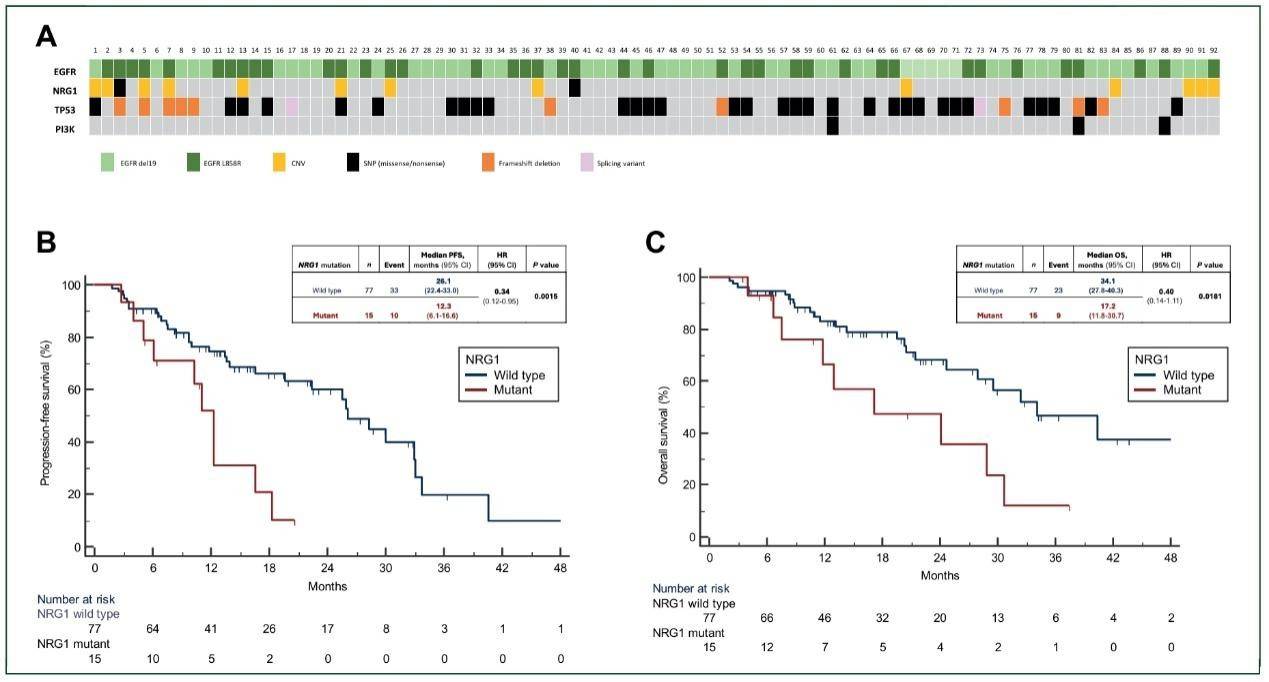
表1. EGFR M+队列情况
讨论与结论
NRG1融合可能是多种实体瘤中的驱动基因,然而其基因异常较为少见,且可能与其他已知的驱动基因共同发生,特别是KRAS和EGFR突变。本次回顾性研究中,研究者对NRG1 VUS进行了全面分析,探索了其在癌症中的生物学作用,并评估了NRG1异常在接受奥希替尼治疗的EGFR突变晚期NSCLC患者中的预后价值,指出NRG1 VUS在EGFR M+患者中的共突变可能显著影响靶向治疗结局。对比EGFR M+/NRG1wt患者,EGFR M+/NRG1 M+患者的PFS(12.07个月 vs. 26.07个月)和OS(20.45个月 vs. 34.06个月)显著较短,该结果同样在多变量分析中得到证实。
当然,研究存在一定局限性,包括对于NRG1 VUS的生物学作用评估探索不够深入,未在动物模型中进行验证等。敏感性分析也未能与更常见的分子学异常(如TMB和TP53共突变)达到统计学相关性,从而更有力地证明NRG1基因组改变可能独立地导致更差的预后。研究者指出,目前在EGFR M+患者一线治疗的格局中,尚无普遍接受的指导治疗方案选择(如EGFR-TKI单药、EGFR-TKI联合化疗)的生物标志物,对NRG1异常的深入探索或将对该问题提供更多参考,指导个体化的治疗决策。同时,NRG1改变也可能作为可靶向的潜在治疗靶点。
总之,研究者指出,这项研究深入评估了NRG1 VUS在NSCLC患者中的流行病学数据和生物学功能,并初步显示了NRG1或可作为接受一线奥希替尼治疗患者生存结果的独立不良预后因素。未来针对NRG1的更深入探索,或许可为NSCLC的个体化治疗打下深厚的基础。
[1] Vita E, et al. Network analysis of NRG1 variants of uncertain significance (VUSes) in advanced non-small-cell lung cancer and their prognostic role in EGFR-mutant patients treated with first-line osimertinib. ESMO Open. 2025 Aug 29;10(9):105556.
本材料由阿斯利康提供支持,仅供医疗卫生专业人士参考,不可用于推广目的。
审批编号:CN-168605
过期日期:2025-12-22
排版编辑:肿瘤资讯-邓文普











 苏公网安备32059002004080号
苏公网安备32059002004080号


