上个月,《新英格兰医学杂志》(NEJM)发表了Keynote-689研究的全文,NEJM同期发表了关于Keynote-689研究的评论。
在这篇评论文章中,作者探讨了很多问题,比如“随着治疗的延长,时间、经济、毒性也增加”、“哪些患者需要17个周期的免疫治疗,哪些患者可以减少治疗量”、“围术期免疫治疗的获益究竟是来自术前的给药还是术后的给药”,等等……
这些问题同样困扰着其他肿瘤的免疫治疗,同样值得其他肿瘤领域的老师们关注。
在上一篇文章中,我们已经详细介绍了Keynote-689研究的内容,也详细分析了这篇评论文章中提出的第一个问题“围术期免疫治疗应该用多久?”,详情链接: NEJM评论Keynote-689研究的第一个问题:围术期免疫治疗应该用多久?
今天,我们继续探讨这篇评论文章中提出的第二个问题: 围术期免疫治疗的疗效,是来自术前的给药还是术后的给药?
围术期免疫治疗的模式有三种:①只在术前用免疫、术后不用 (新辅助治疗,如CheckMate-816) ,②术前不用免疫,只在术后用 (辅助治疗,如CheckMate-577) ,③术前和术后都使用免疫 (新辅助-辅助治疗,如CheckMate-77T) 。
在NEJM的这篇评论文章中,作者写道:
鉴于先前评估同步和辅助免疫治疗的试验结果为阴性,因此我们不知道具体是哪个环节驱动了无事件生存的获益。是否仅2个周期的新辅助帕博利珠单抗就能驱动这一阳性结果?因为它是在肿瘤和淋巴结病灶仍在原位时给药,由此可能产生抗肿瘤免疫。 (原文: Thus, we do not know which specific component is driving the observed eventfree survival benefit, given that the results of previous trials evaluating concomitant and adjuvant immunotherapy treatment segments were negative. Do 2 cycles of neoadjuvant pembrolizumab drive this positive outcome by generating antitumor immunity because they are administered with tumor and nodal disease still in situ?)
事实上,已有多个研究面临同样的问题。
来自于同一个申办方的两项研究,都是关于可切除的非小细胞肺癌:
ADJUVANT BR.31研究显示:术前不用度伐利尤单抗、仅在术后给予度伐利尤单抗辅助治疗,不能改善患者的生存预后;而AEGEAN研究显示:术前和术后都加用度伐利尤单抗后,可以显著改善患者的生存预后。所以,AEGEAN研究的获益究竟是来自于术前的治疗还是术后的治疗?
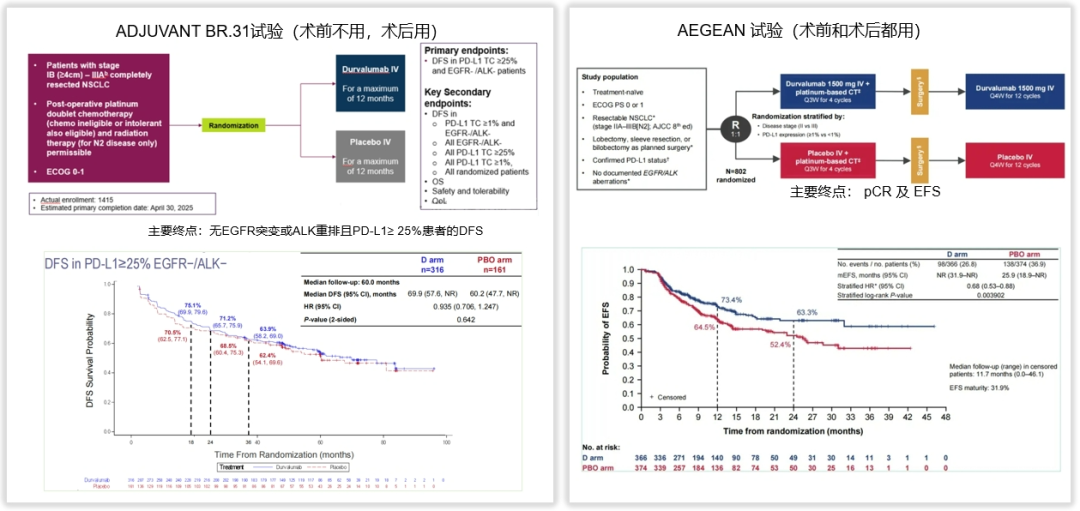
图1.ADJUVANT BR.31研究 和 AEGEAN研究
同样是来自同一个申办方的两项研究,也是关于可切除的非小细胞肺癌:
CheckMate-816研究显示:只在术前用免疫、术后没有用免疫,即可显著改善患者的长期生存预后;而CheckMate-77T研究显示:术前和术后同时使用免疫治疗,也能改善患者的生存预后。所以,CheckMate-77T研究的获益究竟是来自于术前的治疗还是术后的治疗?既然CheckMate-816研究显示了只在术前用免疫就可以获益,那有没有必要继续在术后用免疫?
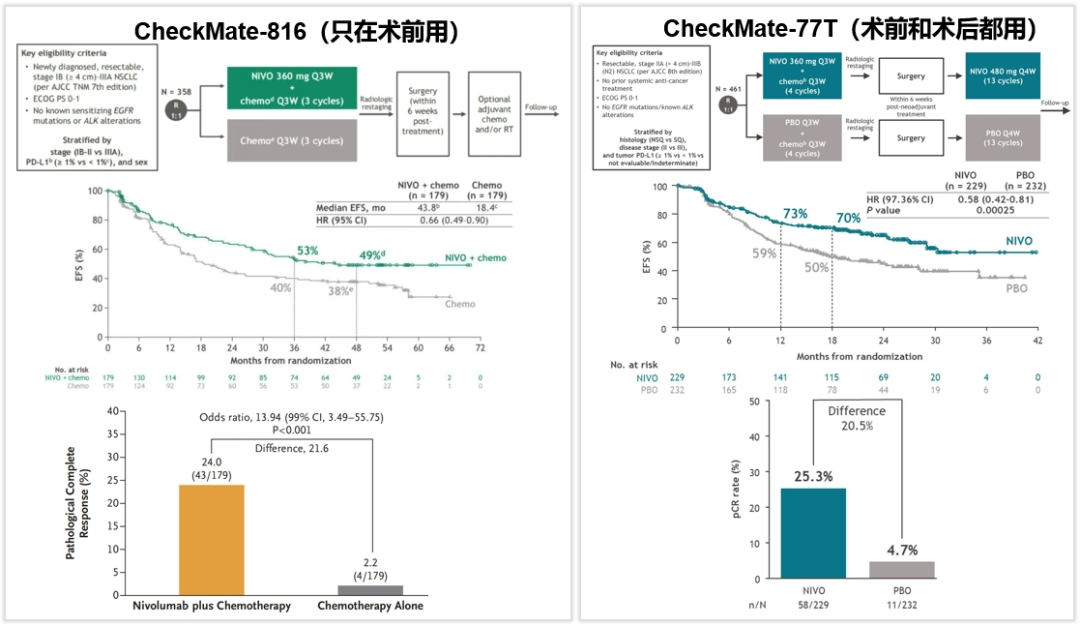
图2.CheckMate-816和CheckMate-77T
我们需要通过一些研究来尝试寻找答案。
动物研究方面:
在一项乳腺癌小鼠模型的实验中,研究发现:与术后的免疫辅助治疗相比,术前的免疫新辅助治疗可以显著提高抗肿瘤疗效;机制方面,术前的新辅助免疫治疗可以显著提高外周血以及脾、肺、肝等器官中CD8+ T细胞的扩增 (参考文献:Cancer Discov. 2016 Dec;6(12):1382-1399) 。
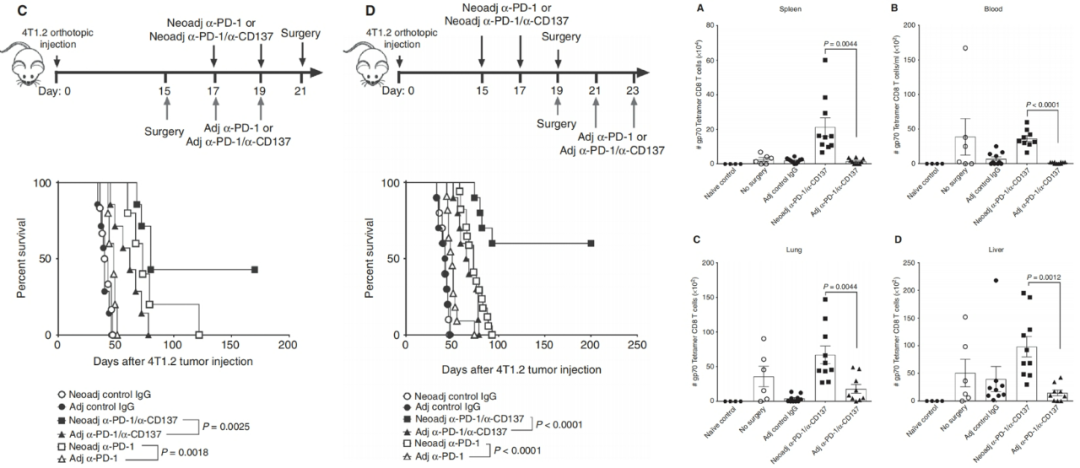
图3.乳腺癌小鼠模型的实验
在另一项头颈部鳞癌小鼠模型的实验中,研究发现:在免疫治疗之前清扫颈部淋巴结,其预后显著更差 (左图) ;同样,颈部大范围(覆盖区域引流淋巴结)、大剂量的放疗会消弱免疫治疗的疗效 (中图) 。
把肿瘤细胞种植在单侧口腔颊粘膜,构建单侧口腔癌模型;该区域的淋巴管仅引流至同侧区域颈部淋巴结。结果:清扫同侧的颈部淋巴结会减弱免疫治疗的疗效;而清扫对侧的颈部淋巴结没有影响免疫疗效。证明了肿瘤引流淋巴结对免疫治疗的重要性 (右图) 。
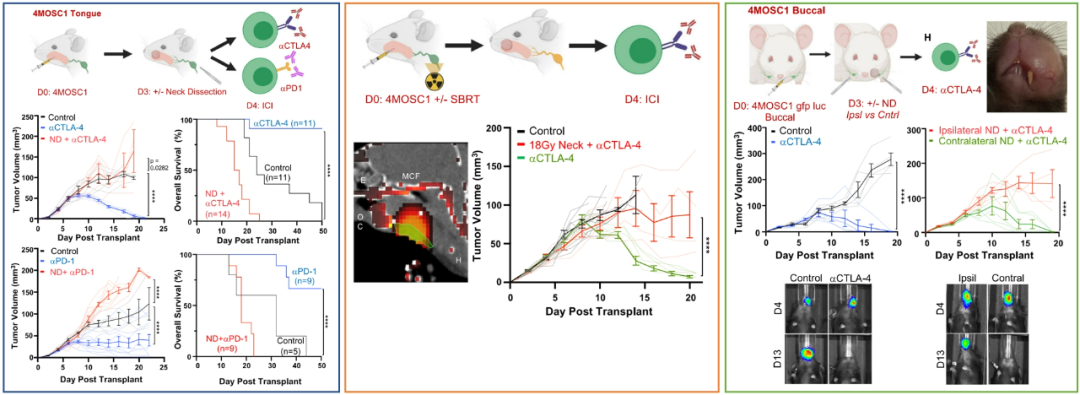
图4.头颈部鳞癌小鼠模型的实验
机制方面:与假手术组相比,颈部淋巴结清扫后肿瘤微环境中CD45-细胞显著增加十倍,而CD8和CD4T细胞则相应减少;免疫抑制性髓系细胞群 (M-MDSCs和M2型巨噬细胞) 过度增殖。同时,抗CTLA-4治疗后:肿瘤引流淋巴结内经典I型树突状细胞 (最有效的抗原呈递细胞) 显著增加;肿瘤引流淋巴结内活化的CD8+细胞和总CD4细胞群显著增值;肿瘤淋巴结内IFN-β表达显著增加,而肿瘤内IFN-β无明显变化。 (参考文献:Nat Commun. 2022 Jul 25;13(1):4298)
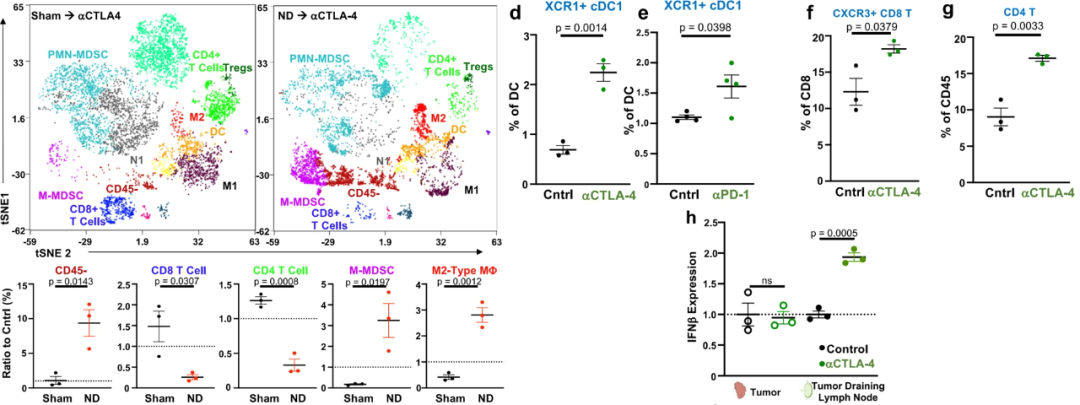
图5.机制研究
临床研究方面:
OpACIN研究是一项前瞻性、小样本的探索性RCT研究,将可切除的黑色素瘤患者随机分为两组:
① 免疫辅助治疗组(10例):先进行手术,术后进行4个周期的纳武利尤单抗+伊匹单抗(O+Y)辅助治疗
② 免疫新辅助治疗组(10例):先进行2个周期的O+Y新辅助治疗,然后手术,术后继续接受2个周期的O+Y辅助治疗
两组接受的免疫治疗的总疗程是一样的,总疗程都是4周期,只是新辅助治疗组是把其中2个周期的免疫治疗提前在手术之前进行。
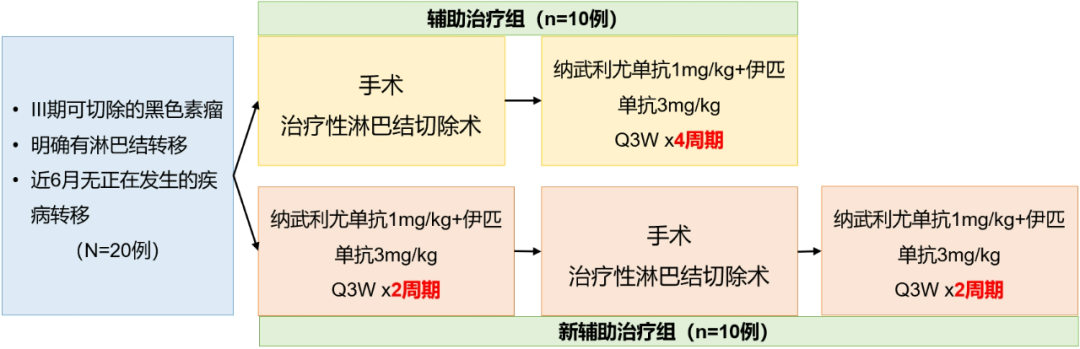
图6.OpACIN研究的设计
尽管样本量很小,但该研究先后发表了3篇顶级期刊论文,可见其意义之重大。 (参考文献:Nat Med. 2018;24(11):1655-1661;Nat Med. 2021;27(2):256-263;Ann Oncol. 2023;34(4):420-430)
结果:新辅助治疗组的5年无复发生存率、5年无事件生存率、5年无远处转移生存率 和 5年总生存率均高于辅助治疗组。基础研究方面:在免疫治疗6周后,新辅助治疗组 肿瘤组织驻留T细胞 显著扩增。
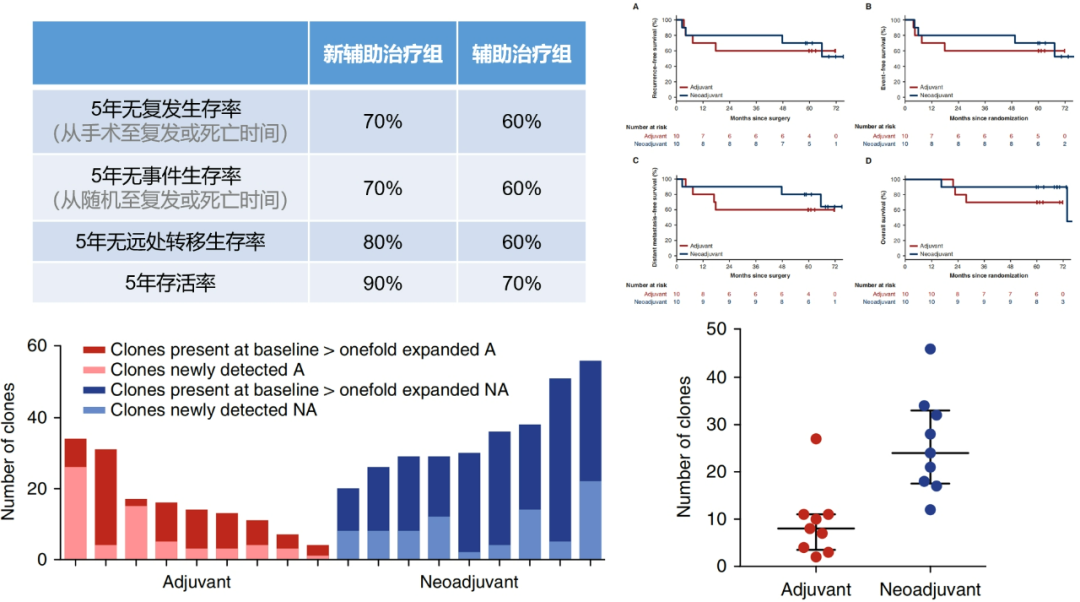
图7.OpACIN研究的结果
当然,小样本研究只能展现一些信号,大三期研究才能真正说明问题。
2023年3月,《新英格兰医学杂志》发表了一项大三期研究。 (参考文献:N Engl J Med. 2023;388(9):813-823)
研究设计上和上述的OpACIN研究很像,将可切除的、可评估的IIIB-IV期黑色素瘤患者随机分为两组:
① 免疫辅助治疗组:先进行手术,术后进行18个周期的帕博利珠单抗辅助治疗
② 免疫新辅助治疗组:先进行3个周期的帕博利珠单抗新辅助治疗,然后手术,术后继续接受15个周期的帕博利珠单抗辅助治疗
两组接受的免疫治疗的总疗程是一样的,总疗程都是18周期,只是新辅助治疗组是把其中3个周期的免疫治疗提前在手术之前进行。
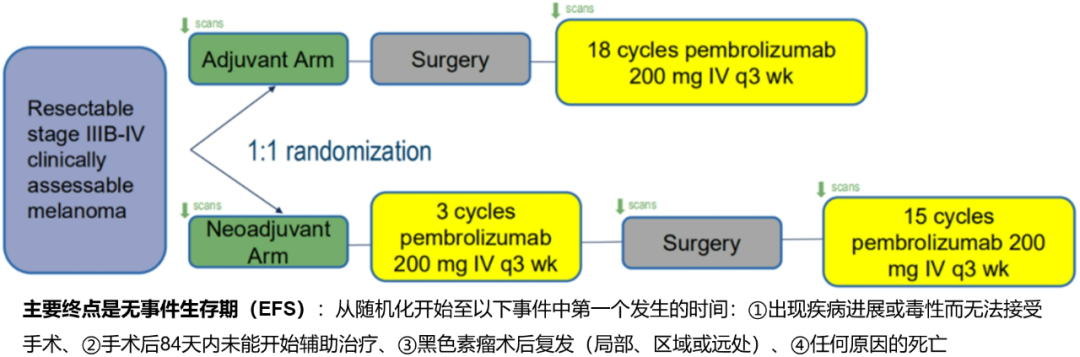
图8.研究设计
结果:免疫新辅助治疗组和免疫辅助治疗组的2年EFS率分别为72% vs 49%;与免疫辅助治疗相比,免疫新辅助治疗可以显著降低患者的不良事件发生率,具有统计学意义 (HR 0.58,95%CI 0.39-0.87,P=0.004) 。
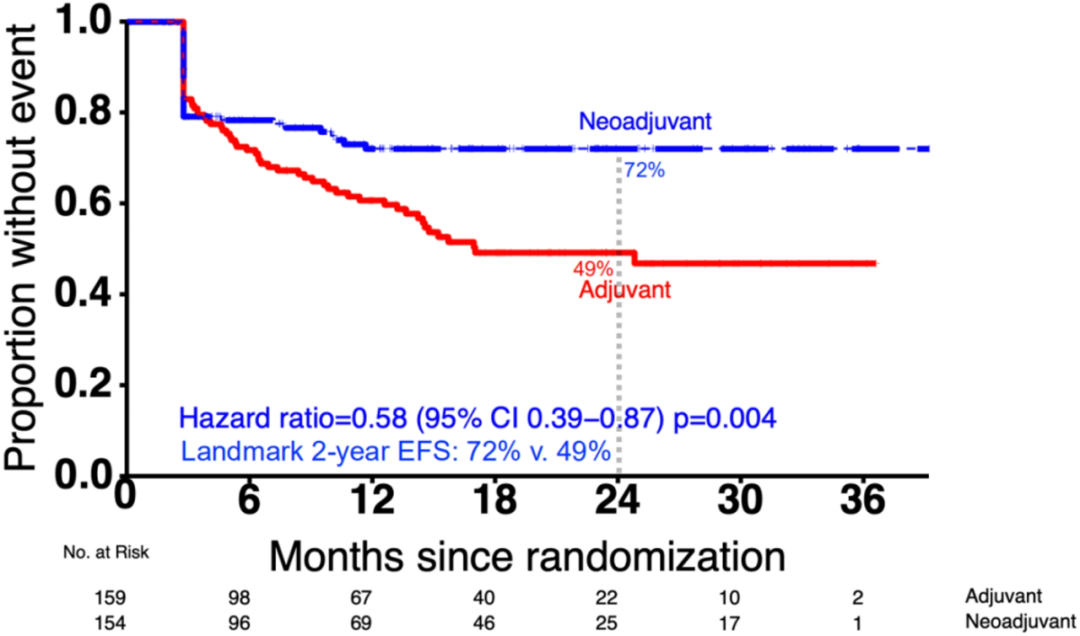
图9.研究结果
这些动物和临床研究均支持术前的新辅助免疫治疗带来的抗肿瘤获益。
在近期的一系列顶刊综述中,大家也都一致地支持新辅助免疫治疗。
去年《Cancer Cell》发表的一篇综述中写道:免疫治疗的成功反应依赖于功能正常且完整的宿主免疫解剖结构——主要是肿瘤引流淋巴结。在这些淋巴结中,免疫细胞之间可以信息传递,且接触过抗原的T细胞得以增殖,最终形成强大的抗肿瘤免疫。相比之下,标准护理疗法——旨在根除局部区域疾病并阻止远处转移进展——本质上会破坏这些关键的免疫结构,阻碍宿主的抗肿瘤免疫,从而导致免疫治疗失败。 (参考文献:Cancer Cell. 2024;42(6):930-933.)
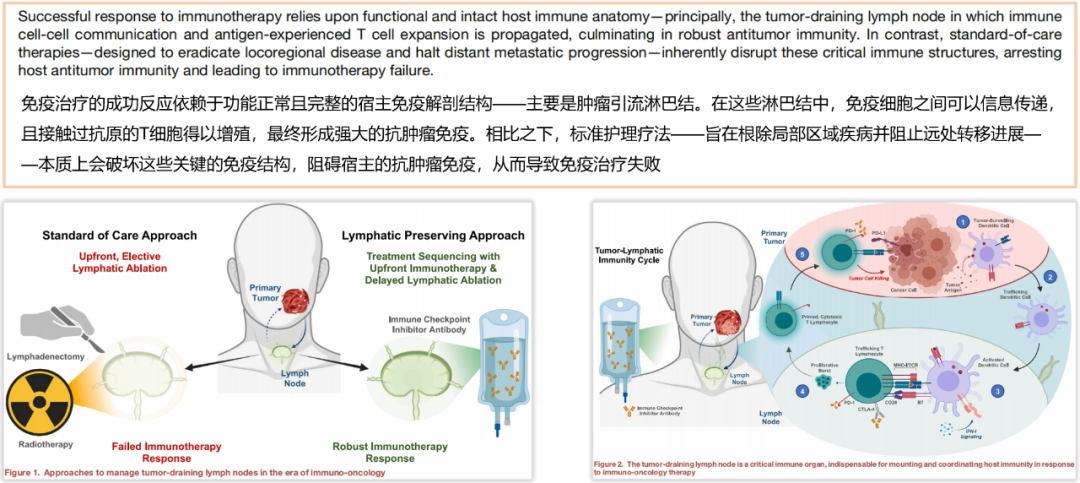
图10.综述1
今年5月份《Trends in Cancer》发表的一篇综述中写道: 最新临床前研究指出,肿瘤引流淋巴结(TDLNs)的切除可能导致免疫治疗的疗效下降;新辅助免疫疗法提供了一种在保留TDLNs的同时增强其抗肿瘤应答的策略。 (参考文献:Trends Cancer. 2025 May 9:S2405-8033(25)00104-9. )
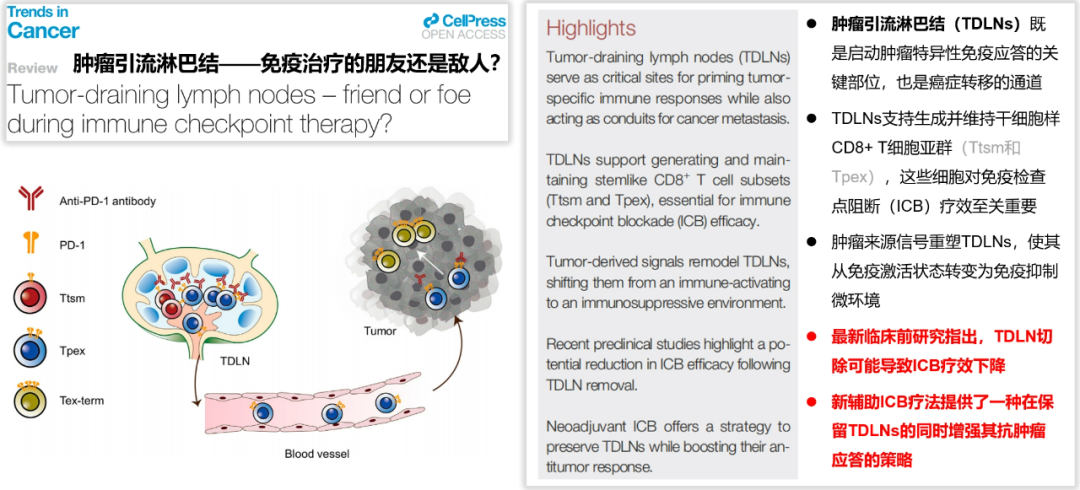
图11.综述2
今年6月份《Nature Cancer》发表的 一篇综述中写道:肿瘤细胞释放肿瘤抗原(Ags),被抗原呈递细胞(APCs)摄取;这些细胞在肿瘤引流淋巴结(LNs)中将抗原呈递给T细胞上的T细胞受体;激活的T细胞扩增并迁移到肿瘤组织,在那里它们通过T细胞受体识别肿瘤细胞并诱导肿瘤细胞死亡(“肿瘤-免疫循环”)。当肿瘤和局部引流淋巴结仍然存在时,给予新辅助免疫疗法可能诱导更高水平的抗原呈递、更多的T细胞启动和扩增,并最终产生针对原发肿瘤和微转移灶的更广泛、更有效和持久的免疫反应。相反,在切除宏观可见的肿瘤负荷后(在辅助治疗中)给予免疫疗法,可能导致针对残留微转移灶的免疫反应减弱。 (参考文献: Nat Cancer. 2025 Jun;6(6):967-987)
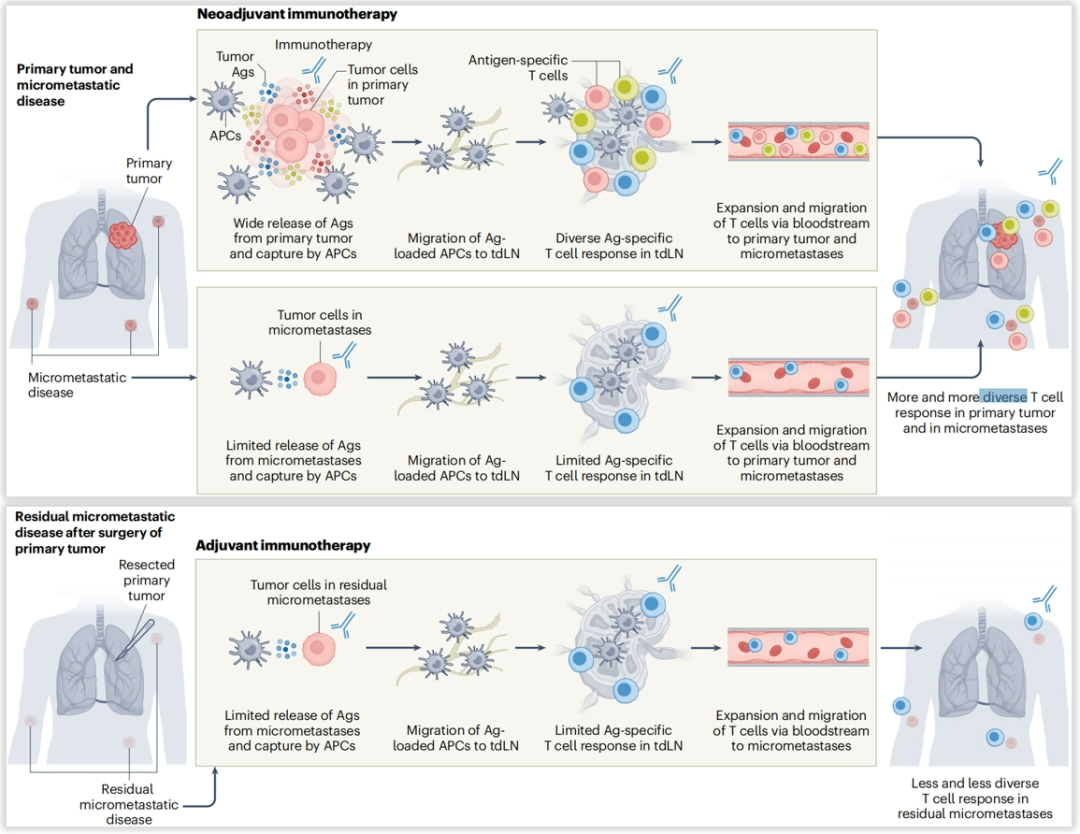
图12.综述3
回到今天的话题上,围术期免疫治疗带来的长期生存获益,可能是术前和术后免疫治疗共同发挥的疗效;但基于已有的研究证据,可以肯定的是,术前的免疫治疗应该是发挥了更大的价值。
因为我自己本身是妇产科学专业的,那就有必要再延申到局晚期宫颈癌的新辅助治疗。
需要注意的是,包括黑色素瘤、肺癌、乳腺癌等,这些癌种的局晚期标准治疗方案包括了新辅助治疗+手术;而对于局晚期宫颈癌,目前的标准治疗是同步放化疗。
我之前在本月初,STTT(IF 52.7分)发表一篇宫颈癌免疫新辅助治疗的研究论文这篇文章中分析过,未来局晚期宫颈癌免疫新辅助治疗的研究需要回答两个问题:
(1)接受完新辅助治疗+手术的患者中,有多少患者不需要接受辅助放疗或辅助放化疗?这些豁免了术后辅助放疗的患者,其长期的无进展生存率和总生存率与标准的CCRT相比,能否达到非劣效?
是的,从我的观点来看,这部分患者的预后不要求优于CCRT,只需要达到非劣效即可。因为我们是一个人口大国,宫颈癌患者人数巨大,而很多医院是没有放疗设备和放疗技术的。所以,如果新辅助免疫治疗+手术、且术后豁免了辅助放疗,同时他们的预后非劣于CCRT,这就很有意义,患者不需要从下面的地级市/县城/乡村跑到省会城市的大医院做放疗。
(2)接受完新辅助治疗+手术、且术后还需要辅助放(化)疗的患者,他们的预后有没有优于CCRT?
是的,从我的观点来看,这部分患者的预后必须优于CCRT,才有意义。否则,既然术后都要进行辅助放疗,那何必多挨一刀?为什么不直接让患者去进行CCRT?
今天的内容就到此,后续继续讨论NEJM上这篇评论文章中提到的与免疫治疗有关的其他问题,请保持关注。











 苏公网安备32059002004080号
苏公网安备32059002004080号


