肺癌是全球发病率和死亡率最高的恶性肿瘤之一。据世界卫生组织国际癌症研究机构(IARC)发布的2022年全球最新癌症负担数据[1]显示,肺癌新发病例数高达248万,死亡人数约为180万 。非小细胞肺癌(NSCLC)是肺癌最常见的病理类型,约占所有肺癌病例的85% [2]。对于不可手术的局部晚期NSCLC患者,同步放化疗(cCRT)一度是标准的治疗模式。然而,尽管采用了积极的局部治疗,患者的预后仍不理想,5年生存率仅为15%左右,且多数患者在治疗后1年内出现疾病进展 [3]。近年来,随着对肿瘤免疫逃逸机制认识的加深,免疫检查点抑制剂(ICIs)的出现为局部晚期NSCLC的治疗带来了革命性的突破。基于GEMSTONE-301研究的积极结果[4, 5],在cCRT后进行舒格利单抗巩固治疗,已成为改善该类患者生存获益的重要策略。四川省肿瘤医院王绎医生分享了一例舒格利单抗作为同步放化疗后的巩固治疗,使得局部晚期鳞癌患者获得36个月的无进展生存期(PFS)的病例。【肿瘤资讯】对此进行整理,并特邀四川省肿瘤医院朱亚杰教授进行点评,与大家共同学习。
四川省肿瘤医院肿瘤内科中心
胸部肿瘤内科 主治医师
个人履历/社会任职:
四川省抗癌协会小细胞肺癌专委会秘书
四川省抗癌协会肿瘤免疫治疗专委会委员
四川省预防医学会肿瘤治疗不良反应防治专委会常务委员
四川省国际医学促进会肿瘤免疫治疗专委会委员
四川省抗肿瘤药物合理化应用专委会委员
四川省医创会肺癌临床研究专委会委员
国际肺癌研究协会(IASLC)会员
病例简介
基本情况
基本信息:患者男,55岁。
主诉:因“咳嗽2个多月,肺癌化疗后1个多月”于2022年8月首次入院就诊。
现病史:2022年6月,患者因咳嗽、咳粘痰,伴有活动后胸闷、气短,在当地医院进行胸部CT检查,结果提示“肺占位”。6月11日的胸部增强CT显示,右肺下叶存在一个大小为2.3 x 2.2 cm的占位性病变,伴有右肺下叶阻塞性不张,高度怀疑为中央型肺癌。当地医院于2022年6月为患者施行了第一周期化疗,方案为白蛋白结合型紫杉醇联合洛铂,并联合了信迪利单抗。然而,7月31日复查胸部CT发现,右肺下叶的病灶非但没有缩小,反而略有增大,尺寸为2.4 x 2.5 cm。为寻求进一步诊治,患者入院就诊。
既往史:无特殊。
个人史:吸烟30年,平均30支/日。
辅助检查
胸部CT(2022年07月31日):右肺下叶占位性病灶较前稍增大(2.4 x 2.5cm)。
胸部CT增强+三维重建(2022年08月09日):右肺中间段、中下叶支气管内软组织充填伴右肺门区不规则肿块(4.8 x 3.5 cm),多系肺癌,伴右肺下叶完全阻塞性不张。右肺门及纵隔数个增大淋巴结,多系转移。
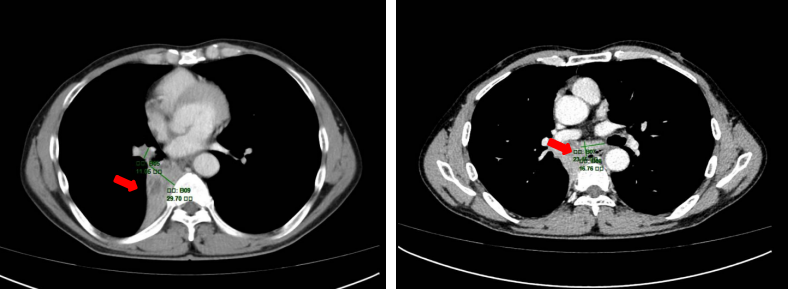
图1 胸部CT/增强CT基线
(左:2022年07月31日;右:2022年8月9日)
纤维支气管镜活检(2022年08月11日):右肺占位EBUS穿刺标本查见鳞状细胞癌。
PD-L1表达检测(2022年8月24日):PD-L1评分,TPS=20%;PD-L1抗体克隆号:22C3。
临床诊断
右肺鳞癌伴纵隔淋巴结转移(T2N2M0, IIIA期)。
治疗经过
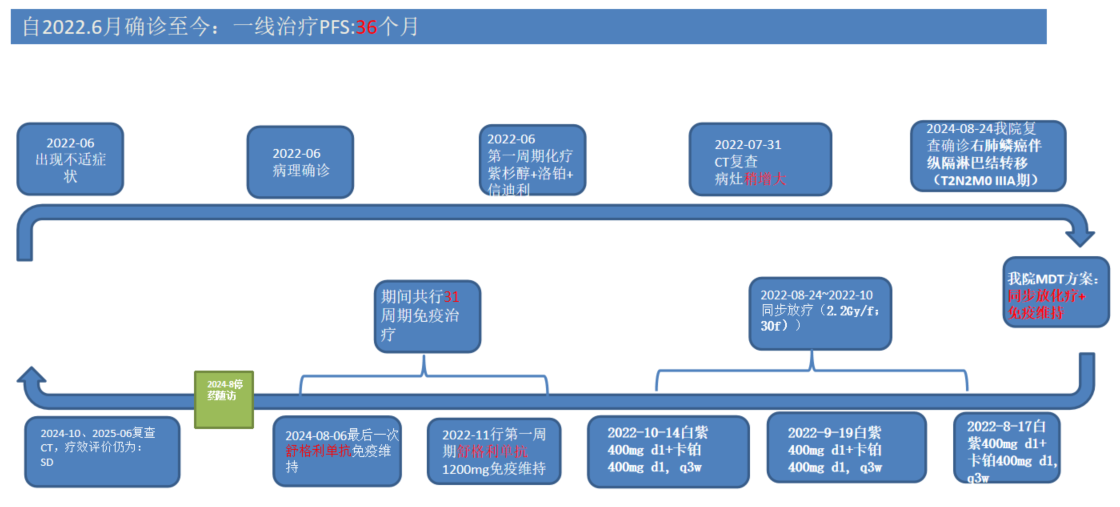
经过多学科团队(MDT)的深入讨论,专家组为患者制定了“同步放化疗,后续辅以免疫检查点抑制剂维持治疗”的综合治疗方案。
患者于2022年8月17日、9月19日和10月14日接受了三周期全身化疗,方案为白蛋白结合型紫杉醇(400mg, d1)联合卡铂(400mg, d1),每三周一次。化疗过程顺利。
与此同时,从2022年8月24日至10月,患者接受了针对肺部原发病灶及纵隔转移淋巴结的同步放射治疗,总计30次。剂量:PTV-GTVp(肺部原发灶) 2.2Gy/f,PTV-GTV-nd(7 LN)2.2Gy/f,qd。
放化疗结束后,患者于2022年11月开始了舒格利单抗1200 mg免疫巩固治疗。此后,患者规律接受免疫维持治疗,直至2024年8月6日,总计完成了31个周期的免疫维持治疗。整个治疗期间,患者耐受性良好,未出现与免疫治疗相关的不良反应。
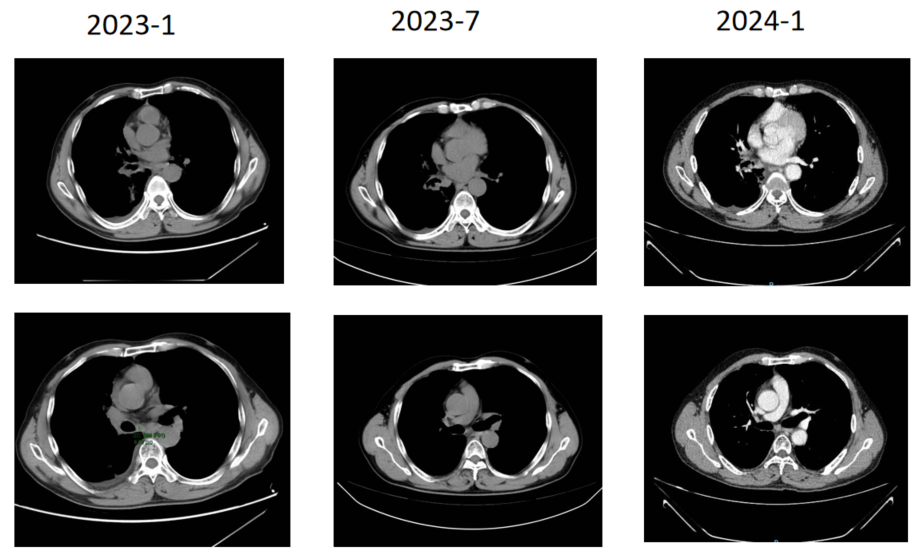
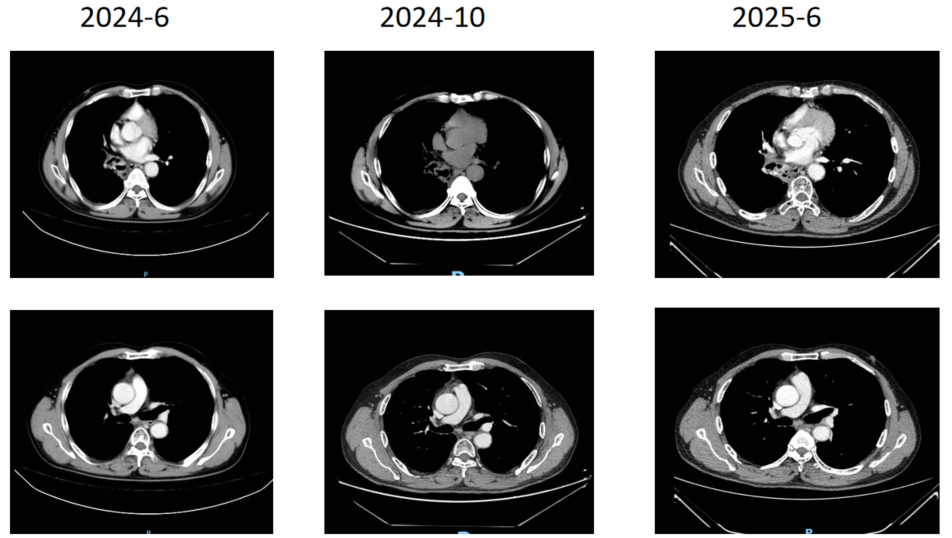
治疗期间的影像学复查(如2023年1月、7月,2024年1月、6月、10月及2025年6月的CT扫描)均显示,病灶持续稳定,疗效评价为疾病稳定(SD)。自2022年6月确诊至今,患者的一线治疗PFS已超过36个月。目前患者已于2024年8月停止治疗,进入密切随访阶段。
病例小结
副主任医师、硕士生导师
第十四届四川省卫健委学术带头人后备人才
中国老年学和老年医学学会肿瘤康复分会 委员
中德医学协会循证医学专业委员会委员
中国老年保健协会肿瘤支持治疗专委会委员
四川省医促会肿瘤分子靶向专委会常务委员
四川省医促会肿瘤免疫治疗专委会常务委员
成都市抗癌协会第二届肺癌诊疗一体化专业委员会常务委员
四川省抗癌协会肿瘤疼痛学青年委员会 副主任委员
四川省抗癌协会肿瘤免疫治疗专委会委员外科学组 副组长
四川省抗癌协会肿瘤免疫治疗专委会常务委员
四川省免疫学会专业委员会委员
四川省女医师协会委员
四川省医疗卫生与健康促进会肿瘤学专委会 委员
专家点评
本案例是一名典型的、符合中国临床特征的局部晚期NSCLC患者(IIIA期、鳞癌、有长期吸烟史),其成功的治疗经验充分体现了“同步放化疗+免疫巩固治疗”这一模式的巨大临床价值,同时也为我们带来了诸多启示和思考。
免疫检查点抑制剂的出现为不可手术切除的III期NSCLC患者的治疗带来了新的突破。PACIFIC研究是首个证实免疫疗法在III期NSCLC中取得成功的里程碑式临床试验。该研究证实,与安慰剂相比,度伐利尤单抗巩固治疗显著延长了患者的中位总生存期(OS)(47.5个月 vs 29.1个月)和PFS(16.9个月 vs 5.6个月),奠定了其在该领域的标准治疗地位 [3, 6]。
GEMSTONE-301 研究是一项专门针对中国人群设计的 III 期研究,旨在评估cCRT或序贯放化疗(sCRT)后,以舒格利单抗作为巩固治疗的疗效与安全性 [4]。该研究的设计更贴近中国的临床实际,例如,研究中纳入了sCRT的患者,且鳞癌患者比例高达69% [4]。
GEMSTONE-301研究的结果令人振奋。研究结果表明,在cCRT/sCRT后的巩固治疗中,舒格利单抗显著延长了不可切局晚期NSCLC患者的生存,对于cCRT,舒格利单抗巩固治疗的中位PFS为15.7个月,而对照组为8.3个月,HR为0.71;两组的2年和3年OS率分别为66.3% vs 57.6%和54.1% vs 19.8%。对于sCRT,舒格利单抗组的中位PFS达到8.1个月,而对照组仅为4.1个月,HR为0.57;两组的2年和3年OS率分别为70.7% vs. 53.7%和59.0% vs. 43.7%[5]。除此之外,研究结果显示舒格利单抗组免疫相关性肺炎发生率仅约 3%,凸显了其良好的安全性[4]。GEMSTONE-301研究进一步验证了免疫巩固治疗模式在更广泛人群以及中国人群中的疗效。基于此,舒格利单抗已获得了《中国临床肿瘤学会(CSCO)NSCLC诊疗指南2025》作为不可手术III期NSCLC同步或序贯放化疗后的巩固治疗的I 级推荐[7]。本案例中的患者正是GEMSTONE-301研究模式的直接受益者,其长达36个月的PFS,远超了研究中位数据,也印证了该方案在中国患者中的卓越疗效。
本案例的成功也为我们揭示了未来治疗中值得深入探讨的几个关键问题。首先,免疫维持治疗的最佳时长尚无定论,例如GEMSTONE-301研究设定了最长2年,而PACIFIC研究为12个月 。因此,对本案例这类长期获益者,当前最合理的策略是在停药后进入密切随访和动态监测。同时,为应对潜在复发也需预先规划,一旦疾病进展,后续治疗方案将依据复发模式、时间及患者状况,从再次局部治疗、更换化疗、靶向治疗乃至再次挑战免疫治疗中进行个体化选择。最后,要实现患者获益最大化,必须实施全方位的管理策略,这不仅包括通过动态监测尽早发现复发迹象、鼓励参与新临床试验,更涵盖了生活方式干预和心理支持,从而在疾病全周期中提升患者的生存质量。
本案例的成功治疗,不仅展示了以舒格利单抗为代表的免疫巩固治疗在局部晚期NSCLC领域的强大实力,也凸显了基于中国人群临床证据指导实践的重要性。随着更多研究的开展和对肿瘤免疫微环境认识的深入,我们有理由相信,通过更加精准的分层、更加合理的联合以及更加个体化的全程管理,未来局部晚期NSCLC患者的生存时间和生活质量必将得到进一步的提升。
1. Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: a cancer journal for clinicians, 2024, 74(3): 229-263.
2. Nicholson AG, Tsao MS, Beasley MB, et al. The 2021 WHO classification of lung tumors: impact of advances since 2015[J]. J Thorac Oncol, 2022, 17(3): 362-387.
3. Antonia, S. J., Villegas, A., Daniel, D., et al. (2017). Durvalumab after Chemoradiotherapy in Stage III Non–Small-Cell Lung Cancer. New England Journal of Medicine, 377(20), 1919–1929.
4. Zhou, Q., Chen, M., Jiang, O., et al. (2022). Sugemalimab versus placebo after concurrent or sequential chemoradiotherapy in patients with locally advanced, unresectable, stage III non-small-cell lung cancer (GEMSTONE-301): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. The Lancet Oncology, 23(2), 209–219.
5. Qing Zhou, et al. Sugemalimab vs Placebo after cCRT or sCRT in pts with Unresectable Stage III NSCLC: Final PFS Analysis of a Phase 3 Study. WCLC 2022. OA02.05.
6. Spigel, D. R., Faivre-Finn, C., Gray, J. E., et al. (2022). Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non–Small-Cell Lung Cancer. Journal of Clinical Oncology, 40(12), 1301–1311.
7. 2025版CSCO NSCLC指南.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


