病史摘要:患者,女性,56岁,因“进食咽部不顺2个月”入院。
症状体征:查体:浅表淋巴结未触及肿大,心、肺、腹(-); ECOG评分:1分。20年前因肠梗阻行手术治疗。无高血压、糖尿病、冠心病病史。
诊断方法:结合胃镜及病理、腹部CT、浅表淋巴超声,食管造影综合诊断。
治疗方法:采取根治性同步放化疗+化疗,TP(注射用紫杉醇+顺铂)方案化疗,同时予以颈段食管病变放疗,因第三周期化疗时,出现3级血小板减少,后给予口服海曲泊帕+皮下注射白介素-11,血小板升高之后,继续放化疗。
临床转归:治疗三月余,影像结果提示病灶部分缓解(Partial Response, PR),患者随访至2022年8月24日未出现肿瘤复发。
适合阅读人群:胃肠外科,肿瘤科
关键词:食管癌;化疗;放疗;血小板减少症 ;海曲泊帕
前言
在放化疗治疗颈段食管癌过程中,血小板减少症是一种常见的血液学副作用,可能导致出血风险增加,从而影响治疗进程和患者安全。本文通过一例54岁女性患者的病例分析,探讨了颈段食管癌放化疗引起的血小板减少症的管理和治疗策略。为了克服这一挑战,当出现血小板减少时,我们可采取海曲泊帕的同步或序贯治疗来提高血小板计数,从而减轻肿瘤治疗所致血小板减少症(Cancer Treatment-Induced Thrombocytopenia,CTIT)的影响,确保放化疗的有效进行。
临床资料
一般资料
患者,女,54岁,因进食咽部不顺2个月,于2022年2月14日就诊我院。查体,未触及浅表淋巴结肿大,心、肺、腹部检查无异常。ECOG评分为1分,生活活动轻度受限。患者在20年前接受了肠梗阻的手术治疗。除此之外,未曾有高血压、糖尿病或冠心病的既往病史。
检查
胃镜:距门齿14-18cm食管粘膜粗糙、颗粒样增生。详见图1。
病理:鳞状上皮乳头状增生伴重度异型增生,灶性原位癌改变。详见图2。
免疫组化:PD-L1(DAKO 22C3)(CPS<1)。
腹部CT:纵隔淋巴结(-),腹部CT未见异常。详见图3。
浅表超声:双侧颈血管及锁上未见明显异常淋巴结。
食管造影:食管颈段粘膜破坏中断,管壁稍僵硬,可见充盈缺损,管腔狭窄,钡剂通过稍受阻,病变长度约为2.3cm。余各段食管及贲门粘膜规则,未见明显破坏中断,管壁光滑柔软,管腔无狭窄,未见充盈缺损,钡剂通过顺利。详见图4。
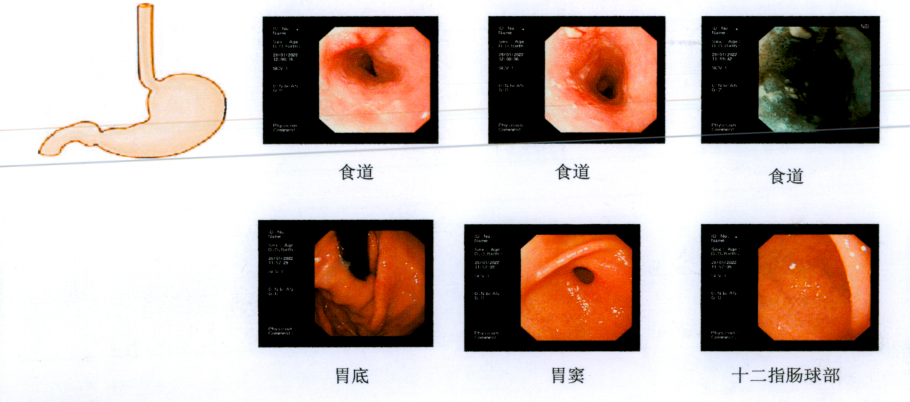 图1. 胃镜结果提示:距门齿14-18cm食管粘膜粗糙、颗粒样增生。
图1. 胃镜结果提示:距门齿14-18cm食管粘膜粗糙、颗粒样增生。
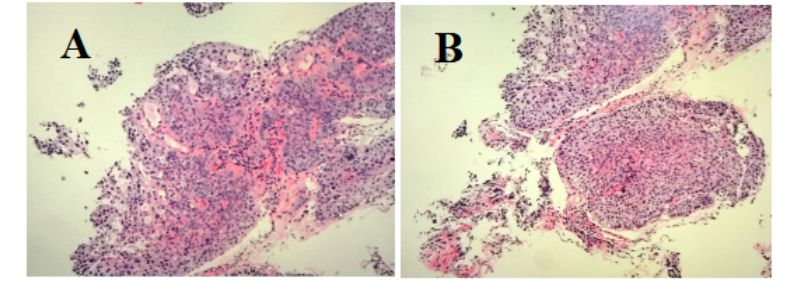 图2. 病理:鳞状上皮乳头状增生伴重度异型增生,灶性原位癌改变
图2. 病理:鳞状上皮乳头状增生伴重度异型增生,灶性原位癌改变
A. HE染色200× B. HE染色 200×
 图3. 腹部CT : A~D纵隔淋巴结(-),未见异常
图3. 腹部CT : A~D纵隔淋巴结(-),未见异常
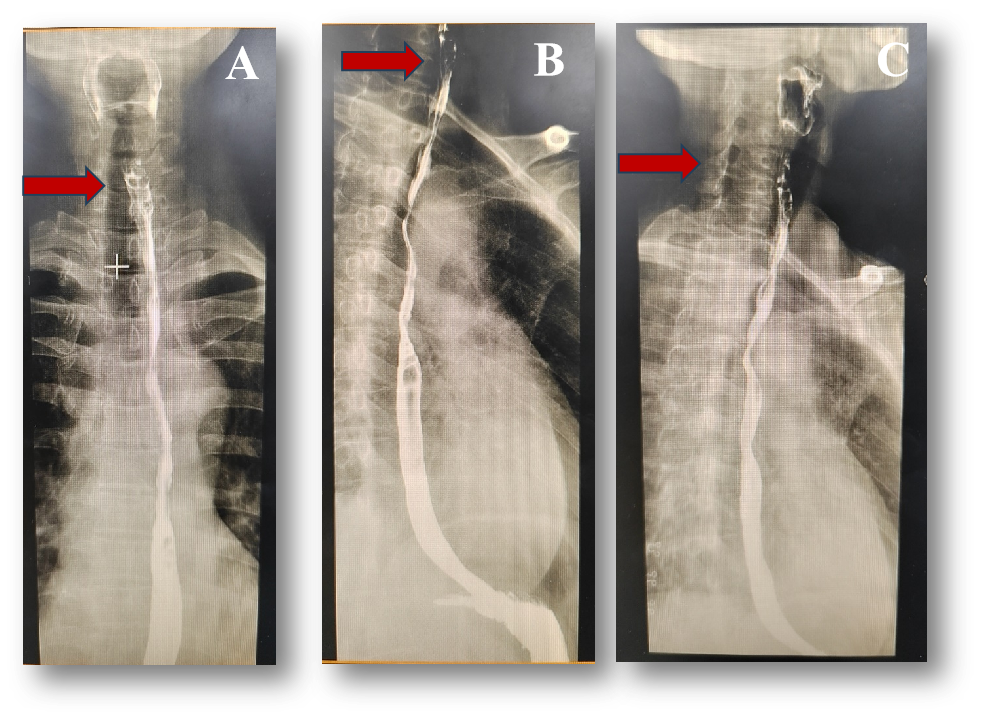 图4. 食管造影:A~C食管颈段粘膜破坏中断,管壁硬,可见充盈缺损,管腔狭窄,钡剂通过稍受阻,病变长度约为2.3cm。余各段食管及贲门粘膜规则,未见明显破坏中断,管壁光滑柔软,管腔无狭窄,未见充盈缺损,钡剂通过顺利。
图4. 食管造影:A~C食管颈段粘膜破坏中断,管壁硬,可见充盈缺损,管腔狭窄,钡剂通过稍受阻,病变长度约为2.3cm。余各段食管及贲门粘膜规则,未见明显破坏中断,管壁光滑柔软,管腔无狭窄,未见充盈缺损,钡剂通过顺利。
诊断与鉴别诊断
诊断:颈段食管癌(cT3N0M0 II期)。
诊断依据:结合患者胃镜及病理、腹部CT、浅表淋巴结超声,食管造影等结果可明确诊断。
鉴别诊断:本病例需与反流性食管炎鉴别。两种疾病皆会在早期表现出相似的症状,如胸骨后不适或吞咽困难,但治疗方法和预后大相径庭。症状的发展模式不同,食管癌往往表现为进行性吞咽困难和体重下降;其次,可通过内镜检查直观区分两者,食管癌可见到肿瘤生长,而反流性食管炎则显示食管黏膜的炎症迹象。
治疗
根据《2022 CSCO食管癌诊疗指南》指导,本病例采取根治性同步放化疗+化疗方案:患者自2022年2月16日-18日开始接受注射用紫杉醇+顺铂的TP方案化疗第一周期。化疗第一周期后,血常规检查显示白细胞计数为3.78×109/L,血小板计数为125×109/L。继第一周期后,患者于2022年3月11日-13日进行了第二周期的TP方案化疗。第二周期化疗后的血常规检查结果为白细胞计数3.58×109/L,血小板计数136×109/L。从2022年3月28日起,患者开始接受同步放化疗。放疗的靶区针对颈段食管病变,GTV周围及上下方向分别外扩0.5cm和2cm,包括双侧颈血管旁淋巴引流区。CTV均匀外扩0.3cm定义为PTV,处方剂量为DT60Gy。随后,患者在2022年4月10日-12日完成了第三周期的同步放化疗。然而,2022年4月15日的血常规复查显示血小板计数降至48×109/L,达到了3级血小板减少的程度。通过这一系列的治疗,患者经历了从化疗到同步放化疗的过程,伴随着血小板数量的显著变化,特别是在第三周期同步放化疗后血小板显著下降。血小板减少可能导致皮肤和黏膜出血,以及更为严重的颅内出血(ICH)[1-2]。血小板减少不仅是化疗药物的常见副作用,还是一种剂量限制性毒性反应[3],可能导致治疗减量、延迟甚至中断。特别是当放疗与化疗同步进行时,骨髓抑制效应会更加明显,可能引发严重的血小板减少,导致重要脏器出血乃至患者死亡[2]。因此,需要进一步的管理和干预。在血小板显著减少,导致暂停放疗一次后,患者被纳入特定的治疗队列,开始接受口服海曲泊帕(每日2片,5mg)+皮下注射白介素-11(每日3mg)的治疗方案[4]。这一治疗组合旨在有效提高血小板计数,从而允许患者安全地继续放疗。
治疗结果、随访及转归
经过短期的治疗,到了4月18日的血常规复查显示,血小板计数显著提高至83×109/L,使得放疗得以在仅耽误一天的情况下恢复。随后,在4月20日的复查中,血小板计数进一步提升至130×109/L。这一治疗进展表明,通过采取针对性的海曲泊帕口服给药配合白介素-11的皮下注射的血小板提升措施,患者成功克服了由同步放化疗引起的血小板减少,保证了放疗计划的顺利进行,展现了良好的治疗效果。血小板计数变化情况详见表1。
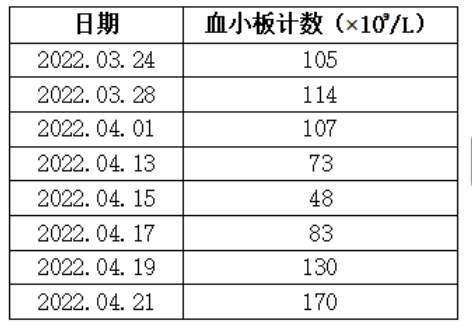 表1. 患者2022年3月24日至2022年4月21日放化疗期间血小板计数变化
表1. 患者2022年3月24日至2022年4月21日放化疗期间血小板计数变化
讨论
在实体瘤患者中,肿瘤治疗所致血小板减少症(CTIT)是指在疾病治疗过程中因化疗、放疗、靶向治疗等导致的血小板减少症,是一种常见的毒性反应。目前,治疗CTIT的主要措施包括血小板输注和促血小板生长因子的应用[5]。血小板输注虽然是严重血小板减少症的即时止血方法,有效降低出血发生率,但长期应用可能对癌症进展有害,如可能增加肿瘤复发率和降低长期生存率[6]。因此,促血小板生长因子的使用成为了CTIT治疗中的重要组成部分,这些因子包括重组人白细胞介素11(rhIL-11)、重组人血小板生成素(rhTPO)以及TPO受体(TPO-R)激动剂如艾曲泊帕、阿伐曲泊帕、海曲泊帕等。
目前国内仅rhIL-11和rhTPO被国家药品监督管理局(NMPA)批准用于CIT。
rhIL-11的作用较为有限,对于轻中度的CIT尚可发挥作用,对于重度CIT效果差。此外,rhIL-11可增加心血管事件的发生率,既往有水钠潴留、心力衰竭、房性心律失常或冠状动脉疾病史的患者,尤其是老年患者,不推荐长期使用。rhTPO在临床治疗中可与内源性TPO交叉反应产生抗药抗体,可能有中和抗体风险[7]。既往一项II期[8]随机安慰剂对照研究显示,接受吉西他滨单药或吉西他滨联合卡铂或顺铂化疗的实体瘤患者,在化疗前5天和化疗后5天分别予艾曲泊帕100 mg治疗,d1艾曲泊帕组血小板计数显著高于安慰剂组。接受联合化疗的患者,血小板计数由最低值恢复正常需8天,而安慰剂组需15天。因此以吉西他滨为基础的化疗方案导致的CIT,经艾曲泊帕治疗可以缩短血小板最低值恢复时间、减少化疗推迟或剂量减低的发生。上述研究结果显示TPO-R激动剂(TPO-RA)可能在CIT中发挥作用,但这些药物均尚无前瞻性临床研究数据支持在CIT应用的剂量和周期,以及是否能够有效替代血小板输注。
海曲泊帕分子作用机制与艾曲泊帕类似,可选择性地结合于TPO-R跨膜区,激活TPO-R依赖的STAT和MAPK信号转导通路,有效刺激巨核细胞增殖分化,产生血小板,从而发挥升高血小板水平的作用[9]。
2021年6月17日,国家药品监督管理局(NMPA)批准恒瑞医药申报海曲泊帕乙醇胺片上市,用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。海曲泊帕作为新兴的TPO-RA类药物,在CIT领域是唯一取得阳性临床结果的TPO-RA药物[10]。海曲泊帕的上市打破了TPO类药物市场进口垄断的局面,为中国CIT患者提供了新的治疗选择。
结合本次颈段食管癌放化疗所致血小板减少症的病例,通过应用海曲泊帕和白介素-11,我们观察到患者血小板计数从显著减少到达到安全水平的明显改善,从而避免了出血事件,确保了治疗的顺利进行。另外,海曲泊帕作为口服制剂,患者使用更方便,管理更便捷,尤其是在目前的医保支付环境下,使用口服药物可以帮助肿瘤患者减少住院时间,减少患者往返医院的次数。因此,TPO-RA口服制剂在提高患者便利性和依从性方面具有较大优势。这一病例强调了在同步放化疗过程中对CTIT的有效管理的重要性,以及TPO-R激动剂在预防和治疗CTIT中的潜在价值。本文中,经过短期的治疗,血小板计数显著提高,使得放疗得以在仅耽误一天的情况下恢复。随后血小板计数进一步提升。通过采取针对性的海曲泊帕口服给药配合白介素-11的皮下注射的血小板提升措施,患者成功克服了由同步放化疗引起的血小板减少,保证了放疗计划的顺利进行,展现了良好的治疗效果。
未来,更多前瞻性的临床研究将有助于确定TPO-R激动剂在CTIT中的最佳应用剂量、周期,以及其是否能有效替代血小板输注,为CTIT患者提供更优化的治疗方案。
[1] Wu Y, Aravind S, Ranganathan G, et al. Anemia and thrombocytopenia in patients undergoing chemotherapy for solid tumors: a descriptive study of a large outpatient oncology practice database, 2000–2007[J]. Clinical therapeutics, 2009, 31: 2416-2432.
[2] Kühne T, Berchtold W, Michaels L A, et al. Newly diagnosed immune thrombocytopenia in children and adults: a comparative prospective observational registry of the Intercontinental Cooperative Immune Thrombocytopenia Study Group[J]. Haematologica, 2011, 96(12): 1831-1837.
[3] Moulis G, Palmaro A, Montastruc J L, et al. Epidemiology of incident immune thrombocytopenia: a nationwide population-based study in France[J]. Blood, 2014, 124(22): 3308-3315.
[4] Gernsheimer T. Chronic Idiopathic Thrombocytopenic Purpura: Mechanisms of Pathogenesis[J]. Oncologist, 2009, 14(1):12-21.
[5] Arnold D M. Bleeding complications in immune thrombocytopenia[J]. Hematology 2014, the American Society of Hematology Education Program Book, 2015, 2015(1): 237-242.
[6] D.V. Pachito, et al. Efficacy of platelet-rich plasma for non-transfusion use: overview of systematic reviews[J]. International Journal of Clinical Practice, 2019, 73(11): e13402.
[7] 史艳侠, 邢镨元, 张俊, 沈波. 中国肿瘤化疗相关性血小板减少症专家诊疗共识(2019版)[J]. 中国肿瘤临床, 2019, 46(18): 923-929.
[8] Winer E S, Safran H, Karaszewska B, et al. Eltrombopag for thrombocytopenia in patients with advanced solid tumors receiving gemcitabine-based chemotherapy: a randomized, placebo-controlled phase 2 study[J]. Int J Hematol, 2017, 106(6):765-776.
[9] Xie C, Zhao H, Bao X, et al. Pharmacological characterization of hetrombopag, a novel orally active human thrombopoietin receptor agonist[J]. Journal of Cellular and Molecular Medicine, 2018, 22(11): 5367-5377.
[10] Xiaohui X, Haiting Z,et al. Hetrombopag plus recombinant human thrombopoietin for chemotherapy-induced thrombocytopenia in patients with solid tumors. [J]. Res Pract Thromb Haemost. 2023 Oct 14;7(7):102231.
排版编辑:肿瘤资讯-Olivia











 苏公网安备32059002004080号
苏公网安备32059002004080号


