浙江省卫生高层次人才(医坛新秀)
浙江省医师协会肿瘤医师分会青委会副主委
浙江省免疫学会临床免疫专委会青委
获得2025 ASCO Long-term International Fellowship
主持国家自然科学基金面上及青年项目、浙江省科协青年人才托举工程及CSCO朝阳肿瘤研究基金等项目
ASCO 解读文献
专场:【Rapid Oral】Breast Cancer- Neoadjuvant Therapy
摘要号:511
A phase 2 study of response-guided neoadjuvant sacituzumab govitecan and pembrolizumab (SG/P) in patients with early-stage triple-negative breast cancer: Results from the NeoSTAR trial.
早期TNBC患者以疗效为导向的新辅助戈沙妥珠单抗和帕博利珠单抗(SG/P)治疗的2期研究:NeoSTAR试验结果
研究背景
三阴性乳腺癌(Triple Negative Breast Cancer,TNBC)因侵袭性强、易复发转移且缺乏明确靶向治疗靶点,是当前乳腺癌治疗的难点。新辅助化疗(Neoadjuvant Chemotherapy,NACT)作为早期TNBC的标准治疗,达到病理完全缓解(pathological Complete Response,pCR)的患者通常有更好的预后。但传统化疗方案存在毒性较大、pCR率仍有提升空间的局限。尽管KEYNOTE-522研究证实免疫治疗联合化疗可显著提高pCR率,但毒性问题仍未得到有效解决,探索更有效、毒性更可控的联合方案仍是研究热点。
戈沙妥珠单抗(Sacituzumab Govitecan,SG)作为全球首个Trop-2靶向抗体偶联药物(Antibody-Drug Conjugate,ADC),凭借其在ASCENT研究等临床试验中的优秀数据、真实世界中的广泛使用成果及其安全性管理经验的成熟,确立其在转移性TNBC二线及后线治疗中的标杆地位。帕博利珠单抗(Pembrolizumab,P)是全球首个获批的PD-1抑制剂,目前已获批用于早期TNBC和PD-L1阳性转移性TNBC。然而,SG与P联合用于早期TNBC新辅助治疗的安全性与有效性尚未明确。
NeoSTAR研究是首个探索SG在TNBC新辅助治疗的临床研究,旨在探索免化疗的新辅助策略,拓宽以化疗为基础的传统治疗模式。此前2022年ASCO年会已报道其Arm A1(SG单药新辅助治疗早期TNBC)结果(2024年全文发表于Annals of Oncology);今年ASCO年会公布的Arm A2最新数据,重点评估了SG联合P用于早期TNBC新辅助治疗的疗效与安全性。

研究方法
1. 研究设计:本研究为单臂、II期临床试验。
2. 入组标准:纳入既往未接受过治疗的早期TNBC患者(肿瘤最大径≥2cm和/或存在淋巴结转移)。
3.治疗流程:
3.1 初始治疗阶段:所有患者接受4个周期的SG(第1、8天给药)与P(第1天给药)联合方案,每21天为1个周期。
3.2 疗效评估与分层处理:完成4周期治疗后,基于RECIST v1.1标准进行影像学评估:
① 对影像学完全缓解(iCR)或接近iCR的患者且进一步通过穿刺活检确认残余肿瘤细胞≤10%:定义为“良好应答者”,直接进入手术阶段;
② 未达到上述标准的患者(存在可疑残留病灶),需继续完成研究者指定的新辅助化疗方案,随后再行手术。
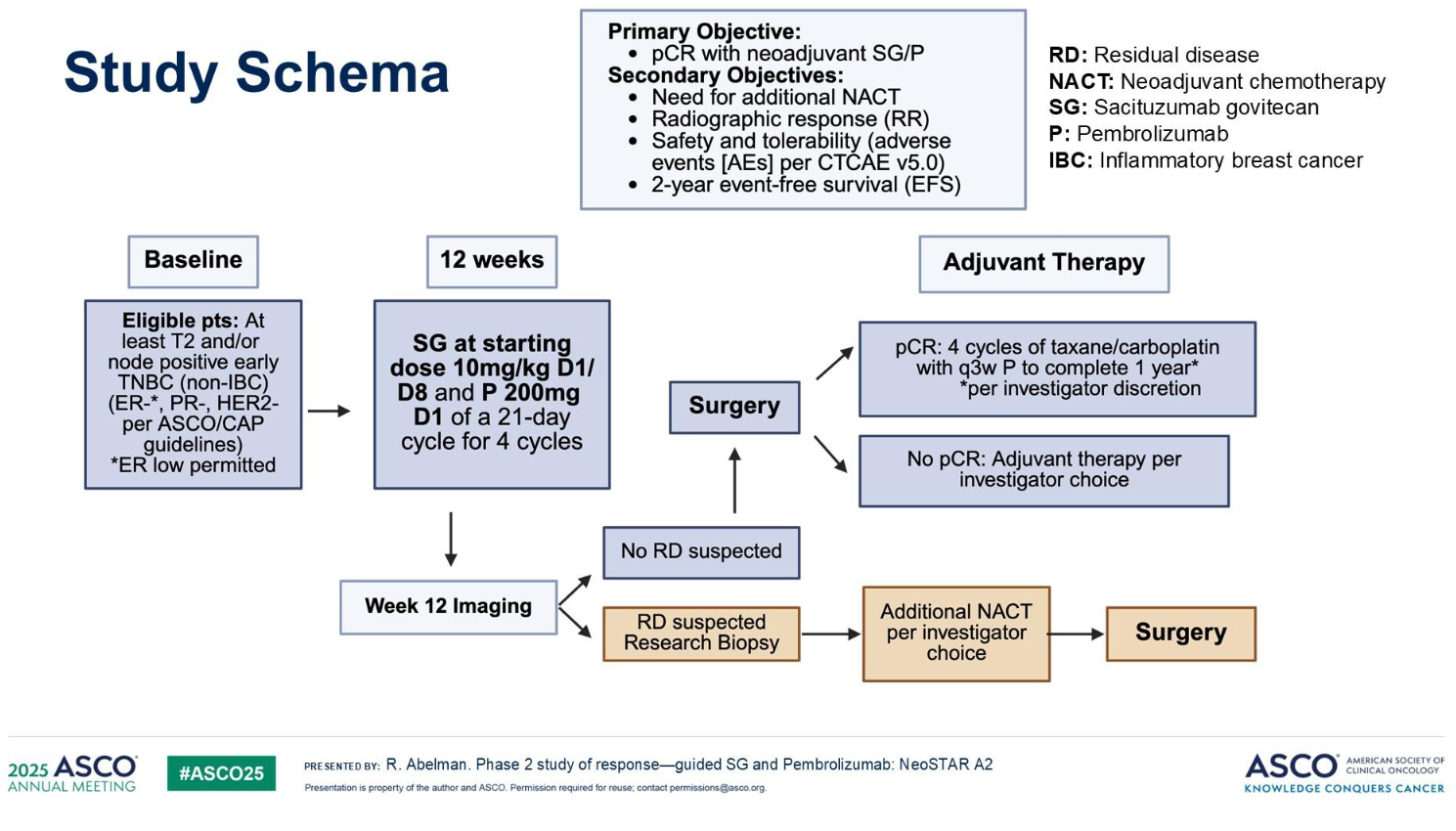
4. 研究终点:主要研究终点为新辅助治疗后的pCR率;次要终点包括额外新辅助化疗的需求比例、影像学缓解率、治疗安全性及耐受性、2年无事件生存期(EFS)。
5. 统计学方法:采用Simon两阶段设计以优化样本量效率,结合标准描述性统计学分析,所有率值均以95%二项式置信区间(CI)报告。
研究结果
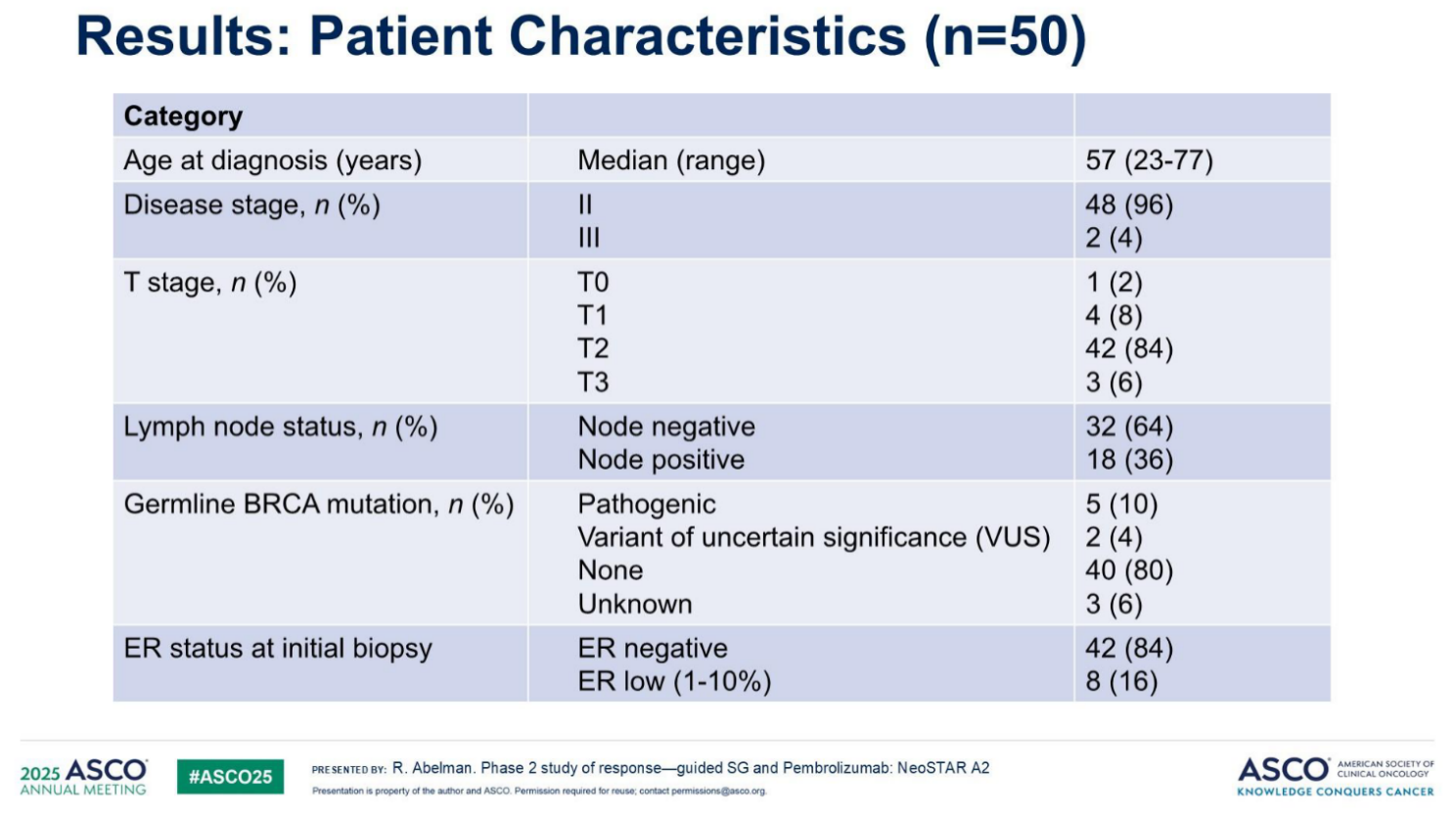
1.入组特征:研究招募时间为2023年5月19日至2024年8月13日,共纳入50例早期TNBC患者,中位年龄57岁(范围23-77岁);其中II期患者48例(96%),III期患者2例(4%)。
2. 疗效终点:
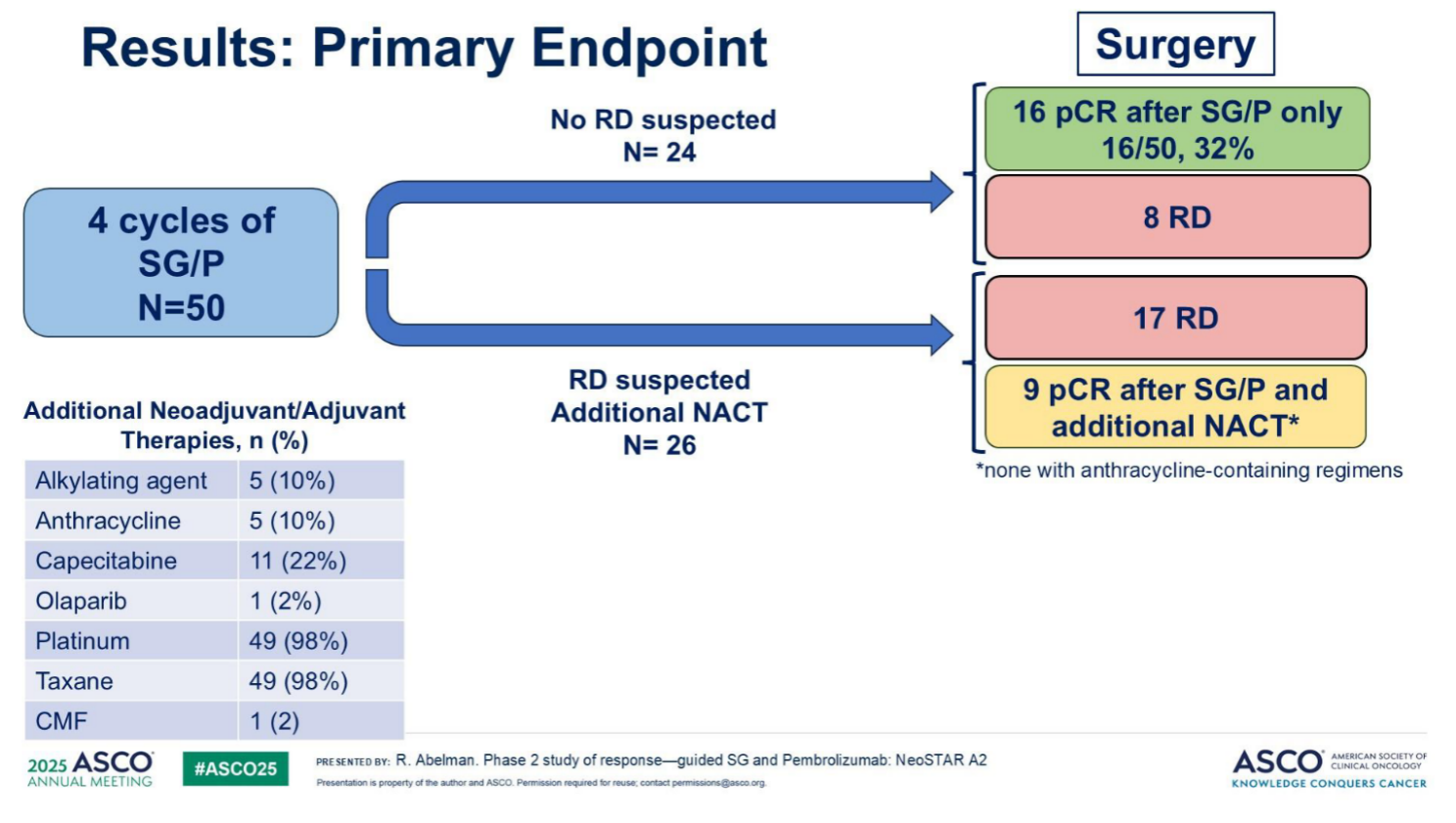
初始治疗后pCR率:SG/P联合4周期治疗后,16例(32%)患者达到pCR;
额外化疗补充疗效:26例未达初始缓解标准的患者接受额外新辅助化疗后,9例(其中2例活检证实残留病灶、6例活检阴性/非诊断性残留、1例未活检)最终达到pCR;
总体pCR率:综合初始治疗与后续化疗结果,手术时总体pCR率为50%(25/50);
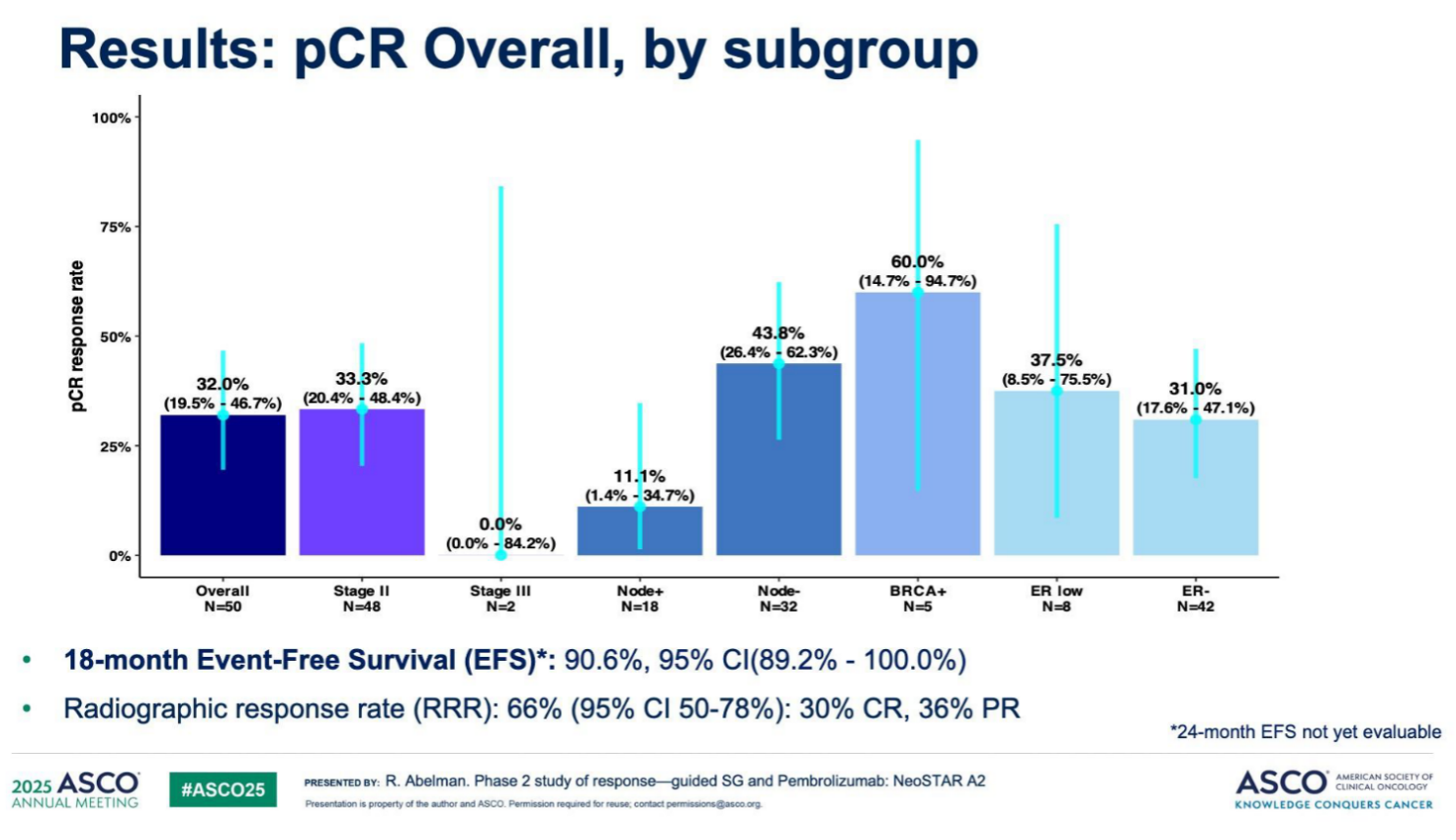
此外,研究通过亚组分析(涵盖临床分期、淋巴结状态、BRCA基因突变情况、ER表达等关键指标),进一步探索了不同人群的pCR差异,旨在识别SG/P联合方案的潜在优势获益群体。特别需要关注到BRCA基因突变亚组5例患者中有3例(60%)在SG/P初始治疗后直接达到pCR,另1例通过额外化疗后也实现pCR,提示该亚组可能对联合方案更敏感。
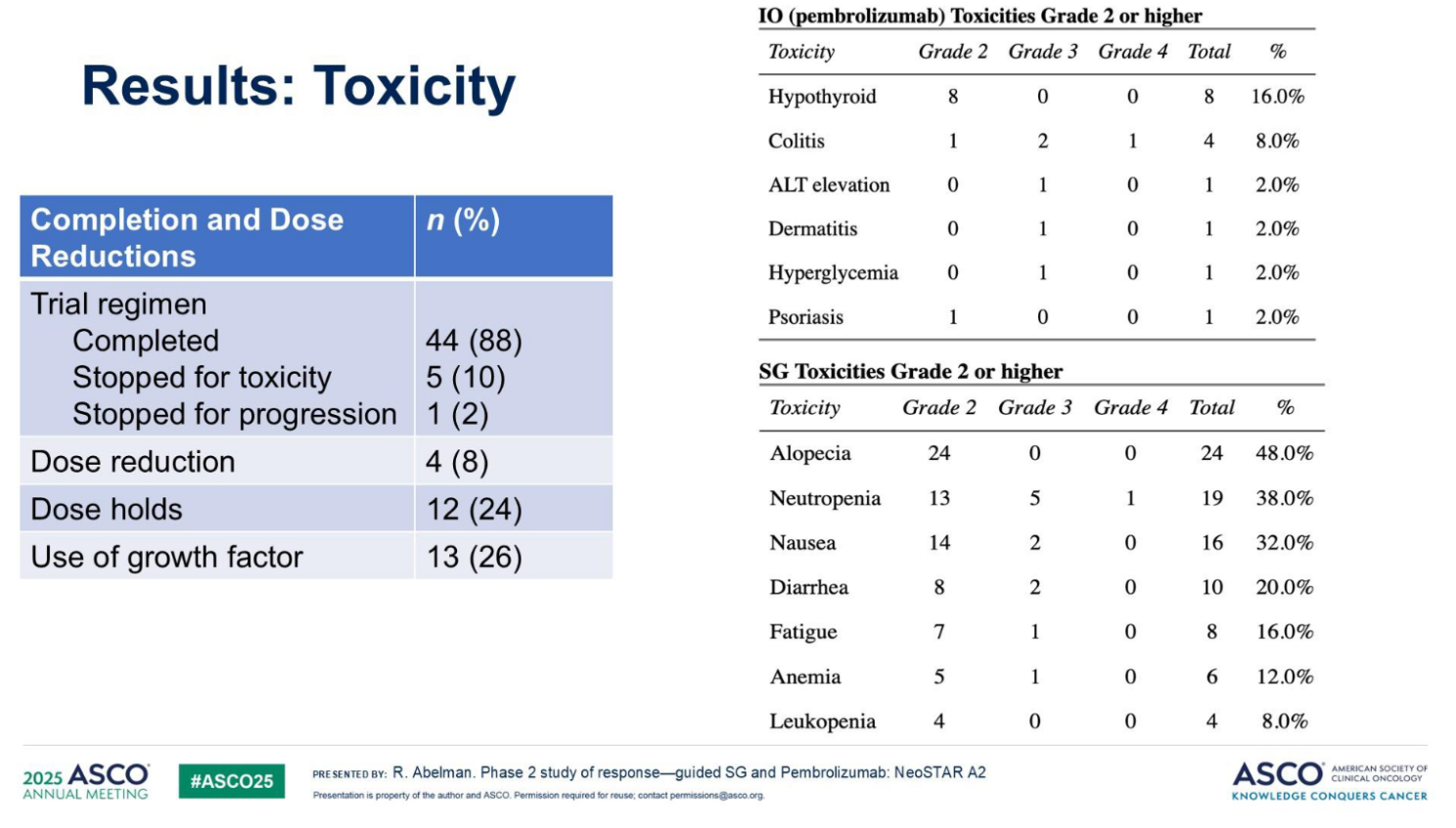
3. 安全性:
SG/P联合治疗的安全性与单药已知毒性谱一致,未观察到预期外的严重安全事件。50例患者中,44例(88%)完成试验方案,另有5例因毒性退出,1例治疗期间疾病进展。有20名患者(40%)发生了3级或更高级别的不良时间(AEs)。最常见的AEs包括脱发、骨髓抑制(中性粒细胞减少、贫血)、恶心、腹泻、疲劳以及免疫相关不良反应(如甲状腺功能异常、皮疹、结肠炎等)。
研究结论
高效:32%的患者在接受4个周期的SG/P后实现了pCR。
安全:没有发现新的安全信号,少数患者经历了剂量减少(8%)或治疗中断(10%)。
免蒽环:50%的患者在本研究免蒽环方案(4周期的SG/P或SG/P加延长的NACT)能够达到了pCR。

解读
免疫治疗在TNBC中的应用
TNBC是乳腺癌中免疫原性最强的亚型,其肿瘤浸润淋巴细胞(TILs)数量、PD-L1表达水平及肿瘤突变负荷(TMB)等指标均显著高于其他乳腺癌亚型,表明其肿瘤微环境(TME)免疫活性较强,为免疫治疗的应用奠定了生物学基础。
KEYNOTE-355作为首项探索帕博利珠单抗联合化疗对比安慰剂联合化疗用于初治局部复发不可手术或转移性TNBC的III期研究,证实了在PD-L1阳性(CPS≥10)转移性TNBC一线治疗中,帕博利珠单抗联合化疗较安慰剂联合化疗显著延长无进展生存期(PFS),绝对获益达4.1个月(9.7个月 vs 5.6个月),复发风险降低35.0%。KEYNOTE-522研究则进一步验证了帕博利珠单抗联合化疗在早期TNBC新辅助及辅助治疗中的价值:与常规新辅助化疗组相比,免疫联合组pCR率显著提升(64.8% vs 51.2%),3年无事件生存率(EFS)亦更优(84.5% vs 76.8%),差异均具有统计学意义。这两项研究成果均发表于《新英格兰医学杂志》(NEJM),引发学界广泛关注。目前,ISPY-2、KEYLNK-009等多项III期研究正进一步探索抗PD-1抑制剂联合不同治疗策略在早/晚期TNBC中的疗效,其结果值得期待。
“去化疗”策略在TNBC新辅助治疗中的探索
尽管KEYNOTE-522等研究已确立化疗联合免疫治疗为新辅助治疗的临床标准,其pCR率达到了65%,但化疗与免疫治疗的联合带来的毒性负担(尤其在长期生存率较高的患者中)成为不可忽视的问题。因此,探索“去化疗”策略以优化疗效-毒性平衡,成为当前研究的重要方向。
ADC作为近年癌症治疗的重大突破,兼具靶向药物的精准性与化疗药物的强杀伤力,被称为“魔法子弹”。国内获批用于乳腺癌的ADC药物包括靶向HER2的恩美曲妥珠单抗、德曲妥珠单抗,以及靶向TROP2的戈沙妥珠单抗(SG)、芦康沙妥珠单抗。其中,SG作为TROP2靶向ADC,已在ASCENT研究中证实其在转移性TNBC二线及以上治疗中的显著疗效,这为其前移至新辅助治疗阶段并与免疫治疗联用提供了理论基础——本研究的核心目标,即探索SG联合帕博利珠单抗(P)能否在不依赖传统化疗的情况下,诱导足够高的pCR率。
NeoSTAR研究作为首项系统性评估SG联合P用于早期TNBC新辅助治疗的临床试验,其结果为“去化疗”策略提供了关键证据:SG/P联合4周期治疗后,32%的患者未接受额外化疗即达到pCR,这是SG首次以“新辅助”角色进入TNBC早期治疗,也是ADC联合免疫治疗可行性的首次验证;此外,结合26例未达初始缓解患者后续接受化疗的结果,总体pCR率提升至50%。
尽管与KEYNOTE-522等标准方案(化疗+免疫)相比,NeoSTAR的pCR率略低,但其临床意义不容忽视:
①毒性显著降低:仅40%的患者出现3级及以上不良反应(多为脱发、乏力、恶心等可管理毒性),且未新增严重免疫相关不良事件;
②避免常规化疗毒性:方案完全摒弃紫杉类、铂类等传统化疗药物,规避了神经毒性、骨髓抑制等常见风险,为化疗禁忌或注重生活质量的患者提供了替代选择;
③亚组优势凸显:在BRCA突变携带者亚组中,SG/P治疗的pCR率可达60%,提示通过分子分型或生物标志物筛选优势人群、实施个体化“去化疗”策略具有实践基础。
“响应指导”为新辅助治疗精准施策
本研究的另一大创新点在于采用了“响应指导”策略,这一模式为新辅助治疗的个体化决策提供了重要探索。该策略的核心是基于早期治疗反应动态调整后续方案:在完成4周期SG/P联合治疗后,通过RECIST v1.1影像学评估及穿刺活检(残余肿瘤细胞≤10%),将患者分为“良好应答者”(影像学完全缓解/iCR或接近iCR且活检提示低残留)和“未达标者”。其中,“良好应答者”可直接进入手术阶段,无需额外化疗;“未达标者”则需继续完成研究者指定的新辅助化疗后再手术。
研究结果初步验证了该策略的预测效能:达到“良好应答”标准的患者,最终手术时pCR的比例显著较高(66.6%,16/24),表明该策略能够精准识别出无需额外化疗即可获得深度缓解的人群。这一发现具有双重意义:一方面,避免了对部分高应答患者的过度治疗;另一方面,为“降阶梯治疗”提供了实践依据,推动新辅助治疗从“一刀切”模式向“个体化”模式转型。
而随着人工智能、多组学技术等精准医学工具的快速发展,未来的“响应指导”策略有望整合更多维度的动态疗效预测指标(如分子标志物变化、免疫微环境重塑等),进一步提升治疗决策的精准性,最终实现“一人一策”的新辅助治疗范式。
研究的局限性
尽管NeoSTAR研究为“去化疗”新辅助治疗提供了重要探索,但受限于研究设计与当前数据成熟度,其结果仍需审慎解读,主要存在以下局限性:
① 研究设计的天然限制——单臂II期设计:本研究为II期单臂临床试验,缺乏随机对照的对照组,因此无法直接与当前标准新辅助治疗方案(如KEYNOTE-522研究确立的化疗联合免疫方案)进行头对头疗效对比。其结果的外部效度(即能否推广至更广泛人群)及与标准方案的相对优势,需通过后续随机对照研究进一步验证。
② 样本量与亚组分析的局限性:研究样本量较小(仅纳入50例患者),部分关键亚组(如BRCA突变携带者,仅入组5例)的入组例数有限,可能导致亚组分析结果的统计学效力不足。例如,BRCA突变亚组的高pCR率(60%)虽提示潜在优势,但需在更大样本量的研究中验证其普适性。
③ 长期生存数据的不成熟性:当前研究主要报告了短期疗效指标(pCR率),而更具临床意义的长期生存终点(如无事件生存期EFS、总生存期OS)数据尚未成熟。pCR虽与长期预后存在相关性,但无法完全替代EFS/OS的直接证据,需更长时间的随访以明确SG/P方案对患者远期生存的影响。
④ “响应指导”策略的验证缺口:“响应指导”策略的长期价值仍需进一步验证:一方面,该策略能否通过减少过度治疗(如避免不必要的化疗)真正改善患者长期预后(如降低复发风险),需更长时间的随访数据支持;另一方面,该策略在临床实践中的标准化实施(如影像学评估标准、活检阈值的统一)也需要更多多中心研究的规范与验证。
未来展望
尽管存在上述局限,研究结果仍为“去化疗”策略提供了重要启示。目前尚不清楚SG/P的更长周期(6-8个周期)是否会导致更高的pCR率,需进一步的探索。未来若III期随机对照研究(如SG/P对比标准化疗+免疫方案)能证实其非劣效性或优势,则SG/P方案有望成为“去化疗时代”新辅助治疗的核心选择。同时还需研究识别与SG/P反应相关的机制和生物标志物,以更精准地实现“响应指导”策略。
此外,探索SG与PARP抑制剂、CTLA-4抗体或新型免疫调节剂的联合策略,或可进一步提升疗效,为不同分子分型的TNBC患者提供更精准的治疗选择。
黄建 教授 浙江大学医学院附属第二医院
TNBC因缺乏激素受体(ER/PR)及HER2表达,是乳腺癌中治疗难度最高、预后最差的亚型,其诊疗策略的突破始终是领域内的核心挑战。王震医生长期深耕TNBC临床与转化研究领域,以“直面难题、探索创新”的科研精神,持续推动该领域的临床实践进展。
本次对NeoSTAR研究的解读中,其工作展现出鲜明的学术特色:
内容维度的全面性:既紧扣研究核心数据展开深度剖析,又系统梳理了TNBC免疫治疗背景、ADC药物机制等关键内容,形成了从“基础机制-临床研究-实践价值”的完整逻辑链条;
数据呈现的严谨性:对研究结果的解读清晰规范,关键指标对比直观明确,体现了对临床研究数据的精准把握;
思维逻辑的缜密性:不仅客观总结了研究的突破性发现(“去化疗”可行性验证),更理性分析了研究的局限性及未来方向,展现了扎实的临床研究素养与科学的批判性思维。
整体而言,该解读兼具学术深度与临床实用性,既为同道提供了NeoSTAR研究的核心价值提炼,也为TNBC新辅助治疗的个体化探索提供了思路参考,充分体现了青年学者在临床研究转化中的专业功底与创新潜力。
【温馨提示】:如果您觉得王震医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


