主持国家自然科学基金青年项目1项(2025.01.01至2028.12.31)
发表多篇学术论文
ASCO 解读文献
Abstract 8518
S1900E: A phase II study examining impact of co-mutations on sotorasib for previously treated stage IV/recurrent KRAS G12C mutated (MUT) non-squamous (Non-sq) non-small cell lung cancer (NSCLC) (ECOG-ACRIN led Lung-MAP Sub-study)
Lung-MAP S1900E研究:一项前瞻性II期研究评估共突变对索托拉西布(sotorasib)治疗既往接受过治疗的IV期/复发性KRAS G12C突变非鳞(Non-sq)非小细胞肺癌(NSCLC)的影响
研究背景
KRAS G12C突变是非小细胞肺癌(NSCLC)中常见的驱动基因变异之一,约占NSCLC的13%。在KRAS突变亚型中,G12C是最主要的类型,占比约46%。
既往,KRAS G12C因蛋白结构曾被视为"不可成药"靶点。随着药物研发的突破,目前全球已有五款KRAS G12C抑制剂获批上市,包括:FDA批准的索托拉西布(sotorasib)和阿达格拉西布(adagrasib),NMPA批准的氟泽雷塞(flurazebostat)、格索雷塞(garsorasib)和戈来雷塞(glecirasib)。上述药物均被批准用于治疗经治的KRAS G12C突变晚期NSCLC患者。既往研究表明,KRAS G12C突变常与TP53、STK11、KEAP1等抑癌基因发生共突变。多项临床试验的事后分析显示,携带这些共突变的患者对KRAS G12C抑制剂的客观缓解率(ORR)、无进展生存期(PFS)及总生存(OS)显著降低。本研究的创新性在于:首次通过前瞻性队列设计,系统评估了KRAS G12C抑制剂索托拉西布在合并共突变的晚期NSCLC患者中的疗效。
研究方法
研究纳入LUNGMAP平台筛选的复发或转移性的KRAS G12C突变NSCLC患者,要求既往接受至少1线全身治疗后进展,并且ECOG体力状况评分为0或1分。
患者根据是否存在特定合并突变分为三个队列:① TP53共突变组(Cohort 1):TP53共突变,STK11/KEAP1/NFE2L2/CUL3野生型;②STK11共突变组(Cohort 2):STK11共突变,TP53/KEAP1/NFE2L2/CUL3野生型;③ 其他共突变组(Cohort 3):不符合上述分组的共突变类型(如:STK11/TP53双突变、KEAP1/NFE2L2/CUL3共突变、或无共突变)。所有患者接受索托拉西布单药治疗(960mg每日一次口服)直至疾病进展或出现不可耐受毒性。主要研究终点是根据RECIST 1.1标准评估各队列的客观缓解率(ORR);次要研究终点是持续缓解时间(DOR)、无疾病进展时间(PFS)、总生存(OS)及毒性。
研究结果
截止2025年4月10日,共有103例可评估的KRAS G12C突变患者纳入研究,包括40例T53共突变,25例STK11共突变及38例其他共突变。在TP53共突变队列、STK11共突变队列及其他共突变队列中,分别有70%、76%和55%的患者接受过铂类及PD-(L) 1的治疗。PD-L1≥ 50%的人群比例分别是45%,4%和32%。在38例其他共突变队列中,有9例(9/38,24%)为KEAP1、NFE2L2或CUL3共突变。三个队列的ORR分别为35%,16%和34%(图1)。中位DOR分别为7.1个月(2.7-11.5),7.9个月(1.6-NA)和6.8个月(3.0-11.8)(图1)。中位PFS分别为5.7个月(2.7-11.5),4.1个月(1.6-NA)和7.1个月(3.0-11.8)(图2A)。中位OS分别为18.2个月(12.2-33.7),8.0个月(5.1-14.2)和13.5个月(9.7-21.2)(图2B)。此外,研究中≥3级不良事件发生率与以往单药索托拉西布研究基本一致,未发现新增安全性信号。
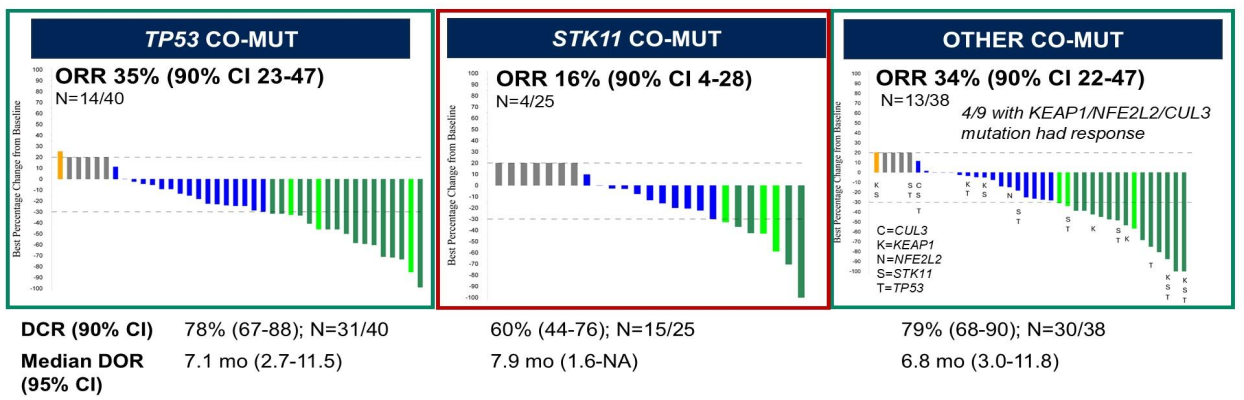 图1 三个队列的ORR、DCR和DOR
图1 三个队列的ORR、DCR和DOR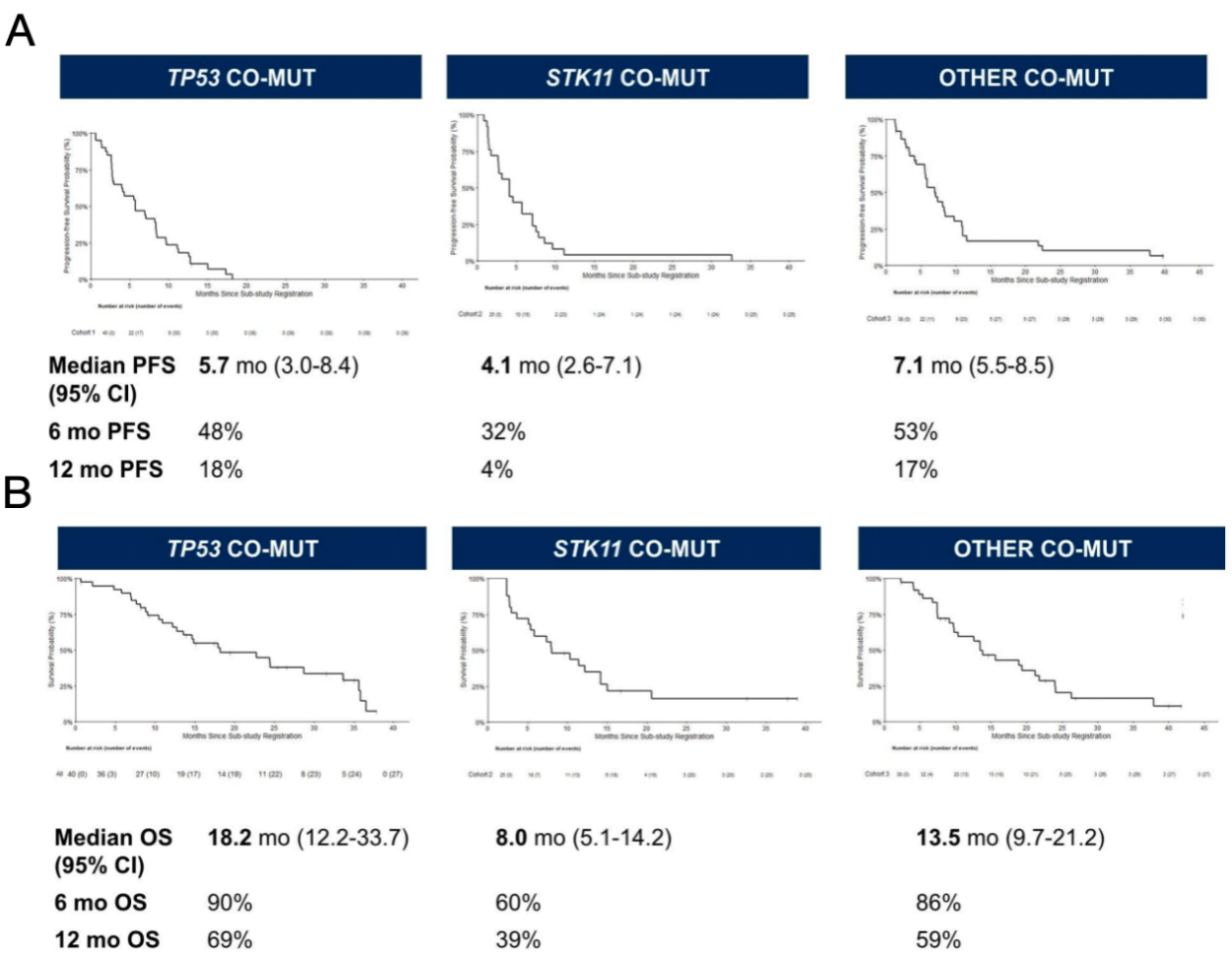
研究结论
本研究前瞻性的揭示了共存突变对KRAS G12C抑制剂索托拉西布疗效的影响。其中STK11共突变亚组未达到主要研究终点,疗效差于TP53共突变亚组及其他共突变亚组,提示STK11共突变可能对索托拉西布产生不利影响。未来需要更大样本量的数据进一步验证。
解读
从“不可成药”到临床突破,Lung-MAP S1900E研究精准定位有效人群
KRAS蛋白因其近球形致密结构、表面缺乏显著药物结合口袋的特性,加之其在GTP结合(活性态)与GDP结合(非活性态)间动态转换,导致小分子抑制剂难以实现高亲和力、选择性结合(尤其需区分突变体与野生型)。这些特性使KRAS长期被视为"不可成药"靶点。随着药物研发突破,首款KRAS G12C抑制剂索托拉西布(sotorasib)获批用于经治KRAS G12C突变NSCLC患者,标志着该类患者靶向治疗新时代的开启。阿达格拉西布(adagrasib)于2022年12月获FDA批准,中国亦相继批准氟泽雷塞、格索雷塞及戈来雷塞上市。作为小分子靶向药,KRAS G12C抑制剂在二线及以上治疗的客观缓解率(ORR)约30%-50%,中位无进展生存期(mPFS)约6-9个月,疗效显著低于EGFR/ALK等驱动基因阳性NSCLC的靶向治疗。虽既往研究提示共突变影响疗效,但结论均源于事后分析。Lung-MAP S1900E研究是首个基于共突变状态进行患者分层的前瞻性KRAS G12C抑制剂临床试验,为进一步精准定位有效人群提供了重要的依据。研究提示合并TP53突变不影响KRAS G12C抑制剂单药的疗效,而当合并STK11突变时患者的ORR、mPFS及mOS均劣于其他两个队列。提示STK11共突变可能对KRAS G12C突变的NSCLC患者中索托拉西布的疗效及预后产生不利影响。
不同共突变对KRAS G12C抑制剂疗效及预后的影响:来自不同研究的横向比较
KRAS G12C最常见合并的的共突变有PT53、KEAP1、STK11、ATM等,目前多项研究已报道共突变对KRAS G12C抑制剂疗效及预后的影响,但结果并非完全一致。
(1) TP53:TP53是最常见的抑癌基因之一。在KRAS G12C突变患者中,TP53共突变的发生率约为18%-50%。既往研究表明,在EGFR敏感突变患者中,TP53共突变会影响EGFR-TKI疗效。然而,在KRAS G12C突变人群中,多项研究证实TP53共突变并不影响KRAS G12C抑制剂的疗效(图3A-B)。Lung-MAP S1900E研究通过前瞻性试验进一步证实了这一点,明确TP53共突变不影响KRAS G12C抑制剂的疗效及预后。
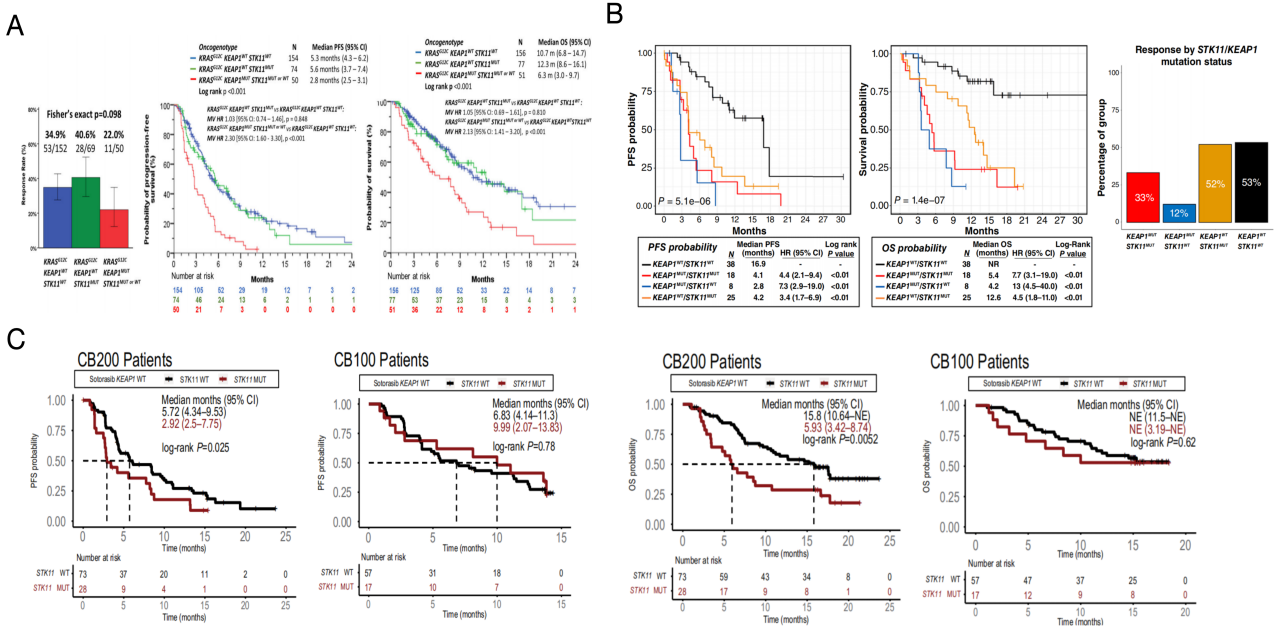
(2) KEAP1:KRAS G12C突变合并KEAP1共突变的发生率约为6%-23%。多项研究一致表明,KEAP1共突变对KRAS G12C抑制剂的疗效和预后产生不利影响(图4A-C)。近期一项Meta分析也指出KEAP1突变是影响KRAS G12C抑制剂疗效和预后的关键因素(图4D)。Lung-MAP S1900E研究的Cohort 3队列关于KEAP1共突变的具体数据尚未公布,有待后续结果披露。
(3) STK11:KRAS G12C突变合并STK11共突变的发生率约为10%-28%。目前多项研究评估了KRAS G12C抑制剂在STK11突变且KEAP1野生型患者中的疗效和预后,但结果存在不一致性(图5A-C)。这表明STK11突变可能并非独立的预测或预后因子,其影响可能受其他分子背景因素(如转录组层面改变)的协同作用,从而导致临床结果的差异。Lung-MAP S1900E研究纳入了25例STK11突变/KEAP1野生型患者,初步结果显示较低的客观缓解率(ORR:16%)、较短的无进展生存期(PFS:4.1个月)和总生存期(OS:8.0个月)。然而,鉴于样本量有限,此结果需谨慎解。
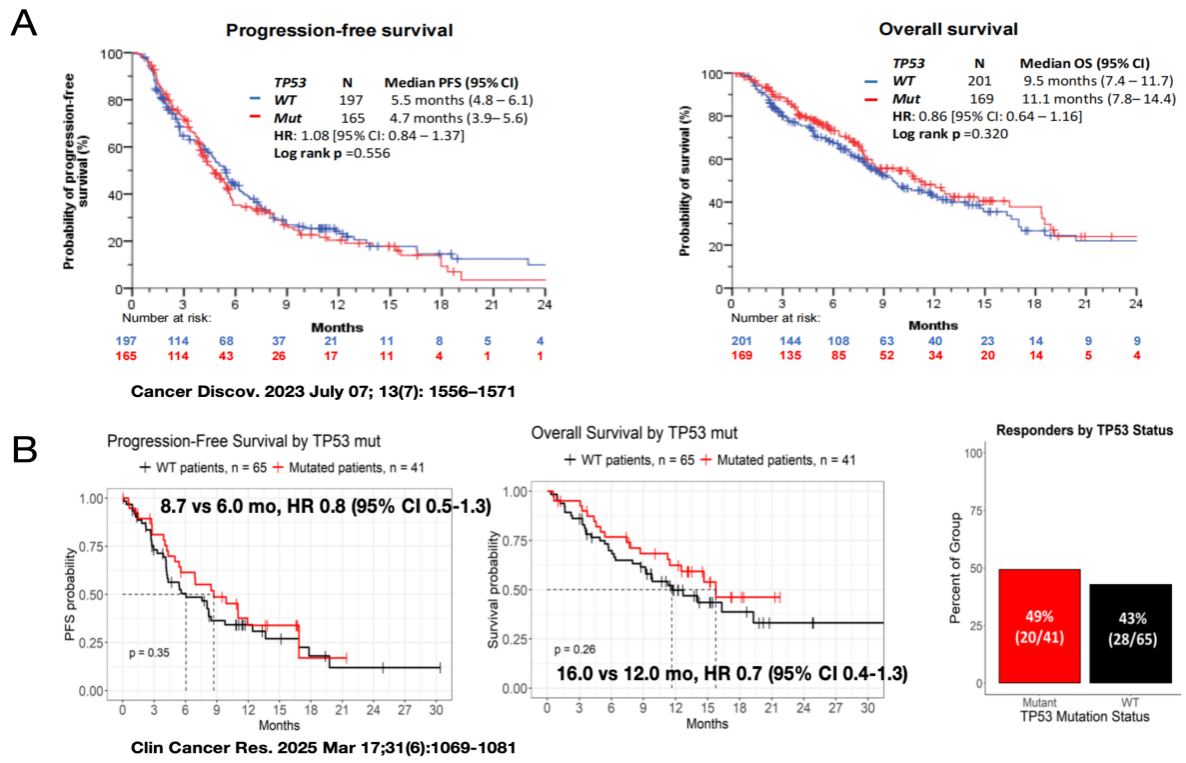 图3 KRAS G12C合并TP53突变的疗效数据
图3 KRAS G12C合并TP53突变的疗效数据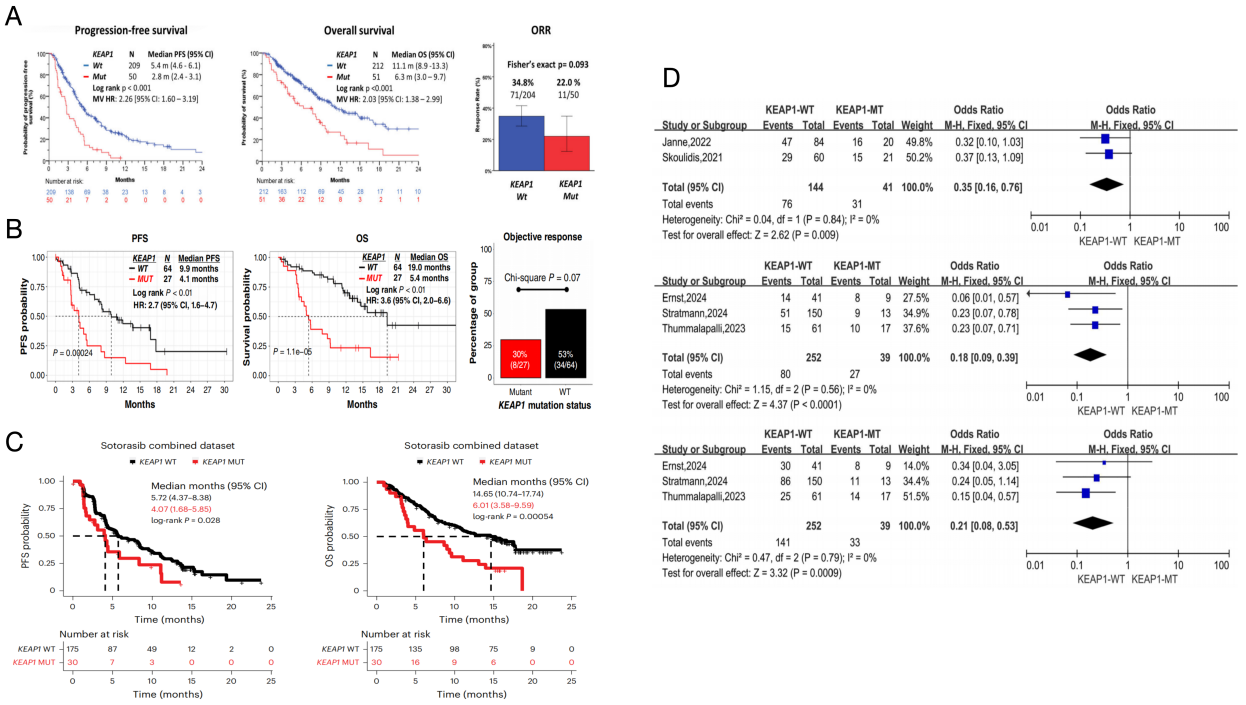
最佳预测生物标记物:基因组亚型 vs 转录组亚型?
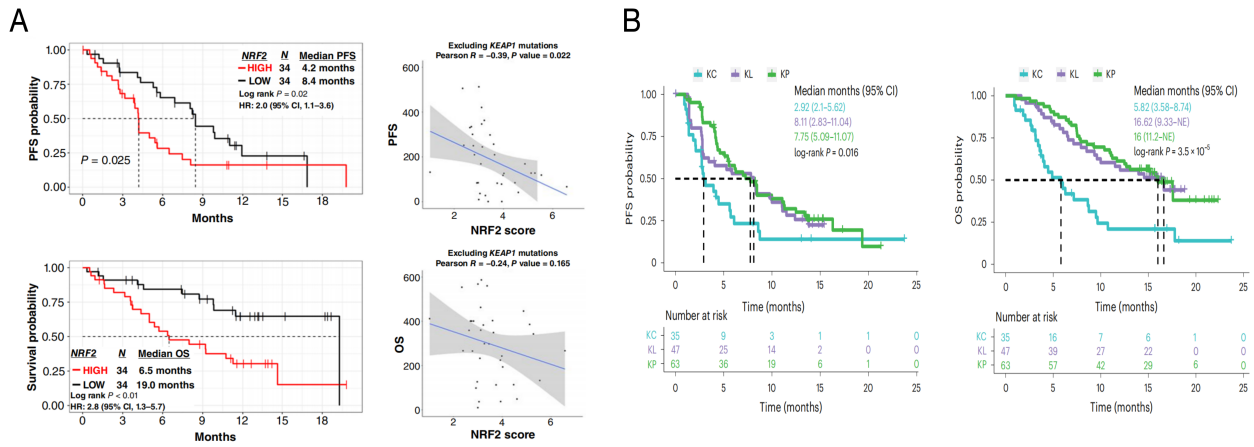
单一的基因组层面分析可能无法完全揭示KRAS突变NSCLC的异质性。因此,部分研究开始关注转录组层面改变对KRAS G12C抑制剂疗效的影响。KEAP1作为CUL3泛素连接酶复合物的底物受体,可与NRF2结合,促进其泛素化降解,从而维持细胞内NRF2的低水平。KEAP1功能缺失突变会导致NRF2在细胞内异常积累和信号通路持续激活。值得注意的是,KRYSTAL-1研究的事后分析发现,NRF2信号通路的高水平激活与阿达格拉西布(adagrasib)较差的PFS和OS显著相关。即使在KEAP1野生型患者中,NRF2高表达者的PFS和OS也显著差于NRF2低表达者(图6A)。这提示,KEAP1野生型但NRF2高表达的肿瘤,在功能表型上可能类似于KEAP1突变型肿瘤。这类肿瘤可能代表了另一类对阿达格拉西布治疗反应不佳、易出现早期进展的患者亚群。进一步地,近期发表的CodeBreaK 100/200研究事后分析,基于分子特征将KRAS G12C突变NSCLC明确划分为三种亚型:KP型(TP53富集、免疫“热”表型)、KL型(STK11/KEAP1突变、PD-L1低表达)和KC型(TTF1低表达、NRF2激活、CDKN2A缺失)。三种亚型在接受KRAS G12C抑制剂治疗时表现出显著不同的临床结局(图6B),其中KP和KL亚型的疗效明显优于KC亚型。
总结
KRAS G12C抑制剂单药是治疗KRAS G12C突变NSCLC患者的有效药物,但其单药整体有效率仍有待提高。既往研究表明,KRAS G12C突变人群肿瘤异质性显著,共存基因组改变或转录组背景异常可显著影响KRAS G12C抑制剂的疗效。因此,识别优势人群、阐明耐药机制并探索克服策略是未来研究的重点方向。此前相关研究多为KRAS G12C抑制剂临床试验的事后分析或回顾性数据解读。Lung-MAP S1900E研究作为首个基于共突变状态进行患者分层的前瞻性KRAS G12C抑制剂临床试验,具有突破性意义。该研究为精准定位KRAS G12C抑制剂有效人群提供了重要依据,并前瞻性地证实了合并TP53突变患者为潜在的优势获益人群。值得注意的是,对于STK11突变人群的作用,近期多项研究提示其可能并非单一的疗效预测或预后因素,其影响KRAS G12C抑制剂疗效的作用可能受其他分子背景的协同调控。鉴于Lung-MAP S1900E研究的样本量有限,对其结果的解读需持审慎态度。未来研究需整合基因层面及转录组层面数据,协同探索能预测KRAS G12C抑制剂疗效或预后的分子标志物,并基于此设计前瞻性临床试验进行验证。
周彩存教授——上海市东方医院
Lung-MAP S1900E研究是KRAS G12C突变NSCLC精准医疗领域的一项重要探索。其核心的价值在于前瞻性地、系统性地评估了共存基因组改变(如TP53、STK11、KEAP1等)对索托拉西布疗效的影响。这些发现为理解索托拉西布的耐药机制提供了线索,强有力地支持了未来基于更全面的分子分型(驱动突变+共突变图谱)来精准筛选最佳获益人群和设计联合治疗策略的必要性。当然,其结论仍需更大样本前瞻性研究进一步验证。陈薪如博士的点评解读系统且全面,引用近期发表的几篇高质量论文,敏锐的捕捉到当下对于KRAS G12C突变人群肿瘤异质性对KRAS G12C抑制剂疗效影响这一热点话题,并根据既往研究数据和本项研究进行深入浅出的分析,体现了其严谨的学术态度和卓越的思辨能力。
【温馨提示】:如果您觉得陈薪如医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


