2020年毕业于中山大学肿瘤防治中心,2020年8月-2022年8月于中山大学附属第六医院完成博士后训练。
2020年8月-2023年8月于中山大学附属第六医院完成放射肿瘤学住院医师规范化培训。
主要从事恶性肿瘤的基础和临床研究,围绕不同类型恶性肿瘤的预后因素、耐药机制、靶向治疗和免疫治疗等科学问题开展系列研究。
主要的研究内容包含两方面:(1)药物调控肿瘤相关巨噬细胞重编程的研究;(2)肿瘤发生、转移及耐药机制的研究。
主持国家自然科学基金青年项目1项、省自然科学基金青年项目1项、博士后启动基金1项,参与国家自然科学基金面上项目2项、省自然科学基金面上项目1项。
已发表论文10余篇,其中,以第一/通讯作者在Journal for ImmunoTherapy of Cancer、Cancer Communications、Journal of Advanced Research、Journal of Translational Medicine、 Frontiers in Oncology、Frontiers in Cellular and Infection Microbiology、Hematological Oncology等杂志发表论文10篇,其中3篇IF>10。
以第一发明人授权发明专利1项
中国老年保健协会肿瘤免疫治疗专业委员;
广东省健康科普促进会干细胞治疗与CART细胞治疗分会委员
ASCO摘要
Abstract 7006
Sintilimab (anti-PD-1 antibody) combined with chidamide (an oral subtype-selective HDACi) followed by P-GemOx regimen in patients with treatment-naïve extranodal natural killer/T cell lymphoma (TN-ENKTL): A multicenter, open-label, single-arm, phase II study (SCENT-2 trial)
信迪利单抗(抗PD-1抗体)联合西达本胺(口服亚型选择性HDAC抑制剂)序贯P-GemOx方案治疗初治结外自然杀伤/T细胞淋巴瘤(TN-ENKTL)患者:一项多中心、开放标签、单臂、II期研究(SCENT-2试验)
摘要
研究背景
结外自然杀伤/T细胞淋巴瘤(ENKTL)是一种高度侵袭性的非霍奇金淋巴瘤(NHL),在亚洲发病率较高。P-GemOx方案是标准一线治疗方案之一,毒性相对较轻。我们在先前的研究(SCENT试验)中证实,信迪利单抗联合西达本胺(SC)在复发或难治性(r/r)ENKTL患者中是安全有效的。在疾病进展至复发或难治状态之前即开始使用SC可能进一步优化患者预后。因此,我们开展了一项前瞻性研究,旨在评估SC序贯P-GemOx方案治疗初治(TN)ENKTL的疗效和安全性(NCT04994210)。本文我们报告早期(I/II期)患者的初步结果。
研究设计
这是一项研究者发起的研究。符合入组标准的患者年龄在18-80岁之间,经组织学确诊为TN-ENKTL。患者接受2个周期的SC治疗(SC×2),采用标准剂量(A部分)。一旦患者达到完全缓解(CR)或部分缓解(PR),则给予2个周期的P-GemOx治疗(P-GemOx×2)(B部分)。若患者达到疾病稳定(SD)或部分缓解(PR),则接受4个周期的P-GemOx(P-GemOx×4)。所有患者在B部分治疗后接受累野放疗(IFRT)。主要终点是A部分+B部分治疗后的完全缓解率(CRR)。关键次要终点包括A部分后的CRR、完全缓解持续时间(DoCR)、无进展生存期(PFS)、总生存期(OS)和安全性。根据P-GemOx方案的历史数据,我们预期A部分+B部分治疗后CRR为80%,最低可接受CRR为60%。所需样本量为47例。采用靶向淋巴瘤相关基因的捕获法二代测序(NGS)对治疗前的福尔马林固定石蜡包埋(FFPE)肿瘤组织和血液样本进行分析。
研究结果
自2022年8月至2024年12月,从中国3家中心入组了47例符合条件的患者。2例患者仍在治疗中。所有患者均接受了PET/CT疗效评估。在完成SC×2治疗的46例可评估疗效患者中,36例(78.2%)获得缓解,其中29例(60.3%)达到CR。接受P-GemOx治疗的中位周期数为2个(范围:1-4个)。在B部分治疗后,42例可评估疗效的患者中,CRR为95.2%(40/42),客观缓解率(ORR)为97.6%(41/42)。中位随访时间为12.4个月(范围:0.2-23.7个月)。1年DoCR率、PFS率和OS率分别为96.2%(95% CI:75.7-99.5)、97.5%(95% CI:83.6-99.6)和95.3%(95% CI:82.2-98.8)。最常见的血液学毒性包括中性粒细胞减少(97.8%)、淋巴细胞减少(89.4%)、贫血(74.5%)、血小板减少(58.7%);非血液学毒性包括食欲减退(38.3%)、恶心(38.3%)、脂肪酶升高(31.9%)。大部分毒性反应源于P-GemOx方案。3例患者死亡,其中2例死于疾病进展,1例死于意外事故。与疗效相关的肿瘤DNA数据将在会议上公布。
结论
SCENT-2试验的初步结果超出了预期的疗效。对于此类患者,该方案可能是一种前景广阔的减量化疗策略,且毒性可控。但仍需要更深入的研究。
解读
门冬酰胺酶基石之上:中国ENKTL治疗的低毒革命与“化疗减量”新征途
在中国,ENKTL发病率占所有淋巴瘤亚型的6%,是最常见的T细胞淋巴瘤亚型,但在欧美国家较为罕见。而早期ENKTL应用西方国家的强化疗疗效欠佳但毒副作用大,让中国患者难以耐受。SMILE方案(地塞米松+甲氨蝶呤+异环磷酰胺+左旋门冬酰胺酶+依托泊苷)在III/IV期初治及复发难治ENKTL患者中的31个月随访数据显示,4年DFS为64%,而3-4级以上AEs高达90%,导致治疗中断率明显升高[1]。
中国学者一如既往的探索ENKTL低毒高效的治疗方案,并卓有成效。基于ENKTL细胞表达高水平的P-糖蛋白,对蒽环类药物天然耐药[2],以门冬酰胺酶为基础的一线治疗方案P-GemOx(培门冬酶+吉西他滨+奥沙利铂)、GELAD(门冬酰胺酶+吉西他滨+依托泊苷+地塞米松)取得了很好的疗效,5年OS高达80%[3],均被NCCN指南推荐为一线标准治疗方案。而DDGP(地塞米松+顺铂+吉西他滨+培门冬酶)和GELOX(吉西他滨+奥沙利铂+左旋门冬酰胺酶)[4]也表现出超SMILE的疗效[5],更重要的是治疗毒性明显下降,耐受性良好。但尽管含门冬酰胺酶的治疗方案给ENKTL患者生存带来了跨越性的提高,但其长期生存仍远未令人满意,2年PFS和OS分别为32%和45%。复发难治患者的生存曲线急转直下,中位OS仅为6个月,因而一线治疗方案的完善仍有很长的道路。
T细胞淋巴瘤的新药进展步伐相对缓慢,但也陆续有些新药探索包括免疫检查点抑制剂、表观遗传调控药物如HDACi、信号通路药物PI3K抑制剂及JAK通路抑制剂、细胞表面靶向抗体(如CD30、CD38、CD52单抗等)等[6]。新药的出现势必会带来新的治疗方案的探索,如何将新药与传统化疗联合应用以达到提升疗效的同时减少化疗的用量,创造“Chemo-Reduced”,甚至 “Chemo-free”的可能性,这也是近些年来研究的热点和难点。
“表观免疫”点火,化疗减量增效:SCENT-2引领ENKTL进入“高效微毒”新时代
研究发现,免疫逃逸机制在ENKTL中扮演了关键角色,虽然PD-1抑制剂单药治疗有一定效果,但CR率和疗效持续时间较短[7]。PD-1抑制剂与传统化疗或其他靶向药物的组合也在不断探索中。PD-1抑制剂联合化疗可显著提升疗效,SPIRIT研究中信迪利单坑联合P-GemOx方案治疗晚期初治患者,总体ORR 100%,CRR 85%,2年PFS和OS分别达64%和91% [8]。提示免疫检查点抑制剂的联合应用可提升疗效,但联用方案需要更多的探索。基因组与转录组的结果显示:异常的表观遗传调控是 ENKTL 的重要分子遗传特征[9, 10],关于免疫逃避中表观遗传学的临床前研究阐明了表观遗传调节剂在增强肿瘤微环境和恢复免疫识别和免疫原性方面的重要作用,可将免疫性冷肿瘤转化为免疫性热肿瘤的活性,从而使肿瘤变得适合免疫治疗干预[11] (详见图1)。
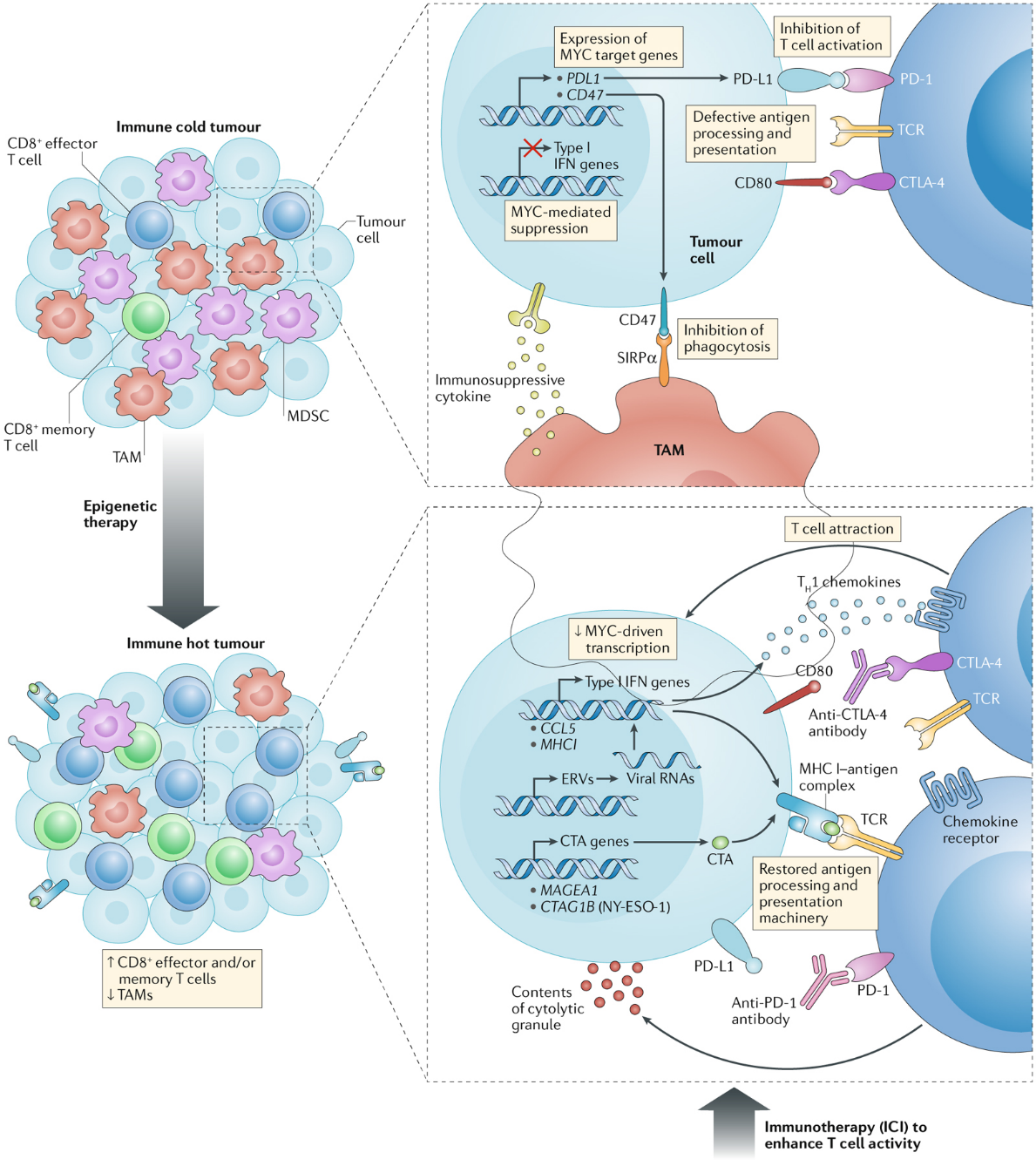 图1 表观遗传学和免疫治疗联合抗肿瘤策略的基本原理
图1 表观遗传学和免疫治疗联合抗肿瘤策略的基本原理黄慧强教授团队的基础研究结果也显示出PD-1抑制剂与HDAC抑制剂联用具有协同作用,继而开展了SCENT研究。SCENT研究中PD-1抑制剂、HDAC抑制剂联合放/化疗在复发难治性ENKTL的ORR 为59.5%,CRR 48.6%,3年OS和PFS率分别为47.4% 和 38.8%[12]。临床证实了PD-1抑制剂与HDAC抑制剂联用具有协同增效作用,展现该联用方案在复发难治患者中具有较好的应用前景。基于SCENT研究的成功,黄慧强教授团队进一步设计了SCENT-2研究,将PD-1抑制剂与HDAC抑制剂的联合方案应用于初治ENKTL患者,序贯联合P-GemOx化疗,旨在验证其在前线治疗中的真正的价值。方案设计上可以看出研究者希望通过减少化疗的暴露,为患者提供更安全、更有效的治疗选择,同时探索初治ENKTL治疗的新方向。
在SCENT-2研究中,主要关注初治ENKTL的早期患者。在治疗方案设计上,考虑到若将多种治疗药物同时应用,可能会导致毒性过大,患者耐受性差,因此将PD-1抑制剂联合HDAC抑制剂前置,序贯P-GemOx化疗,以避免毒性叠加,同时期望疗效能够得到进一步提升(详见图2)。现阶段从疗效来看,结果非常令人鼓舞:第一阶段表观免疫治疗后,ORR 为78.2%,CRR达60.3%;完成全部化疗方案后,ORR 达97.6%,CRR进一步提升至95.2%。中位随访时间为12.4个月,1年DoCR率、PFS率和OS率分别为96.2%、97.5%和95.3%,说明治疗结束时获得CR的患者在1年的随访期中仍保持CR(详见图3)。接受P-GemOx治疗的中位周期数为2个(范围:1-4个),提示患者接受化疗的总剂量明显减少。在安全性方面,大部分毒性反应源于P-GemOx方案,所观察到的毒性反应大多是可恢复、可预测且可控制的(详见图4)。
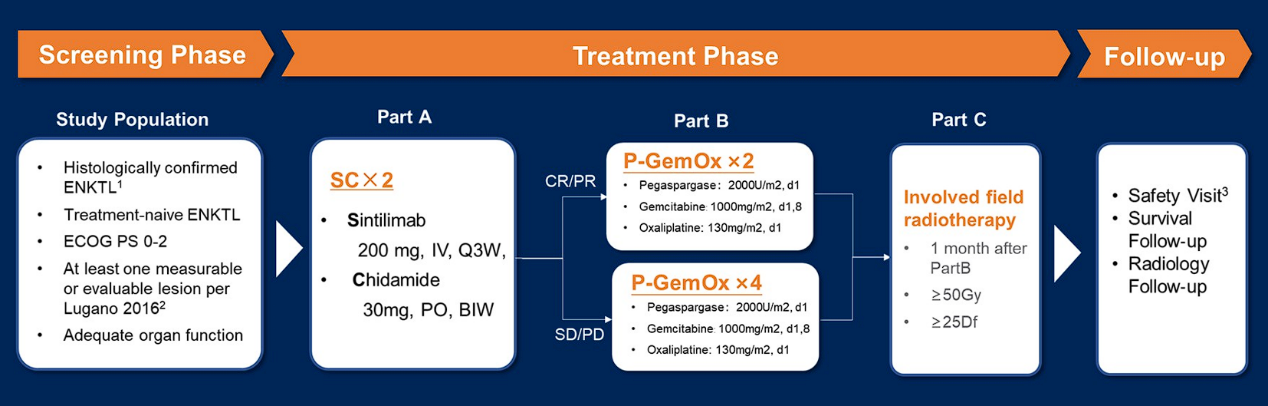 图2 SCENT-2研究设计
图2 SCENT-2研究设计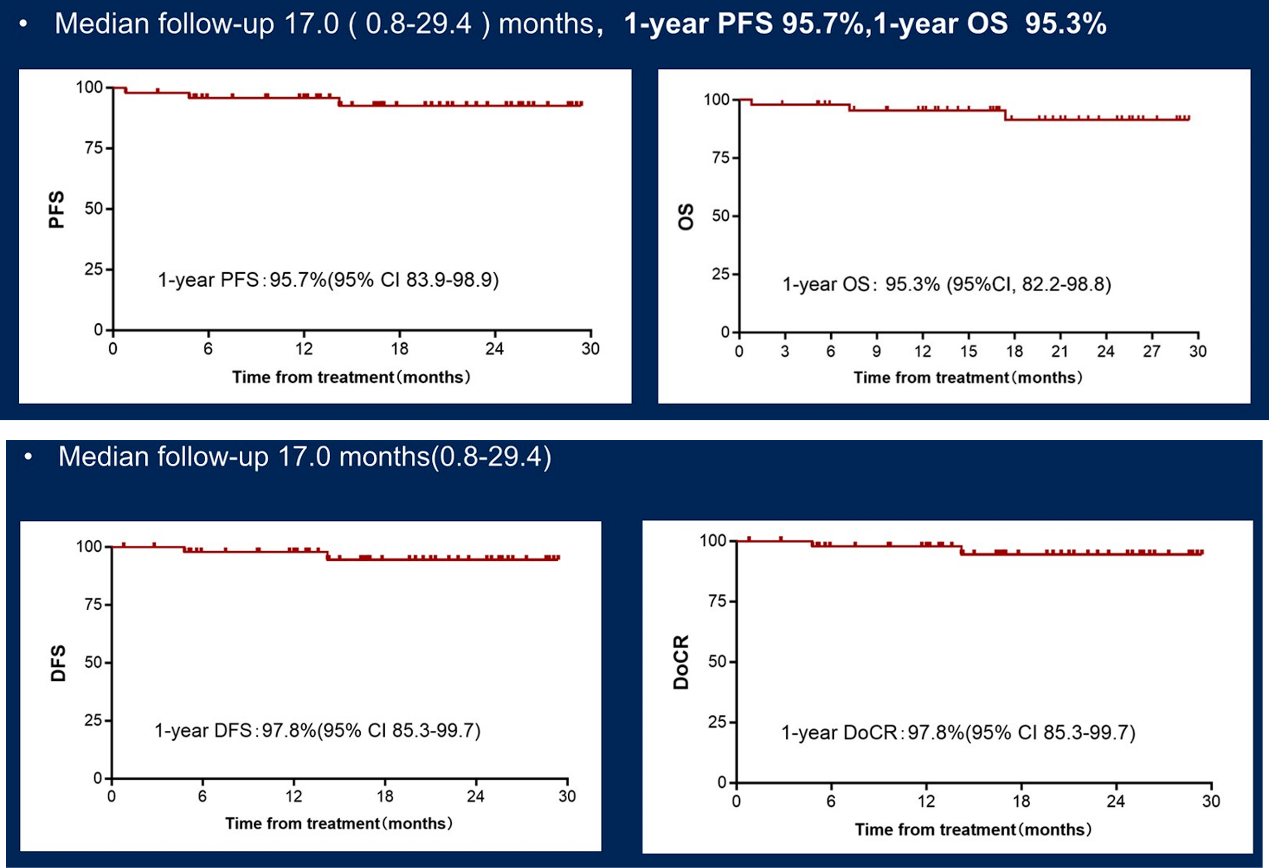 图3 SCENT-2研究结果
图3 SCENT-2研究结果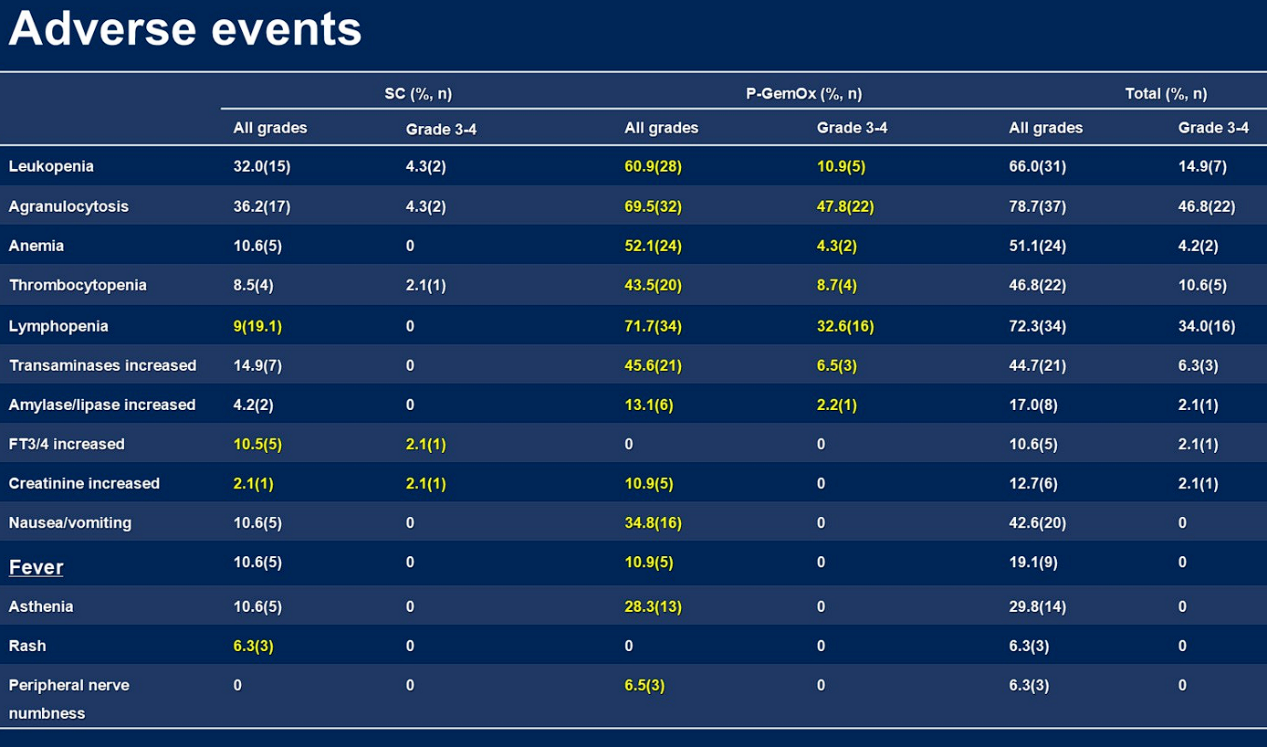
多项研究表明西达本胺单药治疗复发难治性ENKTL患者有效,联合免疫检查点抑制剂时更有强效协同作用机制及优异的临床表现。湖南省肿瘤医院周辉教授团队设计的CTP方案(西达本胺+替雷利珠单抗+培门冬酶)联合放疗,一线治疗高危Ⅰ期和Ⅱ期ENKTL患者,CR率达100%,展示出优越的疗效,安全性良好,主要为1-2级的不良反应[13]。未来我们期待更多高效低毒的一线方案能给ENKTL患者带来更多治疗选择。
晚期ENKTL攻坚:中枢侵犯与噬血综合征成“拦路虎”,深度诱导与靶向方案开辟生存新径
尽管早期ENKTL的一线治疗有诸多尝试,但晚期ENKTL呈高度侵袭性,对蒽环类药物不敏感,具有高复发风险,目前的治疗效果不尽人意,5年生存率仅为30%[14]。晚期患者中对于蒽环类不敏感的患者,接受含门冬酰胺酶方案作为一线治疗可达到约ORR 80%及CRR 50%;对于年轻且在一线化疗后获得CR的患者,进行自体造血干细胞移植(ASCT)可提升持续缓解和治愈机会,预后更佳。老年患者或不适合ASCT的患者可考虑在一线方案中加入PD-1抑制剂,或者是在一线治疗缓解后应用PD-1抑制剂维持治疗。ASCT前能否达到CR是晚期ENKTL患者治愈的关键,因此如何让患者在诱导治疗中尽早达到CR状态仍是研究的难点。复旦肿瘤医院陶荣教授团队在晚期ENKTL中采用MEDA方案(甲氨蝶呤+依托泊苷+地塞米松+培门冬酶)诱导4周期后达CR的患者序贯ASCT巩固治疗,4年EFS可达80%,明显高于应用SMILE和AspMetDex方案作为诱导治疗方案。因此,可使晚期患者尽早达到深度缓解的诱导治疗方案仍值得进一步探索。
晚期患者中还有一部分患者的治疗难度较高:中枢侵犯患者与合并噬血细胞综合征(HLH)的患者。数据统计约有4-8%的ENKTL患者在治疗中出现中枢受侵,而一旦出现中枢受累,其生存期不超过1年[15]。如何治疗中枢受侵的患者,目前尚无统一方案。李志铭教授牵头的一项小样本II期临床研究中,GAD-M(吉西他滨+培门冬酶+地塞米松+大剂量MTX)方案在初治ENKTL中总体ORR达到91.6%,CR率83.3%,5年PFS及OS分别为68.3%及77.8%,没有患者出现中枢复发[16]。CLAMP方案(卡瑞利珠单抗+培门冬酶+依托泊苷+大剂量甲氨蝶呤)治疗的41例患者中有14例为中枢浸润高风险,总体ORR达到了95.12%,2年PFS及OS分别为72.81%和88.03%,较中枢受侵低风险的患者预后无明显差异[17]。以上研究均提示:以培门冬酶为基础,包含大剂量MTX的一线治疗方案在预防中枢浸润方面具有可观的疗效,PD-1抑制剂的作用也值得进一步探索。
约有11.9%的ENKTL患者继发HLH,合并噬血细胞综合征在晚期ENKTL和复发/难治患者中发生率较高(初发晚期约20%合HLH,复发难治阶段则约80%)。一旦并HLH,治疗难度骤升,6个月生存率仅34.4%[18]。包含VP-16及DEX的方案(如L-DEP/DEP、HLH-94等)为常用的治疗方法[19]。也有学者采用GPED(吉西他滨+培门冬酶+依托泊苷+地塞米松)方案治疗初治ENKTL合并HLH的患者获得了ORR 73%,CRR 36%的疗效[20],而在抗HLH治疗之后使用PD-1抑制剂或JAK抑制剂,似乎可改善这类患者的生存[21]。但总的来说对于晚期、治疗难度高的ENKTL患者,表观免疫联合化疗是否也能取得好的疗效,依然需要更多的探索。
综上,SCENT-2在方案设计展现了对ENKTL一线治疗方案的高效低毒提出了新要求,经过对现有一线方案的取长补短、精雕细琢,获得了超预期的疗效和安全性。虽然晚期、高危ENKTL一线治疗探索道阻且长,但在新药时代的背景下,不断尝试更优的组合方式,积跬步以至千里,相信能进一步改善ENKTL一线治疗的结局。
吴辉菁教授—湖北省肿瘤医院
王彩琴博士解读的这篇摘要主要为SCENT-2方案治疗初治ENKTL的单臂II期前瞻性研究,围绕该研究方案背景、研究设计和研究结果进行深入解读。同时,王彩琴博士还结合目前ENKTL一线治疗方案的现状、治疗难点及最新进展,剖析了该研究的独到之处及研究亮点,也提出了对晚期、高危患者的治疗思考。逻辑清晰,解析到位,图文结合方式更直观易懂,也期待ENKTL的一线治疗方案探索不断完善,带来更优的生存。
1.Kwong, Y.L., et al., SMILE for natural killer/T-cell lymphoma: analysis of safety and efficacy from the Asia Lymphoma Study Group. Blood, 2012. 120(15): p. 2973-80.
2. Qi, S.N., et al., First-line non-anthracycline-based chemotherapy for extranodal nasal-type NK/T-cell lymphoma: a retrospective analysis from the CLCG. Blood Adv, 2020. 4(13): p. 3141-3153.
3. Zhang, Y., et al., Sequential P-GEMOX and radiotherapy for early-stage extranodal natural killer/T-cell lymphoma: A multicenter study. Am J Hematol, 2021. 96(11): p. 1481-1490.
4. Wang, L., et al., First-line combination of gemcitabine, oxaliplatin, and L-asparaginase (GELOX) followed by involved-field radiation therapy for patients with stage IE/IIE extranodal natural killer/T-cell lymphoma. Cancer, 2013. 119(2): p. 348-55.
5. Wang, X., et al., Efficacy and Safety of a Pegasparaginase-Based Chemotherapy Regimen vs an L-asparaginase-Based Chemotherapy Regimen for Newly Diagnosed Advanced Extranodal Natural Killer/T-Cell Lymphoma: A Randomized Clinical Trial. JAMA Oncol, 2022. 8(7): p. 1035-1041.
6. Tian, X.P., et al., Novel target and treatment agents for natural killer/T-cell lymphoma. J Hematol Oncol, 2023. 16(1): p. 78.
7. Kline, J., J. Godfrey, and S.M. Ansell, The immune landscape and response to immune checkpoint blockade therapy in lymphoma. Blood, 2020. 135(8): p. 523-533.
8. Tian, X.P., et al., First-line sintilimab with pegaspargase, gemcitabine, and oxaliplatin in advanced extranodal natural killer/T cell lymphoma (SPIRIT): a multicentre, single-arm, phase 2 trial. Lancet Haematol, 2024. 11(5): p. e336-e344.
9. Li, Z., et al., Genetic risk of extranodal natural killer T-cell lymphoma: a genome-wide association study. Lancet Oncol, 2016. 17(9): p. 1240-7.
10. Xiong, J., et al., Genomic and Transcriptomic Characterization of Natural Killer T Cell Lymphoma. Cancer Cell, 2020. 37(3): p. 403-419.e6.
11. Topper, M.J., et al., The emerging role of epigenetic therapeutics in immuno-oncology. Nat Rev Clin Oncol, 2020. 17(2): p. 75-90.
12. Gao, Y., et al., Sintilimab (anti-PD-1 antibody) plus chidamide (histone deacetylase inhibitor) in relapsed or refractory extranodal natural killer T-cell lymphoma (SCENT): a phase Ib/II study. Signal Transduct Target Ther, 2024. 9(1): p. 121.
13. Li yajun,Zeng ruolan,He yizi, Z.h. a prospective phase II clinical trial using chidamide, tislelizumab and pegaspargase in combination with radiotherapy as first-line treatment in stages i/ii of extranodal NK/T-cell lymphoma. in 2023 ASH. 2023.
14. Fox, C.P., et al., Survival outcomes of patients with extranodal natural-killer T-cell lymphoma: a prospective cohort study from the international T-cell Project. Lancet Haematol, 2020. 7(4): p. e284-e294.
15. Zing, N., et al., Diagnosis, prevention and treatment of central nervous system involvement in peripheral t-cell lymphomas. Crit Rev Oncol Hematol, 2021. 167: p. 103496.
16. Wang, Y., et al., Phase II Study of Gemcitabine, Peg-Asparaginase, Dexamethasone and Methotrexate Regimen for Newly Diagnosed Extranodal Natural Killer/T-Cell Lymphoma, Nasal Type: Final Analysis With Long-Term Follow-Up and Rational Research for the Combination. Front Oncol, 2022. 12: p. 796738.
17. Zhang, T.L.Q.L.X.M.H.Z.Y.D.F.Z.X.L.G.W.M.X.L., A phase II prospective study of camrelizumab combined with pegaspargase, etoposide, and high-dose methotrexate in patients with natural killer (NK)/T-cell lymphoma, in 2024 ASCO. 2024.
18. Wei, L., et al., Using etoposide + dexamethasone-based regimens to treat nasal type extranodal natural killer/T-cell lymphoma-associated hemophagocytic lymphohistiocytosis. J Cancer Res Clin Oncol, 2021. 147(3): p. 863-869.
19. Meng, G., et al., Clinical characteristics and treatment of NK/T-cell lymphoma-associated HLH. Ann Hematol, 2022. 101(10): p. 2289-2296.
20. Fu, R., et al., Combination of gemcitabine, pegaspargase, etoposide, and dexamethasone (GPED) in treatment of advanced extranodal NK/T-cell lymphoma. Chin Med J (Engl), 2023. 136(6): p. 732-734.
21. He, Y., et al., The emerging role of anti-PD-1 antibody-based regimens in the treatment of extranodal NK/T-cell lymphoma-associated hemophagocytic lymphohistiocytosis. J Cancer Res Clin Oncol, 2023. 149(5): p. 2017-2027.
【温馨提示】:如果您觉得王彩琴医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


