研究方向:肿瘤生物大数据分析以及肺癌、食管癌的基础研究
日本国立癌症中心访问学者
主要研究机器学习,食管癌,肺癌大数据筛查与临床诊疗
中国抗癌协会肿瘤缺氧生物学和临床应用委员
福建省抗癌协会肿瘤内科专委会第二届青委会委员
福建省医师协会胸外科分会第一届数字医学与应用学组委员
福建省医师协会胸外科分会第一届胸部肿瘤研究者学组委员
中国老年学和老年医学学会肿瘤康复分会委员
2022获得福建省抗癌协会科技进步三等奖,第二完成人
发表多篇学术文章
ASCO 解读文献
LB4027: Tislelizumab (TIS; BGB-A317) plus chemotherapy (CT)/chemoradiotherapy (CRT)
as positron emission tomography (PET)–guided neoadjuvant (n) treatment (tx) for
resectable esophageal squamous cell carcinoma (R-ESCC): RATIONALE-213 final
analysis.
PET-CT引导替雷利珠单抗联合化疗/放化疗新辅助治疗可切除食管鳞状细胞癌的RATIONALE-213最终分析
研究背景
研究表明局部晚期食管鳞癌患者接受新辅助放化疗(nCRT)联合手术对比单纯手术可改善总生存期。然而,术前放化疗可能存在额外的安全问题,导致部分患者接受新辅助化疗(nCT)而非新辅助放化疗。诱导化疗(IC)后PET-CT最大标准化摄取(SUVmax)变化已被证明对接受新辅助放化疗的可切除食管鳞癌患者的病理完全缓解(pCR)具有可靠的预测价值,并且可能优化新辅助治疗方案的选择。替雷利珠单抗(抗PD-1)已改善了食管鳞癌患者的生存期。RATIONALE-213,评估PET引导下新辅助替雷利珠单抗联合CT/CRT用于可切除食管鳞癌(NCT04974047),是一项在中国开展的2期、开放标签、多中心研究,在此,公布其最终分析结果。
研究方法
入组标准为成年患者经组织学确诊为可切除食管鳞癌(cT1-2N+M0或cT3N任何M0),ECOG体能状态为0/1,器官功能良好,无瘘管风险,且未接受过先前治疗。患者进行基线PET扫描、1周期化疗(顺铂-紫杉醇),并在15-21天后进行PET扫描。根据原发肿瘤第二次PET SUVmax的下降百分比,将患者按对化疗反应分为2个队列:反应者(R,≥35%)或无反应者(NR,<35%)。两个队列均接受3周期200mg静脉注射替雷利珠单抗,每3周一次,前2周期反应组联合化疗(2周期顺铂-紫杉醇),无反应组联合放化疗(2周期研究者选择的化疗方案[顺铂-紫杉醇或5-FU+顺铂]+放疗[40Gy/20分次]),然后进行手术。主要终点是当地病理学家评估的pCR。次要终点包括1年无病生存期(DFS)、1年无事件生存期(EFS)、术前客观缓解率(ORR)、研究者评估的R0切除率和安全性。
研究结果
在入组的70例患者中,II期、III期和IVA患者分别有15例(21.4%)、48例(68.6%)和7例(10.0%)。截至2024年10月25日(中位随访25.5个月),30例为反应组,40例为无反应组。反应组中,20例(66.7%)进行了手术。无反应组中,32例(80.0%)进行了手术。疗效终点见下表。反应组和无反应组的中位DFS和EFS均未达到。3级治疗相关不良事件(TRAEs)与既往的化疗或放化疗毒性一致,分别反应组(15例[50.0%])和无反应组(33例[82.5%]);5例反应组(16.7%)和7例未反应组(17.5%)发生严重TRAEs。没有TRAEs导致手术取消或死亡。
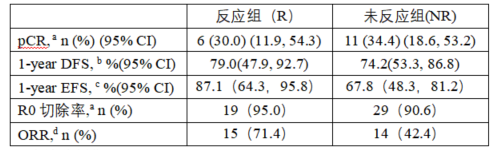
a疗效分析集(EAS):R = 20;NR = 32
b有R0切除的EAS:R = 19;NR = 29
c安全性分析集(SAS):R = 30;NR = 40
d基线时有可测量疾病的SAS:R = 21;NR = 33
研究结论
PET引导的方法可能有助于优化可切除食管鳞癌的新辅助治疗。新辅助替雷利珠单抗联合CT/CRT在反应者和无反应者中均显示出有前景的疗效和可耐受的安全性。
解读
1.PET引导策略的创新价值与设计突破
RATIONALE-213研究最显著的贡献在于开创了基于早期代谢反应的动态适应性治疗模式。该研究采用诱导化疗后PET-CT扫描的SUVmax变化率(ΔSUVmax)作为实时生物标志物,将患者分为应答组(ΔSUVmax≥35%)和非应答组(ΔSUVmax<35%),并据此制定差异化的新辅助治疗方案。应答组继续接受替雷利珠单抗联合化疗(免除放疗),而非应答组则升级为替雷利珠单抗联合放化疗。这种设计首次在食管鳞癌(ESCC)领域实现了治疗强度的动态调整,突破了传统“一刀切”的治疗范式。
这种策略的科学基础在于:肿瘤代谢反应与病理学结局存在紧密关联。既往研究显示,诱导化疗后PET-CT的SUVmax变化能可靠预测新辅助放化疗后的病理完全缓解(pCR)可能性。RATIONALE-213研究创新性地将这一预测指标转化为治疗决策的关键节点,使治疗方案能根据肿瘤的生物学行为进行实时优化。尤其对于初始化疗反应不佳的患者(非应答组),及时增加放疗的强化策略,成功将其pCR率提升至34.4%,甚至略高于应答组的30.0%1。这证实了适应性升级治疗可克服原发耐药,改善传统化疗不敏感患者的肿瘤局部控制。
这种动态策略的临床价值还体现在手术安全性的保障。尽管非应答组因接受放化疗导致≥3级治疗相关不良事件(TRAEs)发生率较高(82.5% vs 应答组50.0%),但未发生因TRAEs导致手术取消或死亡的事件,两组R0切除率均超过90%1。这表明适应性调整在提升疗效的同时,维持了可接受的安全性阈值,为后续手术创造了条件。尤其对于应答组患者,豁免放疗显著降低了肺损伤、食管纤维化等长期并发症风险,这对食管癌患者术后的生活质量至关重要。
2.疗效数据的深度解析与生存悖论
RATIONALE-213研究呈现了看似矛盾的疗效结果:尽管非应答组通过治疗强化获得了与应答组相当的pCR率(34.4% vs 30.0%)和R0切除率(92.6% vs 95.0%),其1年无事件生存率(EFS)却显著低于应答组(67.8% vs 87.1%)。这种pCR与生存获益的“脱节”现象,揭示了当前食管癌新辅助治疗领域的关键科学问题。
2.1 生存差异的潜在机制
这种差异可能源于两类人群本质不同的肿瘤生物学行为。应答组:对化疗敏感,反映其肿瘤微环境可能更易被免疫治疗重塑。较高的EFS率(87.1%)提示该类患者通过替雷利珠单抗+化疗即可获得持久的疾病控制。非应答组:原发化疗耐药提示可能存在更强的肿瘤异质性和免疫抑制微环境。尽管通过增加放疗提高了局部控制(pCR和R0切除率),但较高的远处复发风险仍导致EFS显著降低(67.8%)。
EFS与DFS的差异也提供了重要线索:EFS作为复合终点(涵盖疾病进展、局部复发、远处转移及治疗相关事件),比DFS更敏感地捕捉了非应答组的早期治疗失败事件。这反映了放化疗联合免疫治疗虽能提升局部控制,但对微转移灶的清除能力仍不足。
2.2 跨研究对比的启示
将RATIONALE-213置于食管癌新辅助治疗研究谱系中观察,可见其独特定位:对比NEOCRTEC5010研究(放化疗pCR率43.2%)1:本研究中两组pCR率(30.0%-34.4%)虽未超越该数据,但非应答组在初始化疗无效的前提下仍达34.4%的pCR,证实了治疗升级的价值;对比ESCORT-NEO/NCCES01研究(免疫+化疗pCR率28%)2:应答组通过PET筛选豁免放疗后仍获30.0%的pCR,为降阶治疗提供了依据;对比JCOG1109研究(三药化疗vs放化疗)3:该研究同样显示pCR未转化为OS差异,提示单纯病理学终点不足以预测长期获益,需结合分子分型与代谢反应。
值得注意的是,1年DFS数据(应答组79.0% vs 非应答组74.2%)未显示显著差异,提示单纯局部复发风险在两组中相近。EFS的差异主要源于非应答组更高的全身性进展风险,这为未来优化系统治疗提供了方向。
3.精准医学面临的挑战与未解之题
该项研究是一个II期单臂研究,样本量相对较小(n=70),且缺乏随机对照组。因此,其结果需要更大规模的III期随机对照试验来验证。同时生存数据(中位DFS/EFS)尚未成熟。研究结果支持了PET引导策略的价值,但需要进一步研究来确定最佳的SUVmax变化阈值(35%是否最优)以及这种策略是否确实能比标准方案带来生存优势。生物标志物优化是精准医疗的核心挑战。目前PD-L1表达作为主要预测标志物存在局限性,RATIONALE-213中,PET代谢反应与PD-L1表达水平的关系尚未明确。特别是基于PET代谢反应动态评估的适应性生物标志物,可能比静态指标更具临床指导价值。
总之,RATIONALE-213研究的深层价值在于将“动态适应性治疗” 理念引入食管鳞癌新辅助领域。通过PET代谢反应实时区分化疗敏感人群(豁免放疗)与耐药人群(强化放免联合),该策略不仅使两类人群均获得>30%的pCR率和>90%的R0切除率,更揭示了肿瘤生物学行为对远期生存的深层影响,即使通过治疗升级提升局部控制,原发耐药患者仍面临更高的全身性复发风险(1年EFS 67.8% vs 应答组87.1%)。这种“病理缓解-生存获益”的分离现象,凸显了当前精准医学的复杂性。未来的突破需依赖多组学生物标志物整合(如PET参数+PD-L1+TMB+ctDNA)、新型联合策略(如非应答组加用靶向药物或免疫双抗)。随着多项围手术期III期研究推进,个体化免疫治疗有望重塑食管鳞癌的临床实践,最终实现从“一刀切”到“量体裁衣”的诊疗范式转变。
柳硕岩教授 福建省肿瘤医院
王佩元博士对于RATIONALE-213研究进行深入的解读。该研究通过PET引导在治疗早期识别反应不足患者并及时干预,可能提高整体治疗效果。RATIONALE-213研究开创的PET引导新辅助治疗模式标志着可切除食管鳞癌个体化治疗的重要进步。该研究证明,基于早期代谢反应动态调整治疗策略(替雷利珠单抗+化疗用于响应者,升级为联合放化疗用于非响应者),能够在整体人群中获得不错的pCR率和R0切除率,且安全性可控。这一结果为临床实践提供了一种灵活而精准的治疗框架。这一发展轨迹不仅体现了肿瘤治疗从“一刀切”到“个体化”的演变,更彰显了精准免疫治疗时代下,临床研究与转化医学深度融合的巨大潜力。未来需通过多学科协作(外科、影像、分子病理)构建“局部控制-全身清除”双轨并行的治疗体系,最终实现从“病灶切除”到“生物学治愈”的跨越。
【温馨提示】:如果您觉得王佩元医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. Yang H, Liu H, Chen Y, et al. Long-term Efficacy of Neoadjuvant Chemoradiotherapy Plus Surgery for the Treatment of Locally Advanced Esophageal Squamous Cell Carcinoma: The NEOCRTEC5010 Randomized Clinical Trial [published correction appears in JAMA Surg. 2022 Sep 1;157(9):859. doi: 10.1001/jamasurg.2022.3765.]. JAMA Surg. 2021;156(8):721-729. doi:10.1001/jamasurg.2021.2373
2. Qin J, Xue L, Hao A, et al. Neoadjuvant chemotherapy with or without camrelizumab in resectable esophageal squamous cell carcinoma: the randomized phase 3 ESCORT-NEO/NCCES01 trial. Nat Med. 2024;30(9):2549-2557. doi:10.1038/s41591-024-03064-w
3. Kato K, Machida R, Ito Y, et al. Doublet chemotherapy, triplet chemotherapy, or doublet chemotherapy combined with radiotherapy as neoadjuvant treatment for locally advanced oesophageal cancer (JCOG1109 NExT): a randomised, controlled, open-label, phase 3 trial. Lancet. 2024;404(10447):55-66. doi:10.1016/S0140-6736(24)00745-1











 苏公网安备32059002004080号
苏公网安备32059002004080号


