毕业于北京协和医学院
从事肺癌、消化道等肿瘤诊治
天津市抗癌协会癌症康复与姑息治疗专业委员会委员
天津医科大学总医院新世纪人才、卓越新星
主持国自然自然科学基金青年项目1项
发表sci论文9篇,其中以第一作者身份发表5篇
ASCO 解读文献
Abstract 8507: Sacituzumab tirumotecan (sac-TMT) in patients (pts) with previously treated advanced EGFR-mutated non-small cell lung cancer (NSCLC): Results from the randomized OptiTROP-Lung03 study.
芦康沙妥珠单抗(sac-TMT)用于既往接受过治疗的晚期EGFR突变非小细胞肺癌(NSCLC)患者的随机OptiTROP-Lung03研究结果
研究背景
在EGFR-TKI和含铂化疗进展的EGFR突变NSCLC患者中,多西他赛作为标准治疗疗效欠佳,亟需更优治疗方案。芦康沙妥珠单抗作为新型TROP2 ADC,通过偶联贝洛替康衍生的拓扑异构酶I抑制剂研制而成。Ⅰ期临床试验(AACR 2024)显示,该药物在EGFR突变NSCLC患者中表现出令人鼓舞的抗肿瘤活性。本研究针对EGFR-TKI和含铂化疗后进展的NSCLC患者,比较了芦康沙妥珠单抗与多西他赛的疗效和安全性。
研究方法
研究共纳入137例经EGFR TKI治疗及含铂化疗后进展的晚期EGFR突变NSCLC患者,按2:1比例随机分组接受芦康沙妥珠单抗(5 mg/kg,每2周一次)或多西他赛(75 mg/m²,每3周一次)治疗。多西他赛组患者若经盲态独立评审委员会(BIRC)确认进展且符合条件,可交叉至芦康沙妥珠单抗组。研究的主要终点是BIRC评估的客观缓解率(ORR)。关键次要终点为无进展生存期(PFS)。后续终点为总生存期(OS)。
研究结果
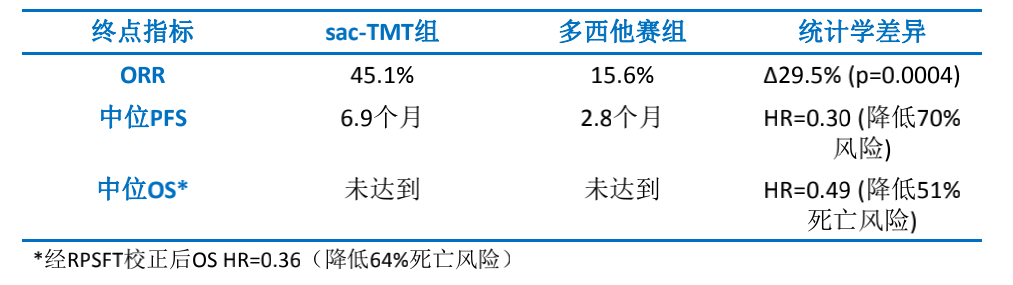
截至2024年12月31日,中位随访时间12.2个月,137名总体人群中(中位年龄56岁;男性43.8%;ECOG PS评分1分者82.5%;93.4%曾接受第三代EGFR-TKI治疗),91名患者随机分配至芦康沙妥珠单抗组,46名患者随机分配至多西他赛组,芦康沙妥珠单抗组25.3%患者仍在接受治疗,而多西他赛组仅为4.3%。研究达到主要及关键次要终点。结果显示,BIRC评估的芦康沙妥珠单抗组ORR达45.1%,显著高于多西他赛组的15.6%(p=0.0004),提升近3倍。在PFS方面,BIRC评估的中位PFS为6.9个月 vs 2.8个月(HR=0.30,p<0.0001),疾病进展/死亡风险降低70%。研究者评估结果同样显著(7.9 vs 2.8个月,HR=0.23,p<0.0001)。更为重要的是,尽管多西他赛组有36.4%的患者在经BIRC确认PD后交叉接受了芦康沙妥珠单抗治疗,芦康沙妥珠单抗组仍显著降低死亡风险51%(HR=0.49,p=0.007)。经RPSFT模型校正交叉治疗影响后,死亡风险降低进一步提高至64%(HR=0.36)。(表1)
表1. 疗效数据(中位随访12.2个月)
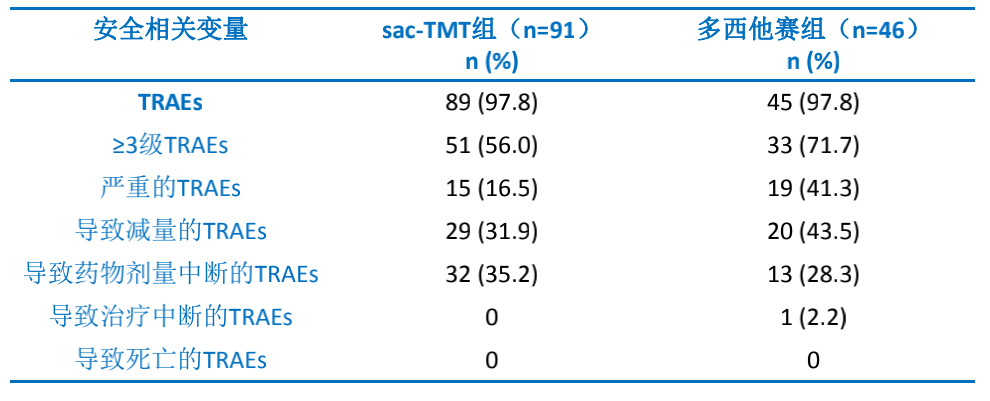
安全性方面,芦康沙妥珠单抗组3级及以上TRAEs与SAEs发生率均低于多西他赛组。芦康沙妥珠单抗组无因治疗相关不良事件(TRAEs)导致停药和死亡的患者,且未报告间质性肺病(ILD)病例。(表2)
表2. 总体安全性概要
研究结论
与多西他赛相比,芦康沙妥珠单抗在经治晚期EGFR突变型NSCLC患者中展现出更优的ORR、PFS和OS获益,且安全性可控。该研究结果凸显了显著的生存获益,提示芦康沙妥珠单抗有望成为该人群新的标准治疗选择。
研究解读
1.EGFR耐药治疗的"至暗时刻":未满足的临床需求
EGFR突变NSCLC患者在历经EGFR-TKI治疗耐药后,后续治疗方案的抉择成为临床上面临的一大棘手问题。虽然部分患者可通过检测到MET扩增等明确耐药靶点而受益于联合靶向治疗,但大多数患者仍缺乏有效的治疗靶点,成为临床研究的重点方向。近年来,随着治疗领域的快速发展,针对EGFR-TKI耐药后的多种治疗策略相继问世。除靶向联合治疗外,现有方案还包括化疗、免疫治疗等(表1),但这些方法在临床应用中均存在明显局限性,亟需开发更有效的治疗手段。
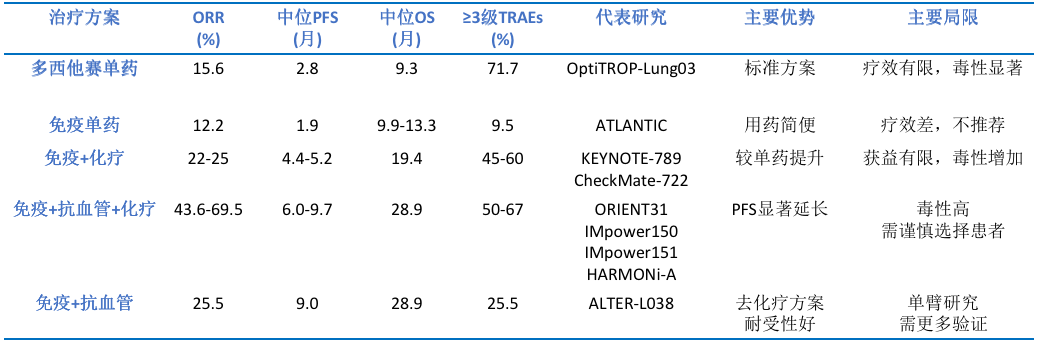
多西他赛作为传统的标准治疗方案,ORR仅为15.6%,中位PFS仅有2.8个月,并且≥3级TRAEs发生率高达71.7%,疗效颇为有限,同时毒性显著[1, 2]。免疫治疗的兴起,为这一困境带来了新的探索方向,但不同组合模式的疗效和安全性存在显著差异。ATLANTIC研究显示经过多线EGFR-TKI治疗后,即使PD-L1高表达,EGFR敏感突变患者使用单免治疗仍无法显著延长患者的PFS和OS[3]。而免疫联合化疗的模式,虽然相较于单药化疗有一定提升,但仍难以满足患者的治疗需求[4, 5]。由此可见,在EGFR耐药人群中,单纯免疫联合化疗未能突破疗效瓶颈。免疫+抗血管生成治疗+化疗,即四药模式,相比单纯化疗,显著延长了EGFR-TKI耐药患者的mPFS[6-8]。该方案虽然疗效显著,但≥3级TRAEs发生率相对较高,在临床应用时,需充分权衡获益与毒性比,谨慎选择。由此可见,传统化疗毒性显著,联合方案虽提升疗效却以毒性增加为代价。 HARMONi-A研究通过双抗设计(靶向PD-1和VEGF)试图解决这一矛盾,但该研究人群局限,且≥3级TRAEs发生率高于对照组[9]。以上研究提示我们,抗血管生成治疗在EGFR耐药治疗中似乎扮演着重要角色。从理论上分析,免疫治疗与抗血管生成治疗可能存在协同作用,共同调节肿瘤微环境,增强抗肿瘤效果,ALTER-L038研究在一定程度上验证了这一理论[10]。不过,该研究为单臂研究,缺乏与其他标准治疗方案的头对头比较,是否能达到与三药或四药联合方案相媲美的疗效,还需要更多大规模、多中心的随机对照试验来进一步明确。
这些数据充分表明,现有治疗方案仍难以满足EGFR耐药NSCLC患者的临床需求,一方面,耐药机制的复杂性(如C797S突变、MET基因扩增、HER2激活等)导致单一治疗手段难以实现持久控制;另一方面,多线治疗后患者体能状态下降与药物毒性累积的矛盾,进一步限制了治疗方案的选择。因此,深入解析EGFR耐药分子机制、开发新型靶向药物治疗策略,仍是突破“至暗时刻”、改善患者长期生存的关键方向。
2.破局之道:创新药物的"三重奏"
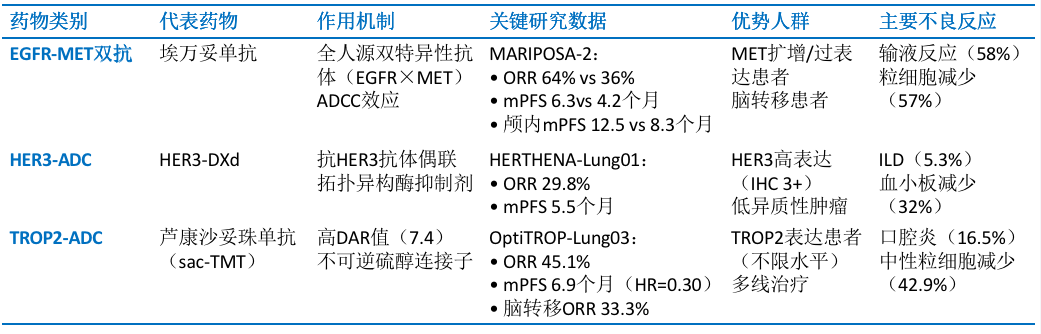
面对传统治疗方案在EGFR耐药NSCLC中暴露出的诸多局限,一些创新机制药物的出现为这一困境带来了新的解决思路(表2)。
2.1 双通路抑制:MET扩增患者的精准钥匙
MET异常激活是EGFR-TKI耐药的重要旁路机制,奥希替尼联合赛沃替尼在MET扩增患者中ORR达55%[11, 12],为特定人群提供有效选择。基于此,双特异性抗体展现潜力:MARIPOSA-2研究显示埃万妥单抗联合化疗显著改善PFS和颅内控制[13]。然而,此类策略仍存局限:联合方案毒性可能影响治疗依从性;需严格筛选MET异常激活患者。值得注意的是,约50%-70%的EGFR-TKI耐药患者并不存在MET异常激活,这部分患者的治疗选择仍面临重大挑战,亟需探索新型治疗策略突破现有治疗瓶颈。
2.2 ADC革命:从HER3异质性到TROP2普适性
随着研究深入,抗体偶联药物(ADC)为EGFR耐药NSCLC的治疗开辟了新路径。ADC由三个核心组分构成:靶向肿瘤抗原的抗体、稳定的连接子和高活性的细胞毒性载荷。抗体精准识别肿瘤表面抗原;连接子确保药物在血液循环中稳定,仅在肿瘤细胞内释放;强效载荷(如拓扑异构酶抑制剂)则发挥杀伤作用。理想的药物-抗体比(DAR=2-8)平衡了疗效与安全性。抗体结合抗原后,复合物内化进入细胞,连接子在溶酶体环境中断裂释放载荷,诱导肿瘤细胞凋亡。具有膜通透性的载荷还能产生"旁观者效应"杀伤邻近细胞。此外,ADC可通过诱发免疫反应和阻断受体信号通路增强抗肿瘤效果。这种"精准打击+多重机制"的特点,使ADC成为肿瘤治疗的重要策略(图1)。
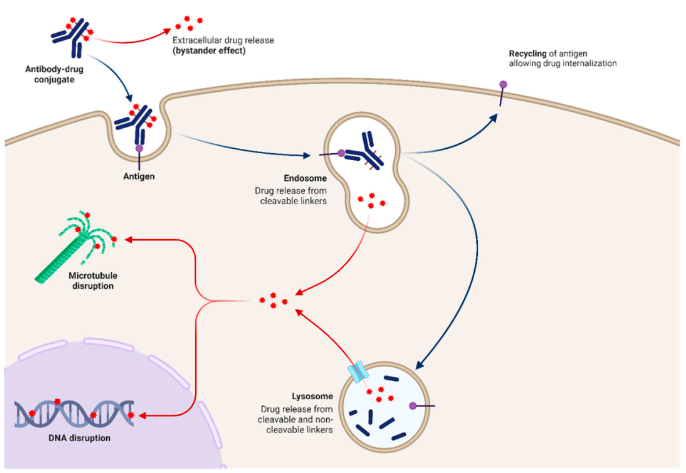
HERTHENA - Lung01研究显示HER3 ADC展现出一定治疗活性,ORR达到29.8%,PFS为5.5个月。然而,HER3表达存在异质性,肿瘤组织内不同肿瘤细胞HER3表达水平与分布不同,导致HER3 ADC难以均匀有效地作用于所有肿瘤细胞,极大影响治疗效果,且≥3级TRAEs发生率高。在优势人群方面,HER3高表达且异质性相对较低的患者或许对HER3 ADC有较好响应,但这类患者在EGFR耐药NSCLC群体中占比有限,限制了HER3 ADC的广泛应用。
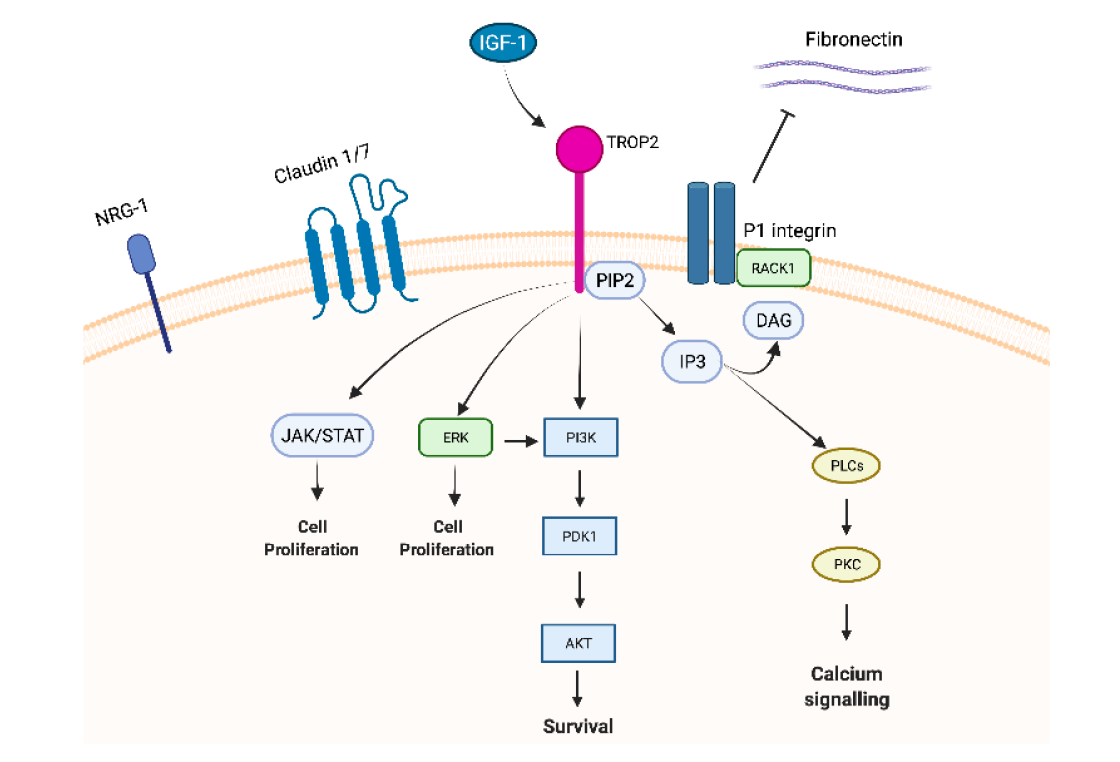
相较于HER3 ADC,Trop2 ADC优势突出。TROP2是一种细胞表面跨膜糖蛋白,在多种肿瘤细胞,特别是EGFR突变的NSCLC细胞中高表达,TROP2可与多种信号通路相互作用,如MAPK、PI3K/Akt等,影响细胞的增殖、分化、迁移和存活(图2)。抑制TROP2可阻断这些促癌信号的传导,从而抑制肿瘤生长,使其成为ADC药物极具潜力的靶点。
目前,两款靶向TROP2的ADC——戈沙妥珠单抗(sacituzumab govitecan)和德达博妥单抗(datopotamab deruxtecan)在晚期NSCLC的1期和2期临床试验中展现出了令人期待的临床活性。然而,在针对未经生物标志物筛选的既往治疗过的晚期NSCLC患者(无论是否存在可靶向的基因组改变)开展的随机3期临床试验中,二者均未能在OS改善方面达到统计学意义[14, 15]。进一步对TROPION-Lung01和TROPION-Lung05研究中EGFR突变患者进行汇总分析发现,ORR更高,达42.7%,中位PFS为5.8个月,这些研究结果表明,靶向TROP2的ADC或许能在EGFR突变的NSCLC治疗中发挥更大优势。
2.3 芦康沙的突破:连接子技术带来的"蝶变"契机
新型靶向TROP2 ADC药物——芦康沙妥珠单抗(sacituzumab tirumotecan,sac-TMT,又名MK - 2870/SKB264)通过独特的Kthiol(嘧啶-硫醇)连接子,将拓扑异构酶I抑制剂KL610023与抗体结合,使得平均DAR为7.4,相较于其它ADC药物,该数值的升高意味着每个抗体能够携带更多的药物载荷,其载荷的膜通透性还可促进旁观者杀伤效应,进一步增强了药物的抗肿瘤效果[16]。机制研究发现,EGFR突变会显著增强肿瘤细胞对sac-TMT的内吞与溶酶体摄取,尤其是对TKI耐药的EGFR突变NSCLC细胞,摄取率更高[17]。1期和2期单臂临床试验也证实,sac-TMT单药治疗能为对TKI耐药的EGFR突变NSCLC患者带来显著临床获益[17]。
OptiTROP - Lung03随机对照试验聚焦于经EGFR-TKI和铂类化疗后进展的EGFR敏感突变NSCLC患者,这与此前泛人群评估TROP2-ADC的研究不同。相比标准治疗多西他赛,sac-TMT显著提升了ORR、PFS和OS,在脑转移等难治亚组中也展现出优势。疗效上,其ORR达45.1%,PFS 6.9个月,总生存风险降低51%,均优于多数免疫联合方案。机制上,不依赖PD-L1/TMB表达,通过TROP2靶向递送,内化效率提升2.8倍,可克服肿瘤异质性,且脑转移活性强,颅内缓解率33.3%。安全性方面,≥3级治疗相关不良反应发生率46.2%,低于免疫联合方案,无免疫相关不良反应,血液学毒性低,治疗相关停药率为0。由此可见,sac-TMT临床适用性广,覆盖后线治疗,对肝转移、快速进展等特殊人群效果更佳,单药给药便捷。耐药后治疗灵活,未耗竭免疫系统,与EGFR-TKI无交叉耐药,可序贯多种治疗。
3.精准化"成蝶"之路
OptiTROP-Lung03 研究确立sac-TMT在EGFR耐药NSCLC中的治疗价值。然而,从临床研究数据转化为个体化治疗实践,核心在于精准识别最能从该药物中获益的人群。基于研究亚组分析与机制探索,我们可从分子特征、临床特征及安全性维度,构建sac-TMT的精准应用策略。
3.1分子特征导向的选择
OptiTROP-Lung03研究显示,携带EGFR经典突变(19外显子缺失、21外显子L858R)的患者接受sac-TMT治疗后,ORR达到45.1%,PFS-HR为0.30,凸显了该药物在经典突变患者中的显著疗效。Ⅱ期临床试验显示sac-TMT对多种EGFR罕见突变亚型(G719X、L861Q、S768I)及ex20ins突变同样具有强效的抗肿瘤活性(2025 ASCO):罕见突变的ORR为34.8%,中位PFS为10.9个月;ex20ins突变的ORR为36.8%,中位PFS为9.0个月。尽管这一结论尚未在大规模临床研究中得到充分验证,但为临床治疗提供了重要的参考方向。
关于TROP2表达水平与sac-TMT疗效的关系,OptiTROP-Lung03研究同样给出了重要启示。研究显示,虽然TROP2是sac-TMT的作用靶点,但其表达水平与治疗反应或PFS并未呈现显著相关性。值得注意的是,即使在TROP2低/中表达患者中,sac-TMT仍展现出显著优于多西他赛的疗效: ORR达37%(vs 多西他赛13%),mPFS为6.1个月(vs 2.8个月)。在TROP2高表达患者中,sac-TMT的疗效更为突出,ORR高达57%,mPFS达8.1个月,因此这类患者应作为sac-TMT治疗的优先选择人群。而对于TROP2低表达患者,sac-TMT仍保持一定的抗肿瘤活性,为这部分患者提供了有价值的治疗选择。这一发现提示我们,sac-TMT的临床获益可能不完全依赖于TROP2的表达水平,其作用机制可能涉及更复杂的生物学过程。
3.2临床特征分层
从临床特征来看,sac-TMT在二线及后线治疗均展现稳定疗效,且对脑转移和肝转移患者具有突出治疗优势。在治疗线数方面,OptiTROP-Lung03研究显示,二线治疗患者使用该药的ORR达48.1%,早期介入治疗能有效控制肿瘤;而三线及以上治疗的患者,ORR为40.0%,相较HER3 - ADC在后线治疗中疗效衰减的情况,该药在多线治疗后仍可维持相对稳定的效果。对于特殊转移灶,脑转移患者使用该药的颅内ORR达22.2%,远高于多西他赛组,显著改善了难治性脑转移患者的治疗困境;肝转移患者使用该药治疗的ORR达55.6%,PFS-HR为0.21(95%CI 0.08-0.61),疾病进展风险显著降低。
3.3安全性考量
在安全性管理方面,sac-TMT的临床应用需结合患者个体特征进行综合评估。对于骨髓功能良好(基线ANC≥1.5×10⁹/L)的患者,因其对药物相关血液学毒性的耐受性更佳,可作为优先考虑人群;同时,无ILD病史的患者发生严重肺部不良事件的风险较低,同样适合接受该药物治疗。需要特别关注的是,对于有重度口腔黏膜炎病史的患者,鉴于治疗中3级口腔炎发生率达16%,建议在用药前充分评估风险,并制定预防性管理方案。此外,OptiTROP-Lung03研究中约80%的患者ECOG PS=1,但对于体能状态较差(ECOG PS≥2)的患者,需审慎评估治疗获益与风险比,必要时考虑调整给药方案。可见,骨髓储备良好且无活动性ILD病史的患者更适合。
综上,从分子特征、临床特征及安全性维度构建的sac-TMT精准应用策略,能帮助精准识别优势人群,让患者更合理地使用该药物,为EGFR耐药NSCLC患者的治疗带来新的希望与方向。
4. 振翅待飞的挑战
sac-TMT的临床应用仍面临挑战:首先是经济可及性,ADC药物的高昂费用可能限制其在基层医院的推广;其次,伴随治疗的优化同样重要,sac-TMT的主要不良反应为血液学毒性(3级中性粒细胞减少发生率39%),临床需提前制定预防性升白策略。对于合并肝肾功能不全的患者,目前缺乏剂量调整数据,需要进一步探索个体化给药方案。另外,特殊人群研究存在空白。老年患者(≥65岁)仅占入组人群20%,其安全性数据仍需补充;研究未纳入携带罕见EGFR突变的NSCLC患者,II期队列研究虽显示出具有前景的临床活性(2025 ASCO ABSTRACT 8615),但仍需III期试验进行验证。最后,ADC药物间的头对头比较研究尚未开展,sac-TMT与DS-1062a、Dato-DXd的疗效差异需要临床研究进一步明确,以指导精准用药选择。
总而言之,OptiTROP-Lung03研究以确凿的临床数据,为EGFR耐药NSCLC患者带来了新的治疗曙光。sac-TMT凭借显著优于传统多西他赛的疗效与可控的安全性,有望重塑临床治疗格局。然而,从临床研究迈向实际广泛应用,仍需攻克经济可及性、特殊人群数据完善等重重关卡。这场EGFR耐药治疗的变革,既是肿瘤内科治疗领域的重大突破,也为后续研究指明了方向。作为临床医生,我们既要把握新疗法带来的机遇,积极应用于患者治疗,也要关注尚存的挑战,持续探索优化治疗方案,共同推动EGFR耐药NSCLC治疗向更精准、更高效、更安全的方向迈进。
张琳琳教授 天津医科大学总医院
高爱医生解读的这篇摘要紧扣前沿热点,逻辑上,从需求切入,经机制、数据到应用挑战,完整呈现sac - TMT价值;数据上,援引代表性研究数据,有力支撑结论;维度上,覆盖精准用药及应用挑战,临床指导价值高,故予以推荐。
【温馨提示】:如果您觉得高爱医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1.Zhou, C., et al., Tislelizumab Versus Docetaxel in Patients With Previously Treated Advanced NSCLC (RATIONALE-303): A Phase 3, Open-Label, Randomized Controlled Trial. J Thorac Oncol, 2023. 18(1): p. 93-105.
2. Nie, K., et al., Osimertinib compared docetaxel-bevacizumab as third-line treatment in EGFR T790M mutated non-small-cell lung cancer. Lung Cancer, 2018. 121: p. 5-11.
3. Garassino, M.C., et al., Durvalumab as third-line or later treatment for advanced non-small-cell lung cancer (ATLANTIC): an open-label, single-arm, phase 2 study. Lancet Oncol, 2018. 19(4): p. 521-536.
4. Yang, J.C., et al., Phase III KEYNOTE-789 Study of Pemetrexed and Platinum With or Without Pembrolizumab for Tyrosine Kinase Inhibitor‒Resistant, EGFR-Mutant, Metastatic Nonsquamous Non-Small Cell Lung Cancer. J Clin Oncol, 2024. 42(34): p. 4029-4039.
5. Mok, T., et al., Nivolumab Plus Chemotherapy in Epidermal Growth Factor Receptor-Mutated Metastatic Non-Small-Cell Lung Cancer After Disease Progression on Epidermal Growth Factor Receptor Tyrosine Kinase Inhibitors: Final Results of CheckMate 722. J Clin Oncol, 2024. 42(11): p. 1252-1264.
6. Nogami, N., et al., IMpower150 Final Exploratory Analyses for Atezolizumab Plus Bevacizumab and Chemotherapy in Key NSCLC Patient Subgroups With EGFR Mutations or Metastases in the Liver or Brain. J Thorac Oncol, 2022. 17(2): p. 309-323.
7. Lu, S., et al., Sintilimab plus bevacizumab biosimilar IBI305 and chemotherapy for patients with EGFR-mutated non-squamous non-small-cell lung cancer who progressed on EGFR tyrosine-kinase inhibitor therapy (ORIENT-31): first interim results from a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol, 2022. 23(9): p. 1167-1179.
8. Zhou, C., et al., Atezolizumab plus bevacizumab and chemotherapy in metastatic nonsquamous NSCLC: the randomized double-blind phase 3 IMpower151 trial. Nat Med, 2025.
9. Fang, W., et al., Ivonescimab Plus Chemotherapy in Non-Small Cell Lung Cancer With EGFR Variant: A Randomized Clinical Trial. Jama, 2024. 332(7): p. 561-570.
10. Shi, M., et al., Benmelstobart plus anlotinib in patients with EGFR-positive advanced NSCLC after failure of EGFR TKIs therapy: a phase I/II study. Signal Transduct Target Ther, 2024. 9(1): p. 283.
11. Hartmaier, R.J., et al., Osimertinib + Savolitinib to Overcome Acquired MET-Mediated Resistance in Epidermal Growth Factor Receptor-Mutated, MET-Amplified Non-Small Cell Lung Cancer: TATTON. Cancer Discov, 2023. 13(1): p. 98-113.
12. de Marinis, F., et al., Savolitinib plus osimertinib in epidermal growth factor receptor (EGFR)-mutated advanced non-small cell lung cancer with MET overexpression and/or amplification following disease progression on osimertinib: primary results from the phase II SAVANNAH study. Ann Oncol, 2025.
13. Passaro, A., et al., Amivantamab plus chemotherapy with and without lazertinib in EGFR-mutant advanced NSCLC after disease progression on osimertinib: primary results from the phase III MARIPOSA-2 study. Ann Oncol, 2024. 35(1): p. 77-90.
14. Ahn, M.J., et al., Datopotamab Deruxtecan Versus Docetaxel for Previously Treated Advanced or Metastatic Non-Small Cell Lung Cancer: The Randomized, Open-Label Phase III TROPION-Lung01 Study. J Clin Oncol, 2025. 43(3): p. 260-272.
15. Sands, J., et al., Datopotamab Deruxtecan in Advanced or Metastatic Non-Small Cell Lung Cancer With Actionable Genomic Alterations: Results From the Phase II TROPION-Lung05 Study. J Clin Oncol, 2025. 43(10): p. 1254-1265.
16. Cheng, Y., et al., Preclinical profiles of SKB264, a novel anti-TROP2 antibody conjugated to topoisomerase inhibitor, demonstrated promising antitumor efficacy compared to IMMU-132. Front Oncol, 2022. 12: p. 951589.
17. Zhao, S., et al., Sacituzumab tirumotecan in advanced non-small-cell lung cancer with or without EGFR mutations: phase 1/2 and phase 2 trials. Nat Med, 2025.











 苏公网安备32059002004080号
苏公网安备32059002004080号


