浙江大学临床博士后
研究方向:
1. 肠道微生态在结直肠癌炎癌转化中的作用机制;
2. 乳腺癌发生发展过程中肿瘤微环境与肠道微生态的改变;
3. 肺癌免疫治疗疗效相关生物标记物探索。
主持国家自然科学基金青年项目、中国博士后科学基金面上项目,参与浙江省“尖兵”科技项目。
以(共同)第一作者身份在GUT、Journal for ImmunoTherapy of Cancer等期刊发表论文,累计发表SCI论文15篇,总计影响因子156,授权专利1项。
ASCO 解读文献
ASCO 8517
研究背景
非小细胞肺癌(NSCLC)是我国恶性肿瘤发病与死亡的首要病因。据2022年中国国家癌症中心最新统计,国内新发肺癌病例约106万,死亡病例约73万。约75%的患者确诊时已为局部晚期或转移性,预后极差。尽管近年来免疫治疗、靶向治疗等多种手段改善了部分患者的生存,但对于多线治疗失败的晚期转移性NSCLC患者,仍缺乏有效的治疗选择。
CAR-T细胞疗法在血液系统肿瘤中已取得显著成功,但在实体瘤领域受限于肿瘤微环境抑制、靶向抗原异质性及安全性等因素,疗效仍不理想。本研究首次报道了低氧响应型CEA CAR-T细胞疗法在晚期转移性CEA阳性NSCLC中的Ⅰ期临床结果(NCT060006390),为细胞治疗在实体瘤领域的突破提供了新的思路。
研究目的与方法
本研究旨在探索低氧响应型CEA CAR-T细胞在经多线治疗失败的CEA阳性晚期NSCLC患者中的安全性与初步疗效。
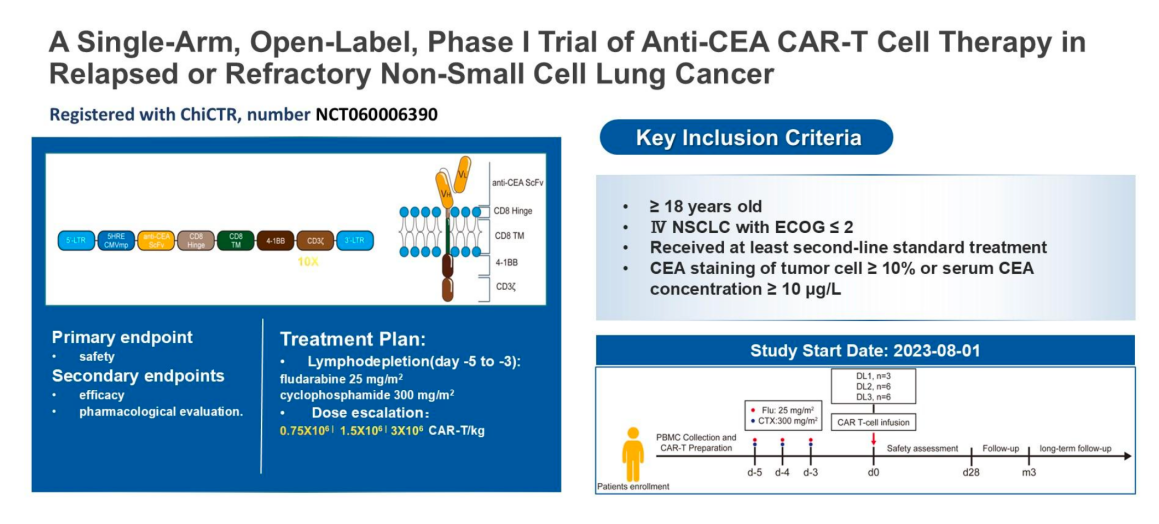
设计:单臂、开放性、I期临床试验。
入组人群:既往接受过≥2线标准治疗失败的成年晚期转移性NSCLC患者,其中患者的肿瘤细胞CEA阳性表达率≥10%或者血清CEA含量大于10μg/L。
预处理:CAR-T输注前5天接受标准的淋巴细胞清除性化疗(氟达拉滨25mg/m2 +环磷酰胺300mg/m2,共3天)。
CAR-T细胞回输:静脉输注CEA CAR-T细胞,剂量分别为0.75×106、1.5×106或 3×106 CAR-T 细胞 /kg。
评估:主要终点为安全性,次要终点包括疗效(ORR, DCR, OS, DOR)以及CAR-T细胞扩增与持久性、探索性生物标志物分析。
研究结果
从2023年8月1日至2024年12月10日,本研究共纳入15例患者(中位年龄60岁,范围52-65岁),其中患者既往治疗线数中位数为4线(范围 3-6 线),其中80%(12/15)患者接受过三线以上的治疗。
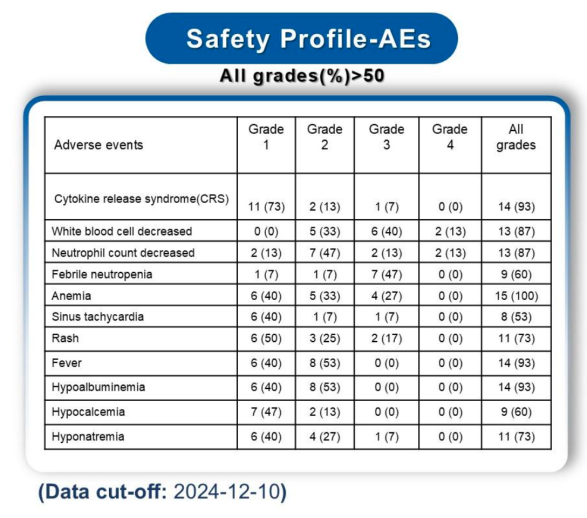
安全性:截至数据截止日,不良事件(Adverse event, AE)发生率大于50%,其中细胞因子释放综合征(cytokine release syndrome,CRS)发生率为93%(14/15),但严重程度较低,仅1例发生3级CRS,无4级及以上CRS发生。其余主要不良反应包括血细胞减少(如贫血、白细胞减少、中性粒细胞减少等)、窦性心动过速(53%,8/15)、皮疹(73%,11/15)、发热(93%,14/15)、低蛋白血症(93%,14/15)等,总体安全性可控。
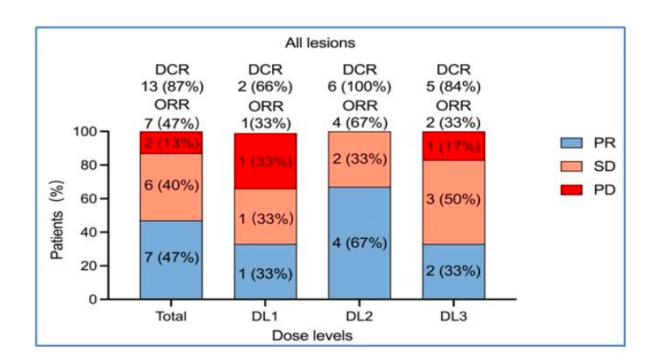
 有效性:截至数据截止日,接受CAR-T治疗的患者1年总生存率(Overall survival,OS)达71.1%;整体疾病控制率(Disease control rate,DCR)高达87%(13/15),其中肺部靶病灶的DCR更是高达93%;客观缓解率(Objective response rate,ORR)达到了47%(7/15),中位缓解持续时间(Duration of response,DOR)为2个月。此外值得注意的是,CEA表达水平≥30%的患者呈现出更优的缓解趋势。
有效性:截至数据截止日,接受CAR-T治疗的患者1年总生存率(Overall survival,OS)达71.1%;整体疾病控制率(Disease control rate,DCR)高达87%(13/15),其中肺部靶病灶的DCR更是高达93%;客观缓解率(Objective response rate,ORR)达到了47%(7/15),中位缓解持续时间(Duration of response,DOR)为2个月。此外值得注意的是,CEA表达水平≥30%的患者呈现出更优的缓解趋势。
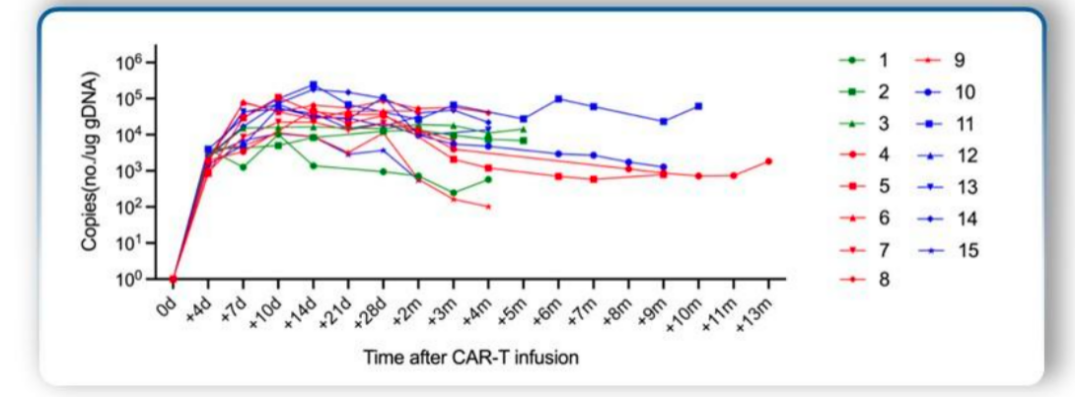
细胞动力学:CAR-T细胞在输注后中位第10天达到体内最大浓度峰值,为50763 copies /μg gDNA,在随访达到13个月的患者中仍可检测到CAR拷贝。且CAR-T细胞剂量越高(1.5×106 & 3×106 CAR-T细胞/kg vs 0.75×106 CAR-T 细胞/kg),峰值浓度越高。
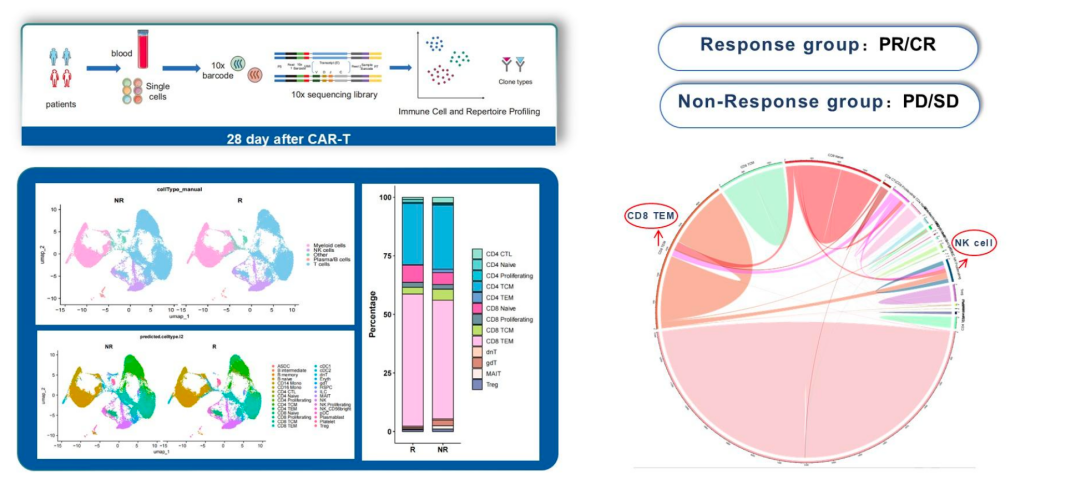
机制研究拓展:外周血单细胞测序结果提示,响应组(PR/CR)患者的效应记忆型CD8+T细胞(CD8 TEM)通过克隆扩增和配体-受体相互作用活化NK细胞。
研究结论
低氧响应型CEA CAR-T细胞疗法在经多线治疗失败的晚期转移性CEA阳性NSCLC患者中,显示出有前景的疗效和可控的安全性,为晚期NSCLC的治疗带来新的希望。
解读
低氧响应CEA CAR-T:突破实体瘤治疗壁垒的精准利刃
复发/难治性肺癌是目前临床治疗的巨大难点及痛点,在既往疗效有限的背景下,各类新型治疗手段持续涌现。而CAR-T细胞疗法,尽管在血液系统恶性肿瘤中取得了突破性进展,在实体瘤中的表现却屡屡受限,主要瓶颈包括:肿瘤微环境的免疫抑制性、肿瘤抗原的异质性、物理屏障限制T细胞浸润等。
本研究创新性地利用实体瘤低氧环境作为“开关”,仅在低氧区激活CAR-T细胞的杀伤功能,最大程度降低了正常组织的脱靶效应和系统性毒性。同时,CEA作为非小细胞肺癌常见的高表达肿瘤相关抗原,为CAR-T精准识别并攻击肿瘤细胞提供了较明确的靶向基础。在多靶点CAR-T探索尚处早期阶段的肺癌治疗领域,本研究作为大会唯一入选的肺癌CAR-T细胞治疗研究,代表了CAR-T技术在肺癌治疗中的应用前沿。
实体瘤CAR-T的重要突破:难治性NSCLC的新希望
本研究虽为Ⅰ期临床试验,样本量小,随访时间有限,但其临床启示意义极大。
在传统三线及以上治疗无效的NSCLC患者中,传统化疗或免疫治疗已面临疗效瓶颈。本研究作为全球首批公布的CEA CAR-T治疗晚期NSCLC的积极临床数据之一,展示了令人振奋的初步疗效:1年总生存率(OS)达71.1%,疾病控制率(DCR)87%,客观缓解率(ORR)47%。在这一高危人群中获得如此结果,极具临床意义,提示该疗法可能突破CAR-T在实体瘤领域的传统天花板。
此外,与其他非小细胞肺癌CAR-T靶点(如MSLN、ROR1、Claudin 18.2、EGFRvIII等)或其他类型实体瘤(如间皮瘤、肉瘤)的CAR-T研究相比,本研究的ORR(47%)显著高于MSLN CAR-T(31.3%),1年OS(71.1%)更是突破晚期NSCLC三线治疗的生存极限,且高级别CRS发生率较低,体现出良好的安全性和耐受性。
特别值得一提的是,CEA表达水平与疗效呈正相关,进一步确立了CEA作为潜在生物标志物在患者筛选与精准治疗中的重要价值。
曙光初现,前路仍长:功能持续性与机制优化仍待攻克
尽管在输注CAR-T细胞13个月的患者体内仍可检测到CAR拷贝,但患者的DOR仅为2个月,揭示CAR-T在实体瘤微环境中遭遇T细胞耗竭及功能性沉默的核心瓶颈。因此,如何增强CAR-T细胞在体内的持续性、抗耗竭能力和持久功能,是下一阶段研究的重要方向。
单细胞测序结果揭示,疗效响应者中存在更高比例的CD8+效应记忆T细胞及活化NK细胞,提示可能存在多细胞协同的免疫清除机制。这不仅为机制研究提供了切入点,也为开发联合生物标志物、优化患者筛选策略提供了线索。
此外,探索联合治疗新策略包括联合免疫检查点抑制剂(如PD-1/PD-L1抗体)以解除肿瘤微环境中的免疫抑制、提高CAR-T持久性,优化CAR-T分子设计减少抗原逃逸、提高细胞治疗反应率,开发新型载体或联用溶瘤病毒、联用共刺激因子以增强CAR-T细胞在肿瘤内部的浸润和激活等都是未来值得进一步探索的方向。
未来可期:跨癌种推广与临床转化的广阔前景
低氧微环境以及高CEA表达不仅局限于NSCLC,在结直肠癌、食管癌、胃癌、胰腺癌、乳腺癌、胆管癌等实体瘤中亦有广泛分布。事实上,2024 ASCO大会报道的Ⅰ期数据(NCT05396300)显示:CEA CAR-T腹腔输注组ORR 25%/DCR 88%(n=24),静脉输注组ORR 8%/DCR 67%(n=16)。我们期待CEA CAR-T细胞疗法在其他实体瘤中的研究结果。
总结
本研究首次在复发/难治性NSCLC患者中验证了低氧响应型CEA CAR-T细胞疗法的安全性和有效性,是实体瘤细胞治疗领域的里程碑式探索。尽管仍需随机对照研究、大样本验证和更长随访期数据支撑,并深入探索机制和优化策略,本研究无疑为CEA阳性的晚期转移性NSCLC患者开辟了一条充满希望的新治疗路径,并为进一步攻克实体瘤CAR-T的瓶颈提供了宝贵的科学洞见和实践经验。
邱福铭教授 浙江大学医学院附属第二医院
李丽丽博士对本研究的解读精准凝练,深刻把握了ASCO 8517研究的双重突破价值:
1. 机制创新性: “低氧响应”设计巧妙利用肿瘤微环境特征,实现了CAR-T活性的时空精准调控,有效克服了实体瘤微环境抑制这一核心瓶颈。
2. 临床显著性: 在经多线治疗失败的晚期CEA阳性NSCLC这一高度难治人群中,取得了卓越的初步疗效(高OS/DCR/ORR)和可控的安全性(低高级别CRS)。
解读中,李博士不仅通过横向对比(如与其他靶点CAR-T数据)客观论证了该疗法的临床优势,更敏锐地指出关键挑战——中位缓解持续时间(DOR)仅2个月,并据此深入探讨了肿瘤免疫微环境、抗原表达动态、CAR-T细胞持久性等前沿议题,见解深刻。
尤为值得肯定的是,其对未来研究方向的展望展现了前瞻性学术思维与解决临床痛点的创新能力:
· 提出基于CEA表达等精准生物标志物优化患者筛选。
· 倡导探索与免疫检查点抑制剂等的协同联合策略。
· 前瞻性指出该平台技术在跨癌种(如结直肠癌、胃癌等)推广的巨大潜力。
该解读充分体现了李丽丽博士扎实的专业功底、敏锐的科研洞察力以及对转化医学前沿的深刻理解,其提出的思路对推动实体瘤CAR-T治疗的临床转化具有重要启发价值。
【温馨提示】:如果您觉得李丽丽医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


