毕业于上海交通大学医学院呼吸内科专业
中国初级卫生保健基金会肿瘤精准诊疗专委会秘书
长期从事胸部肿瘤诊断和治疗工作,并参与多项临床研究,多次在国际会议上进行口头或壁报交流
ASCO 解读文献
CAMPASS研究解读
研究背景
免疫检查点抑制剂单药是目前PD-L1阳性晚期非小细胞肺癌患者的一线标准治疗。贝莫苏拜单抗是一款抗PD-L1人源化单克隆抗体,安罗替尼是一款小分子多靶点酪氨酸激酶抑制剂,已获批晚期非小细胞肺癌患者三线治疗适应症。前期临床研究显示,两药组合具有潜在协同作用,本研究旨在探索贝莫苏拜单抗联合安罗替尼与帕博利珠单抗相比,一线治疗PD-L1阳性、驱动基因阴性的晚期非小细胞肺癌患者的疗效及安全性。
研究方法
这是一项随机、盲态、多中心、III期临床研究,纳入组织病理学确认的局部晚期或转移性非小细胞肺癌患者,患者既往未经治疗且不携带驱动基因突变,年龄18~75周岁,PD-L1≥1%,符合入组标准的患者按2:1的比例,接受标准剂量的贝莫苏拜单抗联合安罗替尼或帕博利珠单抗治疗。主要研究终点为独立评审委员会评估的PFS,次要研究终点为OS、ORR及安全性等。
研究结果
2021年8月至2022年12月期间,贝莫苏拜单抗联合安罗替尼组和帕博利珠单抗组分别入组354例和177例患者,两组基线特征相似。PD-L1≥50%的患者占比分别为44.9%和45.2%,脑转移患者占比分别为6.5%和8.5%,鳞癌患者占比分别为60.2%和60.5%。截至数据截止日期2023年5月20日,贝莫苏拜单抗联合安罗替尼组的PFS中位随访时间为11.4个月,帕博利珠单抗组为10.6个月。该研究达到主要研究终点,贝莫苏拜单抗联合安罗替尼组和帕博利珠单抗组的中位PFS分别为11.0个月和7.1个月(HR=0.70,P=0.0057),6个月PFS率分别为74.7%和56.8%,。亚组分析显示,PD-L1≥50%的患者,两组中位PFS分别为13.3个月和7.2个月,HR=0.60;鳞癌患者,两组中位PFS分别为11.0个月和6.9个月,HR=0.63。两组ORR分别为57.3%和39.5%,DCR分别为85.9%和79.1%。在安全性方面,贝莫苏拜单抗联合安罗替尼组和帕博利珠单抗组任何级别治疗相关不良反应发生率分别为98.3%和88.1%,3级及以上治疗相关不良反应发生率分别为58.5%和29.0%。治疗相关严重不良反应发生率分别为25.3%和21.0%。3级及以上免疫相关不良反应发生率分别为10.8%和12.5%。因TRAE永久停药的发生率分别为7.1%和8.0%,因TRAE导致死亡的发生率分别为1.4%和2.3%。
研究结论
对于PD-L1阳性、驱动基因阴性的晚期非小细胞肺癌患者,贝莫苏拜单抗联合安罗替尼相较于当前帕博利珠单抗的标准治疗,显著延长患者PFS,在PD-L1≥50%的患者中获益更加明显。安全性可控且未发现新的安全性信号。
解读
核心内容解读与个人观点拓展
尽管免疫检查点抑制剂已成为PD-L1阳性晚期NSCLC患者的一线标准治疗,显著改善了患者预后,但其总体疗效仍不尽如人意,中位无进展生存期(PFS)仅 6-7个月。抗血管生成治疗能够使肿瘤血管正常化,改善肿瘤内部的血流灌注以及供氧状态,进而重塑肿瘤微环境,增加免疫效应细胞的浸润,将 “免疫冷肿瘤”转化为“免疫热肿瘤”,提高免疫检查点抑制剂的整体疗效。抗血管生成药物与免疫检查点抑制剂协同作用可发挥更佳的抗肿瘤效应。
安罗替尼临床前数据显示可调节肿瘤免疫微环境,通过血管正常化,打破肿瘤的自身的物理保护屏障,从而增加肿瘤内的血流灌注,提升肿瘤当中的免疫细胞的比例,改善组织缺氧。安罗替尼可阻断VEGF1/2/3,PDGF2/3,以及FGFR和c-Kit等多个信号传导通路,涵盖了多个与肿瘤血管生成、肿瘤细胞增殖及转移密切相关的关键信号通路靶点,从而降低旁路耐药的风险。尽管目前多靶点药物百花齐放,例如仑伐替尼、阿帕替尼、舒尼替尼、卡博替尼等,但唯有安罗替尼在三线治疗中实现了PFS和OS的双重获益。贝莫苏拜单抗是我国自主研发的新型人源化 IgG1 亚型 PD-L1 抑制剂,具有高稳定性、高亲和力、强结合与阻断 PD-L1 的能力,以及独特的 Fc 段 D265A 位点改造特性,已在NSCLC后线治疗中显示出良好抗肿瘤活性。对于部分不耐受化疗/不愿意进行化疗的晚期非小细胞肺癌患者,CAMPASS研究提供了一种去化疗的选择,针对PD-L1阳性的患者,该研究的数据不劣于目前标准的化免联合方案。对于PD-L1≥50%的高表达患者,该方案展示出更强的获益,PFS延长了6个月。对于鳞癌患者,帕博利珠单抗单药组的中位PFS为6.9个月,而联合方案达到11个月,进展风险降低31%(HR=0.63),同时相较于传统抗血管生成药物如贝伐珠单抗,安罗替尼并未报告致命性出血。尽管3级及以上治疗相关不良反应发生率分别为58.5%和29.0%,联合治疗组中安罗替尼相关的不良反应占比较大,主要为高血压、手足综合征、蛋白尿等。但因TRAE永久停药的发生率分别为7.1%和8.0%,因TRAE导致死亡的发生率分别为1.4%和2.3%,联合治疗的不良反应总体可控及可逆。
个人观点拓展:
对于驱动基因阴性晚期非小细胞肺癌患者,免疫治疗已经成为了标准一线治疗的基石。对于PD-L1高表达的人群,选择免疫单药治疗是否足够,还是联合治疗更优目前并没有明确的答案。
1.单药免疫治疗:长期生存与安全性优势
PD-L1高表达晚期非小细胞肺癌患者接受免疫检查点抑制剂单药治疗已积累了充分的循证医学证据。KEYNOTE-024研究作为这一领域的里程碑式临床试验,其5年随访数据为单药免疫治疗提供了强有力的支持。该研究显示,在PD-L1 TPS≥50%且无驱动基因突变的晚期NSCLC患者中,帕博利珠单抗单药治疗组的中位总生存期(OS)达26.3个月,显著优于化疗组的13.4个月(HR=0.62;95% CI 0.48-0.81)。更为引人注目的是,5年生存率达到31.9%,是化疗组的近两倍,意味着近三分之一的患者实现长期生存。
除了生存优势,单药免疫治疗的安全性特征同样突出。KEYNOTE-024研究中,帕博利珠单抗组的3-5级治疗相关不良事件(TRAE)发生率仅为31.2%,显著低于化疗组的53.3%。这种安全性优势在临床实践中意味着更好的治疗耐受性、更少的治疗中断以及更高的生活质量。
单药免疫治疗的另一个重要优势在于其治疗便利性。帕博利珠单抗的标准给药方案为每3周一次静脉输注,每次约30分钟,大大减少了患者的治疗时间负担。同时,对于达到完全缓解(CR)或部分缓解(PR)的患者,KEYNOTE-024研究中完成2年治疗的患者中有46%在停止治疗后仍保持长期缓解,无需继续接受系统治疗。
然而,单药免疫治疗也存在一定局限性。尽管PD-L1高表达人群获益显著,但并非所有患者都能获得理想疗效。研究显示,治疗初期达到CR或PR的患者3年OS率高达81%,而未达到客观缓解的患者预后则明显较差。
免疫联合化疗:生存获益的强化策略
对于PD-L1高表达的晚期NSCLC患者,免疫联合化疗是另一种重要的治疗选择。KEYNOTE-189(非鳞状NSCLC)和KEYNOTE-407(鳞状NSCLC)研究虽然并非专门针对PD-L1 TPS≥50%人群设计,但其亚组分析提供了这一人群的宝贵数据。研究显示,与单纯化疗相比,帕博利珠单抗联合化疗显著改善了整体人群的PFS和OS,且这一获益趋势在PD-L1高表达亚组中更为显著。
免疫联合化疗的核心优势在于其快速起效和高效肿瘤控制能力。化疗药物能够迅速杀伤肿瘤细胞,释放大量肿瘤抗原,同时调节肿瘤微环境,增强后续免疫治疗的效应。这种协同作用在肿瘤负荷大、症状明显的患者中尤为重要。研究数据显示,联合治疗的ORR 通常高于单药免疫治疗,为需要快速缓解症状的患者提供了更好的选择。同时对于肝转移患者,单药免疫治疗反应较差,联合化疗可提高疗效。
然而,联合治疗也不可避免地带来了安全性方面的挑战。免疫联合化疗的3-5级不良事件发生率通常高于单药治疗。在KEYNOTE-189和407研究中,联合治疗组的3级以上不良事件发生率约为60-70%,显著高于单药免疫治疗的30%左右,虽然大部分毒性可通过支持治疗或剂量调整控制,但仍有部分患者因无法耐受而中断治疗。
3. 免疫联合抗血管生成治疗:协同增效的新途径
近年来,免疫检查点抑制剂联合抗血管生成药物已成为PD-L1高表达晚期NSCLC治疗的新兴策略。这种联合的理论基础在于抗血管生成药物能够改善肿瘤微环境,通过正常化肿瘤血管系统、减少免疫抑制细胞浸润、增强T细胞浸润等机制,增强免疫治疗的抗肿瘤活性。双特异性抗体作为该领域的重要突破,实现了单一分子同时靶向PD-1/PD-L1和VEGF通路的创新治疗模式。依沃西单抗作为代表性的PD-1/VEGF双抗,在III期HARMONi-2研究中展现出令人振奋的结果。该研究比较了依沃西单抗与帕博利珠单抗在PD-L1阳性晚期NSCLC患者中的疗效。结果显示,依沃西单抗显著延长了PFS,且在不同PD-L1表达亚组(包括TPS≥50%人群)和组织学类型中均显示显著获益,同时保持了可控的安全性。另一款PD-1/VEGF双抗SSGJ-707在II期临床试验中也取得了优异数据。在单药一线治疗PD-L1阳性晚期NSCLC患者的10mg/kg剂量组中,客观缓解率(ORR)高达70.8%,疾病控制率(DCR)达到100%。这一ORR数据显著高于历史对照中单药免疫治疗约45%的缓解率。在安全性方面,SSGJ-707也表现出良好特征,3级及以上治疗相关不良事件发生率为23.5%。
4. 创新联合策略的探索
其他创新联合策略也在PD-L1高表达人群中展现出潜力。抗体偶联药物(ADC)与免疫治疗的联合是另一重要方向。如TROP2-ADC联合免疫检查点抑制剂。2025 ASCO公布的Ⅱ期OptiTROP-Lung01及扩展研究中,PD-L1 TPS≥50%人群接受SKB264联合免疫治疗的ORR达到了77.8%,中位PFS达 17.8个月。其他TROP2-ADC如Dato-DXd联合免疫治疗时的间质性肺炎风险需警惕;SG的高血液毒性使其联合应用受限。这些新型联合可能进一步延长PD-L1高表达患者的生存期,但需关注联合治疗增加的毒性。
II期CITYSCAPE研究评估了TIGIT抑制剂tiragolumab联合PD-L1抑制剂阿替利珠单抗的疗效。在PD-L1高表达亚组中,联合治疗组的OS显示出具有临床意义的显著改善。但在后续III期的SKYSCRAPER-01中, Tiragolumab联合阿替利珠单抗在初治PD-L1高表达局部晚期、不可切除或转移性非小细胞肺癌患者中虽然PFS和OS有改善,但主要终点尚未达到。
5. 疗效与安全性的综合平衡
面对PD-L1高表达晚期NSCLC患者的多种治疗选择,临床决策需要综合考量疗效和安全性两大维度,同时结合患者个体特征进行个体化选择。
从生存获益角度看,KEYNOTE-024研究5年随访数据显示单药免疫治疗可使近三分之一(31.9%)的患者实现5年长期生存。联合治疗方案虽然在短期指标如ORR、PFS上可能表现更优,但联合化疗方案中,KEYNOTE-189和407长期随访的亚组数据显示PD-L1高表达人群的5年OS率分别为29.6%和23.3%,并未优于单药。联合抗血管生成药物方案的长期生存数据尚不成熟。
从疾病控制速度角度分析,联合策略通常具有明显优势。在肿瘤负荷大、症状明显或存在需要快速缓解的转移灶(如肝转移)的患者中,联合治疗可能带来更快的症状缓解和生活质量改善。而单药免疫治疗的缓解速度相对较慢,可能不适合需要快速缓解的患者。
在治疗耐受性方面,单药免疫治疗显示出明显优势。KEYNOTE-024研究中,帕博利珠单抗单药治疗的3-5级不良事件发生率为31.2%,显著低于化疗组的53.3%。免疫联合化疗的3级以上不良事件发生率则高达60-70%,显著增加。免疫联合抗血管生成药物的安全性介于两者之间。特别值得注意的是,不同治疗方案的安全性问题存在质的差异。单药免疫治疗的主要风险是免疫相关不良事件(irAEs),如肺炎、结肠炎、内分泌疾病等,通常可通过糖皮质激素治疗控制。联合化疗则增加了骨髓抑制、恶心呕吐、脱发等化疗相关毒性。而抗血管生成药物的加入可能带来高血压、蛋白尿、出血风险增加等安全问题。
生物标志物指导的精准分层是当前重要研究方向。尽管PD-L1 TPS≥50%定义了免疫治疗潜在获益人群,但该群体内部仍存在显著异质性。临床决策需综合考虑多种生物标志物和临床因素。在KEYNOTE-001研究中,PD-L1 TPS≥90%患者的5年OS率可达44.8%,显著高于TPS 50-89%人群的26.5%。这类患者单药治疗的缓解率和生存率可能达到与联合治疗相当的水平。除PD-L1外,TMB高负荷(≥10 mut/Mb)及干扰素-γ信号高表达等指标可能进一步优化患者选择。
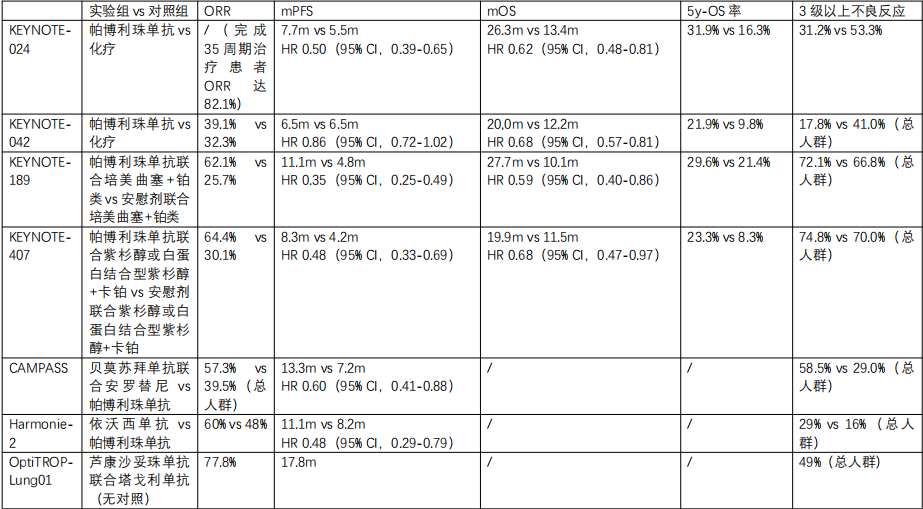
表1. 不同临床试验中PD-L1≥50%人群数据对比
总结
韩宝惠教授 上海市胸科医院
我们团队在多个研究中探讨了免疫与抗血管生成药物联合治疗的潜力,并相继报道了多项研究成果。本次在ASCO上公布的CAMPASS研究进一步证实了抗血管生成药物联合免疫治疗的临床价值,在PD-L1高表达人群中获益更为明显。尽管PD-L1高表达患者总体预后良好,但仍有约70%的患者在5年内死亡,提示仍存在未满足的需求。基于现有证据,钱芳菲医生做了详尽的讨论,在临床决策框架中我们应纳入多维度考量,推动真正意义上的个体化治疗。
【温馨提示】:如果您觉得钱芳菲医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!











 苏公网安备32059002004080号
苏公网安备32059002004080号


