浙江省卫生健康创新转化骨干人才
美国临床肿瘤学会(ASCO)会员、美国癌症研究协会(AACR)会员
欧洲临床肿瘤协会(ESMO)会员、国际妇科癌症协会(IGCS)会员
CSCO老年肿瘤防治专家委员会委员
主要从事宫颈癌、子宫内膜癌、卵巢癌、妇科黑色素瘤以及妇科少见肿瘤临床及转化研究。
主持国自然青年基金1项、浙江省自然青年基金1项、国家中医药管理局科技司-浙江省中医药管理局共建科技计划重点项目1项、钱塘交叉基金1项等,作为课题骨干参与国家科技部重点研发专项、国自然重点项目等。
已在Advanced Science等国际权威期刊发表SCI论文20余篇,《中国临床肿瘤学年度研究进展2024》编委、参与多部国际/国内专家共识撰写、参编专著1部。英国皇家化学学会、iMeta杂志青年编委、Cell Communication and Signaling、Journal of Medical Virology等杂志审稿人。
荣获2023 年 杭州“医创登峰杯”成果转化大赛金奖、杭州国际肿瘤医学成果转化大赛银奖、2023 中欧(浙江)生命健康科技创新创业大赛三等奖、杭州市首届科技成果转化优秀项目等。
ASCO 解读文献
Abstract LBA5504
Pembrolizumab with chemoradiotherapy inpatients with high-risk locally advancedcervical cancer: Final analysis results of thephase 3, randomized, double-blind ENGOTcx11/GOG-3047/KEYNOTE-A18 study
帕博利珠单抗联合放化疗用于高危局部晚期宫颈癌患者:3 期随机双盲ENGOT-Cx11/GOG-3047/KEYNOTE-A18 研究最终分析结果
摘要
研究背景
前期 ENGOT-cx11/GOG-3047/KEYNOTE-A18 研究的中期分析(NCT04221945)表明,针对新确诊且未经治疗的高危局部晚期宫颈癌(Locally Advanced Cervical Cancer, LACC)患者,相较于单纯同步放化疗(Concurrent Chemoradiotherapy,CCRT),帕博利珠单抗联合CCRT,并在 CCRT 后持续使用帕博利珠单抗,能够显著提升患者的总生存期(Overall Survival,OS)与无进展生存期(Progression-Free Survival,PFS)。本次报告为该 Ⅲ 期随机双盲研究的最终分析(Final Analysis,FA)结果,旨在进一步验证帕博利珠单抗联合 CCRT 在这类患者中的疗效与安全性。
研究方法
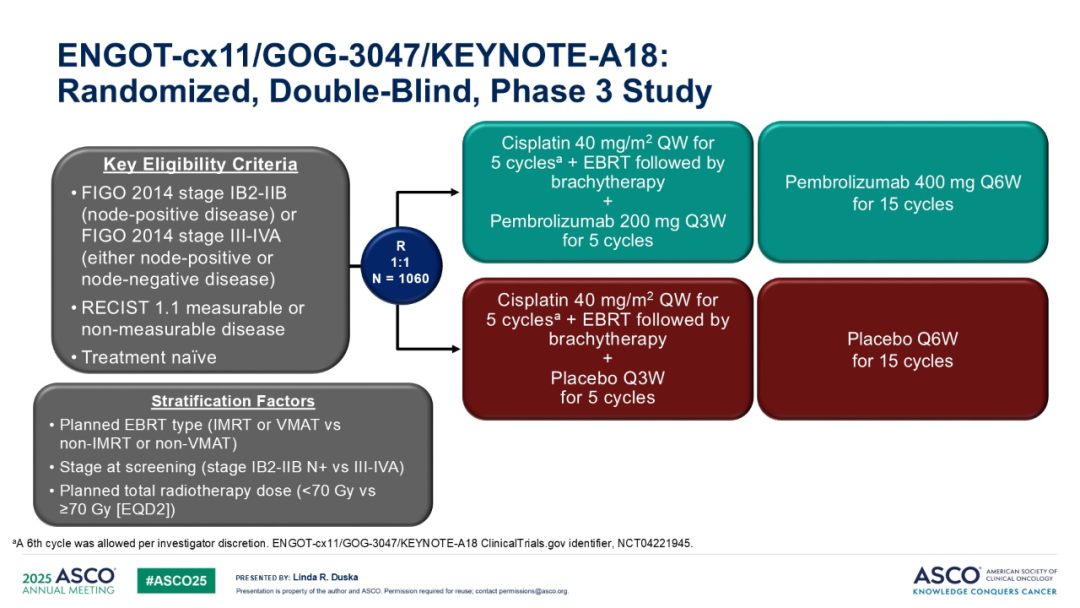
研究纳入新诊断且未经治疗的高危 LACC 患者(依据 FIGO 2014 分期标准,IB2–IIB 期伴淋巴结阳性,或 III–IVA 期,无论淋巴结状态如何)。患者以 1:1 的比例随机分为两组,分别接受不同治疗方案:一组接受帕博利珠单抗(200mg,每 3 周一次,共 5 个周期)联合 CCRT,随后继续使用帕博利珠单抗(400mg,每 6 周一次,共 15 个周期);另一组接受安慰剂联合 CCRT,后续继续使用安慰剂,其余治疗相同。CCRT 方案包含 5 个周期(可选择给予第 6 剂)的顺铂(40mg/m²,每周一次)联合外照射放疗(External beam radiotherapy,EBRT),之后进行腔内近距离放疗。患者依据计划放疗类型(调强放疗 [Intensity-Modulated Radiation Therapy,IMRT]/ 容积调强弧形放疗 [Volume Modulated Arc Therapy,VMAT] 与非 IMRT / 非 VMAT)、筛查时分期(ⅠB2-ⅡB 期与 Ⅲ-ⅣA 期)以及计划的总放疗剂量(等效剂量 < 70Gy 与≥70Gy)进行分层。主要研究终点为依据 RECIST v1.1 标准,由研究者评估的PFS和OS。
研究结果
共计 1060 名患者被随机分配至帕博利珠单抗联合 CCRT(pembro + CCRT,n=529)组或安慰剂联合 CCRT(pbo + CCRT,n=531)组。根据研究方案设定的最终分析(FA)时间点(数据截止日期为 2025 年 1 月 7 日),中位随访时间达到 41.9 个月(范围 24.8-55.0 个月)。86 名患者在疾病进展后接受了免疫治疗,其中 64 例曾接受过帕博利珠单抗治疗。相较于安慰剂联合 CCRT,帕博利珠单抗联合 CCRT 在总生存期(OS)和无进展生存期(PFS)方面持续展现出更具临床意义的改善。在预设亚组中,包括 ⅠB2-ⅡB 期淋巴结阳性患者,帕博利珠单抗 + CCRT 组的 OS 和 PFS 获益趋势与整体人群一致(OS HR=0.92,95% CI:0.62–1.38;PFS HR=0.84,95% CI:0.63–1.14)。帕博利珠单抗联合 CCRT 组≥3 级治疗相关不良事件(TRAE)发生率为 69.5%,安慰剂 + CCRT 组为 61.5%。
表1.本次口头报告研究主要结果一览表
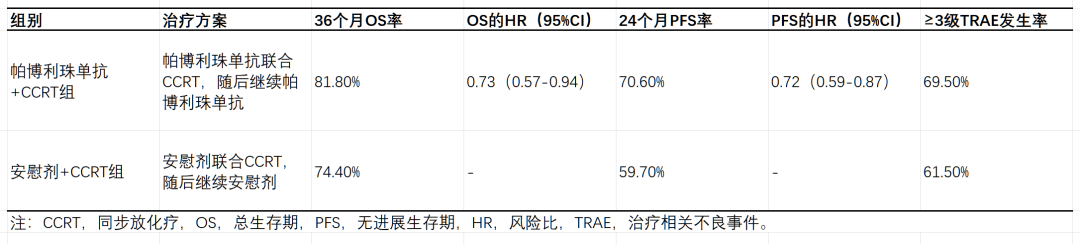
表2.本研究动态报告结果一览表
研究结论
在中位随访时间延长 12 个月后,与安慰剂联合 CCRT 相比,帕博利珠单抗联合 CCRT 在高危 LACC 患者中持续呈现出具有临床意义的 OS 和 PFS 获益,且安全性处于可管理范围。该结果与前期中期分析一致,进一步支持将帕博利珠单抗联合 CCRT 作为此类患者的新标准治疗方案。
临床试验信息:NCT04221945。
研究赞助商:默沙东。

解读
研究背景和既往研究演变
宫颈癌作为全球常见的妇科肿瘤,在我国也构成了严峻的健康威胁[1]。国家癌症中心 2022 年统计数据显示,中国宫颈癌发病率呈逐年上升态势,且约 50%-60% 的患者在初次诊断时已处于LACC[2]。这部分患者疾病负担沉重,参考既往随机 Ⅲ 期临床试验结果,国内外指南目前仍将CCRT作为 LACC 的标准治疗方案。然而,该方案自上世纪 90 年代确立后,二十余年间尚未更新,多项评估新辅助 / 辅助化疗等的试验均未能改善 LACC 患者的生存状况[3-4]。此外,单纯 CCRT 治疗下,淋巴结阳性及 Ⅲ-ⅣA 期(FIGO 2014)的 LACC 患者仍面临较高的复发和死亡风险,高危 LACC 患者预后更差[5]。2030 年是《加速消除宫颈癌全球战略》和《健康中国 2030》纲要的关键节点,对于复发或转移性宫颈癌,如何有效提升 5 年生存率至关重要。因此,中国 LACC 患者面临着占比高、治疗需求未被满足的多重挑战,亟需新的治疗方案来改善高危 LACC 患者的预后。
宫颈癌免疫联合放疗的研究发展遵循着清晰且严谨的逻辑脉络,从单药探索起步,逐步推进至联合优化、精准分层、场景拓展与药物可及阶段。早期 CheckMate 358 试验中,PD-1 抑制剂纳武利尤单抗单药治疗晚期宫颈癌的尝试,成为这一研究领域的重要起点[6]。该试验不仅证实了纳武利尤单抗在晚期宫颈癌中的抗肿瘤活性,客观缓解率达到 26.3%,其安全性数据同样值得关注,3/4 级治疗相关不良事件发生率仅 12.5%,为后续 “放疗 + 免疫” 联合方案的探索提供了坚实的理论与数据基础。鉴于放疗本身具备天然的免疫原性刺激作用,与 PD-1 抑制剂之间潜在的协同效应,迅速成为学界研究的新热点。此后的 CALLA 试验进一步尝试将 PD-L1 抑制剂度伐利尤单抗联合同步放化疗,但研究结果显示,在全人群中该方案未能达到主要终点[7]。不过,深入的亚组分析却带来了意外发现:在 PD-L1 肿瘤比例评分(TPS)≥20% 的患者群体中,生存获益显著(HR 0.62)。这一结果蕴含着重要的临床启示,一方面表明免疫联合放疗的疗效与肿瘤免疫微环境状态密切相关;另一方面也提示 PD-L1 表达水平或许能够作为筛选优势获益人群的生物标志物,为后续研究指明了方向。基于这些前期研究成果,KEYNOTE-A18 试验在设计上进行了针对性优化。该试验将样本量扩大至 1060 例,并聚焦于高危局部晚期人群,这类患者由于复发风险高,更有可能从免疫治疗中获益;同时,将随访时间延长至 41.9 个月,以充分捕捉免疫治疗特有的 “长拖尾效应”;此外,试验摒弃了 PD-L1 分层策略,采用全人群覆盖的方式,验证方案的普适性。最终,KEYNOTE-A18 试验取得成功,证实帕博利珠单抗联合放化疗可显著改善患者总生存期(HR 0.73),为局部晚期宫颈癌确立了新的治疗标准[8-9]。
研究设计及其主要研究结果
ENGOT-cx11/GOG-3047/KEYNOTE-A18 研究通过随机、双盲、III 期临床试验,招募了初治高危局部晚期宫颈癌患者,其定义为 FIGO 2014 IB2-IIB 期(淋巴结阳性)或 FIGO 2014 III-IVA 期(不考虑淋巴结状态)。1060 名患者以 1:1 的比例随机分配至帕博利珠单抗组或安慰剂组:两组均接受 40mg/m² 顺铂(每周一次,共 5 个周期)联合外照射放疗(EBRT)序贯近距离放射治疗,同时每 3 周接受 200mg 帕博利珠单抗或安慰剂,共 5 个周期;之后每 6 周接受 400mg 帕博利珠单抗或安慰剂,共 15 个周期。该研究的两个主要终点为基于 RECIST1.1 标准评估的 PFS 和 OS。
本研究中,两组患者基线特征均衡,实验组和对照组中略超半数患者患有 III-IVA 期疾病(56.0% vs 57.4%)。治疗暴露情况也较为均衡:帕博利珠单抗和安慰剂平均疗程均为 20 个;顺铂平均疗程均为 5 个;放射治疗中位总治疗时间为 52 天,近 75% 的患者在 56 天内完成放疗(74.2% vs. 74.7%);EBRT 中位治疗持续时间均为 37 天;近距离放射治疗中位治疗持续时间均为 12 天。两组中大多数患者接受了 IMRT 或 VMAT(89.4% vs. 87.5%),且均有 94.3% 的患者接受了高剂量率近距离放射治疗(HRD),总 EQD2 剂量为 41。
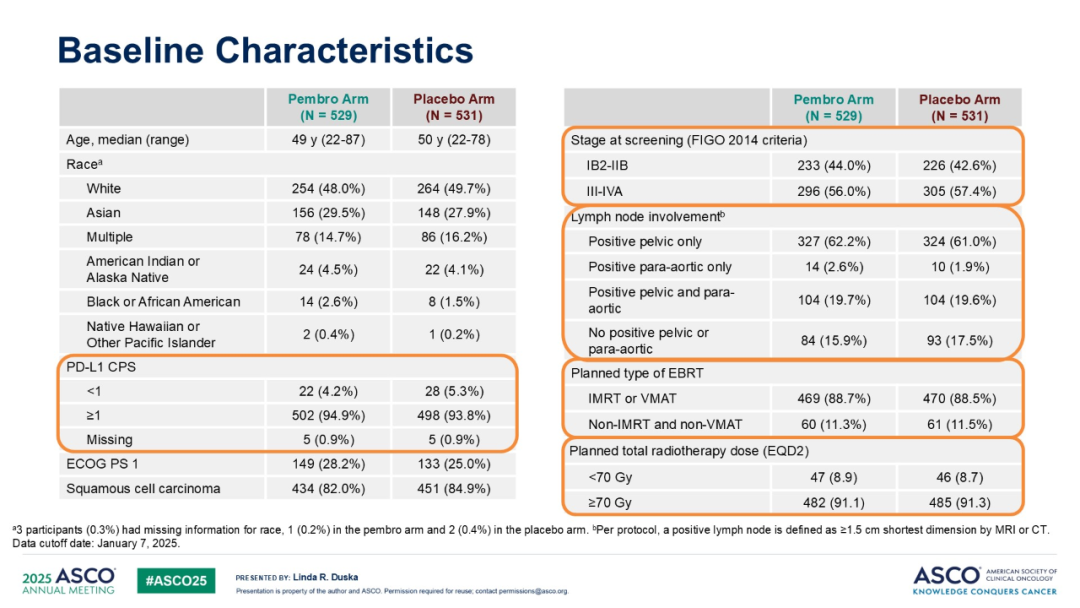 表3.基线数据
表3.基线数据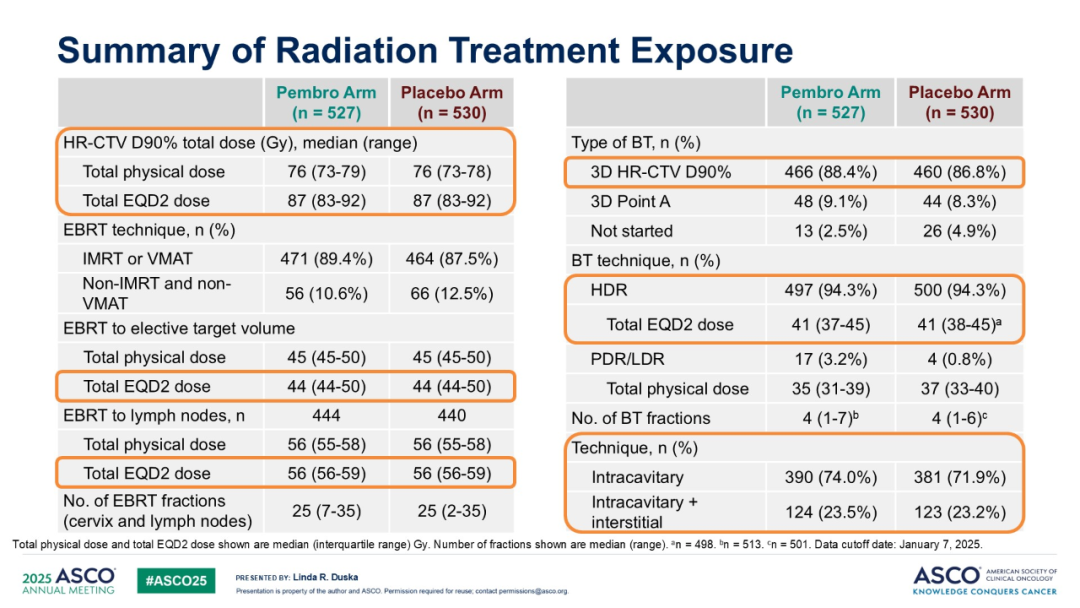
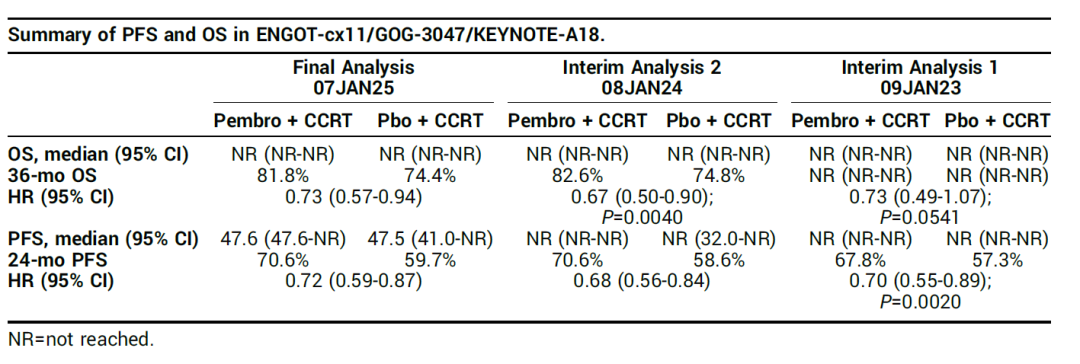
KEYNOTE-A18 研究计划开展 2 项中期分析。中期分析 1 结果显示,中位随访 17.9 个月后,研究达到 PFS 终点,风险比为 0.70。OS 终点在中期分析 2 时达成,中位随访 29.9 个月时,OS 风险比为 0.67。考虑到疾病进展后治疗会对 OS 产生影响,自试验第 2 次中期分析后,进展后治疗的比例有所上升。最终分析时,安慰剂组 33.3% 的患者接受了进展后的免疫治疗。
2025 ASCO 会议分享的最终分析数据,截止日期为 2025 年 1 月。中位随访 41.9 个月时,PFS 风险比为 0.72(95% CI: 0.59-0.87)。实验组和对照组的 24 个月 PFS 率分别为 70.6% 和 59.7%,36 个月 PFS 率分别为 64.3% 和 55.6%。OS 风险比为 0.73(95% CI: 0.57-0.94)。帕博利珠单抗组的 36 个月 OS 率为 81.8%,安慰剂组为 74.4%;48 个月 OS 率分别为 75.4% 和 70.2%。这些数据与前期中期分析结果相符,进一步支持将帕博利珠单抗联合 CCRT 作为该人群的新标准治疗方案。
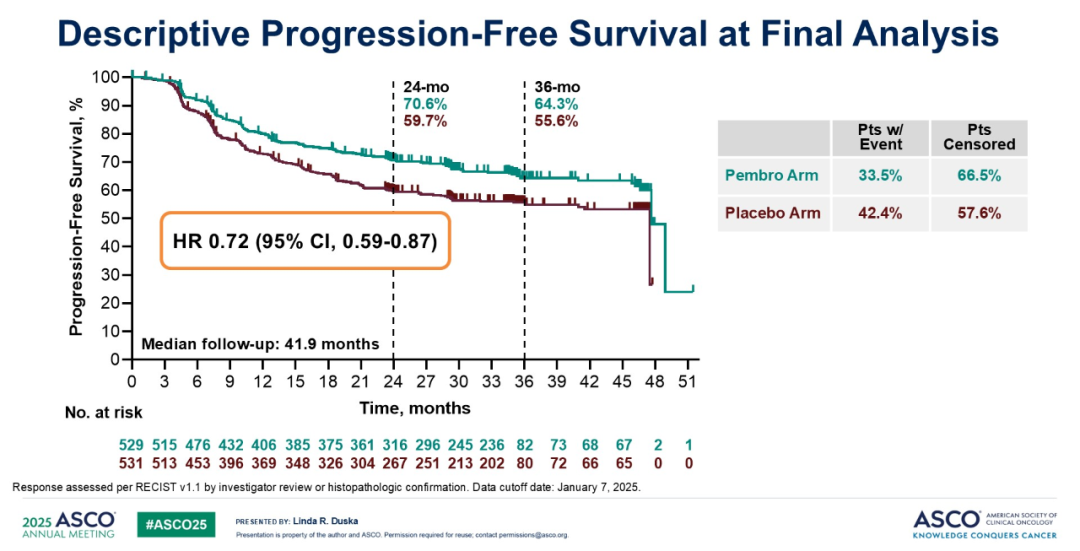
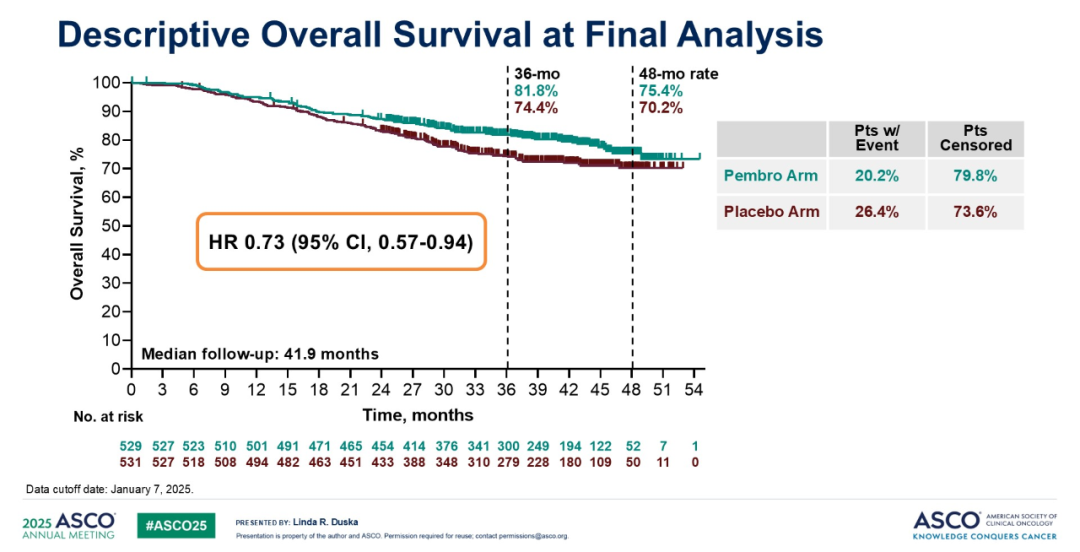
亚组分析:最终分析报告的亚组分析数据与先前结果相近。结果显示,除≥65 岁患者外,在所有预设亚组中,帕博利珠单抗的 OS 均优于安慰剂(HR=1.18;95% CI: 0.58-2.43)。IB2-IIB 期患者亚组的风险比为 0.92,与先前亚组分析结果高度相似。

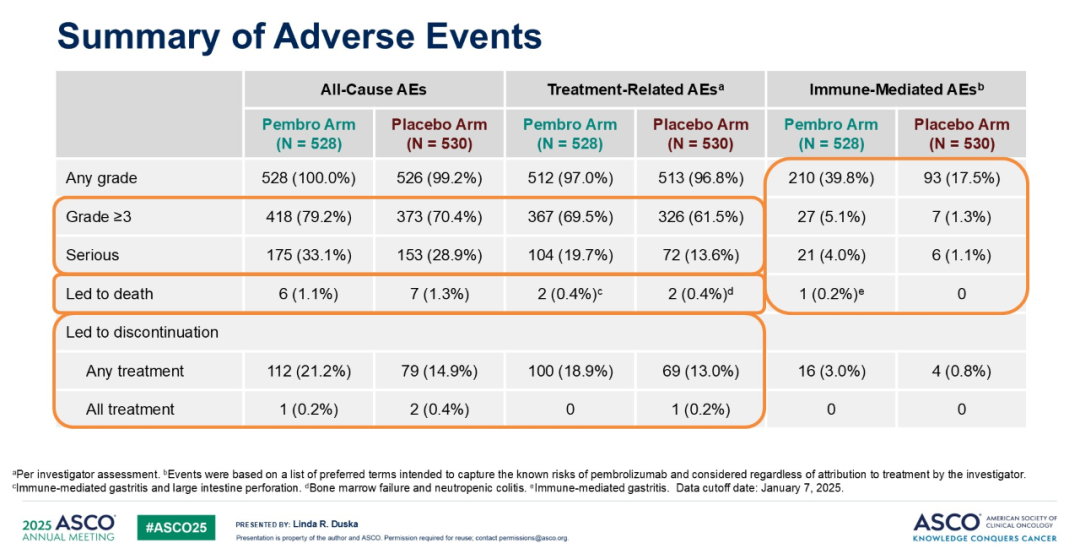
帕博利珠单抗联合 CCRT 的安全性可控,且与各药物已知安全性特征相符。在更长时间的随访中,未发现新的安全性信号。帕博利珠单抗组和安慰剂组分别有 97.0% 和 96.8% 的患者出现治疗相关不良反应(TRAE),其中≥3 级 TRAE 发生率分别为 69.5% 和 61.5%,严重 TRAE 发生率分别为 19.7% 和 13.6%。TRAE 导致停止治疗的患者比例分别为 18.9% 和 13.0%,且两组各有 2 名患者死亡。免疫介导性不良事件在帕博利珠单抗组和安慰剂组的发生比例分别为 39.8% 和 17.5%,分别导致 3.0% 和 0.8% 的患者停止治疗。帕博利珠单抗组有 1 例患者因免疫介导性不良事件死亡。帕博利珠单抗组和安慰剂组报告的最常见免疫介导不良事件包括甲状腺功能减退症(22.9% vs. 7.4%)、甲状腺功能亢进症(12.1% vs. 2.8%)、胃炎(4.5% vs. 4.0%)、结肠炎(3.0% vs. 2.1%)、甲状腺炎(2.3% vs. 0.4%)、肺炎(1.9% vs. 0.9%)、严重皮肤反应(1.5% vs. 0.9%)、肾上腺功能不全(0.9% vs. 0.2%)、肾炎(0.6% vs. 0.2%)和胰腺炎(0.6% vs. 0.2%)。
研究意义及未来展望
免疫联合 CCRT:改写治疗标准的里程碑突破
2025 年 ASCO 公布的 KEYNOTE-A18 最终分析显示,中位随访 41.9 个月时,相较于单纯 CCRT,帕博利珠单抗联合 CCRT 显著降低 28% 的疾病进展风险(PFS HR=0.72)和 27% 的死亡风险(OS HR=0.73),且 OS 获益在多数亚组中表现一致。该方案通过 “同步放化疗 + 免疫维持治疗” 的创新模式,实现了对传统 CCRT 治疗的全面超越,其安全性特征与各单药已知毒理学谱一致,为 “免疫联合放化疗” 成为高危 LACC 一线治疗新标准奠定了循证基础。研究中高质量放疗的实施至关重要:75% 的患者在 56 天内完成包含近距离放疗的全疗程治疗,顺铂化疗中位完成 5 周期,均符合国际治疗标准。这表明:免疫治疗的协同效应高度依赖规范化放化疗平台,只有将精准放疗技术与免疫检查点抑制剂紧密结合,才能使患者获得最大获益。
临床实践挑战
尽管 KEYNOTE - A18 试验成功确立了帕博利珠单抗联合放化疗治疗高危局部晚期宫颈癌的新治疗标准,但在国内临床应用过程中,仍面临着一系列亟待解决的现实问题。部分医疗中心存在放疗技术不规范的情况,如放疗靶区勾画不准确、剂量计算偏差等 ,这可能导致肿瘤局部控制不佳或对周围正常组织造成不必要的损伤 。从设备资源角度来看,一些地区放疗设备陈旧、短缺,无法满足临床需求,使得部分患者无法及时接受放疗,延误治疗时机。同时,免疫治疗带来的免疫相关不良反应,像免疫性肺炎、内分泌异常(如甲状腺功能减退、肾上腺功能不全等),也给临床管理带来了难题[10]。国内部分医疗机构对这些不良反应的识别、监测和处理经验不足,影响了患者的治疗依从性与安全性。例如,免疫性肺炎若不能及时发现和干预,可能进展为严重的呼吸功能障碍,威胁患者生命 。放疗技术和设备差异以及对 irAEs 管理的不足,会显著影响免疫联合放疗方案在临床中的实际应用效果与患者获益程度。
未来优化方向
未来宫颈癌免疫联合放疗领域,可从三方面重点突破。在放疗技术同质化提升上,需开展多中心培训,由权威专家传授前沿放疗技术与规范,同时构建信息化质控体系,全程监控放疗各环节,并推广 IMRT/VMAT 等精准技术,确保高危患者接受足量规范放疗,提高肿瘤局部控制率。不良反应管理标准化方面,鉴于中外医疗环境与患者差异,亟待多学科专家联合制定符合国情的共识,明确 irAEs 分级、监测及处理标准,降低治疗中断与严重后果风险。此外,对于大肿块、多发淋巴结转移等极高危患者,探索联合抗血管生成药物或双免疫检查点阻断策略,可能是突破现有疗效瓶颈的关键,可通过前瞻性临床试验验证其有效性与安全性。
KEYNOTE-A18 的突破性成果为 LACC 治疗开辟了新途径,然而,要将临床试验证据高效转化为临床实践,仍需放疗科、肿瘤内科、影像科等多学科团队的协同合作,最终实现患者生存质量与预后的双重提升。
浙江省肿瘤医院 妇瘤放疗科 楼寒梅教授:
这篇对 KEYNOTE-A18 研究的解读兼具学术深度与临床视角,系统梳理了高危局部晚期宫颈癌治疗的演进脉络、研究设计核心要素及最终分析价值。在背景阐述中,既点明CCRT作为标准治疗20余年未突破的困境,又结合中国 50%-60%初诊患者为 LACC的疾病特征,精准勾勒出免疫联合治疗的临床迫切性,尤其对淋巴结阳性及 Ⅲ-ⅣA 期患者 30%-40% 复发风险的数据锚定,为研究意义奠定扎实基础。
研究设计解析环节,清晰拆解了Ⅲ期随机双盲框架——从 1:1 分组、帕博利珠单抗联合 CCRT 后维持治疗的方案设计,到按放疗技术/分期/剂量分层的严谨逻辑,均体现对研究科学性的深度理解。对结果的剖析尤为透彻:中位随访41.9个月时,OS HR=0.73、PFS HR=0.72的持续获益数据,与中国亚组HR=0.31的突破性结果形成证据链,既强调全球人群获益一致性,又突出中国患者因鳞癌比例高、放疗技术规范带来的显著疗效优势。安全性分析中,69.5% vs 61.5% 的≥3 级TRAE发生率对比,客观呈现联合方案的可控性。
在研究价值阐释中,紧扣NCCN指南更新与FDA获批历程,将免疫联合CCRT 确立为新标准的临床变革意义层层递进,同时敏锐指出放疗技术同质化、不良反应管理等实践挑战,为后研究时代的临床转化提供务实方向。整体解读逻辑链完整——从疾病背景到研究设计,从数据解读到指南落地,既保持对研究核心结论的精准提炼,又兼具学术严谨性与临床指导价值。
【温馨提示】:如果您觉得冯越医生解读的好,请在下方为她点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
[1] Francoeur AA, Monk BJ, Tewari KS. Treatment advances across the cervical cancer spectrum. Nat Rev Clin Oncol. 2025 Mar;22(3):182-199.
[2] Xu M, Cao C, Wu P, Huang X, Ma D. Advances in cervical cancer: current insights and future directions. Cancer Commun (Lond). 2025 Feb;45(2):77-109.
[3] Chemoradiotherapy for Cervical Cancer Meta-Analysis Collaboration. Reducing uncertainties about the effects of chemoradiotherapy for cervical cancer: a systematic review and meta-analysis of individual patient data from 18 randomized trials. J Clin Oncol. 2008 Dec 10;26(35):5802-12.
[4] Rose PG, Bundy BN, Watkins EB, et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer. N Engl J Med, 1999, 340(15):1144-1153.
[5] Kyrgiou M,A Athanasiou,M Paraskevaidi,A Mitra,I Kalliala,P Martin-Hirsch,M Arbyn,P Bennett,E Paraskevaidis. Adverse obstetric outcomes after local treatment for cervical preinvasive and early invasive disease according to cone depth: systematic review and meta-analysis. Bmj, 2016, 354: p. i3633.
[6] Naumann RW, Oaknin A, Moore KN, et al. Safety and Efficacy of Nivolumab Monotherapy in Recurrent or Metastatic Cervical, Vaginal, or Vulvar Carcinoma: Results From the Phase I/II CheckMate 358 Trial [J]. J Clin Oncol, 2019.
[7] Monk BJ, Toita T, Wu X, et al. Durvalumab versus placebo with chemoradiotherapy for locally advanced cervical cancer (CALLA): a randomised, double-blind, phase 3 trial [J]. Lancet, 2023.
[8] Amboree TL, Damgacioglu H, Sonawane K, et al. Cost - Effectiveness of Pembrolizumab With Chemoradiotherapy for Locally Advanced Cervical Cancer[J]. JAMA Netw Open, 2023, 6(12):e2347433.
[9] Duska LR, Moore KN, Fujiwara K, et al. Pembrolizumab or placebo with chemoradiotherapy for newly diagnosed, high - risk, locally advanced cervical cancer (ENGOT - CX11/GOG - 3047/KEYNOTE - A18): a randomised, double - blind, phase 3 trial[J]. Lancet, 2024, 403(10398):1309 - 1320.
[10] Naumann RW, Hollebecque A, Meyer T, Devlin MJ, Oaknin A, Kerger J, López-Picazo JM, Machiels JP, Delord JP, Evans TRJ, Boni V, Calvo E, Topalian SL, Chen T, Soumaoro I, Li B, Gu J, Zwirtes R, Moore KN. Safety and Efficacy of Nivolumab Monotherapy in Recurrent or Metastatic Cervical, Vaginal, or Vulvar Carcinoma: Results From the Phase I/II CheckMate 358 Trial. J Clin Oncol. 2019 Nov 1;37(31):2825-2834.











 苏公网安备32059002004080号
苏公网安备32059002004080号


