华南恶性肿瘤防治全国重点实验室 助理研究员
匹兹堡大学医学中心(UPMC)联合培养博士
中山大学博士后、中南大学湘雅医学院八年制医学博士
新加坡南洋理工大学、俄罗斯鄂木斯克国立医科大学访问交流
主要研究方向为头颈鳞癌的多学科综合治疗和表观遗传学研究
主持国家自然科学基金、广东省自然科学基金及广州市科技计划3项
参与多项国家级、省部级、NIH研究基金
连续3年参编《中国临床肿瘤学年度研究进展》头颈肿瘤章节
发表 SCI 论文 12 篇
担任广东省精准医学应用学会头颈肿瘤分会委员、中山大学肿瘤防治中心临床技能培训教官、多中心Ⅲ期临床试验分中心 Sub-I、多本SCI期刊审稿专家等
曾在 AHA 等国际会议发表口头报告,并入选湖南省科技创新创业菁英培育计划(首批)、中南大学八年制医学生创新领军项目、国际医学生联合会项目等
ASCO 解读文献
Neoadjuvant and adjuvant pembrolizumab plus standard of care (SOC) in resectable locally advanced head and neck squamous cell carcinoma (LA HNSCC): Exploratory efficacy analyses of the phase 3 KEYNOTE-689 study.
摘要
研究背景
在标准治疗(SOC)的基础上联合新辅助/辅助免疫检查点抑制剂已在多种肿瘤类型中被证实可带来疗效获益。随机III期KEYNOTE-689研究(NCT03765918)显示,对于可切除局部晚期头颈部鳞癌(LA HNSCC)患者,相较于单纯SOC治疗,在SOC的基础上联合新辅助/辅助帕博利珠单抗显著改善无事件生存期(EFS),且该获益不受PD-L1综合阳性评分(CPS)限制:CPS≥10人群风险比(HR)为0.66(95% CI 0.49-0.88,P=0.00217),CPS≥1人群HR=0.70(95% CI 0.55-0.89,P=0.00140),全人群HR=0.73(95% CI 0.58-0.92,P=0.00411);本文旨在汇报该研究总治疗人群的探索性疗效终点数据。
研究方法
本研究将喉癌/下咽癌/口腔癌(III/IVA期)及口咽癌(p16阴性III/IVA期或p16阳性III期T4 N0-2)成年患者按1:1随机分配至两组:对照组接受SOC治疗(手术+术后放疗±同步顺铂100 mg/m²每3周一次);试验组在此基础上加用2周期新辅助帕博利珠单抗、3周期辅助帕博利珠单抗同步术后放疗±顺铂及12周期辅助帕博利珠单抗(200 mg静脉输注每3周一次)(见图一)。主要研究终点为按RECIST 1.1标准的经独立中心盲审评估的EFS,次要研究终点为安全性。预设探索性研究终点包括局部区域控制(自随机化至首次影像学/活检证实的局部区域进展或复发时间)、无远处转移生存期(DMFS;自随机化至首次远处转移或死亡时间)以及第二原发头颈癌及其他癌症发生率。
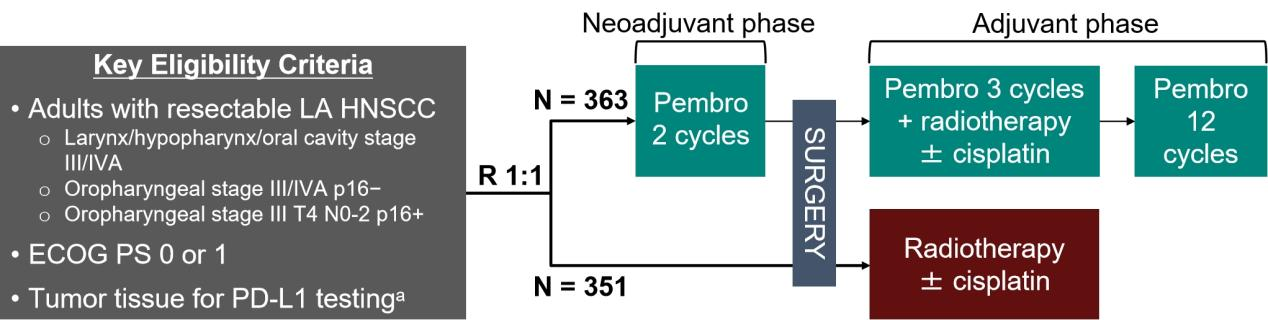
图一 KEYNOTE-689研究流程示意图
研究结果
本研究共随机入组714例患者,帕博利珠单抗组包含363名受试者(其中234名CPS≥10分,347名CPS≥1分),对照组包含351名受试者(其中231名CPS≥10分,335名CPS≥1分),各组约88%受试者完成手术治疗。首次中期探索性分析(数据截止2024年7月25日)显示,中位随访时间为38.3个月(9.0-66.5个月),并在全部受试者群体中发现以下探索性研究终点:
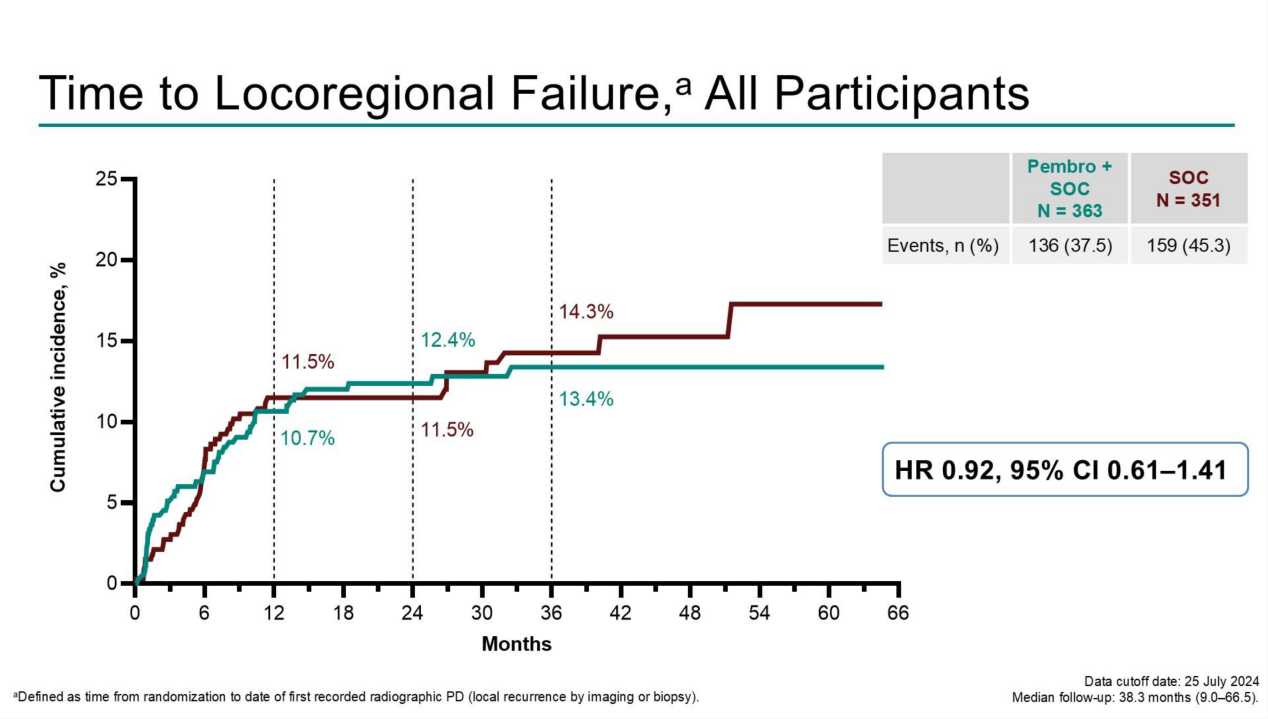
(1)帕博利珠单抗+SOC组与SOC组的36个月局部区域进展或复发的累积发生率分别为13.4%和14.3%,局部区域治疗失败HR为0.92(95% CI 0.61-1.41)(见图二);
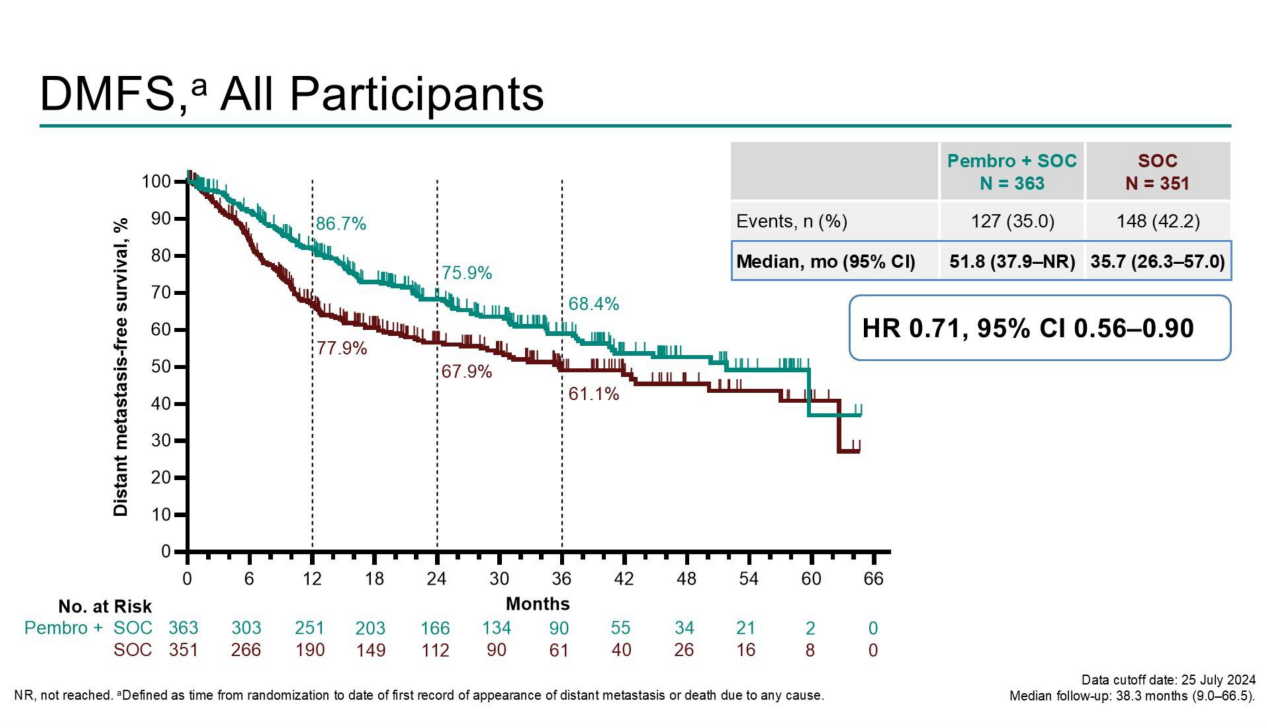
(2)帕博利珠单抗+SOC组与SOC组的DMFS中位数分别为51.8个月和35.7个月(HR=0.71,95% CI 0.56-0.90),36个月DMFS率分别为59.1%和49.0%(见图三);
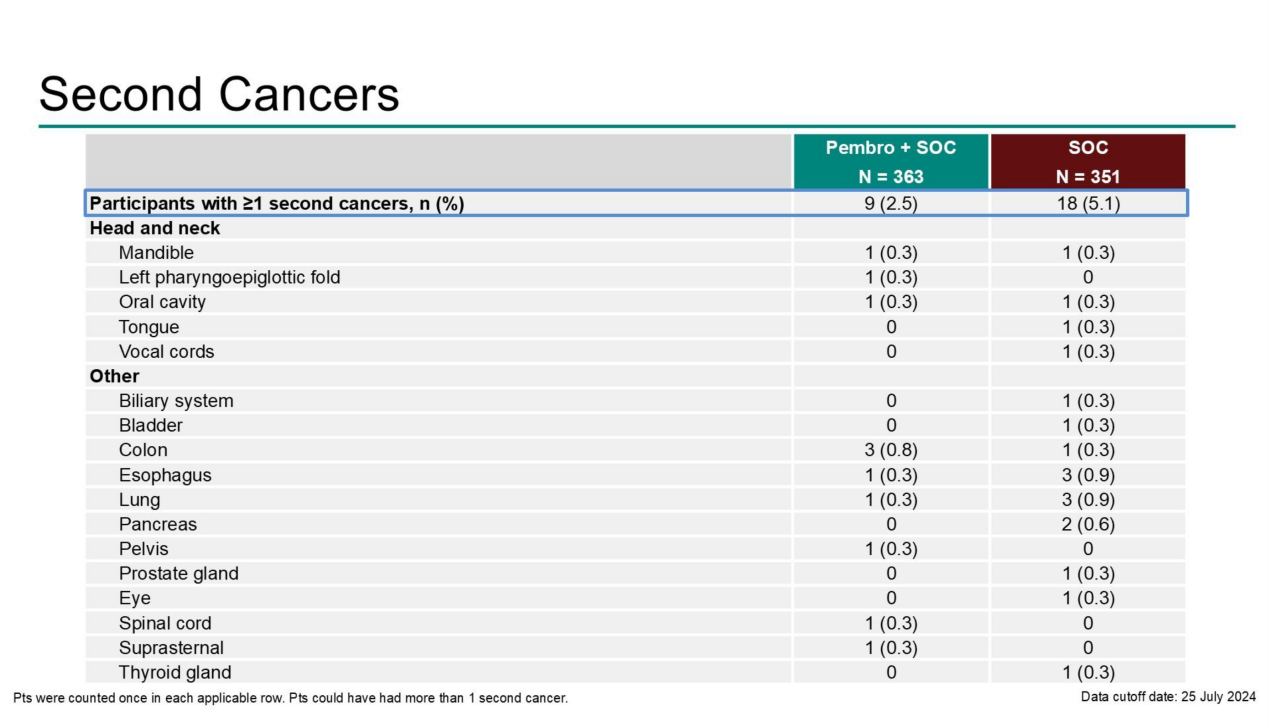
(3)帕博利珠单抗+SOC组与SOC组的第二原发头颈癌及其他癌症发生率分别为2.5%(9例)和5.1%(18例)(见图四);
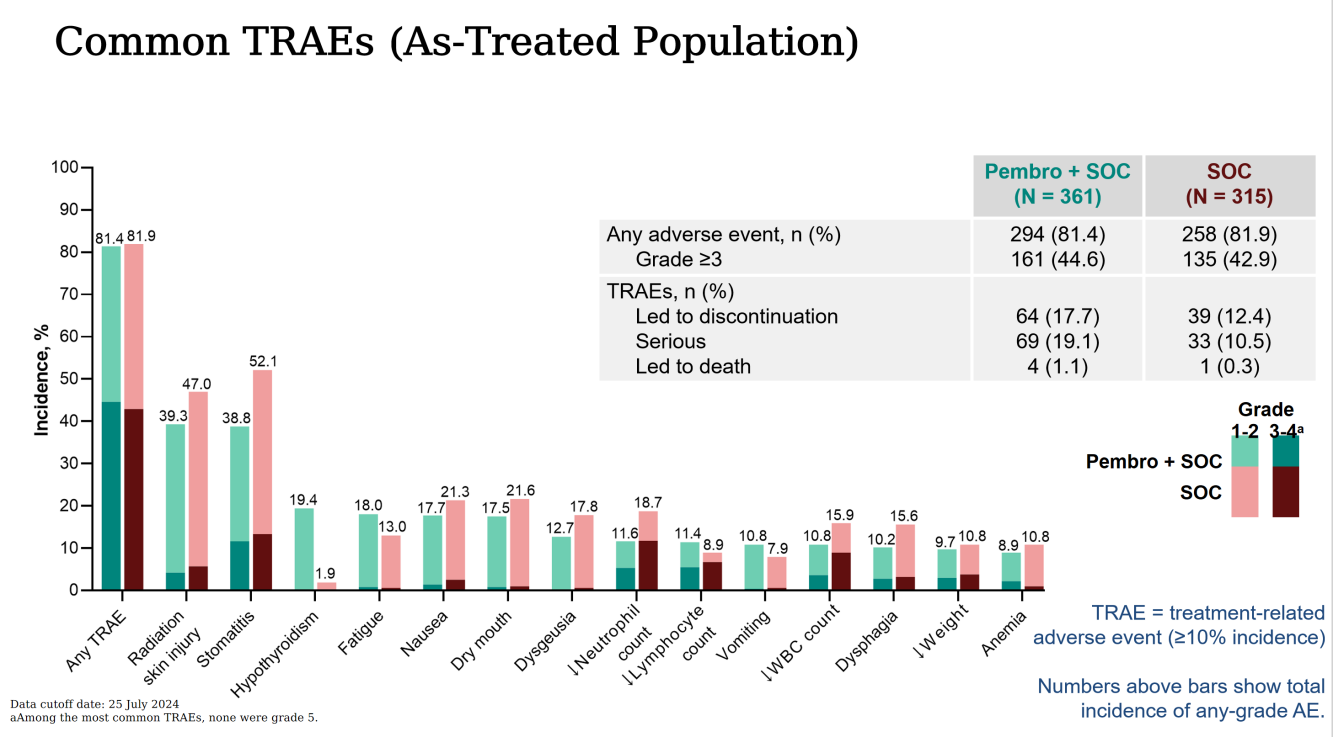
(4)帕博利珠单抗+SOC组与SOC组的治疗相关不良事件总体发生率相似,其中所有不良事件发生率分别为81.4%和81.9%,3级以上不良事件发生率分别为44.6%和42.9%(见图五)。
研究结论
在KEYNOTE-689的探索性研究结果中,围手术期帕博丽珠单抗显著改善DMFS并降低第二原发癌的发生率,进一步支持了在SOC基础上联合使用围手术期帕博利珠单抗的临床获益,该结果与本研究主要研究终点EFS的阳性结论一致。本研究未发现两组患者的局部区域控制率显著差异,且未观察到帕博利珠单抗新的安全性问题。
临床试验注册号:NCT03765918。
解读
KEYNOTE-689研究背景:LA HNSCC治疗现状及困境需求
头颈鳞癌(HNSCC)是全球范围内第七大肿瘤,发病部位多样,解剖结构复杂。绝大多数HNSCC患者首次诊断时已是局部晚期(>60%),预后较差,然而近年来尚未取得突破性治疗进展。EORTC 22931、RTOG 9501等前期研究确立了现有的标准治疗模式(SOC),在可切除局部晚期头颈鳞癌(LA HNSCC)患者中采用“手术+辅助放疗±化疗”模式,其中不含不良病理特征(如:阳性切缘或淋巴结外侵犯)的低危LA HNSCC患者,术后SOC为辅助放疗;对于高危LA HNSCC患者,术后SOC为辅助同步顺铂放疗[1]。然而,经过SOC治疗的LA HNSCC患者的1年疾病复发率约30%,5年生存率低于50%。
免疫治疗是肿瘤学近20年最重大的发现之一,其中PD-1免疫治疗在多个癌种(如:肠癌)中表现出重大临床获益及治疗潜力。在HNSCC领域,明星研究KEYNOTE-048奠定了免疫治疗在HNSCC中的重要意义并将其提升为复发/转移HNSCC的一线治疗[2]。然而,免疫治疗在HNSCC中的进一步临床试验探索蜿蜒曲折,大型III期临床研究,如KEYNOTE-412、IMVoke010等[3-4],未如预期取得阳性研究终点;已取得进展的研究主要集中于复发/转移性HNSCC,而LA HNSCC亟需更多的免疫治疗支撑性证据。
KEYNOTE-689研究亮点解读
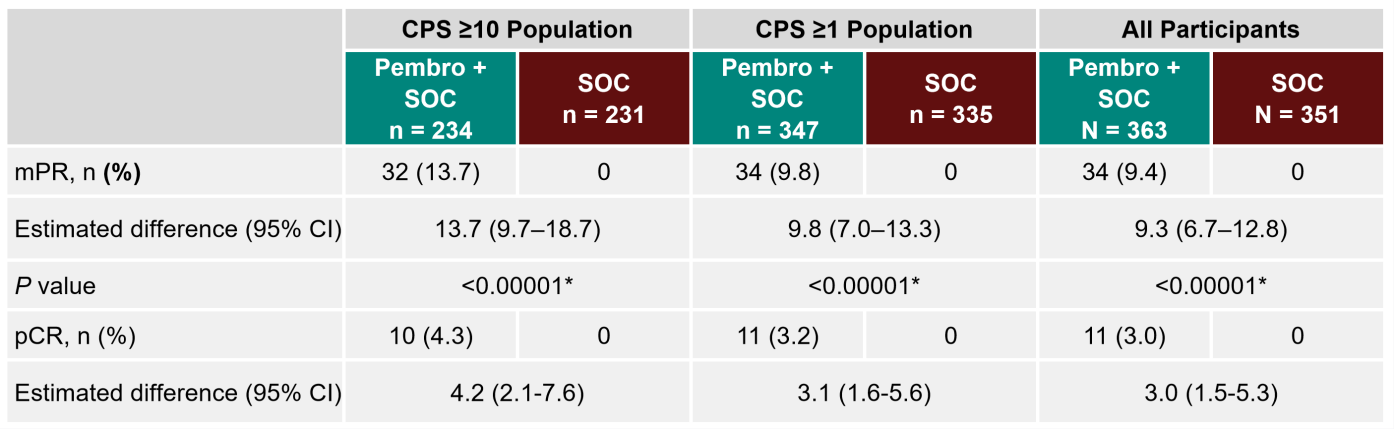
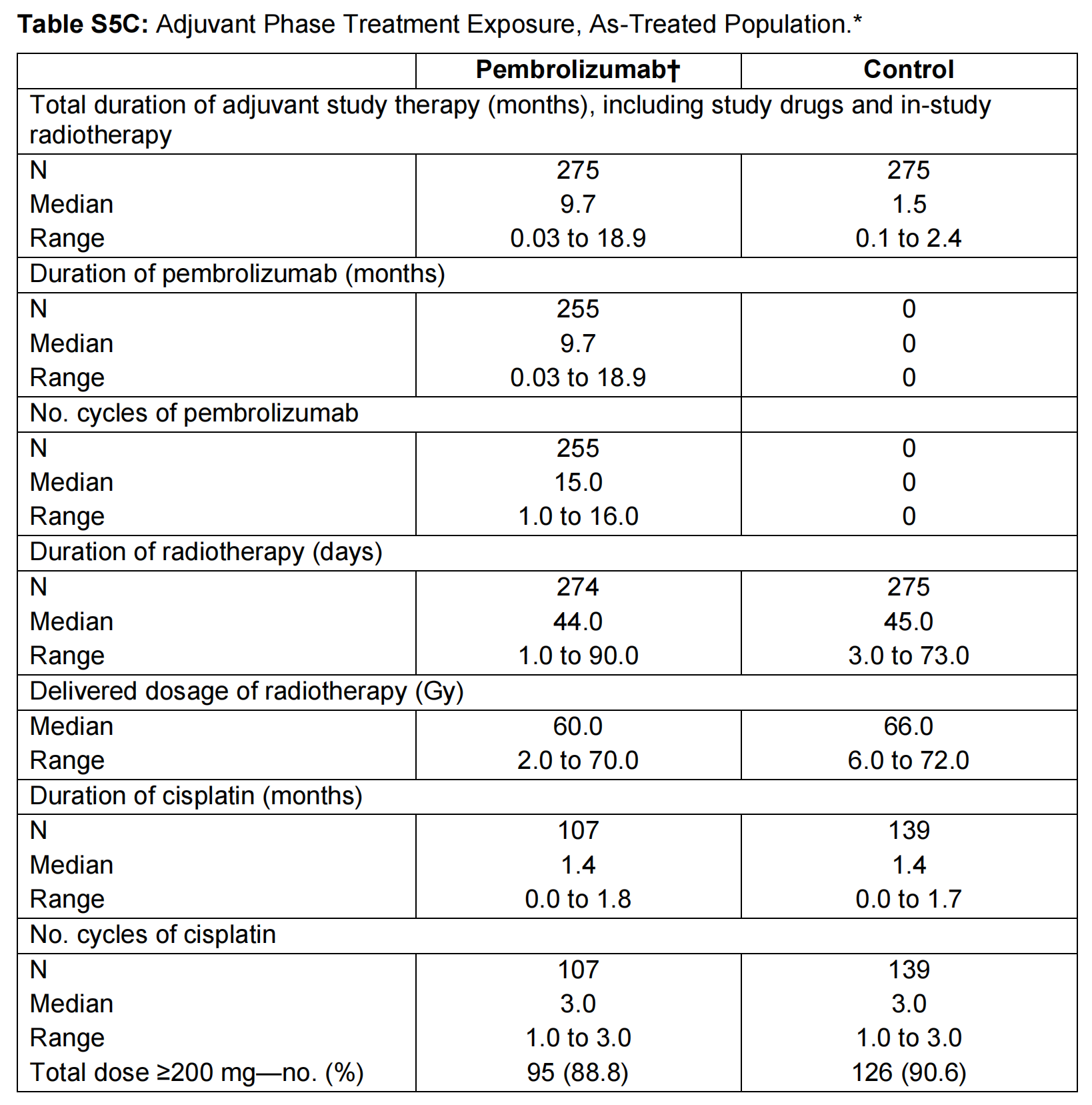
在此背景下设计执行的KEYNOTE-689研究取得了免疫治疗在LA HNSCC领域的重大突破,被誉为近二十余年来首个在术后LA HNSCC患者中取得优于SOC阳性结果的III期临床试验,于今年4月和6月分别在美国癌症研究协会以及美国临床肿瘤学会进行了结果汇报,并于6月19日在新英格兰医学杂志见刊[5-6]。KEYNOTE-689中期研究报告及探索性结果报告已证实(见图六、图七及表一):(1)在CPS≥10、CPS≥1及全体受试者组中,帕博利珠单抗联合SOC方案可显著延长可切除LA HNSCC患者的EFS并提升MPR率;(2)帕博利珠单抗联合SOC方案可延长无远处转移生存期(DMFS)、降低第二原发癌发生率、降低术后高危病理特征比例从而降低接受辅助放化疗的比例及剂量,且不影响手术可行性;(3)帕博利珠单抗联合SOC方案安全性良好,与SOC相近。该研究将帕博丽珠单抗免疫治疗拓展至LA HNSCC围手术期(新辅助+辅助),根据CPS及病理危险因素进行患者分层,并取得EFS、DMFS、主要病理缓解(mPR)、病理完全缓解(pCR)等多个阳性指标,取得LA HNSCC综合治疗的多个“首次突破”。
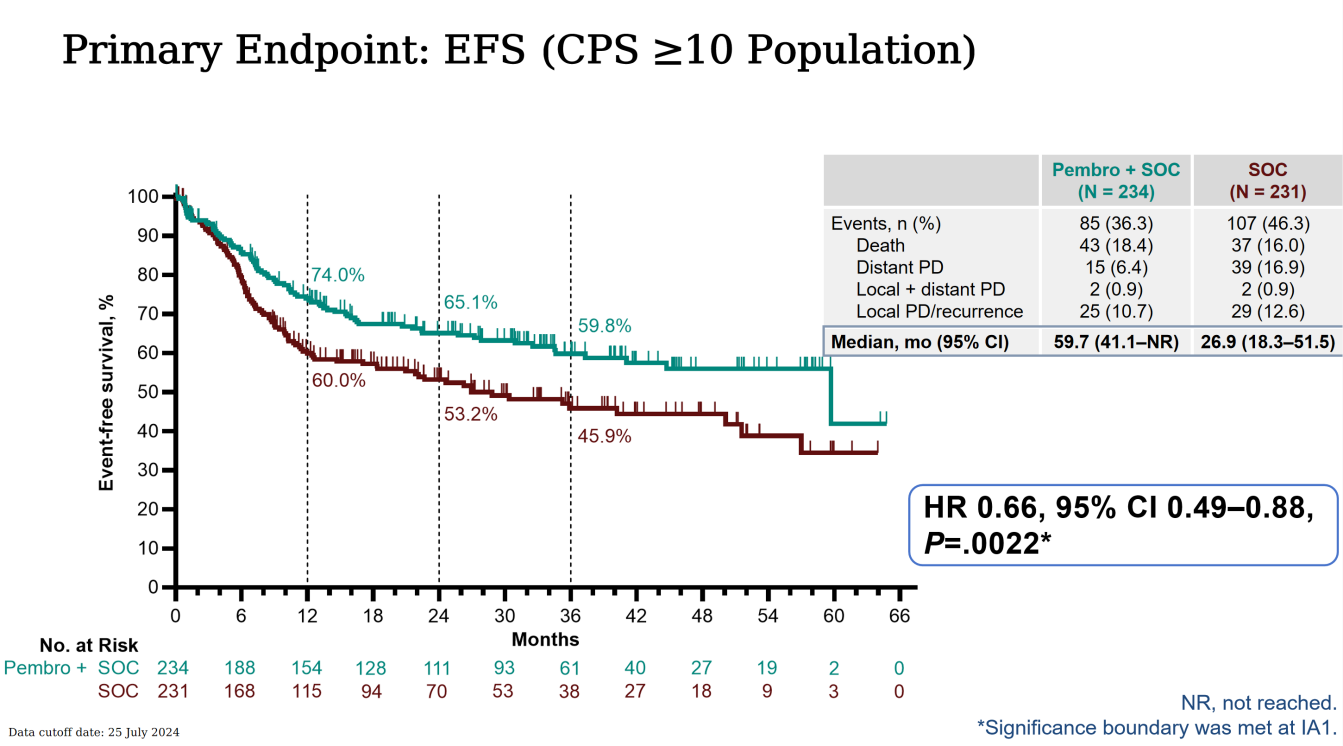
值得一提的是,对比同期类似的多个研究,如:2025ASCO同期发布的NIVOPOSTOP研究[7]、2024ASCO发布的PATHWay研究[8],KEYNOTE-689研究具备一系列的实验设计及结果意义的优势。NIVOPOSTOP同为随机III期临床试验,针对根治性手术后患者进行1:1比例随机分组:A组接受SOC治疗,B组接受放疗前纳武利尤单抗240 mg,继以标准放化疗联合纳武利尤单抗360 mg(每3周1次,共3周期),后续以纳武利尤单抗480 mg(每4周1次,共6周期)维持治疗。研究结果提示纳武利尤单抗可显著改善PD-L1全人群的DFS。相比NIVOPOSTOP,KEYNOTE-689有以下优点:(1)探索了LA HNSCC患者的围手术期免疫治疗(新辅助+辅助)临床获益并取得阳性结果;(2)研究囊括了低危及高危LA HNSCC,患者分型及来源更广泛,研究意义可指导更全面的LA HNSCC免疫治疗策略;(3)进一步探讨了CPS分层对于免疫治疗的结果对比。PATHWay研究也提供了辅助免疫治疗在术后高危LA HNSCC中的临床获益证据,并取得更优PFS的研究终点,然而相比KEYNOTE-689和NIVOPOSTOP,PATHWay研究作为II期研究,其受试者体量及研究终点较少,其提供数据的突破性较KEYNOTE-689相形见绌。
KEYNOTE-689带来的启示及未来发展方向:前路在何方
尽管KEYNOTE-689研究证实了围手术期帕博利珠单抗联合SOC方案治疗LA HNSCC的临床获益,并且取得的多项重要阳性结果、具备推进临床实践的指导意义,该研究存在多个阴性结果、异质性、人群代表性(如:HPV阳性患者少、CPS<1少)等问题,这进一步引发了对未来临床试验的启示及思考。
在阴性结果方面,尽管KEYNOTE-689研究发现新辅助免疫治疗提高了mPR及pCR率,但并未发现局部区域控制的获益;中期报告及探索性终点报告均报道了OS获益倾向,但未达到统计学意义,而主要研究者提出其中的可能原因是随访观察时间不足。我们可以由该研究的设计及结果提出以下问题:(1)新辅助免疫治疗带来的病理缓解导致了临床及病理降期,进而导致辅助治疗阶段的放化疗剂量减少(见表一),该改变是否导致了局部区域控制的无获益?针对降阶梯治疗时机与程度的进一步探索可能为此提供答案。(2)尽管本研究证实围手术期的免疫治疗有助于改善预后,但EFS曲线大约在3个月出现分离,大致群体为接受新辅助免疫治疗和根治性手术后患者,而既往根治性CCRT同期和辅助联合免疫治疗的多项研究均为阴性结果,是否有理由推定新辅助和辅助免疫治疗的获益比重存在差距?其中的关键可能在于平衡“免疫应答维持”,而这需要更多关于围手术期组合策略及序贯方式的临床证据。
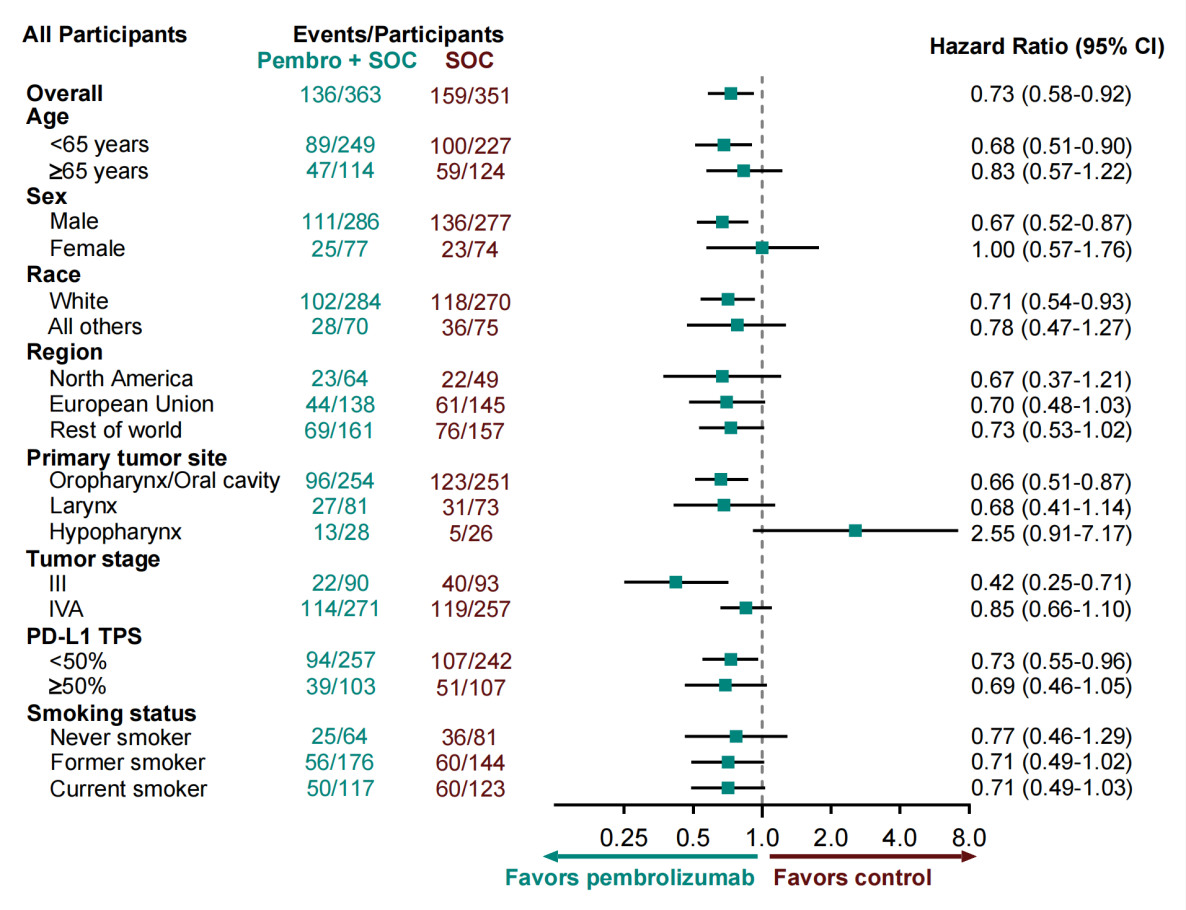
在异质性方面,围手术期帕博丽珠单抗联合SOC提升EFS的效能在各亚组间存在差异,突出表现在解剖部位、性别及年龄亚组中(见图八),尤其在下咽癌中表现为几乎未获益,其原因需进一步探讨。期待KEYNOTE-689的后续探索性研究终点提供进一步信息,如:免疫治疗标记物、基因组/转录组分析等。
在研究终点设计方面,KEYNOTE-689并未对不同解剖亚部位进行独立分析,各瘤种患者例数分布不均,此外没有体现咽喉功能保全情况及患者肿瘤退缩对生活质量的积极影响。既往研究表明,“多西他赛+顺铂+氟尿嘧啶”新辅助方案可提高喉保留率。未来临床试验设计可结合新辅助阶段的病理缓解情况,针对下咽/喉癌设立包含“功能保留”的综合疗效评估及特异性研究终点,在病理缓解良好的部分患者中探索缩小切除边界与降低放疗剂量,将治疗观念从“绝对根治导向”逐步向“综合生存导向”转型。
在免疫反应预测方面,CPS是目前公认的免疫应答关键指标。在KEYNOTE-048等研究中,CPS>20患者群体具有显著更优的免疫治疗反应[2]。然而,KEYNOTE-689研究中的CPS>10、CPS>1及全体人群均获得了更优的EFS结果,并且CPS>10及CPS>1人群的EFS优效性差异甚微[6],该研究间差异亦提出了CPS作为免疫反应预测性指标的可靠性疑惑,期待未来HNSCC免疫治疗临床及基础研究提供进一步解答。
在新辅助组合策略方面,本研究中新辅助免疫单药带来的mPR及pCR率均低于其他组合策略的II期临床试验,如:(1)纳武利尤单抗+卡铂+紫杉醇新辅助治疗带来42%的pCR及65%的mPR+pCR率[9];(2)西米普利单抗+铂双药化疗+西妥昔单抗带来40%的pCR率和60%的mPR率[10]。并且,本研究试验组有8.3%的患者在新辅助阶段退出试验,具体原因尚未报道。考虑到本研究仅获得全人群9.4%的mPR率,参考KEYNOTE-048中高达40%的帕博利珠单药组的疾病进展比例,我们可以推测部分患者出现肿瘤进展、调整系统性治疗方案或肿瘤进展导致死亡的可能。基于以上,我们有理由推荐新辅助免疫联合化疗可能是更佳的新辅助治疗方案并持续关注KEYNOTE-689对部分退组人群的后续分析及报告。
作为头颈肿瘤外科医生,我们也应当思考手术与免疫治疗在LA HNSCC治疗中的重要性权重及临床意义对比。近年来,针对治疗后免疫辅助治疗的IMvoke010研究为阴性结果,但其中接受根治性手术后的辅助免疫治疗人群(38%)具有EFS获益的趋势(HR=0.79)[4];NIVOPOSTOP研究针对根治性手术后高危患者,在术后辅助同期放化疗前、放疗同时和放疗后给予纳武利尤单抗的免疫治疗,也达到了DFS的主要终点获益[7]。这些数据提示,根治性手术后患者的免疫治疗探索或许更容易达成研究终点。
正如KEYNOTE-689研究者Nancy Lee教授所言,进入免疫治疗时代,我们应思考如何进一步提高免疫应答及疗效,并探索更优的研究设计以达成研究终点。未来的HNSCC免疫治疗可以从以下几个方面进一步探索:(1)低毒、高病理缓解的新辅助疗法探索,如:双药化疗+免疫治疗+靶向治疗,追求更高的mPR及pCR率;(2)降强度探索,如:新辅助治疗后手术范围的缩小,达到mPR患者的放疗照射范围及剂量的缩小;(3)辅助治疗顺序探索,如:免疫治疗与放疗±化疗的分离及序贯顺序,辅助治疗的周期选择;(4)免疫治疗反应标志物探索,如:更优的CPS替代标志物,探索新辅助治疗获益人群并延长新辅助治疗的周期。
中山大学肿瘤防治中心 头颈科主任 宋明教授:
杜明远博士对KEYNOTE-689探索性研究及中期研究进行了系统性解读,涵盖了对KEYNOTE-689及其他相关临床研究的纵横对比,分析全面,洞察深刻。该研究作为首个在可切除LA HNSCC围手术期免疫治疗中取得阳性结果的III期试验,首次实现新辅助与辅助免疫全程覆盖的临床获益模式。杜博士精准提炼了KEYNOTE-689研究在LA HNSCC治疗模式中的核心突破,并敏锐指出了关键矛盾点:尽管新辅助阶段取得一定病理缓解率、带来临床病理降期、减少辅助治疗强度,但是局部区域控制却未显著改善。他结合辅助治疗降阶现象提出“治疗应答维持不足”的科学假设,并关联亚组异质性,为未来临床研究中如何优化研究设计及治疗组合提供了重要思路。同时,该解读充分探讨CPS分层预测效能、病理缓解程度较低等问题并提出了具备前瞻性的研究展望。本解读兼具临床价值与科研启发性,均体现了他对头颈鳞癌免疫治疗研究的深度理解,具备优秀的批判性思维及独特洞见力。
【温馨提示】:如果您觉得杜明远医生解读的好,请在下方为他点赞并将文章分享给更多的同道!当然,您也可以在下方留下您的个人见解哦!
1. Cooper JS, Pajak TF, Forastiere AA, et al. Postoperative concurrent radiotherapy and chemotherapy for high-risk squamouscell carcinoma of the head and neck. N Engl J Med 2004;350:1937-44.
2. Harrington KJ, Burtness B, Greil R, et al. Pembrolizumab With or Without Chemotherapy in Recurrent or Metastatic Head and Neck Squamous Cell Carcinoma: Updated Results of the Phase III KEYNOTE-048 Study. J Clin Oncol. 2023 Feb 1;41(4):790-802.
3. Machiels JP, Tao Y, Licitra L, et al. Pembrolizumab plus concurrent chemoradiotherapy versus placebo plus concurrent chemoradiotherapy in patients with locally advanced squamous cell carcinoma of the head and neck (KEYNOTE-412): a randomised, double-blind, phase 3 trial. Lancet Oncol. 2024 May;25(5):572-587.
4. Haddad R, Fayette J, Teixeira M, et al. Atezolizumab in High-Risk Locally Advanced Squamous Cell Carcinoma of the Head and Neck: A Randomized Clinical Trial. JAMA. 2025 May 13;333(18):1599-1607.
5. Douglas A, Robert IH, Yungan T, et al. Neoadjuvant and adjuvant pembrolizumab plus standard of care (SOC) in resectable locally advanced head and neck squamous cell carcinoma (LA HNSCC): Exploratory efficacy analyses of the phase 3 KEYNOTE-689 study. 2025 ASCO.
6. Uppaluri R, Haddad RI, Tao Y, et al. Neoadjuvant and Adjuvant Pembrolizumab in Locally Advanced Head and Neck Cancer. N Engl J Med. 2025 Jun 18. Epub ahead of print.
7. Jean B, Anne A, Christian B, et al. NIVOPOSTOP (GORTEC 2018-01): A phase III randomized trial of adjuvant nivolumab added to radio-chemotherapy in patients with resected head and neck squamous cell carcinoma at high risk of relapse. 2025 ASCO.
8. Alexander TP, Tanguy YS, Roger BC, et al. A randomized, double-blind, placebo-controlled phase II study of adjuvant pembrolizumab versus placebo in patients with head and neck squamous cell cancers at high risk for recurrence: The PATHWay study. 2024 ASCO.
9. Zinner R, Johnson JM, Tuluc M, et al. Neoadjuvant nivolumab (N) plus weekly carboplatin (C) and paclitaxel (P) in resectable locally advanced head and neck cancer. 2020 ASCO.
10. Wong W, Cracchiolo JR, Riaz N, et al. Neoadjuvant cemiplimab with platinum-doublet chemotherapy and cetuximab to de-escalate surgery and omit adjuvant radiation in locoregionally advanced head & neck squamous cell carcinoma (HNSCC). 2023 ASCO.











 苏公网安备32059002004080号
苏公网安备32059002004080号


