

针对(IA/B期)非小细胞肺癌(NSCLC)和局部晚期(II-IIIA/B期)NSCLC,手术仍是主要的治疗方法。随着临床医生对免疫治疗和靶向治疗的认识不断深入,局部晚期NSCLC的治疗模式和可切除性评估标准正发生重大变革。2025年1月,美国胸外科医师协会(STS)在The Annals of Thoracic Surgery(IF=3.7)发表了一篇多学科专家共识,以指导局部晚期NSCLC可切除性的判定及治疗方案的决策。本篇共识聚焦于局部晚期NSCLC的三大主要领域:(1)可切除性评估与多学科管理模式;(2)新辅助治疗(含手术围期治疗)策略;(3)辅助治疗,最终共形成19条共识。这些共识充分反映了基于最新文献资料及当前临床实践经验,对局部晚期肺癌可切除性及多学科综合治疗的最新认知与见解。【肿瘤资讯】特此整理,以飨读者。

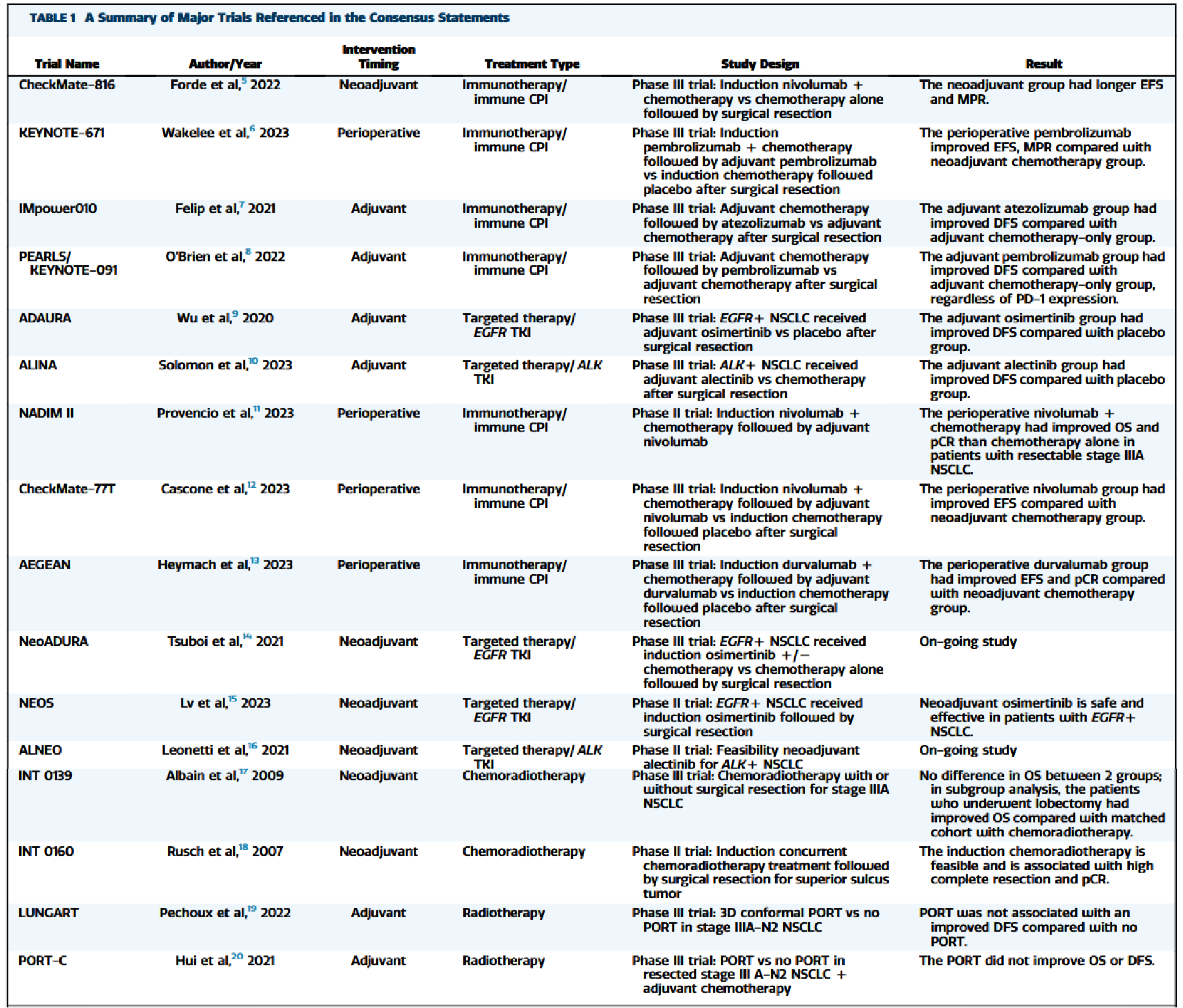
本共识引用的主要临床试验如下表所示:
局部晚期肺癌可切除性评估与多学科管理模式
多学科肿瘤委员会的作用
共识1:局部晚期非小细胞肺癌(NSCLC,临床分期为IIA期至IIIA期)患者应由多学科肿瘤(MDT)委员会讨论,该委员会应包括但不限于具备肺癌手术经验的认证胸外科医师以及专注于胸部的医学肿瘤学家和放射肿瘤学家,以讨论最佳治疗方案,包括确定手术切除的可行性和适宜性、潜在的诱导治疗方案以及其他替代治疗方案。
共识2:应在治疗初期明确手术可切除性。在获得更多数据之前,对于最初被判定为不可切除的患者,不应给予新辅助治疗以试图将不可切除疾病转化为可切除疾病。
临床T2b/T3 N0期NSCLC的多学科管理
共识3:对于无临床淋巴结转移且无驱动基因突变的4-7cm的NSCLC患者,若其身体状况可耐受手术,术前新辅助治疗方案更倾向于选择含铂类药物的化疗联合免疫治疗,而非术后辅助治疗,尤其在程序性死亡配体1(PD-L1)高表达的肿瘤中;对于4-5cm的肿瘤,目前尚无充分数据明确新辅助化疗联合免疫治疗是否优于术后辅助治疗。
临床T1-3 N1期NSCLC的多学科管理
共识4:对于无驱动基因突变且身体状况可耐受手术的临床N1期(单个或多个N1淋巴结受累)NSCLC患者,术前新辅助治疗方案更倾向于选择含铂类药物的化疗联合免疫治疗,而非术后辅助治疗,尤其在程序性死亡配体1(PD-L1)高表达的肿瘤中。
临床T1-3单站N2期NSCLC的多学科管理
共识5:对于经活检标本证实的无驱动基因突变的单站、非巨大块型N2病变的NSCLC患者,若其身体状况可耐受手术,作为多学科综合治疗模式的一部分,通常适宜进行手术切除,且术前新辅助治疗方案更倾向于选择含铂类药物的化疗联合免疫治疗,而非术后辅助治疗。
共识6:对于经病理证实的单站、巨大块型N2病变的NSCLC患者,目前尚缺乏足够的数据来指导手术切除是否优于其他治疗选择。然而,在某些特定病例中,尤其是在考虑可能进行肺叶切除的情况下,经过多学科肿瘤委员会讨论后,可将手术作为多学科综合治疗的一部分。强烈鼓励将这些患者纳入临床试验。
多站(≥2)N2期NSCLC的多学科管理
共识7:经病理证实的多站N2病变的NSCLC患者,通常不被视为手术切除的合适对象,因为他们在手术后长期预后较差,尤其是在巨大块型淋巴结病变的情况下。然而,在某些特定病例中,如果为非巨大块型、2至3个受累的N2站,且肺叶切除被认为可行,经过多学科肿瘤委员会讨论后,可考虑将手术作为多学科综合治疗的一部分。强烈鼓励将这些患者纳入临床试验。
诱导治疗后持续性N2淋巴结的多学科管理
共识8:对于可切除的NSCLC患者,若在诱导治疗后仍存在持续性N2病变,但无疾病进展,通常适宜继续进行手术切除。
T4期疾病的多学科管理
共识9:临床T4期NSCLC患者是一个异质性群体,在某些经过诱导治疗后的T4 N0-1期患者中,经过多学科肿瘤委员会在经验丰富的中心讨论后,可以考虑进行手术切除。临床示例包括:
肿瘤直径>7cm或不同肺叶有卫星结节且伴有N0或N1期淋巴结受累的NSCLC患者。
侵犯膈肌、纵隔结构、喉返神经、椎体或气管隆突的T4 N0-1期肿瘤患者。
共识10:T4 N2期肿瘤患者通常被认为不适合以治愈为目的的手术治疗,最好采用非手术治疗方案。
肺上沟瘤的多学科管理
共识11:对于可切除的无N2淋巴结受累的肺上沟瘤患者,术前同步放化疗后行手术切除仍是标准治疗方案,在临床试验之外,不推荐诱导化疗联合免疫治疗。
新辅助治疗
可切除NSCLC的新辅助治疗与围手术期治疗
共识12:II A期及以上的NSCLC患者可接受新辅助或围手术期(围辅助)化疗联合免疫治疗。目前尚不明确哪种方法更优,但新辅助治疗后达到病理完全缓解(pCR)可预测无事件生存期。
PD-L1表达水平与术前治疗指导
共识13:在符合新辅助化疗联合免疫治疗条件的可手术切除的III期NSCLC患者中,肿瘤程序性死亡配体1(PD-L1)的表达可预测对新辅助治疗的反应。然而,PD-L1表达缺失不应作为排除患者接受新辅助免疫治疗的依据。
诱导化疗联合免疫治疗的禁忌证
共识14:在可手术切除的II期至III期NSCLC患者中,对于EGFR、ALK、ROS1、RET、HER2和NTRK基因突变的肿瘤,新辅助免疫治疗联合化疗并无额外疗效或效果甚微,因此不推荐在这些分子亚型中使用。这些患者可接受新辅助化疗或化疗联合放疗,随后进行手术切除,以及在获批的情况下接受辅助靶向治疗。或者,当合适时,可选择手术切除,随后进行辅助靶向治疗(有或无化疗),作为替代治疗方案。
诱导靶向治疗的作用
共识15:新辅助靶向治疗的研究尚处于起步阶段,对于具有驱动基因突变的II期至III期NSCLC患者(大多为腺癌组织学类型),应当考虑参与,并且如果有机会,应积极讨论关于纳入合适靶向治疗(包括新辅助治疗)的临床试验。
辅助治疗
对于接受术前诱导治疗(即化疗联合免疫治疗)后仍有持续淋巴结病变的患者,辅助系统治疗的作用
共识16:尽管在接受新辅助化疗联合免疫治疗后仍有持续性N2淋巴结病变的患者具有较差的肿瘤学预后,但额外辅助化疗的作用尚不清楚。根据已报告的围手术期免疫治疗试验,为患者提供辅助免疫治疗可能是合理的。
共识17:如果患者接受了具有III期数据的围手术期治疗方案,可继续进行辅助免疫治疗;对于EGFR突变的NSCLC患者,应提供奥希替尼作为辅助治疗,持续3年(理想情况下,在新辅助治疗阶段未接受过免疫治疗)。
诱导治疗(即化疗联合免疫治疗)后术后放射治疗的作用
共识18:对于接受新辅助化疗联合免疫治疗后进行手术的N2期受累的NSCLC患者,术后放射治疗(PORT)并非常规推荐。如果存在显著的持续性纵隔淋巴结病变(例如,ypN2 >1个淋巴结站),在多学科肿瘤委员会讨论后,可考虑将小体积、高度适形的PORT作为一种选择(与额外的系统治疗相比)。强烈鼓励患者参加临床试验,如果有机会,应与患者讨论临床试验。
共识19:如果手术病理结果显示为R1/R2切除,应考虑进行PORT。
总结
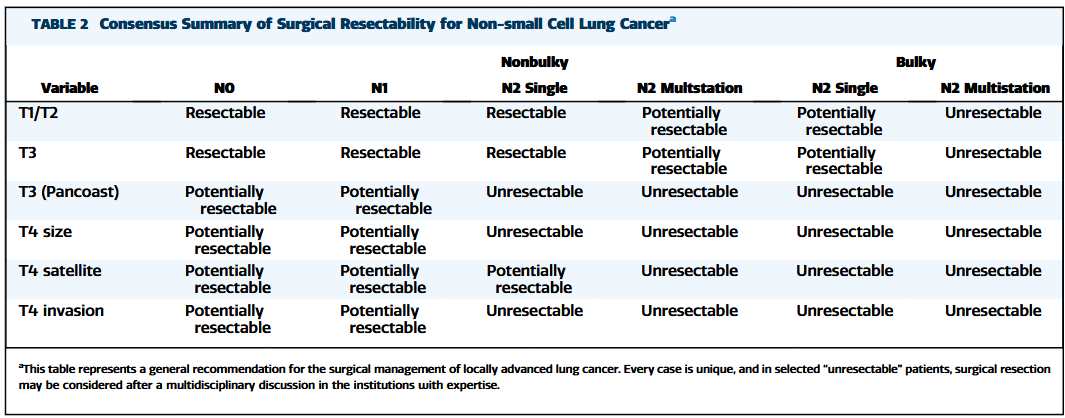
局部晚期NSCLC患者的诊疗策略应经过MDT讨论,以寻求最佳循证治疗。局部晚期NSCLC的可切除性不应该意味着我们“可以”取出它,而是我们“应该”。因此,胸外科医生必须了解最新的数据,才能为患者提供最佳的手术干预。表2强调了基于临床分期的局部晚期NSCLC可切除性的共识总结。准确的术前诊断,分期和分子分类是指导患者和MDT团队实现最佳治疗的关键。
排版编辑:肿瘤资讯-明小丽
Kim SS, Cooke DT, Kidane B, Tapias LF, Lazar JF, Awori Hayanga JW, Patel JD, Neal JW, Abazeed ME, Willers H, Shrager JB. The Society of Thoracic Surgeons Expert Consensus on the Multidisciplinary Management and Resectability of Locally Advanced Non-small Cell Lung Cancer. Ann Thorac Surg. 2025 Jan;119(1):16-33.











 苏公网安备32059002004080号
苏公网安备32059002004080号


