肺癌是目前全球最常见的恶性肿瘤之一,其发病率和死亡率常年位居前列。随着基础研究和临床科研的持续突破,精准诊疗策略在肺癌诊疗中发挥着越来越重要的作用。驱动基因阳性的晚期非小细胞肺癌(NSCLC)的靶向治疗策略已日趋完善并在日益丰富,此外,双特异性抗体、放射配体疗法(RLT)也有望在小细胞肺癌(SCLC)拓展全新的精准治疗策略。这些治疗策略的持续改进,有助于显著提升广大肺癌患者临床获益。2025年美国临床肿瘤学会(ASCO)年会已于当地时间5月30日至6月3日在美国芝加哥盛大召开,此次大会也公布了多项罕见靶点突变肺癌诊疗的最新进展,【肿瘤资讯】特此整理,以飨读者。
多维度探索NSCLC治疗获益
MET异常NSCLC的靶向治疗药物正日益成为肺癌精准治疗的关注热点,MET异常包括MET 14号外显子(METex14)跳突、MET基因扩增以及MET蛋白过表达等。卡马替尼是一种口服高选择性MET-TKI,为METex14跳突NSCLC患者提供了全新的治疗希望。此前报告的II期临床研究GeoMETry mono-1研究[1]和基于中国人群开展的GeoMETry-C研究[2]均显示卡马替尼一线治疗METex14跳突NSCLC患者的卓越疗效和可管可控的安全性。在全球人群中卡马替尼一线治疗客观缓解率(ORR)68.3%,疾病控制率(DCR)98.3%,中位无进展生存期(mPFS) 12.5个月,中位随访时间46.4个月,中位总生存期(mOS)达21.4个月,疗效数据稳定的同时,在安全性方面,卡马替尼≥3级治疗相关不良事件(TRAE)发生率较低,在中国人群中无AE导致的停药,治疗期间外周水肿和肝毒性的发生率亦较低,大多为1-2级[1, 2]。本次ASCO年会上公布的一项回顾性真实世界队列研究[3]再次验证了卡马替尼优异且稳定的临床疗效,一线接受不同剂量水平MET TKI治疗的17例患者(卡马替尼11例,特泊替尼6例)汇总数据显示,至治疗终止时间(mTTD)为22.1个月,mPFS为19.6个月,mOS为33.3个月,总体预后良好,剂量减少的常见原因为外周水肿、疲劳、急性肾损伤和肝功能异常,该研究结果提示对于部分患者可能因治疗不耐受而接受非常规剂量方案仍可维持稳定的疗效获益,保证治疗持续性,避免治疗终止,是平衡疾病控制与生活质量的可行策略之一。
此外,2025年ASCO还公布了一项全球多中心开放标签、Ⅱ期临床研究(NCT05541822)[4],在队列1中评估了高选择性MET抑制剂Vabametkib(ABN401)800mg QD治疗METex14跳突NSCLC患者的安全性和有效性。结果显示,可评估人群(n=37)的ORR为43.2%,初治患者mPFS为15.9个月,既往经治患者mPFS为6.2个月,常见TRAE为恶心(70%)、腹泻(35%)、呕吐(30%)和外周水肿(12.5%),提示Vabametkib是METex14跳突NSCLC患者的潜在治疗药物。另一项ASCO公布的美国多中心单臂II期研究[5]报告了卡博替尼治疗28例转移性MET变异肺癌队列的最终分析结果,其中23例(82%)为METex14跳突,2例(7%)为MET扩增,既往接受系统治疗线数为2(range:1-6),86%曾接受MET TKI治疗。有效性分析显示 ORR 仅22%,mPFS 4.5个月,mOS 7.2个月。常见治疗相关不良反应为疲乏(39%),腹泻(39%),掌跖红斑(36%)和厌食(36%),≥3级AEs包括低磷血症(14%)、高血压(11%)和脂肪酶水平升高(11%)。该结果为既往TKIs治疗失败的患者提供了可选的靶向治疗方案。未来针对MET靶点还存在诸多深入探索的方向,如上市后药物开展真实世界研究、新药研发、MET TKI耐药后治疗、MET TKI联合治疗,MET扩增cutoff、围术期治疗、其他实体瘤等。
新联合模式优化AE管理
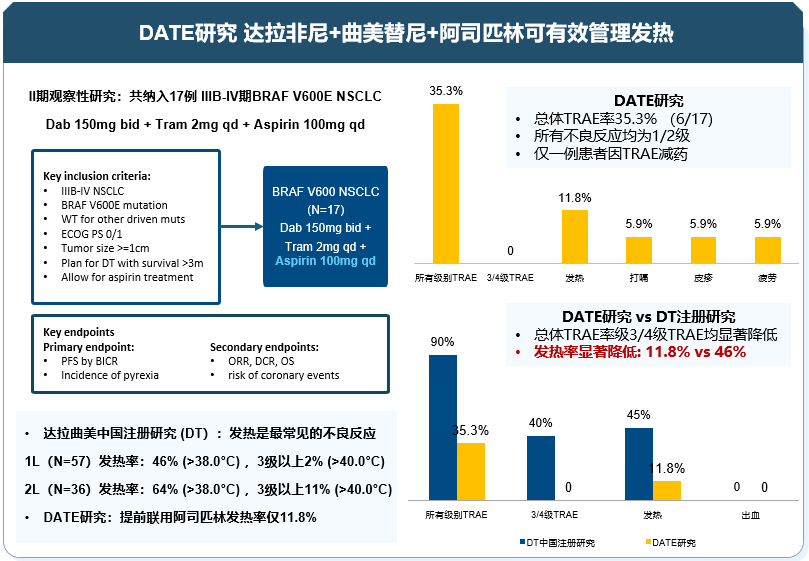
目前达拉非尼联合曲美替尼(Dab+Tram)双靶方案是国内外指南一致推荐治疗BRAF V600突变NSCLC的优选方案。在全球多中心的II期临床试验[6]中,Dab+Tram联合方案用于一线治疗BRAF V600突变的NSCLC患者的ORR 为64%,mPFS达到14.6个月,mOS可达2年,Dab+Tram方案在中国NSCLC人群的疗效数据[7]更为出色,ORR高达75%,DCR达到95%;在安全性方面,双靶方案在中国人群中显示出更优的安全性,3级以上发热的发生率仅5%(1/20),优于全球人群的11%。此次ASCO更新了Dab+Tram方案治疗相关发热综合征临床结局分析[8],研究结果显示,在包括肺癌的各瘤种中,发热发生率无显著差异,发热综合征发生率约为40%,且多在治疗早期。值得关注的是,发热患者的治疗持续时间显著长于未发热者,这提示发热患者可能具有更优的生存获益,且针对Dab+Tram方案发热的不良反应管理有助于进一步提升患者治疗获益。2025 年ASCO公布了在BRAF V600 突变NSCLC患者中同时使用阿司匹林与Dab+Tram双靶方案的II期研究的初步安全性结果[9]。此项研究结果显示联合治疗模式显著降低了发热发生率,仅为11.8%(2例,均为G1/2),仅1例(5.9%)需剂量减量,无治疗中断或≥3级不良事件,AE谱与既往报道基本一致,无消化道出血或冠状动脉事件(图1)。阿司匹林作为COX抑制剂,不仅能通过降低PGE2缓解发热,还可能通过调节PI3K-AKT-mTOR和RAS-RAF-MEK通路延缓耐药,本研究在Dab+Tram联合方案中添加阿司匹林结果显示可有效降低发热的发生率,并最大限度地减少治疗中断。
新方案破局SCLC治疗潜能
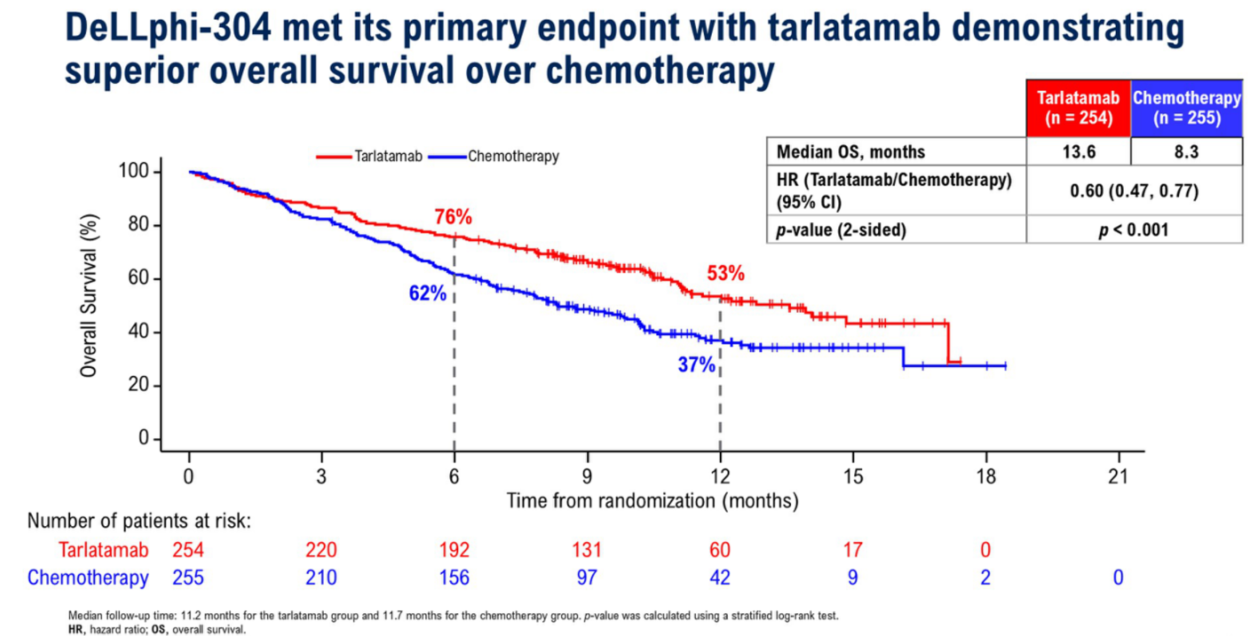
在SCLC治疗领域,此次ASCO也以LBA的形式公布了III期DeLLphi-304研究的主要分析结果[10]。Tarlatamab是一种靶向Delta-like ligand 3(DLL3)和CD3的双特异性T细胞衔接器免疫疗法,可同时与肿瘤细胞上的DLL3和T细胞上的CD3相结合,导致T细胞介导的肿瘤细胞裂解,从而起到肿瘤杀伤的作用[11]。DeLLphi-304研究评估了Tarlatamab对比化疗作为SCLC二线治疗的疗效和安全性。研究结果显示,与化疗相比,Tarlatamab治疗可使SCLC死亡风险降低40%,OS显著延长(mOS:13.6 vs 8.3个月;风险比[HR] 0.60 [95%CI:0.47-0.77];P<0.001)(图2);PFS亦显著改善(mPFS:4.2 vs 3.2个月;HR 0.71 [95%CI:0.59-0.86];P<0.001)。并且铂类耐药和脑转移等不良预后因素的患者也能获益。此外,与化疗相比,Tarlatamab可改善患者报告的呼吸困难和咳嗽症状。在安全性方面,Tarlatamab耐受性良好,高级别不良事件发生率较低 (27% VS 62%),导致治疗中断的不良事件发生率较低。因此,Tarlatamab有望成为SCLC新的二线治疗方案,也意味着SCLC患者“去化疗”治疗模式迈入临床视野。DLL3是Notch信号通路的关键抑制性配体,在小细胞肺癌、大细胞神经内分泌癌(LCNEC)等神经内分泌肿瘤中特异性高表达(80-85%的SCLC患者呈DLL3阳性),而在正常组织中几乎不表达,还与SCLC患者预后不良显著相关,且在肿瘤微环境中呈现“旁观者效应”,即在低表达DLL3的肿瘤细胞也能被邻近高表达细胞释放的毒素杀伤[12-17]。这种肿瘤表达的高选择性和靶点特性,使其成为极具潜力的精准治疗靶点,目前除外双特异性抗体之外,抗体偶联药物(ADC)、CAR-T疗法、RLT也针对DLL3广泛期小细胞肺癌(ES-SCLC)领域开展了相应临床研究,有望为ES-SCLC患者带来更多新的治疗希望。
ctDNA助力肿瘤精准检测
正确开展分子病理检测、获得准确分子靶向信息对于肿瘤精准治疗的开展至关重要。目前,国内外肺癌诊疗指南均建议对初诊的肺腺癌患者进行分子基因检测[18]。组织活检是NSCLC诊断的“金标准”,然而由于组织活检侵入性强及患者耐受性差等原因,部分驱动基因阳性NSCLC患者错失了靶向治疗的机会。循环肿瘤DNA(ctDNA)作为一种源于肿瘤细胞释放到循环系统中的DNA片段,已成为一种极具潜力的非侵入性液体活检标志物,越来越多的被应用于真实世界癌症早期检测和疾病监测之中。此次ASCO年会也公布了多项基于ctDNA的肺癌早期诊断策略的最新研究进展,相信这些前沿的检测手段将有力地提高肺癌罕见靶点突变的检出率,为患者后续治疗决策提供重要支持。
一项关于新型磁珠法循环游离DNA(cfDNA)提取技术的研究显示[19],该优化方案(XH)通过改进预处理、裂解和结合步骤,相较于传统的QIA试剂盒,在模拟血浆样本中表现出显著更高的提取产率(39.91 ng vs 31.17 ng, p < 0.05)。这一技术为基于NGS的ctDNA分析提供了更可靠的平台。
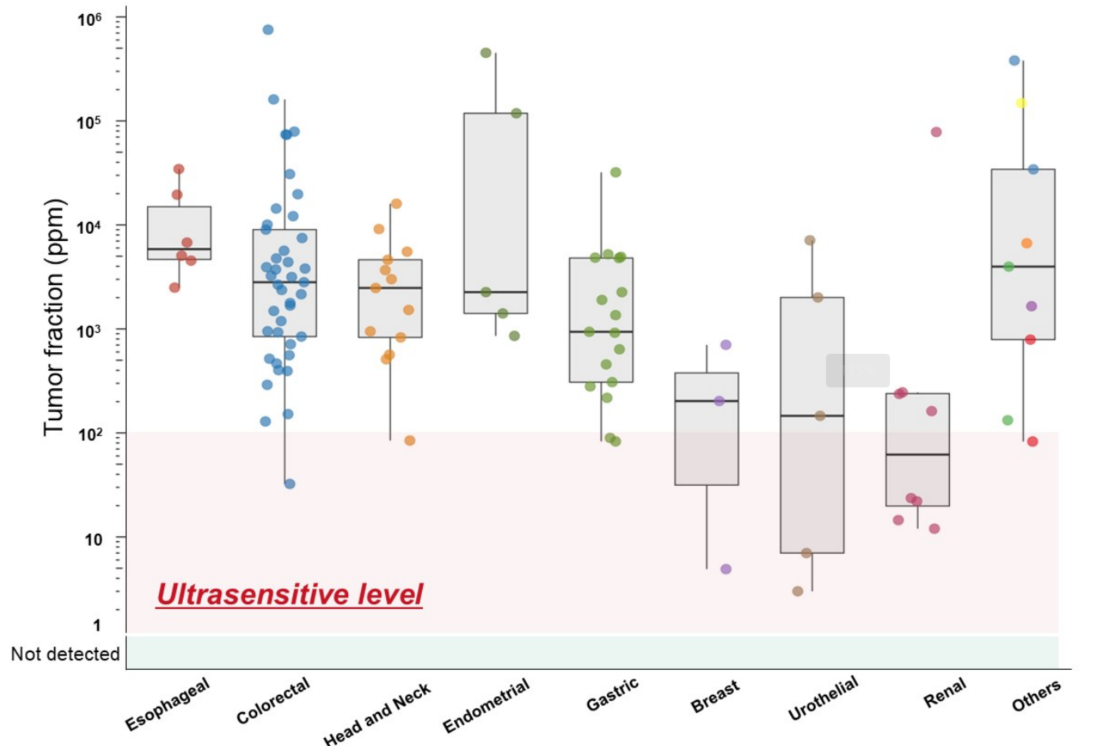
MONSTAR-SCREEN-3研究基于超灵敏全基因组测序(WGS)的个性化ctDNA检测在8种癌症类型的97.2%患者中成功创建了个性化检测方案。在基线样本中实现了100%的检测灵敏度(图3)[20]。
此外,ctDNA的来源也不再局限于外周血。针对伴有恶性胸腔积液的肺腺癌患者,研究发现从胸腔积液细胞学上清液中提取的ctDNA可能更可靠地反映肿瘤的基因组特征[21]。异常甲基化的ctDNA也可作为肺癌的潜在诊断生物标志物[22]。多篇研究[23,24]均强调了多组学标志物的联合应用的重要性,将循环肿瘤RNA(ctRNA)整合到液体活检中,同时进行ctDNA和ctRNA联合检测可以进一步提升检测的广度和临床效用,尤其是在基因融合的检测方面。
结论与展望
随着2025年ASCO年会上公布的众多前沿研究成果,肺癌诊疗策略正不断得到丰富和完善。罕见靶点突变NSCLC的靶向治疗策略在多维度得到丰富,无论是真实世界疗效的补充,抑或是AE管理方案的不断提升,都更进一步为该类患者的临床获益“保驾护航”。双特异性T细胞衔接器免疫疗法等新型疗法也为SCLC的治疗提供了全新的思路,这无疑为这类治疗选择和临床获益均有限的患者提供了新的希望。此外,精准检测技术的日新月异,不仅提高了检测的准确性和灵敏度,还为患者提供了更多非侵入性的检测选项,液体活检技术的不断进步也将进一步提高肺癌的早期诊断率和治疗监测的准确性,为患者带来更好的预后。我们有理由相信,在精准医学的推动下,未来肺癌的诊疗将会更加精准、高效和安全,为患者带来更好的治疗效果和生存体验。
[1] Wolf, Jürgen et al. The Lancet Oncology, 2024, Volume 25, Issue 10, 1357 - 1370.
[2] Yi-Long Wu, et al. 2022 ESMO AISA, 388P.
[3] 2025 ASCO Abstract# e20671
[4] 2025 ASCO Abstract# 8640
[5] 2025 ASCO Abstract# 8645
[6] Planchard D, Besse B, Groen HJM et al. Phase 2 Study of Dabrafenib Plus Trametinib in Patients With BRAF V600E-Mutant Metastatic NSCLC: Updated 5-Year Survival Rates and Genomic Analysis. J Thorac Oncol. 2022 Jan;17(1):103-115.
[7] Fan Y, Zhou J, Zhao Y, Yu Y, Yang N, Li J, Wang J, Zhao J, Wang Z, Chen J, Zhu T, Li H, Passos VQ, Bury-Maynard D, Zhang L. Efficacy, safety, and quality of life of dabrafenib plus trametinib treatment in Chinese patients with BRAFV600E mutation-positive metastatic non-small cell lung cancer. Transl Lung Cancer Res. 2024 Dec 31;13(12):3382-3391.
[8] 2025 ASCO Abstract# e24092
[9] 2025 ASCO Abstract# e20632
[10] 2025 ASCO Abstract# LBA8008
[11] Ahn MJ, Cho BC, Felip E, et al. N Engl J Med. 2023 Nov 30;389(22):2063-2075.
[12] Zhang H, et al. Targeting the Notch signaling pathway and the Notch ligand, DLL3, in small cell lung cancer. Biomed Pharmacother. 2023 Mar;159:114248.
[13] Yao J, et al. DLL3 as an Emerging Target for the Treatment of Neuroendocrine Neoplasms. Oncologist. 2022 Nov 3;27(11):940-951.
[14] Tanaka K, et al. Prevalence of Delta-like protein 3 expression in patients with small cell lung
cancer. Lung Cancer. 2018;115:116-120.
[15] Huang RSP, et al. Delta-like Protein 3 Prevalence in Small Cell Lung Cancer and DLL3 (SP347) Assay Characteristics. Arch Pathol Lab Med. 2019 Nov;143(11):1373-1377.
[16] Rudin CM, et al. Rovalpituzumab tesirine, a DLL3-targeted antibody-drug conjugate, in recurrent small-cell lung cancer: a first-in-human, first-in-class, open-label, phase 1 study. Lancet Oncol. 2017 Jan;18(1):42-51.
[17] Morgensztern D, et al. Efficacy and Safety of Rovalpituzumab Tesirine in Third-Line and Beyond Patients with DLL3-Expressing, Relapsed/Refractory Small-Cell Lung Cancer: Results From the Phase II TRINITY Study. Clin Cancer Res. 2019 Dec 1;25(23):6958-6966.
[18] 中国医师协会肿瘤多学科诊疗专业委员会,国家肿瘤质控中心肺癌质控专家委员会. 原发性肺癌罕见靶点靶向治疗中国临床诊疗指南(2024版)[J]. 中国肿瘤临床与康复,2024,31(5):265-295.
[19] 2025 ASCO Abstract# 3051
[20] 2025 ASCO Abstract# 3007
[21] 2025 ASCO Abstract# e20029
[22] 2025 ASCO Abstract# 8034
[23] 2025 ASCO Abstract# 3016
[24] 2025 ASCO Abstract# 3062
审批码TAB0048564-102968,有效期为2025-06-16至2026-06-15,资料过期,视同作废
排版编辑:肿瘤资讯-CYX
版权声明











 苏公网安备32059002004080号
苏公网安备32059002004080号


