免疫治疗目前已成为驱动基因阴性晚期非小细胞肺癌(NSCLC)一线治疗的标准治疗方案,明显改善患者预后。目前,针对一线免疫治疗耐药的后续治疗,临床尚缺乏统一的标准治疗方案,免疫再挑战联合化疗或抗血管生成治疗仍可为患者带来生存获益。当前多项临床研究正探索新型治疗方案,涵盖不同免疫检查点抑制剂的联合应用等前沿方向。
本文分享一例驱动基因阴性、PD-L1低表达的肺鳞癌患者,在经历一线PD-1抑制剂联合化疗及多线后续治疗失败后,通过艾托组合抗体联合方案成功实现疾病缓解的典型案例。
本案例由广西中医药大学第一附属医院姚菲教授分享,并邀请广西中医药大学第一附属医院石玮教授进行点评。此病例不仅展示了艾托组合抗体在免疫治疗再挑战中的优势,也为类似患者群体提供了新的治疗思路。现将病例及点评内容整理如下,供大家分享、交流。
患者基本信息
一般资料:
患者男性,既往有高血压病史3年,血压控制一般,主要以低压升高为主。
病史概述:
1. 2021年1月因"反复咳嗽咳痰2月余"在外院就诊。
2. 胸部CT:左肺上叶下舌段周围型肺癌并左肺门、纵隔淋巴结转移;左肱骨头致密影,考虑转移瘤。
3. 肺穿刺活检病理:非小细胞肺癌,符合鳞状细胞癌,低分化。
4. 免疫组化:CK(+), CK7(+), CK5/6(+), P40(+), NapsinA(-), CD56(-), Syn(-), CgA(-), TTF-1(-), Ki67(+)约85%。
5. 基因检测:未见基因突变,PD-L1<1%。
初步诊断:
左肺上叶低分化鳞癌合并双肺门、纵隔、双锁骨上多发淋巴结转移、全身多发骨转移。
分期:cT1cN3M1b,IV期。
诊疗历程
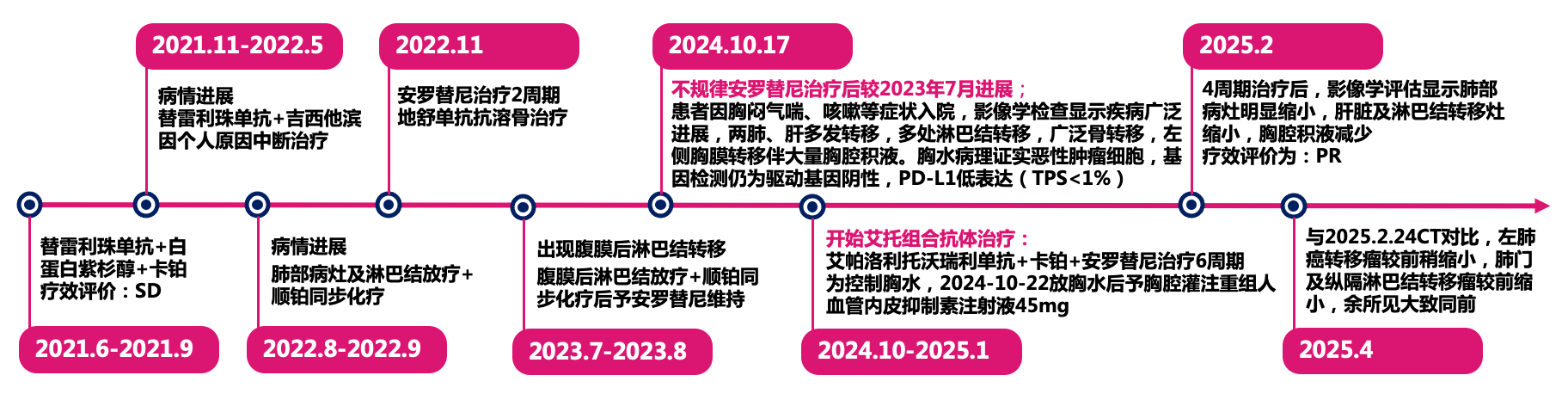
初始治疗及免疫联合化疗:2021年1月-2022年5月
患者确诊后拒绝常规治疗,自行服用中药3个月。2021年6月复查显示病情进展后,接受替雷利珠单抗联合白蛋白紫杉醇和卡铂治疗4周期,疗效评价为疾病稳定(SD)。2021年11月出现进展后,调整为替雷利珠单抗联合吉西他滨方案6周期,疗效评估为SD,后因个人原因中断治疗。
放化疗及靶向治疗:2022年8月-2023年7月
2022年8月复查显示病情进展,随后接受肺部病灶及淋巴结放疗联合顺铂化疗,疗效评估为基本稳定。2022年11月起开始安罗替尼靶向治疗,并予地舒单抗抗溶骨治疗。2023年7月出现腹膜后淋巴结转移,接受局部放疗联合顺铂化疗,放疗结束后继续不规律服用安罗替尼。
艾托组合抗体治疗:2024年10月至今
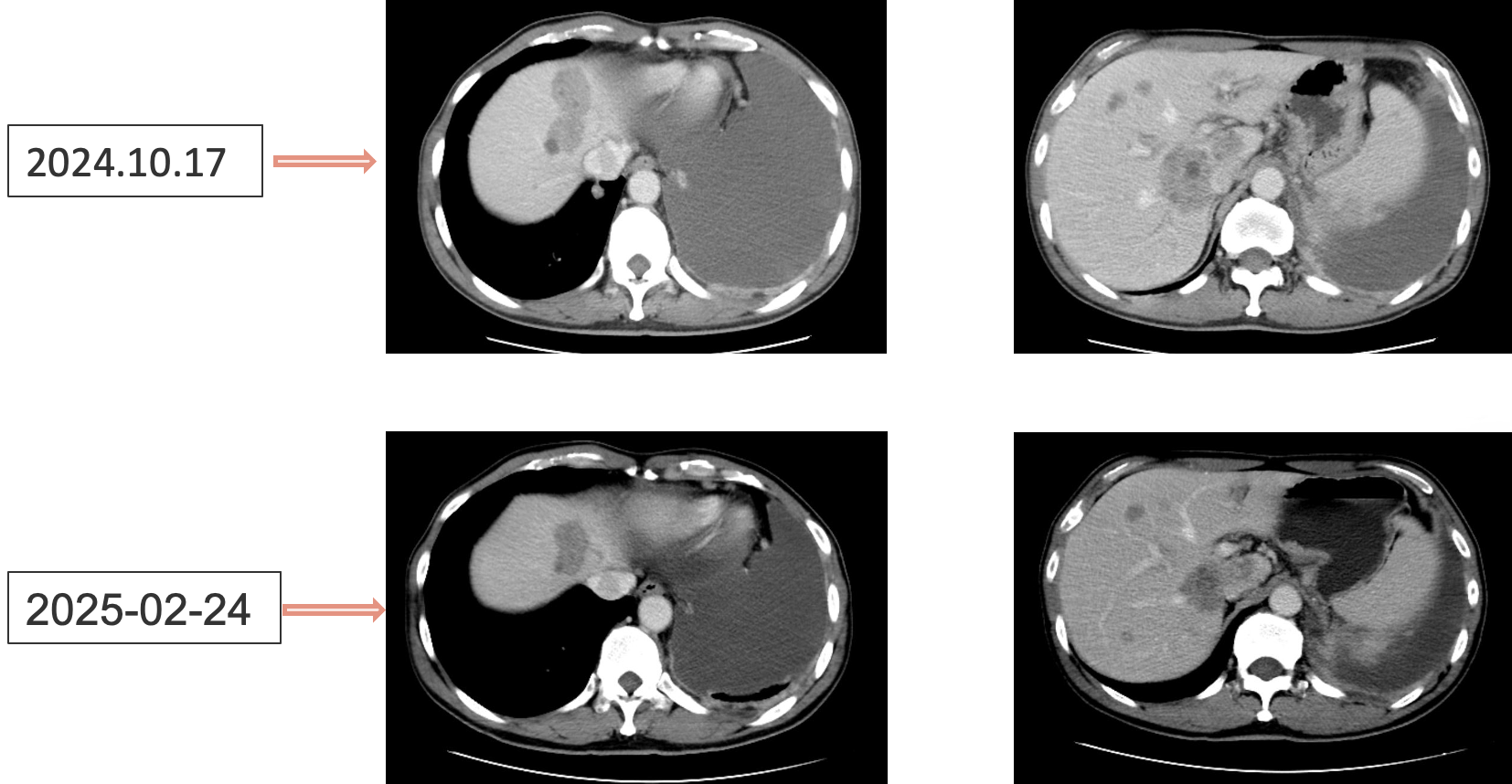
2024年10月患者因胸闷气喘、咳嗽等症状入院,影像学检查显示疾病广泛进展,双肺、肝多发转移,多处淋巴结转移,广泛骨转移,左侧胸膜转移伴大量胸腔积液。胸水病理证实恶性肿瘤细胞,基因检测仍为驱动基因阴性,PD-L1低表达(TPS<1%)。
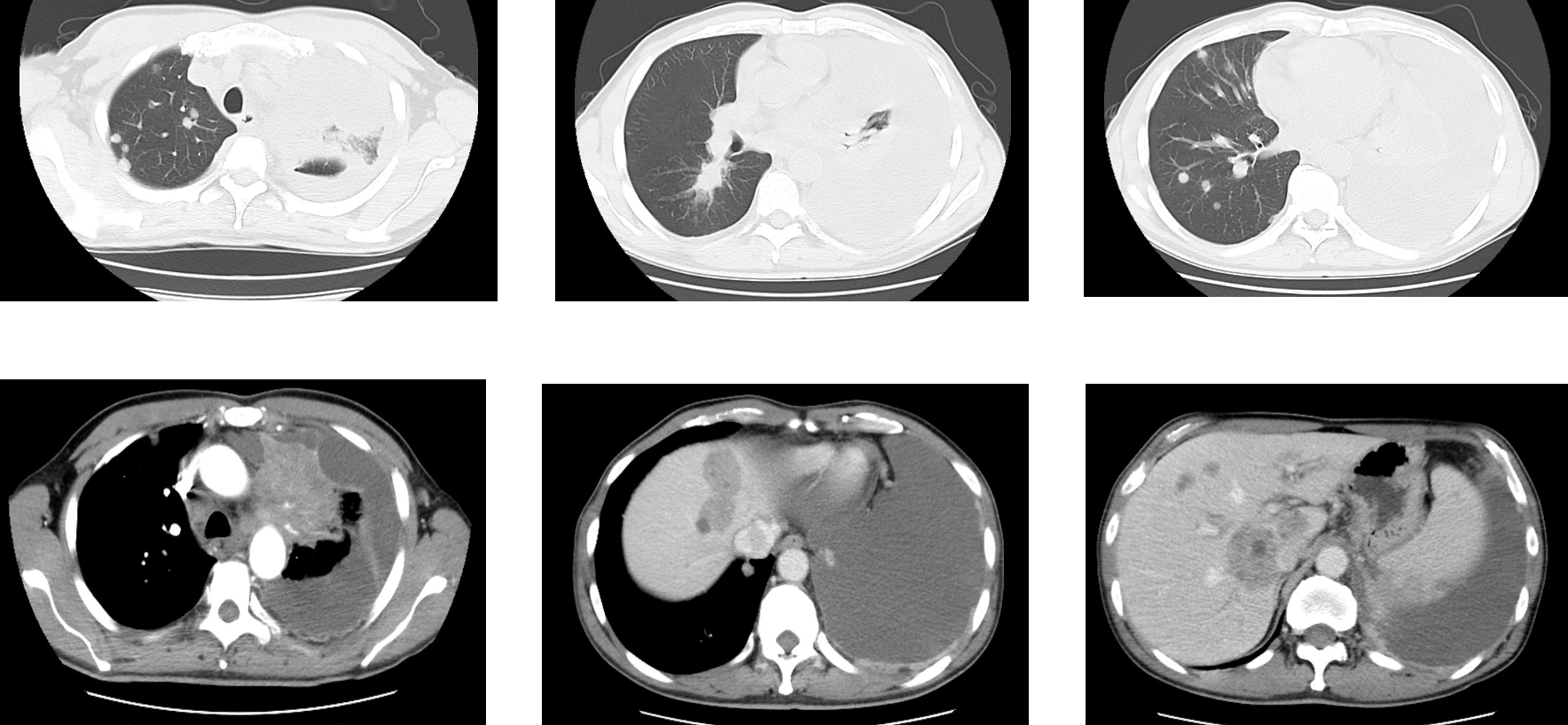
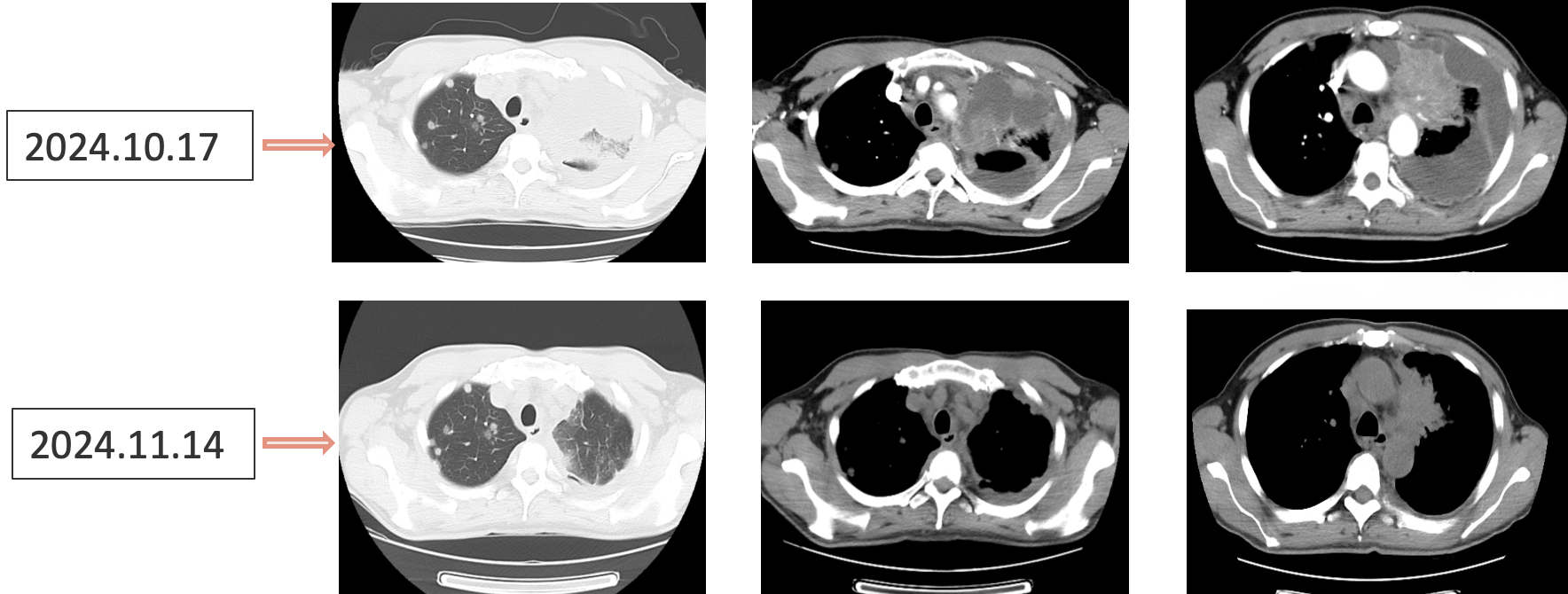
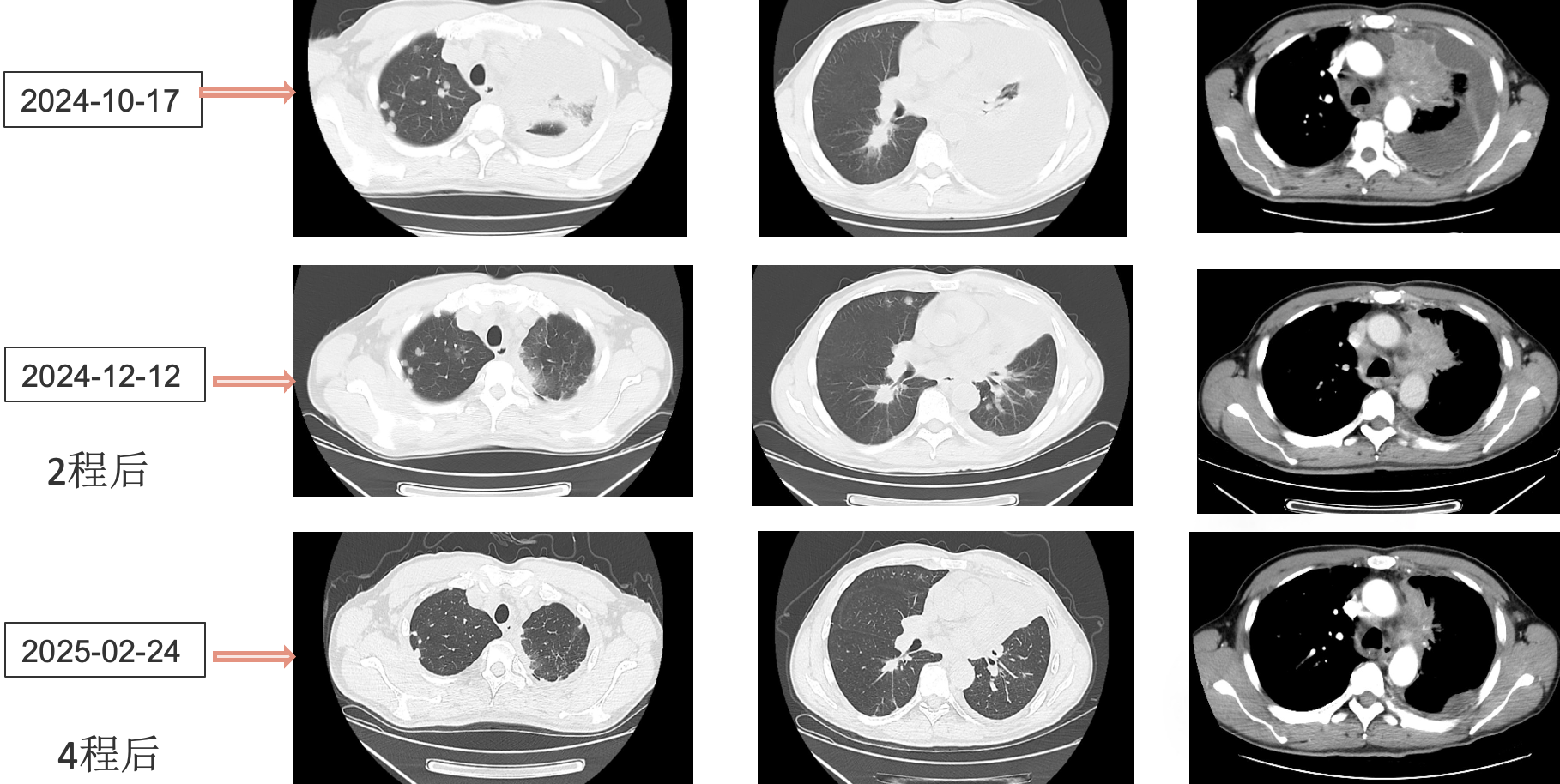
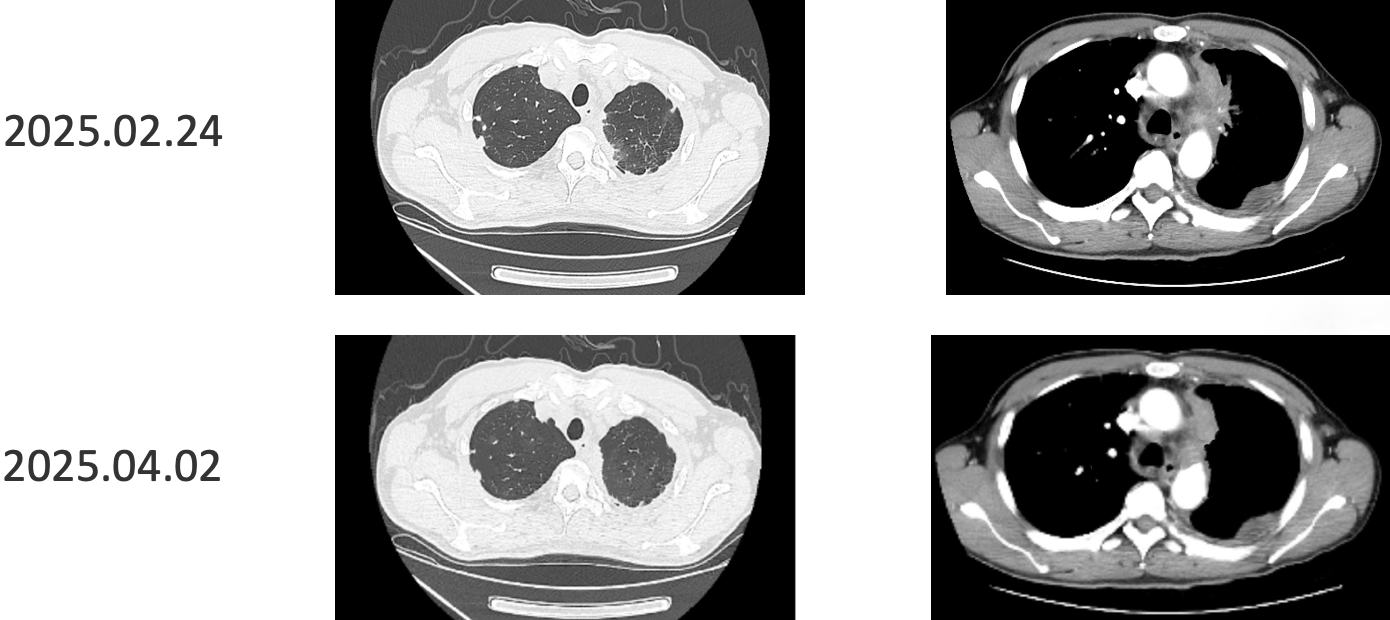
患者采用艾托组合抗体(PD-1/CTLA-4组合抗体)联合卡铂和安罗替尼治疗,同时进行血管内皮抑素胸腔灌注控制胸水。第一周期治疗后出现发热气喘等不良反应,经对症处理后症状改善。6周期治疗后影像学评估显示肺部病灶明显缩小,肝脏及淋巴结转移灶缩小,胸腔积液减少,疗效评价为PR(部分缓解),患者临床症状明显改善,生活质量显著提升。
疗效评估
1. 艾托组合抗体联合方案治疗6周期后,患者肺部病灶明显缩小,肝脏及淋巴结转移灶缩小,胸腔积液减少,疗效评价为PR(部分缓解);
2. 患者临床症状明显改善,胸闷气喘症状缓解,咳嗽减轻,生活质量提高;
3. 治疗期间出现的不良反应(发热气喘)通过对症治疗得到有效控制,整体耐受性良好。
专家点评
姚菲教授点评
医学博士 博士后 副主任医师 硕士研究生导师
世界中医药学会联合癌症姑息治疗委员会理事
亚太卫生健康协会肿瘤学分会常务委员
广西临床肿瘤学会青年专家委员会常务委员
广西生物信息学会肿瘤专业委员会常务委员
广西民族医药协会肿瘤防治专业委员会常务委员
广西中医药优秀人才培养对象
医院首届青年拔尖人才
主持国家自然科学基金及广西自然科学基金课题共5项
发表SCI及核心论文多篇
艾托组合抗体:克服耐药,精准施治
Q1:为何选择艾托组合抗体联合治疗方案?
姚菲教授:本例患者为驱动基因阴性、PD-L1表达<1%的肺鳞状细胞癌,经历了多线治疗后仍出现疾病进展。患者既往接受过免疫联合化疗(替雷利珠单抗+白蛋白紫杉醇+卡铂/吉西他滨)、放化疗及抗血管生成药物(安罗替尼)治疗,但疗效均不持久,患者后续治疗面临选择难题。
艾托组合抗体作为新型PD-1/CTLA-4双功能组合抗体,能够同时阻断PD-1和CTLA-4两条免疫抑制通路,这种双重免疫检查点阻断策略可能克服单一PD-1抑制剂治疗后产生的耐药机制, 可能成为这类患者"免疫再挑战"新的治疗选择。
考虑到患者既往对安罗替尼有一定的耐受性,我们选择将其纳入联合方案中,希望通过抗血管生成药物与免疫治疗的协同作用进一步提高疗效。
这种多靶点联合策略在DUBHE-L-201研究队列5中已显示出良好的临床效果,艾托组合抗体联合化疗和贝伐珠单抗在EGFR-TKI耐药NSCLC这类"冷肿瘤"中取得了54.8%的客观缓解率、8.5个月的中位无进展生存期和26.5个月的中位生存期[1],也为PD-L1阴性这类"冷肿瘤"免疫治疗耐药患者提供治疗参考。
治疗结果证实我们的选择是正确的。患者接受艾托组合抗体联合卡铂和安罗替尼治疗后,肿瘤病灶明显缩小,肝脏及淋巴结转移灶缩小,胸腔积液减少,临床获益显著,疗效评价为PR。
艾托组合抗体联合方案临床获益明显
Q2: 艾托组合抗体治疗的临床疗效如何?
姚菲教授:在本例患者的治疗过程中,艾托组合抗体联合化疗和抗血管生成药物治疗对免疫治疗耐药及多线治疗后进展的NSCLC患者显示出良好疗效。患者迅速获得临床缓解,影像学评估显示病灶明显缩小,体现了艾托组合抗体克服PD-1抑制剂耐药的特性,该例患者免疫再治疗挑战成功。
安全性方面,患者在治疗期间仅出现轻度发热和气喘,经对症处理后症状改善,未出现严重的免疫相关不良反应。这得益于艾托组合抗体结构设计,CTLA-4单抗经Fc段改造,半衰期缩短,减轻了CTLA-4长时间抑制可能引发的不良反应。
总之,本例患者的治疗过程充分体现了个体化治疗的重要性。在一线免疫及其他多线治疗失败后,艾托组合抗体联合化疗和抗血管生成治疗为患者带来了显著获益。这一成功案例为驱动基因阴性、PD-L1低表达NSCLC患者的免疫再挑战治疗提供了宝贵的临床经验。
石玮教授点评
主任医师 医学博士 博士后 博士研究生导师
广西青年岐黄学者
广西中医药大学第一附属医院首届青年名中医、青年拔尖人才培养对象
中国临床肿瘤学会(CSCO)理事
中国临床肿瘤学会(CSCO)中西医结合专家委员会常务委员
广西临床肿瘤学会乳腺癌专业委员会副主任委员
广西临床肿瘤学会中西医结合专家委员会副主任委员
广西抗癌协会肿瘤心理学专业委员会副主任委员
广西免疫学会副理事长
广西中医药学会肿瘤分会常委兼秘书
主持和参与国家级、省部级科研项目10余项,发表学术论文40余篇
擅长肺癌,乳腺癌,肝癌,结直肠癌的中西医结合防治研究
艾托组合抗体在免疫治疗耐药后的应用价值
Q1:能否请您谈谈驱动基因阴性、PD-L1低表达NSCLC患者免疫治疗耐药后的免疫再挑战策略?艾托组合抗体在这一人群中的应用前景如何?
石玮教授:免疫治疗的多数患者最终仍会出现耐药,目前免疫治疗耐药后的治疗尚缺乏规范化方案。免疫治疗耐药机制非常复杂,且不同患者的耐药机制存在差异,因此在免疫治疗进展后再次行组织学活检,明确患者耐药类型是制定后续治疗策略的关键第一步。
本例患者一线接受替雷利珠单抗联合白蛋白紫杉醇和卡铂治疗4周期,疗效评价为SD,后续替雷利珠单抗联合吉西他滨方案6周期,疗效评估仍为SD,且病情稳定持续超过6个月。这符合继发性耐药的特征,即药物暴露时间及病情稳定持续时间≥6个月后出现的疾病进展。
对于继发性耐药患者,继续使用免疫治疗能否带来生存获益一直是广受关注的热点问题。一项回顾性研究纳入了208例经免疫治疗至少SD 3个月以上后出现疾病进展(PD)的IV期NSCLC患者,结果显示继续使用免疫治疗的患者中位总生存期(mOS)明显长于暂停免疫治疗的患者[2],这提示了再挑战的潜在价值。此外,多项研究对免疫再挑战联合化疗或抗血管生成治疗等联合策略进行了探索,并显示出这一策略相较于不含免疫治疗的方案进一步延长生存的潜力[3]。关于免疫再挑战的时机,真实世界研究数据表明在两次免疫治疗之间进行穿插化疗可能优化治疗效果。综上,对于免疫治疗继发性耐药患者,通过合理的联合治疗和穿插治疗等策略,免疫再挑战依然有可能为患者带来生存获益。
艾托组合抗体作为新型PD-1/CTLA-4双功能组合抗体,代表了双免治疗的创新方向。一项前瞻性II期研究RECLAIM的结果显示[4],在PD-L1低表达或阴性的单免治疗耐药患者中,双免联合方案(PD-1抑制剂+CTLA-4抑制剂)+放疗的客观缓解率(ORR)达到29%,显示出良好的抗肿瘤活性。这一结果提示,通过同时阻断PD-1和CTLA-4两条关键免疫抑制通路,有望克服单一PD-1抑制剂治疗后产生的耐药。
本例患者在一线PD-1抑制剂耐药及穿插治疗进展后,选择艾托组合抗体联合方案进行“免疫再挑战”,时机非常关键。这种多靶点联合策略通过双重免疫检查点阻断联合化疗及抗血管生成治疗,临床实践证明疗效显著。
多线治疗后的个体化方案:艾托组合抗体的临床决策
Q2:对于免疫治疗耐药后的多线治疗NSCLC患者,如何制定更加精准的个体化治疗方案?特别是考虑到肿瘤异质性和治疗耐药等因素。
石玮教授:多线治疗后NSCLC患者的治疗决策需要更精细化、个体化的考量,我们应从以下几个关键方面进行全面评估:
1. 科学评估疾病进展:对于免疫治疗后出现进展的患者,iRECIST标准(实体瘤免疫相关疗效评估标准,immune-related response evaluation criteria in solid tumors)是目前目前在免疫药物临床研究中常作为探索性疗效评估标准,可有效区分真性进展与假性进展。对于临床状态稳定的初次PD患者,进展病灶的活检至关重要。本例患者在疾病进展后进行了胸水病理和基因检测,确认为真性进展,为后续精准治疗奠定了基础;
2. 精确判断进展模式:寡进展和广泛进展需要采取完全不同的治疗策略。寡进展患者(进展病灶数目有限且可通过局部治疗控制)可考虑维持原免疫治疗方案同时联合局部治疗。本例患者出现双肺、肝多发转移,多处淋巴结转移,广泛骨转移及胸腔积液,属于典型的广泛进展,需要调整全身治疗方案;
3. 系统评估既往治疗反应:患者对既往各治疗方案的反应模式和耐受性是制定后续方案的重要参考。本例患者既往接受过免疫联合化疗、放化疗及安罗替尼治疗,对安罗替尼显示出良好的耐受性,这为将其纳入后续联合方案提供了合理依据;
4. 深入分析肿瘤微环境变化:多线治疗后,肿瘤微环境往往发生显著改变,如免疫抑制状态增强、血管生成异常等。针对这些变化,选择合适的联合治疗策略至关重要。本例患者选择PD-1/CTLA-4组合抗体联合抗血管生成药物,正是考虑到了多靶点协同作用的可能性;
5. 全面考量患者整体状况:多线治疗后的患者往往体能状况下降,合并症增多,治疗耐受性降低。精准评估患者的ECOG评分、重要脏器功能和生活质量,对于制定既有效又安全的治疗方案至关重要。本例患者尽管经历了多线治疗,但ECOG评分仍然良好,这为选择强化治疗提供了可能;
6. 多学科协作决策:复杂病例的治疗决策需要多学科团队(MDT)的智慧。肿瘤内科、胸外科、放疗科、影像科、病理科等专家的共同参与,可以从不同维度分析患者情况,制定最优的个体化治疗方案。
本例患者的免疫再挑战治疗策略体现了精准医学的核心理念。选择艾托组合抗体联合卡铂和安罗替尼的方案,既考虑了患者既往治疗反应特点,又采用了创新的双重免疫检查点阻断策略,最终取得了显著的临床获益,疗效评价达到PR,患者生活质量显著提升。
总之,多线治疗后NSCLC患者的精准治疗需要基于循证医学证据,综合考虑疾病进展模式、既往治疗反应、肿瘤微环境变化、患者整体状况等多维度因素,通过多学科协作,制定个体化的治疗策略。本例患者的成功经验表明,即使在多线治疗失败后,仍有可能通过创新的免疫再挑战联合治疗策略获得显著的临床获益,为驱动基因阴性、PD-L1低表达且一线免疫治疗耐药后患者带来新的希望。
1. Fang W, et al. ESMO Asia 2024; Abstract 646P.
2. Xu Y, et al. Front Oncol. 2021; 11:642883.
3. 中国临床肿瘤学会非小细胞肺癌专业委员会. 中华医学杂志. 2024;104(06):411.
4.Bahce I, et al. ESMO 2022; Abstract 1020P.
排版编辑:肿瘤资讯-jyy











 苏公网安备32059002004080号
苏公网安备32059002004080号


