头颈部鳞状细胞癌(HNSCC)是头颈部肿瘤最为常见的一种类型[1]。由于早期症状不典型,大多数HNSCC患者确诊时已处于局晚期。近年来,随着靶向治疗、免疫治疗在局部晚期(LA)HNSCC治疗中不断取得突破,靶免联合的创新模式正在改写传统治疗格局,为患者增添新的选择。近日,在今年的美国临床肿瘤学会(ASCO)年会上,中山大学肿瘤防治中心刘学奎教授团队公布了一项靶免化联合方案新辅助治疗LA HNSCC的Ⅱ期研究结果,为该联合治疗方案提供了新的循证依据。基于此,【肿瘤资讯】特邀刘学奎教授深度解析靶免化联合治疗策略在LA HNSCC中的前沿进展,以飨各位读者。
中山大学肿瘤防治中心头颈科副主任
广东临床医学学会咽喉肿瘤专业委员会 主任委员
广东省抗癌协会肿瘤整形外科专业委员会 候任主任委员
广东省医学会机器人外科学分会 副主任委员
中国抗癌协会肿瘤整形外科专业委员会 委员
中国修复重建外科专业委员会头颈外科学组 委员
广东省抗癌协会头颈肿瘤专业委员会 常务委员
广东省健康管理学会肿瘤防治专业委员会 副主任委员
广东省抗癌协会鼻咽癌专业委员会 委员
广东省医学会耳鼻咽喉分会 委员
您团队在2025年ASCO年会中发表了关于赛帕利单抗联合西妥昔单抗、白蛋白紫杉醇和顺铂(NeoZCPC)用于可切除局部晚期下咽/喉鳞状细胞癌患者新辅助治疗的研究结果。首先请您为我们详细介绍一下这项研究。
刘学奎教授:本中心开展的这项开放标签、单臂Ⅱ期临床试验,目的是评估赛帕利单抗联合西妥昔单抗、白蛋白紫杉醇和顺铂在可切除局部晚期下咽和喉鳞状细胞癌新辅助治疗中的疗效与安全性[2]。
研究纳入未经治疗的可切除局部晚期下咽和喉鳞状细胞癌患者,接受NeoZCPC方案,第1天给予赛帕利单抗240 mg、顺铂60 mg/m²和白蛋白紫杉醇260 mg/m²,21天一个周期,共3个周期;西妥昔单抗在第1天给予400 mg/m²,随后每周250 mg/m²,持续8周。完成治疗之后进行手术或根治性放疗。主要终点为依据RECIST 1.1标准评估的客观缓解率(ORR),次要终点包括病理完全缓解(pCR)率、主要病理缓解(mPR)率、喉保留率(LPR)、无进展生存期(PFS)和总生存期(OS)。
2023年9月至2024年12月期间,一共纳入了26例患者。10例患者的原发灶位于下咽,16例患者的原发灶在喉部。疗效结果显示,完成靶免化联合新辅助治疗后,患者ORR达到了96.2%,其中完全缓解(CR)率为50%,部分缓解(PR)率为46.2%。11例患者接受了后续根治性放疗,15例患者接受了手术,术后pCR率为33.3%,mPR率为40%。截止到2025年1月1日,喉保留率、PFS和OS的数据都还没有成熟。在安全性方面,5例患者发生1-2级治疗相关不良事件(TRAEs),仅3例患者报告了4级TRAEs,包括过敏反应(7.7%)、肺炎(3.8%)、心力衰竭(3.8%)和心肌梗死(3.8%)。未发生5级TRAEs。
综上所述,此靶免化联合方案在可切除局部晚期下咽和喉鳞状细胞癌患者新辅助治疗中表现出良好的ORR、pCR和mPR,且毒性可控、可接受。没有因毒性反应或不良事件导致手术延期,也未增加手术并发症。研究的随访还在进行中,未来也会进一步报告长期生存数据,也希望通过这个研究能为靶免化联合在新辅助治疗中提供更多证据。
该研究中15例接受手术患者的术后pCR率为 33.3%、mPR率为40%,您如何评估这一结果的临床意义?
刘学奎教授:这项临床研究设计有其独特之处,其核心考量是希望进一步提高喉功能保留率。研究中,患者在接受新辅助3个疗程治疗后进行评估,其中11例临床评估达到CR或PR的患者免于手术而直接接受放疗;另外15例临床评估疗效相对较差的患者则接受了手术治疗,因而这部分患者的pCR率相对较低。需说明的是,若本研究与其他研究设计一致(即所有患者均接受手术治疗),整体pCR数据可能会更加理想。
您是基于何种考量而决定开展这样一项研究呢?
刘学奎教授:HNSCC是头颈部肿瘤最常见的一种类型,因为早期症状不典型,约半数的患者在确诊时已经处于局部晚期,局部晚期的患者面临着局部复发和远处转移的双重风险,总体5年生存率较差[1],仍然需要新的治疗方案来改善生存。随着抗EGFR单抗和免疫检查点抑制剂在HNSCC治疗中的广泛应用,能否进行这两类药物的联合治疗,也非常值得探索。大量的临床前研究[3-6]表明,免疫治疗和靶向治疗联合使用具有协同的抗肿瘤作用:以西妥昔单抗为代表的抗EGFR单抗,可以通过增强肿瘤的抗原递呈与PD-(L)1抑制剂解除T细胞耗竭形成互补,逆转免疫抑制的肿瘤微环境以及诱导PD-L1的表达上调等等作用机制,来共同促进抗肿瘤免疫,增强免疫治疗的敏感性。
基于这一理论基础,近年来多项研究已证实靶免联合方案在复发/转移性(R/M)HNSCC治疗中的有效性和安全性。抗EGFR单抗联合不同的免疫药物选择及化疗配伍,在复发/转移患者不同的治疗线中都展现出良好的疗效[7-9]。这一方案也得到了临床指南的认可,目前,CSCO指南已经将靶免联合治疗列为治疗R/M HNSCC的推荐方案,也充分体现出这样的联合策略在临床实践中的认可度和应用前景。
我们开展的这项研究则是在可通过手术切除的局部晚期患者中,探索这一治疗策略的可行性。对于可切除的局晚期下咽癌或者喉癌患者,如何通过术前新辅助治疗来缩小肿瘤,实现临床降期,从而缩小手术切除范围以及提高喉保留率,一直是外科医生非常关心的问题之一。希望通过有效的术前治疗,能够为患者提供更好的预后和生活质量。
KEYNOTE-689研究近期公布了首次期中分析的结果,证实了在可切除的LA HNSCC患者中,围术期联合免疫治疗有助于改善EFS的主要研究终点[10],结果令人鼓舞。但如果深入分析新辅助阶段的疗效数据,可以发现使用单药免疫的mPR率在ITT人群中只有9.4%,在CPS≥20的人群中也只有13.7%,仍然有进一步的提高空间。亚组分析显示,下咽癌未能从围术期单纯免疫治疗获益,提示仍需进一步探索更为有效的联合治疗方案。抗EGFR单抗在缩瘤方面的优势能否和免疫治疗进行互补,在新辅助治疗阶段达到1+1>2的效果,成为更有效的治疗方案,进而让更多的患者有保喉的机会,这也是我们开展这项研究主要想回答的问题。
靶免化联合在LA HNSCC新辅助治疗中是否还有其他的研究证据?能否请您给我们梳理一下?
刘学奎教授:事实上,既往也有研究探索过类似的治疗策略,不过不同研究选择的药物方案和人群略有不同。一项来自纪念斯隆-凯特琳癌症中心(MSKCC)的单臂Ⅱ期研究在30例LA HNSCC患者中,探索了西米普利单抗联合西妥昔单抗及含铂双药化疗新辅助治疗的疗效和安全性[11]。
该研究纳入30例符合手术切除标准且需要接受术后辅助放疗的LA HNSCC患者,主要终点为安全性和耐受性。基线数据显示共29例患者可评估,其中26例为口腔癌,T3患者17例,T4患者10例。结果显示前10例患者未观察到剂量限制毒性,达到了主要研究终点。疗效上,mPR率达66%,pCR率为31%,中位随访时间7.5个月,所有患者均处于无疾病状态,前10例患者无疾病状态超过2年(图1)。其中,28例原本需要游离皮瓣的患者在新辅助治疗后17例(61%)不再需要游离皮瓣,20例(69%)患者符合省略辅助放疗的条件,提示该联合方案用于新辅助治疗具有良好的安全性和疗效。
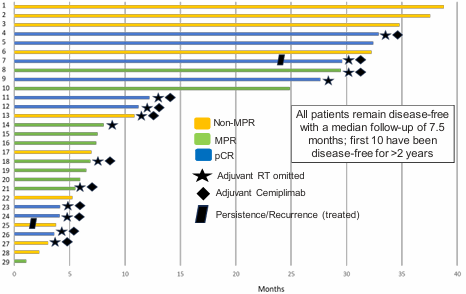
另一项回顾性研究在21例适合手术切除的LA HNSCC患者中,评估帕博利珠单抗联合西妥昔单抗及含铂化疗新辅助治疗的疗效和安全性[12]。基线特征显示原发肿瘤部位以口咽部占比最高,为42.9%,cT3-cT4患者占47.6%,cN2患者占76.2%。疗效数据显示新辅助治疗后原发肿瘤部位ORR达到了90.5%,mPR率也达到66.7%,pCR率为52.4%,颈部淋巴结的mPR率为61.1%,pCR率为50%(图2)。47.6%的患者观察到临床降期,其中12例患者T分期下降,10例患者N分期下降。在手术方面,新辅助治疗后原发肿瘤体积显著缩小,总体喉功能保留率达90.9%,所有手术患者在新辅助免疫联合化疗后均达到切缘阴性,且手术过程中未发生严重并发症或死亡。提示帕博利珠单抗联合西妥昔单抗和含铂化疗有望成为新辅助治疗方案的新选择。
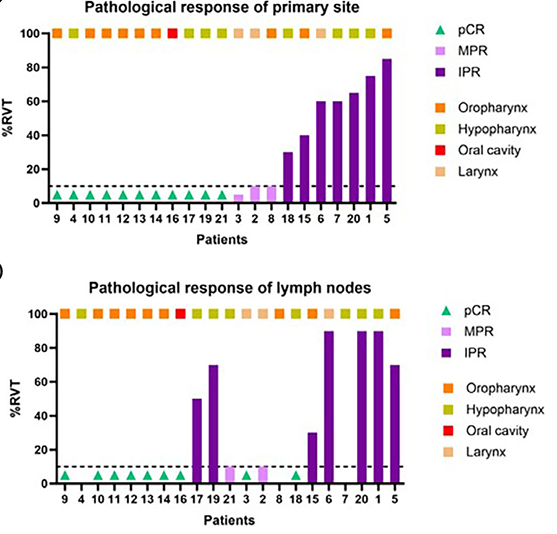
本中心的研究选择了有保喉需求的下咽和喉癌患者,针对性更强,从结果来看,靶免化联合的新辅方案的ORR可以达到96.2%,mPR率也可以达到40%。结果达到了我们的预期,也和既往的研究数据高度吻合。这样的新型联合方案或许可为可切除LA HNSCC患者带来更多的器官保留机会和更高的生活质量。
您对未来靶免联合治疗策略的进一步研究探索有什么计划和展望?
刘学奎教授:首先,对于本中心的研究,我们计划继续跟踪患者的长期生存数据,以获取更全面的疗效评估。这项工作不仅能帮助我们深入理解靶向治疗与免疫治疗联合的长期效果,还能揭示不同患者在接受此类治疗后的生存趋势和生活质量变化。
在此基础上,我们希望能够通过多中心的III期临床试验,验证前期的研究结果,使研究结果更加具有普遍性和可靠性。此外,我们还希望进一步加强基础研究,探索新的靶向与免疫联合治疗的生物标志物,帮助我们筛选出最有可能从靶免化联合治疗中获益的患者群体,为个体化的精准医疗提供重要依据。
此外,随着免疫治疗在头颈肿瘤的广泛应用,如何为免疫治疗耐药的患者提供个体化精准治疗也是临床中亟需解决的问题,近期有两项研究提示西妥昔单抗联合紫杉醇对这类患者具有良好的挽救治疗效果。一项前瞻性、多中心、国际Ⅱ期临床研究[13]纳入57例ICIs经治的R/M HNSCC患者,接受西妥昔单抗联合紫杉醇治疗,疗效结果显示,ORR为47.4%,其中8例(14.0%)患者达到CR,中位PFS为5.9个月,中位OS为14.0个月。另一项Ⅱ期临床研究[14]纳入35例ICIs经治的R/M HNSCC患者,接受紫杉醇联合西妥昔单抗治疗,疗效结果显示,在33例可评估疗效的患者中,ORR为69.6%(图3),在中位随访16.6个月的存活患者中,中位PFS和OS分别为5.5个月和13.3个月,DCR达到93.7%。
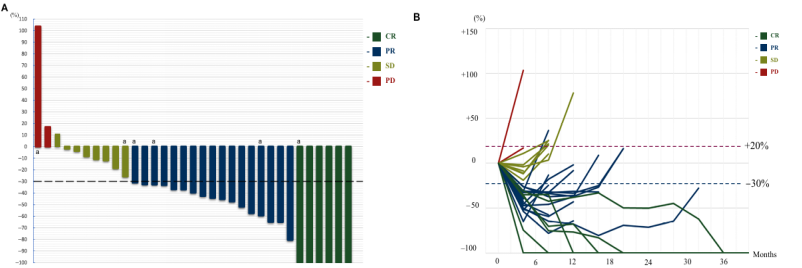
随着临床对肿瘤生物学行为的理解不断加深,靶免联合在HNSCC患者的治疗中将可能扮演越来越重要的角色。而对于免疫耐药的患者,靶向联合化疗或许能带来良好的治疗效果。期待通过更多的临床研究为不同类型的肿瘤患者提供个体化的治疗方案,从而最大化患者获益。
排版编辑:肿瘤资讯-TJ
[1] Mody MD, Rocco JW, Yom SS, et al. Head and neck cancer. Lancet. 2021 Dec 18;398(10318):2289-2299.
[2] Lin RB, Cao F, Wu D, et al. Efficacy and safety of neoadjuvant zimberelimab and cetuximab plus nab-paclitaxel and cisplatin (NeoZCPC) for resectable locally advanced hypopharyngeal/laryngeal squamous cell carcinoma: An open-label, single-arm phase II clinical trial. 2025 ASCO. e18095.
[3] Ferris RL, Lenz HJ, Trotta AM, et al. Rationale for combination of therapeutic antibodies targeting tumor cells and immune checkpoint receptors: Harnessing innate and adaptive immunity through IgG1 isotype immune effector stimulation. Cancer Treat Rev. 2018 Feb;63:48-60.
[4] Saba NF, Chen ZG, Haigentz M, et al. Targeting the EGFR and Immune Pathways in Squamous Cell Carcinoma of the Head and Neck (SCCHN): Forging a New Alliance. Mol Cancer Ther. 2019 Nov;18(11):1909-1915.
[5] Kumagai S, Koyama S, Nishikawa H. Antitumour immunity regulated by aberrant ERBB family signalling. Nat Rev Cancer. 2021 Mar;21(3):181-197.
[6] Tian X, Zhang H, Han Y, et al. Current status and future prospects of combined immunotherapy and epidermal growth factor receptor inhibitors in head and neck squamous cell carcinoma. Cancer Treat Rev. 2025 Jan;132:102864.
[7] Sacco AG, Chen R, Worden FP, et al. Pembrolizumab plus cetuximab in patients with recurrent or metastatic head and neck squamous cell carcinoma: an open-label, multi-arm, non-randomised, multicentre, phase 2 trial. Lancet Oncol, 2021, 22(6): 883-892.
[8] Guo Y, Li ZD, Hu DS, et al. Updated safety and efficacy of toripalimab combined with cetuximab in platinum-refractory recurrent or metastatic head and neck squamous cell carcinoma (R/M-HNSCC): a phase Ib/II clinical trial. J Immunother Cancer, 2023; 11(Suppl 1): A769.
[9] Chung CH, Bonomi M, Steuer CE, Li J, Bhateja P, Johnson M, et al. Concurrent cetuximab and nivolumab as a second-line or beyond treatment of patients with recurrent and/or metastatic head and neck squamous cell carcinoma: results of phase I/II study. Cancers 2021;13:1180.
[10] Uppaluri R, et al. Neoadjuvant and adjuvant pembrolizumab plus standard of care (SOC) in resectable locally advanced head and neck squamous cell carcinoma (LA HNSCC): Phase 3 KEYNOTE-689 study. 2025 AACR. Abstract CT001.
[11] Dunn L, Cracchiolo J, Ho AL, et al. 859P-Neoadjuvant cemiplimab with platinum-doublet chemotherapy and cetuximab to de-escalate surgery and omit adjuvant radiation in locoregionally advanced head & neck squamous cell carcinoma (HNSCC). Annals of Oncology (2024) 35 (suppl_2): S613-S655.
[12] Yao Z, Wang J, Jiang Y, et al. Pembrolizumab plus cetuximab with neoadjuvant chemotherapy for head and neck squamous cell carcinoma. Head Neck. 2025;47(1):289-299.
[13] Fuereder T, Klinghammer K, Hahn DA, et al. Paclitaxel plus cetuximab for the treatment of recurrent and/or metastatic head and neck cancer after first-line checkpoint inhibitor failure: Primary analysis from the pace ace trial. Ann Oncol, 2024, 35 (suppl_2): S613-S655.
[14] Koyama T, Kiyota N, Boku S, et al. A phase II trial of paclitaxel plus biweekly cetuximab for patients with recurrent or metastatic head and neck cancer previously treated with both platinum-based chemotherapy and anti-PD-1 antibody. ESMO Open. 2024 Jun;9(6):103476.











 苏公网安备32059002004080号
苏公网安备32059002004080号


