Discussing controversies often raises more unanswered questions than providing definitive answers.
讨论争议常常会引出比提供明确答案更多未解决的问题。
在期别相同的情况下,透明细胞卵巢癌(CCOC)和透明细胞子宫内膜癌(CCEC)的临床预后差,代表了妇科肿瘤学家面临的重要未满足医疗需求,临床意义的进展备受期待。
2025年1月,David Tan等在International Journal of Gynecological Cancer (IJGC)发表了题为“Controversies in the management of clear cell carcinoma of the uterus and ovary“(子宫和卵巢透明细胞癌治疗中的争议)的综述文章,总结了卵巢透明细胞癌 (CCOC)子宫内膜透明细胞癌 (CCEC)当前共识,以及未决问题的本质争议。
文章内容翔实,文章前面是根据文章内容总结的全文精要,后面是文章的全文翻译。供大家学习讨论。

全文精要总结
疾病本质再认识:从形态统一到分子分型

局限性疾病管理:手术与辅助治疗优化
手术决策
淋巴结清扫争议
• CCOC:LND改善DFS但未证实OS获益 → 前哨淋巴结(SLN)定位或替代(证据等级ⅡB)
• CCEC:LND可能改善早期OS(中国多中心研究)→ 仍推荐(NCCN 2A)
辅助治疗
晚期/复发疾病:靶向治疗突破与挑战
免疫治疗新策略
新兴靶点与药物
ARID1A缺失靶向
• 机制:诱导复制应激 → 吉西他滨/ATR抑制剂敏感(临床前)
• 临床:ATARI试验中ATR抑制剂ceralasertib ± 奥拉帕利(ORR 14%初步活性)PI3K/mTOR通路
• CCOC中≥80%激活 → CYH-33(PIK3CA抑制剂)在研(Ⅱ期)抗体偶联药物(ADC)
• HER2过表达亚群:T-DXd在泛瘤种ORR 37%(DESTINY-PanTumor02)

未来方向与协作需求
1.生物标志物驱动
建立透明细胞癌特异性分子分型(整合TP53/ARID1A/dMMR)
探索HIF-1α下游靶点(代谢/血管生成通路)
2.临床试验设计
跨区域合作(尤其纳入亚洲人群)
伞式试验(如BOUQUET)加速罕见亚型药物评估
3.临床实践优化

总结:从争议到行动

三大争议主题汇总表
以下为全文翻译:
摘要
透明细胞卵巢癌和子宫内膜癌是罕见的侵袭性妇科恶性肿瘤,由于在临床试验中代表性不足且前瞻性数据有限,给临床管理带来了独特的挑战。在本报告中,我们旨在探讨透明细胞卵巢癌和子宫内膜癌管理中的三个主要争议,强调需要进一步研究的领域。
首先,我们探讨了透明细胞卵巢癌和透明细胞子宫内膜癌的独特表型特征,以及它们是否应被视为一个统一的疾病实体还是不同的疾病。最近的试验将这些癌种归为一类,可能扩大了它们的治疗选择。然而,新兴的分子数据强调了透明细胞卵巢癌和透明细胞子宫内膜癌之间的显著差异,对这种联合方法提出了质疑。这种区分对于指导个体化治疗策略至关重要。
其次,我们研究疾病早期阶段的处理策略。尽管透明细胞癌常被早期诊断发现,但最佳的手术和辅助治疗策略仍不确定。目前的实践通常依赖于包含有限透明细胞组织学亚型的更广泛研究的数据。本综述强调需要更具体的证据来完善治疗方案,平衡疗效与降低治疗相关并发症风险。
第三,我们探讨了治疗复发性疾病的新型治疗策略。对透明细胞癌生物学理解的进展,揭示了其在免疫微环境、细胞过程和代谢中的潜在靶点。正在进行的临床试验正在研究这些方法,这些方法有望改变治疗格局和患者结局。
总之,本综述强调了国际协作和纳入多样化患者群体的必要性,以应对透明细胞癌带来的挑战。通过聚焦这些争议,我们旨在促进进一步研究,并支持为这些罕见但具有挑战性的癌症制定更基于证据的个体化管理方法。
关键词:
透明细胞;卵巢;子宫内膜;争议
引言
卵巢癌是全球女性癌症相关死亡的主要原因之一。 上皮性肿瘤占病例的90%以上,其中高级别浆液性癌最为普遍,占病例的70%。 透明细胞卵巢癌是第二常见的卵巢癌亚型,因其与其他亚型的显著差异和较差的总体预后而受到妇科肿瘤专家及基础研究人员的广泛关注。同样,子宫内膜癌也显示出显著的病理多样性, 其中子宫内膜样亚型最常见,约占病例的75%。相比之下,透明细胞子宫内膜癌占病例不足10%,同样因其较差的总体预后而受到关注。透明细胞卵巢癌和透明细胞子宫内膜癌代表了妇科肿瘤学家面临的重要未满足医疗需求,临床意义的进展备受期待。
历史上,透明细胞卵巢癌和透明细胞子宫内膜癌一直与其上皮性对应癌种一起治疗,基于包含最常见组织学类型的关键性试验。然而,近年来,一些试验开始独立考虑透明细胞卵巢癌和透明细胞子宫内膜癌,并逐步重塑这些罕见肿瘤的治疗格局。尽管这些试验尚未显著改善生存率,但它们强调了针对透明细胞癌独特特征制定专门策略的重要性。同时,这些新数据也引发了关于这些患者管理特殊性的若干问题。
本综述旨在汇编自透明细胞卵巢癌和子宫内膜癌区别于其上皮性对应癌种以来,其管理中涌现的一些主要争议方面。首先,我们研究了透明细胞卵巢癌和透明细胞子宫内膜癌共有的表型和流行病学特征,将其定义为独特的妇科癌种,而非两种罕见的上皮亚型。其次,我们将涵盖局限性透明细胞卵巢癌和透明细胞子宫内膜癌在手术程序和辅助放疗及全身治疗获益方面的争议。最后,在转移性背景下,传统和新兴疗法的角色和疗效引发了关于最佳治疗顺序的争论。
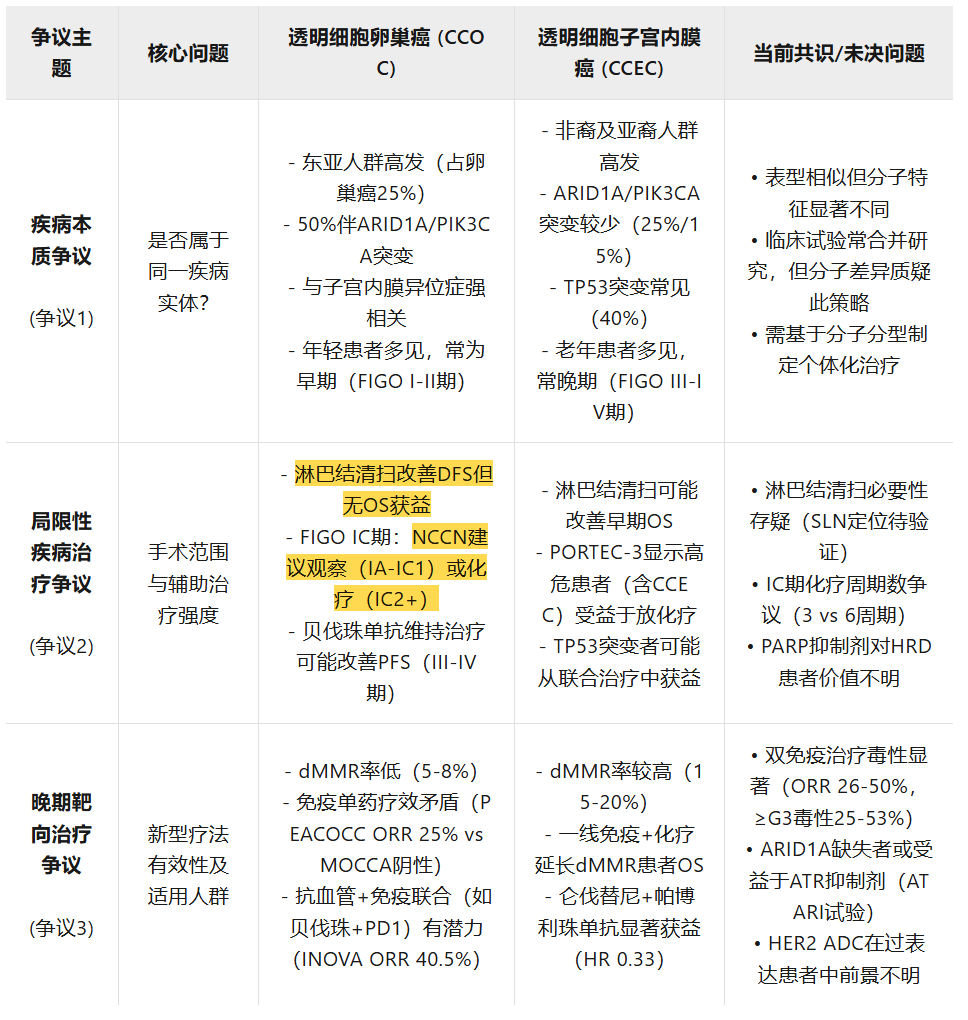
争议一:透明细胞卵巢癌和子宫内膜癌,相同但又不同?
妇科透明细胞癌可起源于卵巢、子宫内膜、宫颈或阴道,代表上皮性癌的罕见亚型。它们具有相同的定义透明细胞表型的病理特征。这些肿瘤由多个含有粘液的黄色结节组成。其微观模式包括混合有透明细胞的嗜酸性细胞,这些透明细胞具有富含糖原的丰富细胞质,以及具有裸露细胞核且几乎无细胞质的钉突细胞。8 在免疫组织化学标记方面,透明细胞癌细胞角蛋白7阳性,细胞角蛋白20阴性,表达上皮膜抗原、癌胚抗原、CA125、napsin A、肝细胞核因子1β和PAX8。
尽管形态相同,但透明细胞卵巢癌和透明细胞子宫内膜癌的分子谱已报道存在显著差异。PI3K和SWI/SNF通路的改变是透明细胞卵巢癌和透明细胞子宫内膜癌的关键分子特征。值得注意的是,ARID1A和PIK3CA突变均在约50%的透明细胞卵巢癌病例中被检测到。在透明细胞子宫内膜癌患者中,这些改变的出现频率显著较低,分别出现在约25%和15%的病例中。透明细胞卵巢癌中其他复发突变基因包括PPP2R1A、KRAS和PIK3R1,而TP53突变罕见,发生率低于10%。相反,TP53在透明细胞子宫内膜癌患者中频繁突变,出现在约40%的病例中。微卫星不稳定性(MSI)是一种罕见的分子事件,在少于5%的透明细胞卵巢癌患者中检测到,在透明细胞子宫内膜癌患者中更常见(约10%)。它导致高突变表型和高肿瘤突变负荷(TMB),是美国食品药品监督管理局(FDA)批准的肿瘤不可知性生物标志物,赋予免疫检查点抑制极高的敏感性。
将透明细胞癌与其他上皮亚型的基因表达谱进行比较,揭示了一个高度特异性的基因特征,该特征不仅为透明细胞卵巢癌和透明细胞子宫内膜癌所共有,也与肾透明细胞癌共有,表明不同起源器官可能存在共同的祖细胞。有趣的是,与透明细胞表型强烈相关的通路涉及血管生成以及葡萄糖和氧气代谢,其中缺氧诱导因子1α(HIF-1α)是过表达最显著的因素。然而,尽管与肾透明细胞癌有这些相似之处,透明细胞卵巢癌和透明细胞子宫内膜癌的分子谱仍然不同,特别是妇科肿瘤中不存在VHL突变。
透明细胞卵巢癌独特的方面之一是其人口分布。尽管它在西欧和北美约占卵巢癌病例的10%,但在日本、新加坡和韩国可高达25%。同样,透明细胞子宫内膜癌在亚洲更为普遍,尤其是在中国、韩国和菲律宾女性中。此外,透明细胞子宫内膜癌在非裔美国人社区更为普遍,其风险约是高加索人的两倍。造成这种差异的原因尚不完全清楚,这可能解释了透明细胞癌在大型III期试验中代表性不足至今。
透明细胞卵巢癌与子宫内膜异位症之间的关联已得到充分证实。大约一半的透明细胞卵巢癌病例与同时存在的子宫内膜异位症相关,自我报告的子宫内膜异位症与发生透明细胞卵巢癌的风险增加3倍相关。然而,导致这种致癌性分化的机制尚未完全阐明,可能涉及ARID1A和PIK3CA突变作为早期致癌事件以及氧化应激,导致免疫微环境失调和表观遗传修饰。相反,子宫内膜异位症与透明细胞子宫内膜癌的关系尚未得到证实。尽管如此,子宫内膜异位症似乎与发展子宫内膜癌(包括透明细胞子宫内膜癌)的风险较高相关,尽管其程度低于透明细胞卵巢癌。
与高级别浆液性癌不同,透明细胞卵巢癌常在年轻女性中被诊断,且多为早期(国际妇产科联盟[FIGO] I或II期)。相比之下,透明细胞子宫内膜癌影响老年女性,在超过80%的病例中伴有肌层浸润,且常被诊断为晚期疾病(FIGO III/IV期)。然而,在同样的分期情况下,透明细胞卵巢癌和透明细胞子宫内膜癌与其他上皮亚型相比,临床结局显著更差。为了探索透明细胞卵巢癌和透明细胞子宫内膜癌之间的共性,Rauh-Hain等比较了复发率、转移部位和对铂类化疗的反应,证明两者表现出非常相似的表型。此外,在根据年龄、疾病范围、肿瘤细胞减灭术和铂类化疗使用进行调整的多变量分析中,透明细胞卵巢癌和透明细胞子宫内膜癌患者具有相似的总生存率。
总体而言,透明细胞卵巢癌和子宫内膜癌似乎共享多种临床、病理和流行病学特征。因此,这些观察结果促使专门针对该独特亚型的试验出现,这些试验纳入了这两种疾病。然而,也报道了一些耐人寻味的差异,透明细胞癌的独特性质仍然存在争议。在不久的将来,我们预计除了显微镜下的表现外,致癌作用中涉及的分子通路将在治疗决策中发挥越来越重要的作用。
争议二:肿瘤早期的管理策略,降阶梯治疗(De-escalation)有空间吗?
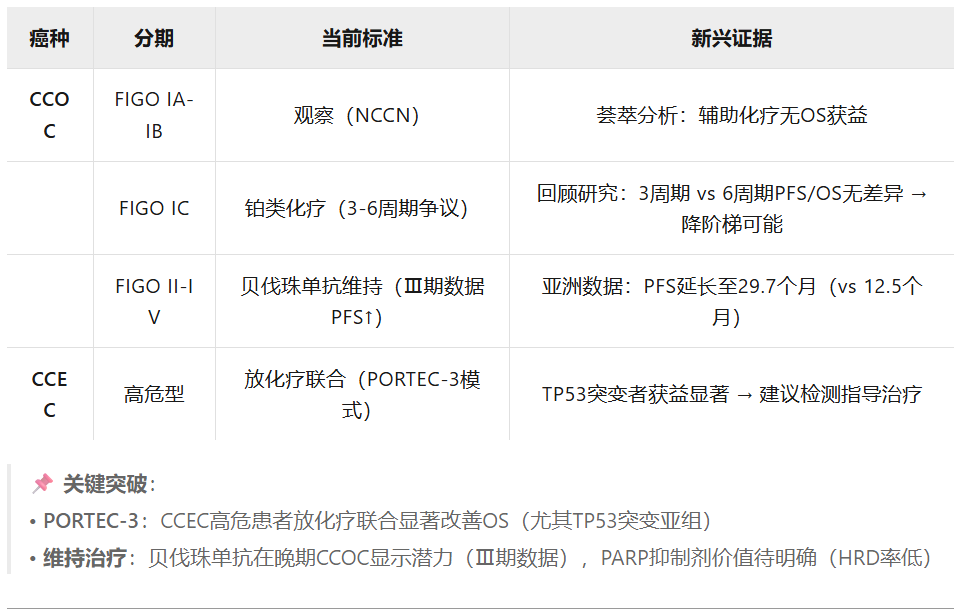
妇科透明细胞癌的一个重要特征是其化疗耐药性。因此,在肿瘤早期,完全手术切除可能是关键的主要治疗手段。完全手术切除是否必须包括淋巴结清扫术仍然存在争议,尤其是因为它是一种具有长期并发症风险的侵入性操作。透明细胞卵巢癌的淋巴血管侵犯率很高,一项回顾性分析报告超过70%的I至IV期透明细胞卵巢癌为淋巴血管侵犯阳性。一项专门探讨透明细胞卵巢癌该问题的荟萃分析发现,在早期和晚期阶段进行淋巴结清扫术并未带来总生存获益,但改善了无病生存期和疾病特异性生存期。尽管缺乏总生存获益,美国国家综合癌症网络(NCCN)针对透明细胞卵巢癌的指南推荐标准手术入路,包括盆腔和腹主动脉旁淋巴结清扫术(2A级证据)。在子宫内膜癌中,透明细胞组织学通常被认为是需要淋巴结清扫的高危特征,来自中国的一项多机构队列研究显示,在早期透明细胞子宫内膜癌中,淋巴结清扫术带来5年总生存获益。然而,随着前瞻性研究证明其安全性和有效性,前哨淋巴结定位(SLN mapping)可能很快成为淋巴结清扫术的合理替代方案,即使在高危组织学如透明细胞亚型中也是如此。尽管如此,证实前哨淋巴结定位对淋巴结清扫术非劣效性的随机试验仍然缺乏;因此,淋巴结清扫术通常仍推荐用于透明细胞卵巢癌和透明细胞子宫内膜癌。
另一个争议领域在于辅助治疗的作用,不同指南对透明细胞卵巢癌的不同分期阈值推荐不同的辅助治疗。NCCN指南建议对FIGO IA至IC1期进行观察,而对FIGO IC2期及以后推荐铂类化疗。相比之下,欧洲肿瘤内科学会(ESMO)指南推荐从I期开始的早期卵巢癌进行辅助化疗,尽管他们也指出对于IA至IC1期是可选的。这得到两项荟萃分析的支持,这两项分析结合了超过9000例透明细胞卵巢癌病例,报告在FIGO IA和IB期辅助化疗未能改善无病生存期或总生存期,仅在FIGO IC期及以后观察到总生存获益。尽管多项研究表明IC2期(术前破裂)和IC3期(腹水或腹腔冲洗液中发现恶性细胞)的预后显著差于IC1期(术中破裂),但这些荟萃分析并未探讨辅助化疗在IC期各细分分期中的作用,这仍然未明确。辅助治疗领域的另一个争论点是I C期至II期患者所需的化疗周期数。一项回顾性多中心队列研究比较了接受3个周期与6个周期卡铂和紫杉醇治疗的I至II期透明细胞卵巢癌患者的结局,发现复发率或总生存期无差异。这为在此特定背景下化疗降阶梯提供了潜在的依据。此外,尽管JGOG 3016 III期研究表明,对于非选择组织学类型的卵巢癌,剂量密集紫杉醇联合卡铂与3周一次紫杉醇联合卡铂相比具有总生存获益,但随后的亚组分析显示,它对透明细胞卵巢癌患者并未显著改善生存。总体而言,目前,FIGO IC期透明细胞卵巢癌患者应至少接受3个周期的辅助3周方案卡铂联合紫杉醇,而对于2期及以后的患者,则推荐至少6个周期。
PORTEC-3试验证明了联合辅助化疗和放疗(放化疗)与单纯盆腔放疗相比,对高危子宫内膜癌女性的生存获益。然而,化疗的获益是来自同步部分(放疗期间给予2个周期的顺铂50 mg/m²静脉注射)还是辅助部分(放疗后给予4个周期的卡铂和紫杉醇),抑或两者兼有,仍然存在争议和未知。PORTEC-3试验对于加深我们对子宫内膜癌分子分型的理解具有关键作用。事后分析发现,III期和“G2型”肿瘤女性获益最大,随后在TP53突变型子宫内膜癌患者中获益也显著。透明细胞子宫内膜癌患者占PORTEC-3试验人群的9%,并且常为TP53突变。因此,我们认为该人群应能从辅助放化疗中获得显著益处,尽管缺乏专门针对透明细胞子宫内膜癌的数据。
透明细胞卵巢癌中维持治疗策略的作用值得进一步研究。尽管BRCA1/2突变在13%至15%的卵巢癌中被检测到,最常见于高级别浆液性癌,但在透明细胞卵巢癌中较少见,在该亚型中检测率约为6%。重要的是,在存在BRCA1/2突变或高度基因组不稳定性(HRD)的情况下,聚腺苷二磷酸核糖聚合酶(PARP)抑制剂维持治疗显著改善了无进展生存期和总生存期,代表了子宫内膜癌患者的重大突破。因此,透明细胞卵巢癌患者当然应进行BRCA1/2突变和同源重组缺陷(HRD)检测,如果符合条件,应提供PARP抑制剂。然而,使用PARP抑制剂的关键性试验仅招募了高级别浆液性或子宫内膜样组织学亚型的患者。因此,PARP抑制剂在透明细胞卵巢癌中的作用尚不清楚。
相反,贝伐珠单抗维持治疗在透明细胞卵巢癌中前景看好。III期试验GOG-021855和ICON756招募了所有组织学亚型,并为高危子宫内膜癌使用维持贝伐珠单抗提供了依据。GOG-0218招募了肿瘤细胞减灭术后FIGO III期(不可完全切除)和IV期子宫内膜癌患者,发现将贝伐珠单抗加入6个周期的卡铂和紫杉醇后,再进行贝伐珠单抗维持治疗,与单用卡铂和紫杉醇组相比,无进展生存期显著改善(14.1个月 vs. 10.3个月),但总生存期无显著差异。在透明细胞卵巢癌患者中,回顾性数据也报告了III至IV期患者显著的无进展生存获益,加入贝伐珠单抗将中位无进展生存期从12.5个月显著延长至令人印象深刻的29.7个月,并将中位总生存期从34.7个月数值上提高至51.4个月。此外,来自一家亚洲中心的回顾性分析表明,在晚期/复发性透明细胞卵巢癌患者中,将贝伐珠单抗加入铂类化疗后进行贝伐珠单抗维持治疗,与单用化疗相比,显示出更长的中位无进展生存期,尽管这种获益在统计学上不显著。尽管这些是回顾性数据且缺乏前瞻性数据,贝伐珠单抗对于III至IV期透明细胞卵巢癌患者将是一个合适的维持策略。
争议三:晚期肿瘤背景下的靶向治疗,是否已准备好进入一线(Prime Time)?
妇科透明细胞肿瘤仍然具有化疗耐药性,在复发或转移性背景下生存结局较差,在复发性透明细胞卵巢癌中,化疗的无进展生存期(PFS)约为2-3个月,这凸显了对新型治疗药物的迫切需求。一项对256例复发性透明细胞卵巢癌患者的回顾性综述发现,铂敏感患者在首次复发或任何复发时,接受铂类或非铂类治疗的无进展生存期无显著差异,进一步强调了其化疗耐药性。一个有争议的策略是免疫检查点抑制(ICI)。其疗效的生物学基础可能是透明细胞妇科癌症独特的免疫抑制性肿瘤微环境(TME),由LAG3、Tim-3和PD-1表达增加所诱导。此外,PIK3CA通路突变和ARID1A功能缺失与高PD-L1水平、白细胞介素(IL)6和IL8表达增加以及进一步的免疫抑制相关。
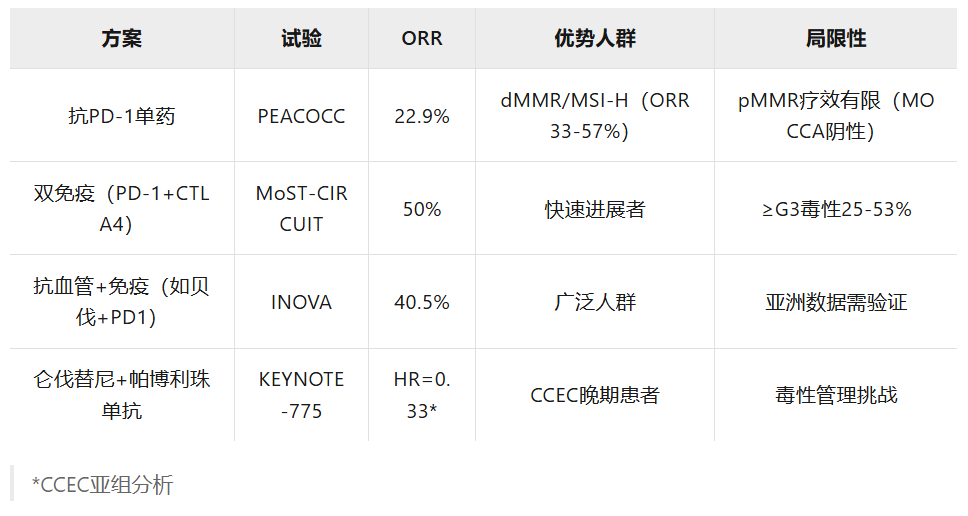
免疫检查点抑制已在错配修复缺陷(dMMR)背景下获得肿瘤不可知性批准,适用于所有患者,包括透明细胞卵巢癌和透明细胞子宫内膜癌患者,这是基于KEYNOTE-158试验的结果。该试验招募了233名dMMR/微卫星高度不稳定(MSI-H)患者,证明了34%的客观缓解率(ORR),其中子宫内膜癌为57%,卵巢癌为33%。大约5%至8%的透明细胞卵巢癌患者为dMMR,在透明细胞子宫内膜癌中为15%至20%。透明细胞亚型的肿瘤突变负荷(TMB)通常也较低,透明细胞卵巢癌的平均TMB为3.8 Mut/Mb。有趣的是,基于非预设的亚组分析,免疫检查点抑制的益处似乎超出了dMMR患者。例如,在一项针对复发或持续性子宫内膜癌的纳武利尤单抗(nivolumab)对比纳武利尤单抗/伊匹木单抗(ipilimumab)的II期试验中,透明细胞亚型患者对纳武利尤单抗/伊匹木单抗治疗的反应可能性是其他亚型患者的5倍。然而,专门针对透明细胞亚型的免疫检查点抑制II期试验得出了相互矛盾的结果;因此,免疫检查点抑制的使用仍存在争议。II期PEACOCC试验结果是积极的,证明了帕博利珠单抗(pembrolizumab)单药治疗复发性透明细胞癌(41例透明细胞卵巢癌和6例透明细胞子宫内膜癌)的益处,令人鼓舞的客观缓解率为25%,中位缓解持续时间(DOR)接近1年。然而,相反地,II期MOCCA试验将错配修复功能完整(pMMR)的复发性透明细胞卵巢癌患者随机分配至度伐利尤单抗(durvalumab,一种PD-L1抑制剂)组或医生选择的化疗组,结果为阴性,未观察到客观缓解率或无进展生存获益。
在子宫内膜癌中,基于RUBY70和NRG-GY018试验71的结果,目前一线治疗已批准免疫检查点抑制。该试验分别观察到在化疗中加入多塔利单抗(dostarlimab)和帕博利珠单抗带来的无进展生存期和总生存期获益。dMMR子宫内膜癌的获益是毋庸置疑的,RUBY试验的更新结果显示,dMMR患者在多塔利单抗组的中位总生存期尚未达到,而安慰剂组为31.4个月。然而,在pMMR人群中,生存优势不那么显著,多塔利单抗组的中位总生存期为34个月,安慰剂组为27个月(HR 0.79, 95% CI 0.60 to 1.04, nominal p=.049)。最有可能从联合化疗-免疫检查点抑制治疗中获益的pMMR子宫内膜癌病例仍有待确定。在RUBY试验中,TP53突变病例似乎从添加免疫检查点抑制中获益最大,而MITO END-3同时报告了相互矛盾的数据。RUBY试验中仅有17名患者具有透明细胞组织学(总共494名患者),这种独特的患者亚群是否真正从一线治疗中添加免疫检查点抑制中获益仍有待观察。一个局限性在于该试验未进行组织学的中心审查。尽管如此,免疫检查点抑制的使用现在已被推进到dMMR子宫内膜癌的一线治疗,FDA目前的批准仅限于dMMR人群。
双重免疫检查点抑制是一种改善免疫检查点抑制反应的新兴策略。共有3项试验研究了这种方法:随机II期BrUOG试验(NCT03355976)、II期篮子试验DART/SWOG S1609和MoST-CIRCUIT试验74研究了纳武利尤单抗(一种PD-1抑制剂)和伊匹木单抗(一种CTLA4抑制剂)在妇科透明细胞癌中的使用,客观缓解率分别为26.6%、37%和50%。在BrUOG试验中,妇科透明细胞癌患者的中位无进展生存期为5.1个月,而在DART/SWOG S1609研究中,卵巢透明细胞癌患者的中位无进展生存期为3.7个月,在透明细胞子宫内膜癌中的获益不太明显。最后,另一种将帕博利珠单抗与IDO-1抑制剂epacadostat联合的替代策略显示出21%的缓解率,中位无进展生存期为4.8个月;然而,该研究因药物供应不足而提前关闭,未能进入第二阶段。
另一个提高透明细胞卵巢癌对免疫检查点抑制反应的新兴方法是添加抗血管生成药物(表见原文)。单独抗血管生成单药治疗的缓解率较低;NI/ENGOT-0V36研究将复发性透明细胞子宫内膜癌和透明细胞卵巢癌患者随机分配到尼达尼布(nintedanib,一种VEGFR、PDGFR和FGFR抑制剂)组或医生选择的化疗组。尼达尼布单药治疗显示缓解率为2%,无显著无进展生存获益。然而,它促使了进一步的研究,将抗血管生成药物与其他新型药物(如免疫检查点抑制剂)在该人群中进行联合。血管内皮生长因子(VEGF)是肿瘤微环境(TME)中的关键免疫抑制调节因子,通过抑制T细胞增殖和功能以及招募免疫抑制性T调节细胞。贝伐珠单抗(一种VEGF抑制剂)可能能够逆转这种免疫抑制性TME并使肿瘤血管正常化,从而增强免疫检查点抑制的疗效。INOVA试验(NCT04735861)是一项单臂研究,招募了复发性卵巢透明细胞癌患者,并联合了贝伐珠单抗和信迪利单抗(sintilimab,一种PD-1抑制剂)。它已显示出有希望的活性,客观缓解率为40.5%,中位无进展生存期为6.9个月。KEYNOTE-775按组织学亚型进行的事后亚组分析表明,在所有亚型中,帕博利珠单抗和仑伐替尼(lenvatinib)联合治疗相较于医生选择的治疗方案具有总生存获益,在晚期透明细胞子宫内膜癌中HR值0.33令人鼓舞。此后,多项试验研究了在该独特亚型中联合免疫检查点抑制和VEGF抑制剂的潜在协同作用。LARA试验(NCT04699071)是一项单臂II期研究,招募了接受帕博利珠单抗联合仑伐替尼治疗的复发性透明细胞卵巢癌和透明细胞子宫内膜癌患者。24周时确认的客观缓解率为44.0%,该方案显示出令人鼓舞的无进展生存期为23.4周。此外,BOUQUET试验(NCT04931342)是一项伞式试验,招募了罕见上皮性子宫内膜癌患者,包括透明细胞卵巢癌患者,设有多组,包括一项将患者随机分配到阿替利珠单抗(atezolizumab,一种PD-L1抑制剂)联合贝伐珠单抗的研究组。中期结果显示客观缓解率为14%(3/21名患者,其中1名患者患有透明细胞卵巢癌),疾病控制率(DCR)为71%。另外,DOVE试验(APGOT-OV7/ENGOT-ov80)是一项正在进行的随机三臂II期研究,比较多塔利单抗±贝伐珠单抗与标准化疗在复发性妇科透明细胞癌患者中的疗效。目前,基于II期数据,治疗透明细胞子宫内膜癌最有前景的选择是帕博利珠单抗联合仑伐替尼、纳武利尤单抗联合伊匹木单抗的双重免疫检查点抑制,以及贝伐珠单抗联合PD-1抑制剂。尽管MoST-CIRCUIT试验中双重免疫检查点抑制的客观缓解率高达50%,但≥3级毒性为25%74;因此,每种有前景方案的益处需要在其毒性的背景下进行评估。
富含AT交互结构域蛋白1A(ARID1A)代表了一个有前景的新型治疗靶点,尽管目前尚无临床适用的靶向疗法。它是透明细胞癌中最常突变的基因之一,作为染色质重塑肿瘤抑制因子发挥作用。ARID1A通过与共济失调毛细血管扩张症和Rad3相关(ATR)的相互作用被募集到双链脱氧核糖核酸(DNA)断裂处,并且ARID1A缺失已被证明会导致异常的细胞周期控制。这种复制应激似乎驱动了对吉西他滨的特殊敏感性,吉西他滨在ARID1A突变的透明细胞卵巢癌中似乎选择性更有效,尽管我们需要更多数据和对此的机制解释。尚不清楚类似发现是否延伸至透明细胞子宫内膜癌。此外,ARID1A缺陷的癌症DNA损伤反应受损,并对ATR抑制剂表现出敏感性。基于此,正在进行的ATARI试验是一项II期临床试验,在该试验中,患有透明细胞子宫内膜癌和透明细胞卵巢癌的患者以及其他罕见妇科肿瘤的患者,接受ATR抑制剂ceralasertib单药或与PARP抑制剂奥拉帕利(olaparib)联合治疗。来自队列1A(接受ceralasertib单药的复发性卵巢透明细胞癌/透明细胞子宫内膜癌伴ARID1A缺失患者)和队列2(无ARID1A缺失的CCC接受ceralasertib和奥拉帕利治疗)的初步数据显示客观缓解率均为14%,表明该治疗策略具有一定活性,更多数据尚待公布。一种新型药物ENMD-2076,一种选择性靶向Aurora A和VEGFR的口服多靶点激酶抑制剂,在一项针对未选择人群的透明细胞卵巢癌II期研究中未达到其6个月无进展生存期阈值;然而有趣的是,在ENMD-2076治疗中,ARID1A缺失与更好的无进展生存期相关。有必要进一步研究ARID1A作为可能从ENMD-2076中获益患者的预测性生物标志物。此外,表观遗传药物如EZH2抑制剂,已被证明在体外和体内实验中选择性抑制ARID1A突变卵巢癌细胞的生长。作为肿瘤抑制或“看门”基因,肿瘤中的ARID1A缺陷代表了新型药物产生细胞特异性细胞毒性的潜在合成致死表型。
基于透明细胞子宫内膜癌和透明细胞卵巢癌的分子谱,另一个潜在靶点是PI3K通路。由于超过80%的透明细胞卵巢癌表现出AKT-mTOR通路激活,GOG268试验将mTOR抑制剂替西罗莫司(temsirolimus)联合术后卡铂和紫杉醇,随后进行1年维持治疗用于透明细胞卵巢癌。一项II期研究未能证明生存获益。同样,一项正在进行的II期CYH33-G201试验正在研究使用CYH-33(一种α选择性PIK3CA抑制剂)治疗具有PIK3CA热点突变的复发性或持续性透明细胞卵巢癌患者。
最后,抗体药物偶联物(ADC)仍然是包括透明细胞卵巢癌在内的许多实体瘤中有前景的突破。关于透明细胞子宫内膜癌和透明细胞卵巢癌中HER2过表达率的文献不一致,具体取决于所使用的检测方法,存在显著差异。DESTINY-PanTumor02 II期试验显示,在二线或更后线治疗中,曲妥珠单抗德喜替康(T-DXd)在子宫内膜癌和卵巢癌中具有令人鼓舞的37%的客观缓解率。此外,针对HER2扩增的晚期实体瘤使用T-DXd治疗的HERALD试验在子宫内膜癌和卵巢癌中均显示出令人印象深刻的客观缓解率(分别为83%和100%),尽管两项试验均未报告是否纳入了透明细胞亚型。尽管如此,T-DXd在HER2过表达的透明细胞癌中仍然是一种令人兴奋的新型ADC策略,其他即将出现的ADC靶向叶酸受体α100、紧密连接蛋白6(claudin 6)101和CDH6等靶点。
讨论
透明细胞卵巢癌和子宫内膜癌是目前研究不足的疾病亚型,主要原因是其在西方人群中的罕见性,这导致它们在随机临床试验中代表性不足。这造成了在指导治疗决策方面前瞻性数据的显著缺乏。对这些罕见疾病实体进行III期随机试验所面临的挑战,常常导致临床实践不得不依赖于从其他组织学亚型的治疗中推断数据。然而,最近的进展强调了透明细胞卵巢癌和子宫内膜癌在妇科恶性肿瘤中的独特性,凸显了需要针对特定背景量身定制创新和个性化方法。因此,新一代临床试验正在开展,有望改变治疗格局并改善这些癌症患者的结局。
在本综述中,我们讨论了妇科透明细胞癌管理中的三个争议方面。首先,独特的流行病学和临床背景提出了一个问题:透明细胞癌是否代表一个单一的疾病实体,而非两种独立的疾病。为支持这一概念,最近的试验招募了患有透明细胞卵巢癌或透明细胞子宫内膜癌的患者,在某些情况下甚至包括极为罕见的透明细胞宫颈癌患者,为这些罕见的组织学亚型提供了更多的治疗选择。然而,最近的报告强调了透明细胞子宫内膜癌和透明细胞卵巢癌之间耐人寻味的差异,特别是在其分子背景方面,引发了关于这种方法的新疑问。其次,由于大多数透明细胞卵巢癌和透明细胞子宫内膜癌病例在早期被诊断,因此局限性疾病的管理在手术程序和辅助策略方面至关重要。遗憾的是,大多数决策基于仅包含一小部分透明细胞癌的关键性试验。迫切需要研究人员为该特定人群确定最佳治疗顺序,以在最大程度减少不必要操作相关并发症的同时实现最佳结局。最后,尽管在理解透明细胞癌的生物学背景方面取得了重大进展,但针对复发背景的有效个性化治疗方法仍然有限。基于强有力的临床前理论基础,目前正在深入研究靶向免疫微环境、异常细胞过程和代谢重编程的策略,这些策略具有改变治疗格局的潜力。通过将新药纳入临床试验来扩大其可及性,对于加速开发能使更广泛患者群体受益的有效策略至关重要。
讨论争议常常会引出比提供明确答案更多未解决的问题。在罕见肿瘤领域,我们必须承认在做出高质量循证决策方面面临的挑战,同时不断努力挑战现有标准。尽管如此,国际合作,特别是纳入代表性不足的族裔群体,成为在透明细胞癌领域取得重大进展的关键要求。











 苏公网安备32059002004080号
苏公网安备32059002004080号


