EGFR基因突变是非小细胞肺癌(NSCLC)中最常见的驱动基因突变,近年来,随着精准医疗的发展,EGFR突变晚期NSCLC的治疗模式逐渐优化,显著提高了这类患者的生存率和生活质量。2025年美国临床肿瘤学会(ASCO)年会于当地时间5月30日至6月3日在美国芝加哥盛大召开,此次大会也公布了多项EGFR突变晚期NSCLC治疗的最新进展,从一线治疗的深度探索,到后线耐药的破解之道,再到新药、新联合方案的临床探索,今年的ASCO大会可谓亮点纷呈。【肿瘤资讯】特邀广州医科大学附属第一医院杨海虹教授,深度解读EGFR突变晚期NSCLC治疗领域的最新进展,以期为临床实践带来更多参考。
广州医科大学附属第一医院
广州抗癌协会理事
广州抗癌协会分子靶向治疗专委会主任委员
广东省药学会专业药房专业委员会顾问
广东省杰出青年医学人才
中国医学教育协会肿瘤免疫治疗专委会委员
广东省女医师协会肺癌专委会常委
就职于广州医科大学附属第一医院胸部肿瘤科
主攻NSCLC脑和脑膜转移和ALK阳性肺癌的综合治疗
擅长临床统计学,开展NSCLC脑和脑膜转移的转化医学研究
一线治疗:新型双抗药物领衔EGFRm晚期NSCLC联合治疗新高度
目前,EGFR-TKI已成为EGFR突变晚期NSCLC患者的标准一线治疗方案,随着临床医生对EGFR靶点认识的不断深入,第三代EGFR-TKI的联合治疗模式显示了巨大的潜力,有望为越来越多患者带来了切实的生存获益。
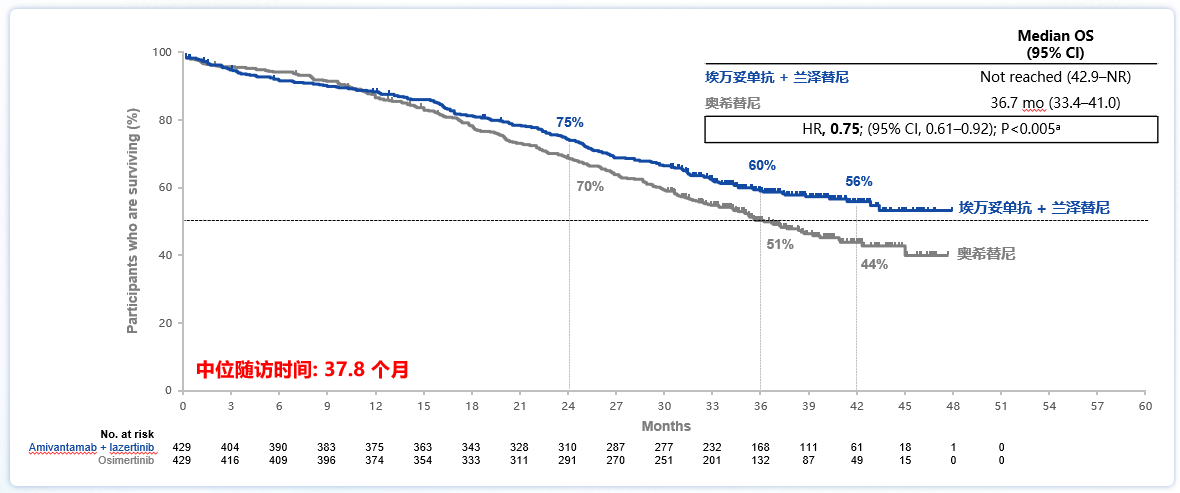
MARIPOSA研究探讨了埃万妥单抗(EGFR/MET双特异性抗体)联合兰泽替尼(三代EGFR-TKI)在EGFR经典突变一线治疗中的应用。研究结果显示[1],对比奥希替尼单药组,埃万妥单抗联合兰泽替尼组的中位无进展生存期(mPFS)显著延长(23.7个月 vs. 16.6个月;P<0.001),疾病进展或死亡风险降低30%;亚洲人群的疗效和全人群相一致,亚洲人群mPFS在数值上显示更长的获益趋势,达到27.5个月。其最新的总生存期(OS)数据[2]显示(图1),中位随访37.8个月时,相较于奥希替尼组,埃万妥单抗联合兰泽替尼的中位OS尚未达到,但改善预计超过一年(HR 0.75,P<0.005),因此,该方案是首个且唯一一个在一线治疗携带EGFR突变的晚期NSCLC患者中相比奥希替尼有总生存获益的疗法。基于MARIPOSA研究的积极结果,埃万妥单抗联合兰泽替尼已获得美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)批准用于EGFR敏感突变NSCLC一线治疗,并获NCCN指南推荐。《2025年CSCO NSCLC诊疗指南》也新增加埃万妥单抗联合兰泽替尼作为EGFR敏感突变NSCLC一线治疗的III级推荐,这一联合疗法有望成为新的标准一线治疗。
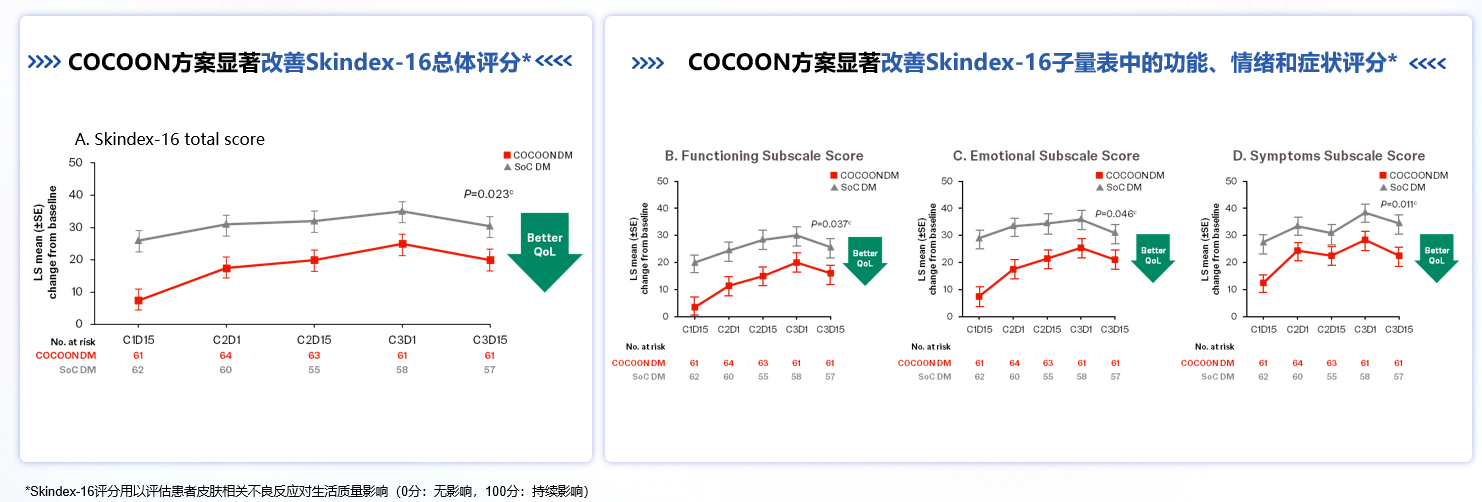
旨在评估加强皮肤管理对于接受埃万妥单抗+兰泽替尼一线治疗时皮肤相关AEs发生率影响的II期、开放性、随机研究,COCOON II期研究在2025 ELCC首次公布了其预防性管理数据[3]。研究结果显示,COCOON皮肤强化管理方案达到了主要终点,COCOON皮肤管理方案(COCOON DM)与标准皮肤管理方案(SoC DM)相比,≥2级皮肤不良事件(AE)减少了50%(38.6% vs 76.5%, p<0.0001)。2025 ASCO公布了其最新研究结果,治疗前12周的患者报告的结局(Patient Reported Outcomes, PROs)[4],显示在第3周期第15天(约10周时),COCOON DM组的Skindex-16量表总分显著低于SoC DM组(P=0.023)(图2A),并且在所有Skindex-16子量表(功能,情绪和症状)(图2B-D)中,观察到患者可显著且一致地从COCOON DM获益, 提示COCOON皮肤加强管理方案全面改善皮肤相关AE对患者生活质量影响,包括功能、情绪和症状维度,获得一致提升。
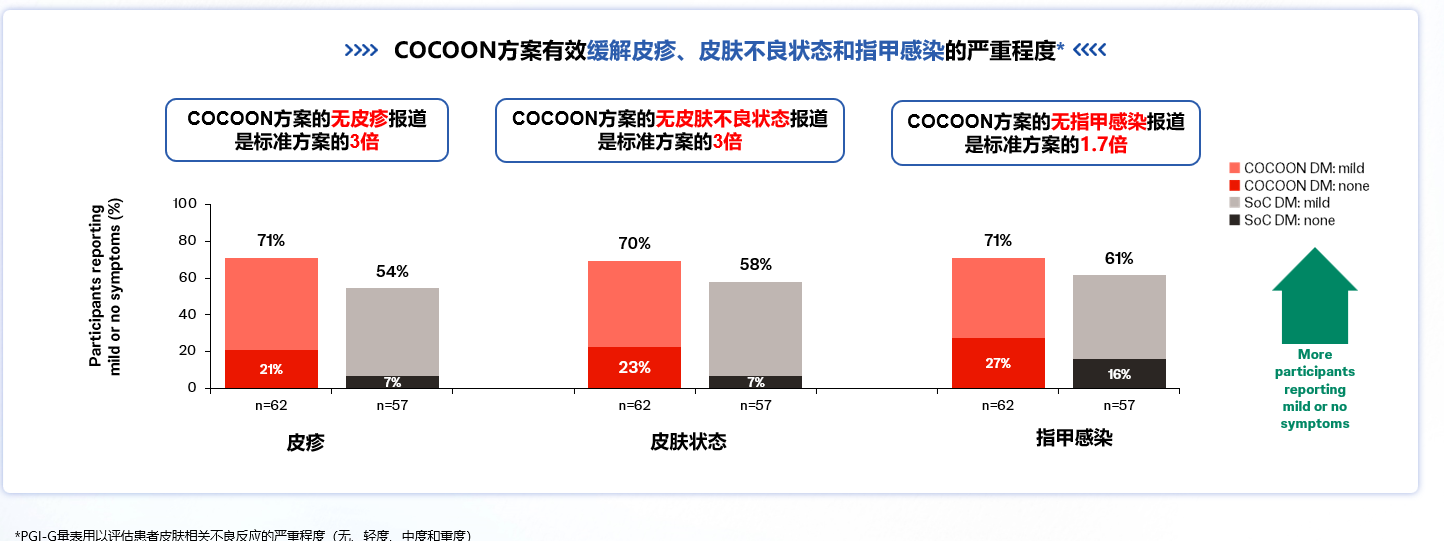
此外,前3个治疗周期中,COCOON DM组报告总体严重程度印象(PGI-S)皮疹/皮肤状况/指甲感染为轻度或无症状的患者比例更高,超过2/3的患者在前三个周期内报告无症状至轻微症状(图3)。因此,COCOON DM不仅降低了皮肤相关AE的风险和严重程度,也改善了患者的QoL。
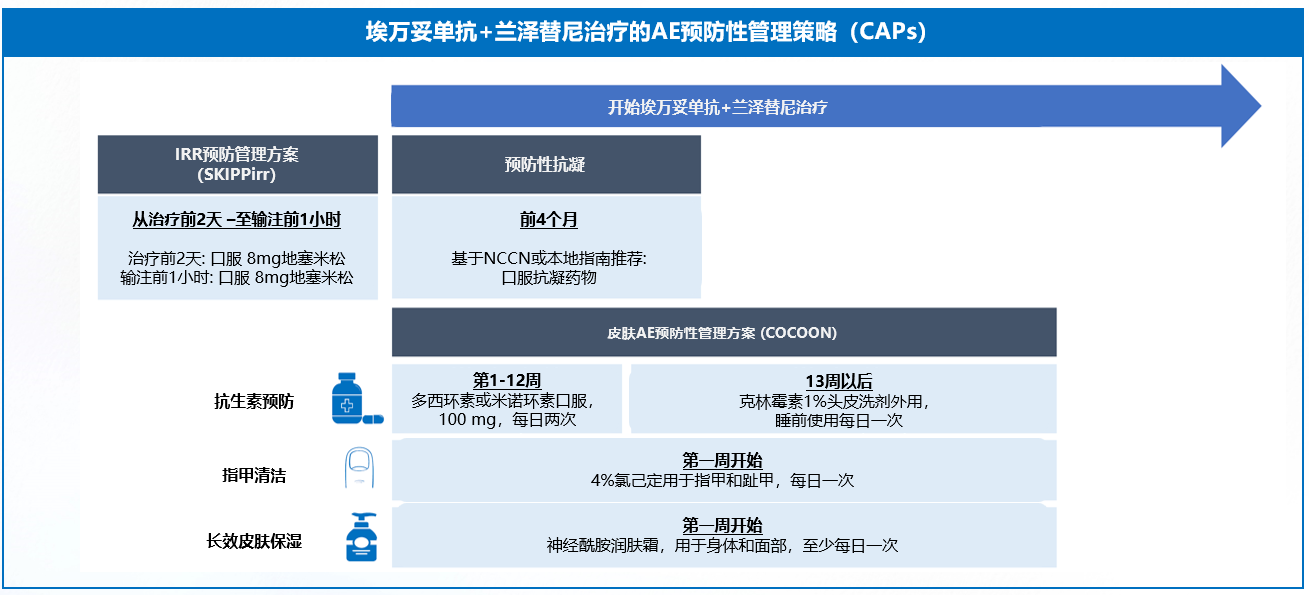
在全方位预防性管理策略下(图4),埃万妥单抗联合兰泽替尼的生存获益有望通过改善患者体验、提升耐受性而进一步提升。
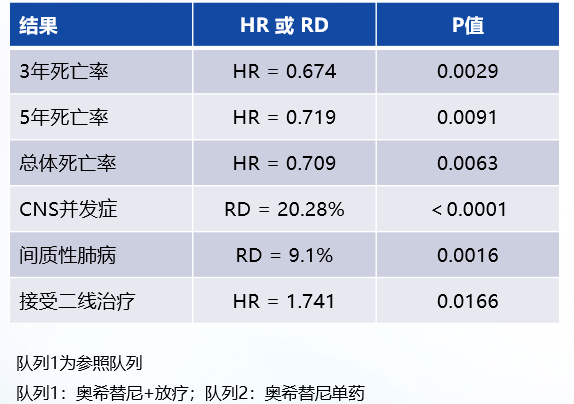
FLAURA2研究同样探索了第三代EGFR-TKI的联合治疗方案(奥希替尼联合化疗)在EGFR经典突变晚期NSCLC一线治疗的价值。首次中期分析结果显示[5],无论通过研究者评估还是盲态独立中心审查(BICR),奥希替尼联合化疗组相较于奥希替尼单药组,均显著延长了患者的PFS约9个月,疾病进展或死亡风险降低38%。2025 ASCO公布了一项回顾性研究分析了TriNetX数据库中接受奥希替尼联合放疗与奥希替尼单药治疗脑转移患者的生存差异[6],研究结果显示,Kaplan-Meier分析提示:奥希替尼联合放疗组3年、5年和总体死亡率均更低,但CNS并发症和间质性肺病发生风险更高(表1)。这表明奥希替尼联合放疗可降低伴脑转移患者的死亡率,但需权衡疗效获益和治疗风险,以优化患者治疗。
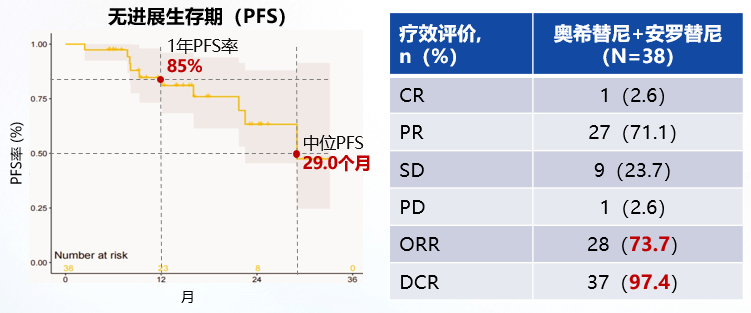
一项单臂、前瞻性、多中心II期研究[7]探索了奥希替尼联合安罗替尼一线治疗EGFR突变伴共突变(至少存在TP53、PI3KCA或RB1中的一种)的晚期NSCLC的疗效和安全性。研究结果显示,中位随访14.5个月时,奥希替尼联合安罗替尼的1年PFS率达85%(95%CI:70%-95%),中位PFS为29.0个月(95%CI:22.5-未达到)。客观缓解率(ORR)为73.7%,疾病控制率(DCR)达97.4%(图5)。在安全性方面,所有患者均出现治疗相关不良事件(TRAEs),其中18.3%发生3级及以上TRAEs。因此,奥希替尼+安罗替尼一线治疗EGFR阳性伴共突变晚期NSCLC展现较好的前景。
后线治疗:多靶点,多机制的全面探索有望克服EGFR-TKI复杂耐药机制
第三代EGFR-TKI是当前EGFR突变晚期NSCLC患者一线治疗的关键药物。然而,大部分患者会面临耐药问题,并且由于第三代EGFR-TKI耐药机制复杂,涉及多个耐药通路,探究克服耐药的后线治疗策略迫在眉睫。为克服耐药难题,基于免疫机制的联合方案以及靶向EGFR的双特异性抗体等新型治疗策略已相继获得批准,同时更多克服耐药的方案仍在积极研发中。
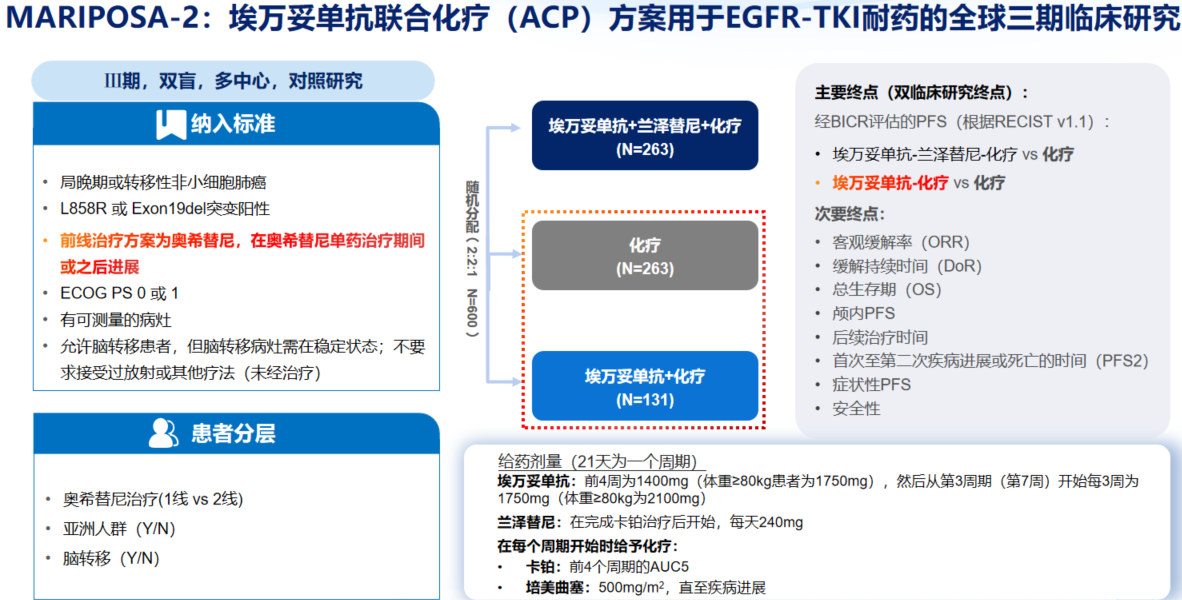
MARIPOSA-2研究[8]是一项III期、全球多中心、随机对照研究,旨在评估埃万妥单抗联合化疗±兰泽替尼治疗奥希替尼耐药的EGFR突变晚期NSCLC患者的疗效和安全性。MARIPOSA-2入组的基线人群为100%奥希替尼后进展的患者,且44%有脑转移病史,并将是否有脑转移作为预设分层因素(图6)。
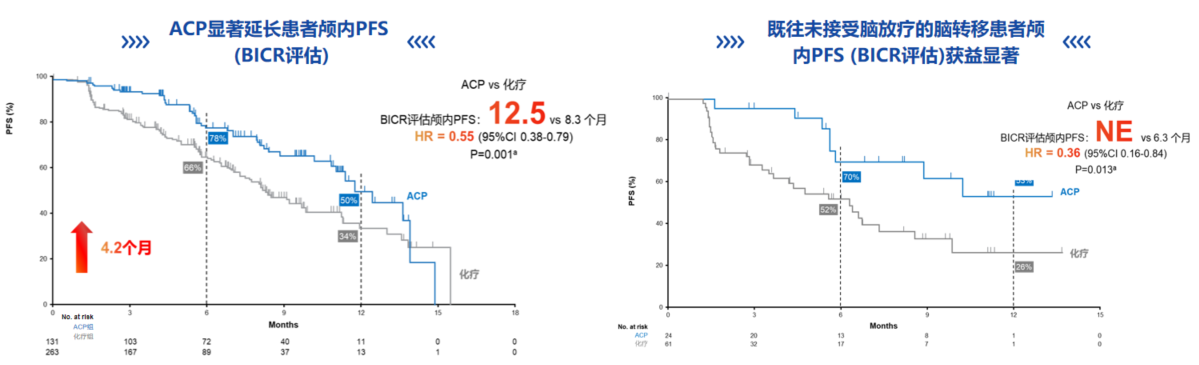
此前更新的长期随访结果显示[9],埃万妥单抗联合化疗方案不仅可改善患者至症状进展时间(TTSP),至停药时间(TTD),至后续治疗时间(TTST)和首次后续治疗后的无进展生存期(PFS2)等疾病进展后与症状改善情况相关指标获益,亦可延长患者OS,两组患者的中位OS分别为17.7个月 vs. 15.3个月(HR=0.73;95%CI:0.54-0.99;P=0.039),死亡风险降低达27%。此外值得注意的是,该项研究纳入的患者亚洲人群近一半,并且基线存在脑转移的患者超过40%。由于脑转移患者的预后通常较差,且其治疗选择和疗效评估具有独特的挑战性,MARIPOSA-2研究中高比例的基线脑转移患者数据不仅有助于更好地理解脑转移患者的疾病特征和治疗反应,还可能为优化治疗策略提供依据,从而改善这类患者的临床预后。研究结果显示,埃万妥单抗联合化疗(ACP方案)延长颅内中位PFS至12.5个月,降低颅内进展和死亡风险45%(图7);对于既往未接受过脑放疗的脑转移人群,ACP组的颅内PFS获益更显著,降低了64%的颅内疾病进展或死亡风险(图7)。脑转移人群作为预设分层因素,提示埃万妥单抗联合化疗可预防或延缓脑转移在治疗脑转移人群有更好的优势。
伴有脑转移的晚期NSCLC的难治性与血脑屏障、发病机制未明、肿瘤异质性及检测结果差异等相关,大部分临床研究均仅允许入组基线稳定的脑转移灶患者,排除了活动性脑转移和伴有软脑膜转移患者(软脑膜转移可引起颅高压和脑神经压迫症状,严重影响患者生活质量并缩短生存期)。一项II期研究[10]结果显示,埃万妥单抗+兰泽替尼治疗EGFR-TKI耐药伴活动性CNS疾病的患者中,脑转移组全身ORR为30%,PFS达5.9个月,OS达17.9个月;脑膜转移组全身ORR为33%,PFS达8.3个月,OS达14.4个月。这一研究再次验证了埃万妥单抗在脑实质和脑膜转移患者中的可观疗效。
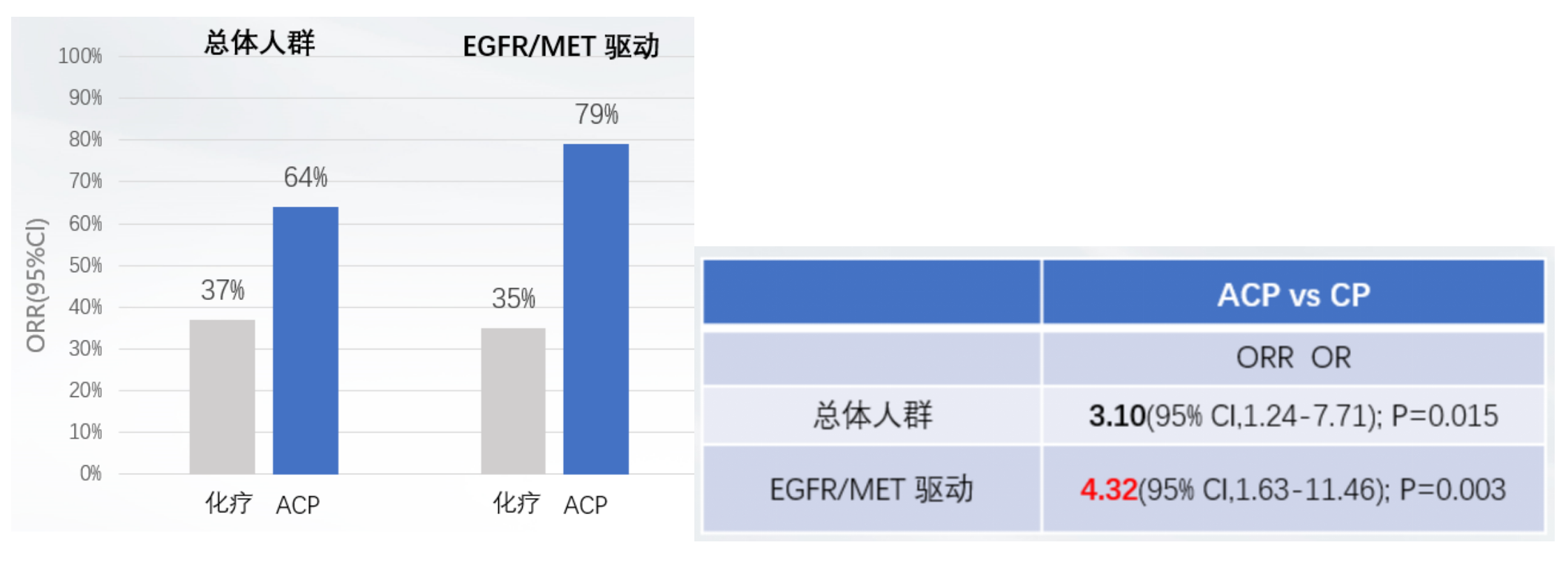
此次2025 ASCO也公布了MARIPOSA-2研究中奥希替尼耐药机制分层分析[11]。研究结果显示, ACP与化疗组在基线时最常见的突变:MET扩增(10% vs 14%)和继发性EGFR耐药突变 (13% vs 18%) 。对于EGFR/MET依赖型耐药机制人群,ACP方案组 vs化疗组ORR的比值比(OR)为4.32(图8),意味着ACP治疗组获得缓解的可能性是化疗组的4.32倍,进一步支持了ACP方案在TKI耐药人群中优势人群的获益。因此,ACP方案在无论“On/Off-Target”或未知耐药机制人群中,均较化疗显著改善疗效。即可有靶打靶,又多维破局奥希替尼耐药的复杂性。该研究进一步证明ACP方案无惧耐药机制复杂性,可全方位抑制肿瘤细胞,产生长期疗效,基于此,ACP方案有望适用于全部TKI耐药人群。
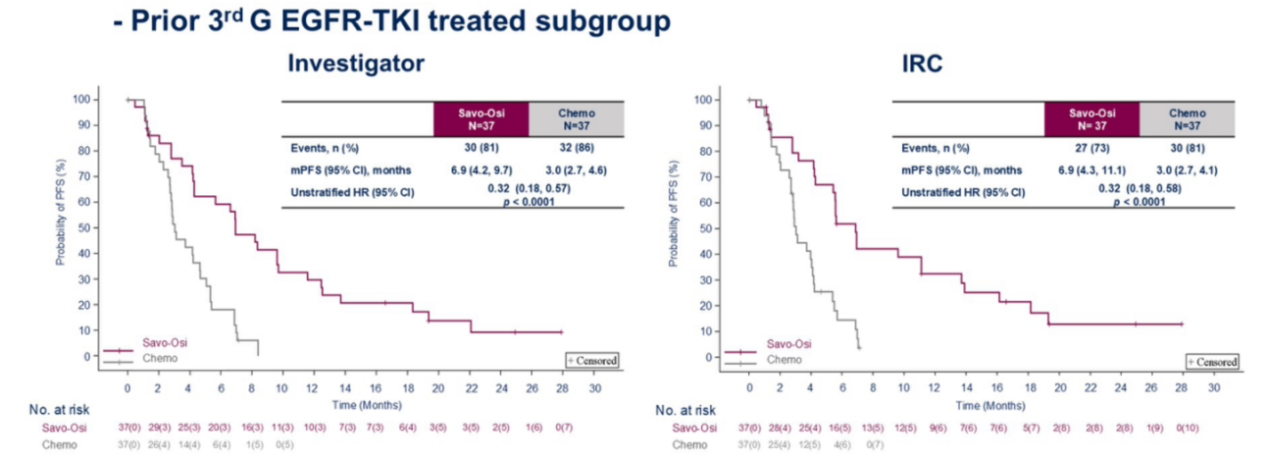
随机III期SACHI研究探究了赛沃替尼联合奥希替尼对比化疗治疗EGFR突变和MET扩增晚期NSCLC患者经EGFR-TKI治疗后疾病进展的疗效,此次ASCO也公布了其中期分析结果[12],研究结果显示在第三代EGFR-TKI经治患者中,赛沃替尼联合奥希替尼组mPFS显著延长(6.9个月 vs 3.0个月,HR=0.32,p<0.0001),并且IRC评估的PFS获益与上述结果一致(图9)。本次分析时OS数据尚不成熟。在安全性方面,赛沃替尼联合奥希替尼组与化疗组≥3级治疗期间不良事件(TEAE)发生率接近。基于此,赛沃替尼联合奥希替尼有望成为该类人群的潜在新治疗选择。
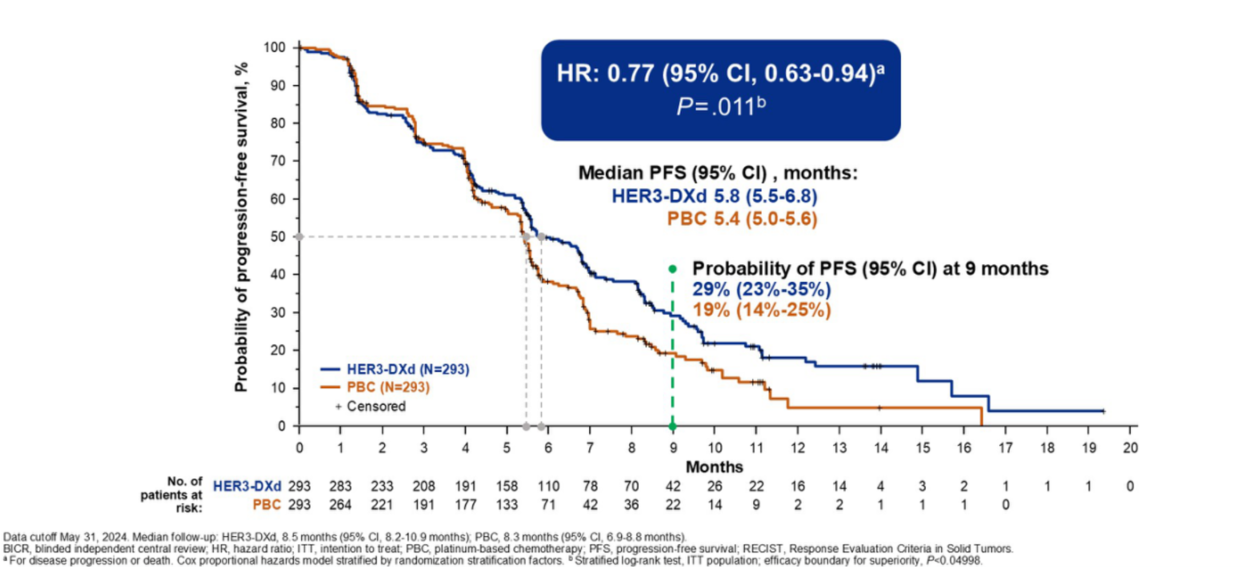
抗体偶联药物(ADC)也在积极探索克服EGFR-TKI耐药的更多可能性。HERTHENA-Lung02研究探索了靶向HER3的ADC HER3-DXd用于第三代EGFR-TKI耐药患者的疗效和安全性。研究结果[13]显示,与铂类化疗相比,HER3-DXd可显著改善PFS(HR=0.77;95%CI:0.63-0.94;P=0.011)(图10)。在基线伴脑转移患者(经CNS BICR确认)中,HER3-DXd组和铂类化疗组的中位颅内PFS分别为5.4个月和4.2个月(HR=0.75;95%CI:0.53-1.06)。至数据截至日期,OS数据尚不成熟。HER3-DXd的安全性特征与既往报道一致且可控。
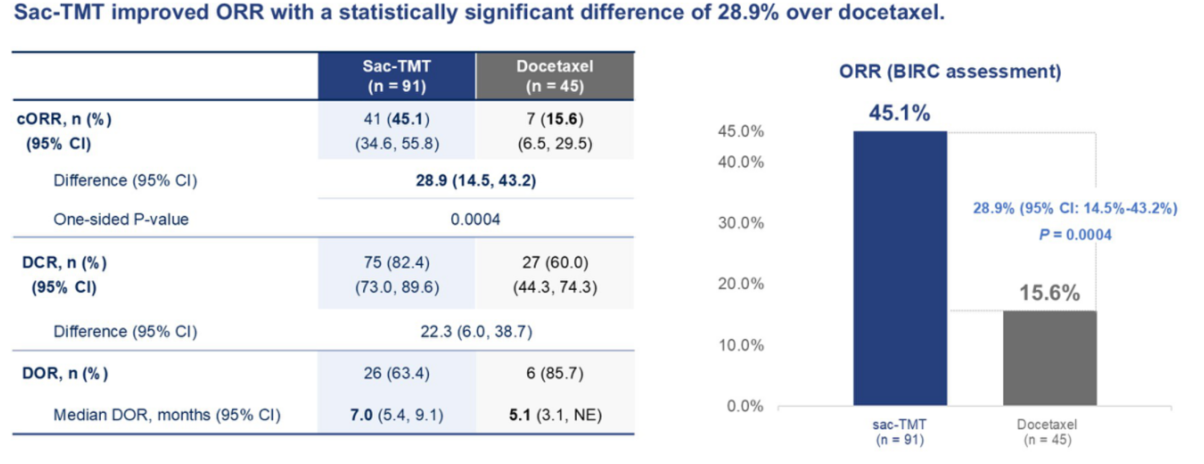
OptiTROP-Lung03研究探索了靶向TROP2的ADC芦康沙妥珠单抗(sac-TMT)在经治晚期EGFR突变NSCLC患者中的疗效。研究结果[14]显示,在经治晚期EGFR突变NSCLC患者中,sac-TMT较多西他赛可显著提高ORR(45.1% vs 15.6%,单侧p=0.0004)(图11)、延长PFS(45.1% vs 15.6%,单侧p<0.0001)和OS(两组均未达到中位OS,HR 0.49[0.27-0.88],单侧p<0.0001),且安全性可控。
总结
杨海虹教授:2025年的ASCO年会无疑为EGFR突变晚期NSCLC的临床实践带来了众多的启示。今年的进展呈现出两大核心趋势:一线治疗的“强强联合”与后线治疗的“多维突破”。
在一线治疗领域,联合治疗模式有望成为新的标准治疗方案,基于MARIPOSA研究,埃万妥单抗联合兰泽替尼的方案展现出广阔的应用前景。同时,临床探索并未止步,其他以三代EGFR-TKI为基础的药物联合模式正在进行中,无论是奥希替尼联合放疗以提升脑转移患者的生存,还是联合安罗替尼在EGFR共突变这一棘手人群中展现出的卓越疗效,这些探索都标志着一线治疗正朝着更精准的个性化治疗迈进。
在后线治疗领域,本届ASCO更是亮点颇多。MARIPOSA-2研究的结果尤为关键,它不仅确立了ACP方案在EGFR-TKI耐药后尤其是基线存在脑转移患者中的重要地位,更揭示了该方案能够超越复杂的耐药机制,为各类患者均提供PFS获益。奥希替尼联合赛沃替尼可显著改善EGFR-TKI耐药后具有MET扩增患者的临床获益,也为该类患者提供了精准且有力的治疗武器。与此同时,以HER3-DXd和sac-TMT为代表的ADC通过靶向HER3或TROP2等不同靶点,在后线治疗中相较传统化疗也取得了一定的进展,为EGFR-TKI耐药后的治疗拓展了新的思路。
[1] Byoung C Cho, et al. N Engl J Med. 2024 Jun 26.
[2] 2025 ELCC, abstract# 4O.
[3] Girard N, et al. ELCC 2025 4MO.
[4] 2025 ASCO abstract# 8641.
[5] Natalia Valdiviezo, et al. 2024 ELCC. Abstract 4O.
[6] 2025 ASCO abstract# 8556.
[7] 2025 ASCO abstract# 8627.
[8] Passaro A, et al. Ann Oncol. 2024 Jan;35(1):77-90.
[9] 2024 ESMO. Abstract LBA54.
[10] Helena Alexandra Yu, et al. 2024 ASCO Rapid Oral 8517.
[11] 2025 ASCO abstract# 8639.
[12] 2025 ASCO abstract# LBA8505.
[13] 2025 ASCO abstract# 8506.
[14] 2025 ASCO abstract# 8507.
*截至发布日期
CRC Code: EM-184241
Approved Date::2025/06/09
排版编辑:肿瘤资讯-TJ
✅ “本资料仅用于医学、科学交流,可能涉及尚未在中国获批的产品和适应症。强生创新制药不支持、不鼓励任何未被批准的药品/适应症使用。”
✅ “本资料中涉及的AE/SS/PQC已按照公司的要求上报。”(适用于含AE/SS/PQC的资料)











 苏公网安备32059002004080号
苏公网安备32059002004080号


