腹膜转移是消化道肿瘤常见的转移方式,其复杂的肿瘤异质性为临床治疗带来了巨大挑战。近期,两项分别针对胃癌/食管胃结合部癌和结直肠癌腹膜转移的研究,深入探讨了原发灶与转移灶之间的分子表达差异、肿瘤微环境特征以及潜在的治疗靶点,为破解这一难治疗题提供了新的视角。
一项来自意大利团队的研究发表于Gastric Cancer,其旨在评估胃癌/食管胃结合部癌(G/EGJ)原发灶与腹膜转移灶(PM)之间预测性生物标志物表达的差异性。

研究背景
胃癌及食管胃结合部癌(G/EGJ)确诊时多已进展至晚期,腹膜转移(PM)是常见复发形式,约占所有复发的50%。PM的治疗选择有限,预后极差。近年来,靶向治疗(如抗HER2、抗CLDN18.2)和免疫检查点抑制剂的应用为患者带来了新希望,但肿瘤的时空分子异质性可能导致治疗耐药。既往研究表明,G/EGJ伴PM患者中微卫星不稳定性(MSI)和HER2过表达率较低,且PD-1抑制剂对该类患者的疗效尚不明确。因此,明确原发灶与转移灶的分子标志物表达差异对指导治疗至关重要。
研究方法
研究纳入了2012年至2022年间74例确诊为G/EGJ伴同步或异时性PM的患者,收集其原发肿瘤和配对PM样本。通过免疫组化(IHC)检测HER2、PD-L1、Claudin18(CLDN18)、错配修复(MMR)蛋白、p53和E-cadherin的表达,并通过原位杂交(ISH)技术检测EBER。HER2评估采用Hoffmann四层评分标准,0/1+和非扩增2+定义为非过表达,扩增2+和3+定义为过表达。PD-L1评估采用联合阳性分数(CPS),以1和10为阈值。CLDN18阳性定义为≥75%肿瘤细胞中强度2+/3+。分子分型基于TCGA和ACRG分类标准。统计方法包括Cohen’s κ系数评估一致性,卡方检验和Fisher精确检验分析差异。
研究重要结果
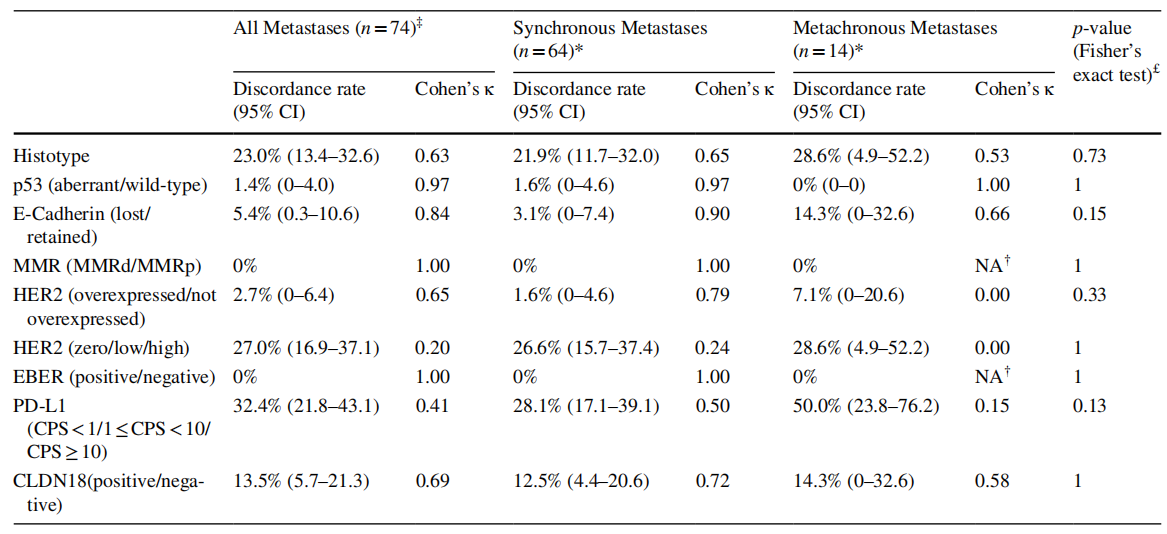
研究发现原发肿瘤中PD-L1(CPS≥1)阳性率为79.7%,但仅14.9%为CPS≥10;CLDN18阳性率为31.1%;HER2过表达率为5.4%,HER2低表达率为14.9%;MMR缺陷(MMRd)和EBER阳性率分别为4.1%和1.4%。根据TCGA分类,50%为染色体不稳定型(CIN),44.6%为基因组稳定型(GS)。
在标志物一致性方面,MMR状态和EBER表达在原发灶与PM间完全一致(κ=1.00);HER2过表达/非过表达的一致性为97.3%(κ=0.65)。然而,PD-L1表达差异显著,32.4%的病例存在不一致性,且转移灶阴性转化更常见。CLDN18在原发灶与PM的阳性率分别为31.1%和30.8%,一致性为86.5%(κ=0.69)。值得注意的是,在HER2非过表达且PD-L1 CPS<1的“双阴性”患者中,28.6%的患者为CLDN18阳性,提示其可作为潜在治疗靶点。此外,HER2低表达状态在原发灶与PM间的差异率为27%,支持转移灶复检的必要性。组织学分析显示,23%的病例原发灶与PM组织学类型不一致,多见于混合型或黏液型肿瘤。

表1 74例原发性胃和食管胃交界癌及配对同步和异时性腹膜转移癌的形态学、分子特征和预测性生物标志物的表达比较
研究结论
本研究首次系统比较了G/EGJ原发灶与PM的分子标志物表达差异,发现MMR、EBER和HER2(过表达/非过表达)在原发灶与PM间高度一致,而PD-L1表达异质性显著,提示其评估需结合原发灶数据。CLDN18表达一致性较高,且在HER2/PD-L1“双阴性”患者中阳性率接近30%,可能成为PM治疗的新靶点。HER2低表达状态和PD-L1的时空异质性强调了对转移灶复检的重要性,以优化治疗决策。该研究为G/EGJ伴PM的精准治疗提供了重要依据,未来需进一步探索CLDN18靶向疗法及克服PD-L1异质性的策略。
一项聚焦于结直肠癌(CRC)腹膜转移(PM)的研究发表于CLINICAL CANCER RESEARCH杂志,旨在阐明区分原发肿瘤(PTs)与PMs的分子特征,并寻找促进跨体腔播散和进展的可作用靶点。

研究背景
结直肠癌(CRC)是常见的消化道恶性肿瘤,PM是CRC患者预后不良的重要因素。肿瘤微环境(TME)在CRC PM的发生发展中扮演着重要角色,但目前针对TME的治疗策略仍然有限。该研究旨在通过多组学分析,揭示CRC PM中原发灶与转移灶的分子差异,以及TME中可用于治疗干预的新靶点。
研究方法
研究者对来自136例患者的227个样本进行了多组学分析,包括56个原发肿瘤(PT)和120个同步PM(图1a和1b),其中包含34个匹配的PT-PM对。进行全外显子组和批量RNA测序分析,以鉴定原发性和腹膜病灶之间潜在的基因组畸变和转录组差异。研究者对肿瘤-基质区室的微环境进行了空间表征,并研究了基质表型在促进肿瘤发生中的作用。
研究重要结果
全外显子测序(WES)发现,PT和PM之间的基因组改变和克隆性模式大致相似。研究队列中最常突变的基因包括肿瘤抑制基因TP53(51%)和APC(38%)、致癌基因KRAS(26%)和肿瘤抑制基因SMAD4(18%)(图1c)。与既往报道一致,在PM样本中发现APC突变的比例相对较低。然而,研究者并未发现PT和PM之间驱动基因突变频率有显著差异(图1d)。与之前的报道一致,肿瘤突变负荷(TMB)没有显著差异(P=0.708)。同样,基因组改变部分的比例(P=0.810)、主要等位基因频率(MAF)中位数(P=0.860)、全基因组加倍(WGD)(P=0.736)和克隆性(P=1.000)也没有显著差异(图1d) 。
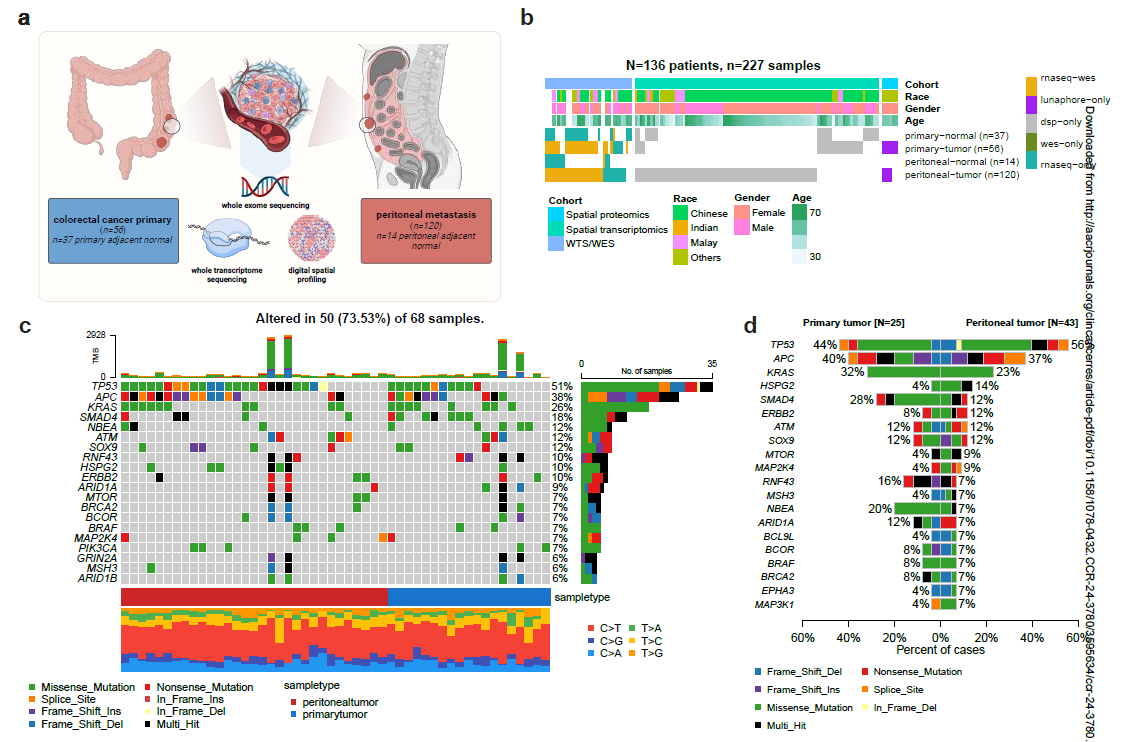
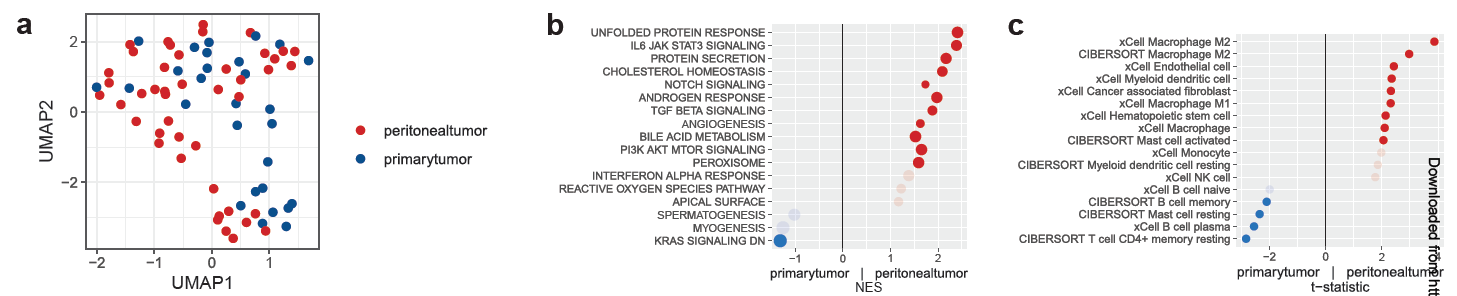
研究团队对来自34例患者的28例PT、44例PM、18例原发正常组织(PN)以及14例肉眼未见肿瘤累及的腹膜正常组织(PMN)样本进行了全转录组测序(WTS)。与通过WES揭示的原发肿瘤与腹膜转移灶之间大致相似的基因组图谱相比,研究人员在基因表达谱层面观察到了更为显著的差异,这表明转录重编程在转移过程中可能发挥了更重要的作用(图2a)。
通过转录组分析,研究者发现在PM中,IL6-JAK-STAT3信号、TGF-β和血管生成通路显著富集(图2b)。细胞类型比例分析显示,在腹膜肿瘤中,M2巨噬细胞、内皮细胞和癌相关成纤维细胞(CAFs)的比例显著增加(图2c)。
应用空间分析,研究者鉴定出一种纤维-胶原和免疫浸润的基质表型(基质簇 [SC] 2),其特征是癌相关成纤维细胞、记忆B细胞、M2巨噬细胞和T细胞耗竭增加。这些发现通过多重免疫组化得到了正交验证。具有SC2基质的患者预后较差,其特征是SERPINE-1(PAI-1)表达高。具有SC2基质的PM患者与富集的致癌通路(如TGF-β)相关。在PAI-1阳性腹水中,PAI-1抑制CRC PM细胞系(Colo-205)显示IL2-STAT5和TGF-β通路减少,并导致细胞死亡 。
研究结论
该研究揭示了CRC PM中独特的分子特征和潜在的治疗靶点,加深了对肿瘤细胞与基质微环境之间复杂相互作用的理解。研究发现的SC2基质表型与不良预后相关,提示PAI-1可能是CRC PM治疗的一个潜在靶点。
这两项研究分别从胃癌和肠癌的角度阐述了PM与原发灶异质性,并揭示了肿瘤微环境在PM发生发展中的重要作用。胃癌研究强调了PD-L1表达的异质性以及CLDN18作为潜在治疗靶点的价值;肠癌研究则揭示了CRC PM中预后不良的基质表型SC2以及PAI-1的治疗潜力。两项研究均提示,深入理解肿瘤异质性和肿瘤微环境的特征,有助于开发更有效的治疗策略,改善PM患者的预后。
[1]Angerilli V, Callegarin M, Govoni I, et al. Heterogeneity of predictive biomarker expression in gastric and esophago-gastric junction carcinoma with peritoneal dissemination. Gastric Cancer. Published online April 9, 2025. doi:10.1007/s10120-025-01609-7.
[2]Ong JC, Zhao JJ, Liu Y, et al. Spatial heterogeneity, stromal phenotypes, and therapeutic vulnerabilities in colorectal cancer peritoneal metastasis. Clin Cancer Res. Published online April 29, 2025. doi:10.1158/1078-0432.CCR-24-3780.
排版编辑:肿瘤资讯-AS











 苏公网安备32059002004080号
苏公网安备32059002004080号


