晚期胃癌的治疗仍然面临诸多挑战,特别是对于合并幽门梗阻的患者,如何在改善症状的同时优化系统治疗方案,是临床关注的重点。近年来,免疫治疗的兴起为晚期胃癌患者带来了新的治疗契机,尤其是以舒格利单抗为代表的PD-1/PD-L1抑制剂,在多个临床研究中展现出良好的疗效和安全性。舒格利单抗作为全球首个基于PD-L1表达水平(CPS≥5)获批一线治疗晚期胃癌的PD-L1抗体,其在GEMSTONE-303研究中显示出显著的临床获益。
浙江省肿瘤医院杜义安教授团队诊治了一例进展期晚期胃癌合并幽门梗阻的患者,展现了舒格利单抗联合放化疗的转化潜力。团队成员叶泽耀教授分享了该病例的详细诊疗过程:患者初诊时已出现明显进食受限,经胃空肠营养管置入改善营养状况后,接受舒格利单抗联合化疗,4周期后疗效评估为部分缓解(PR),胃镜复查示梗阻情况明显改善,患者恢复经口进食。随后MDT团队进一步优化治疗策略,考虑到肿瘤体积缩小,局部病灶明显减轻,患者具备手术机会。经充分评估后,患者接受了根治性手术,术后病理提示肿瘤降期。目前患者原方案继续化疗,治疗过程中未出现严重不良反应。【肿瘤资讯】将此病例诊疗过程整理如下,并邀请浙江省肿瘤医院杜义安教授对病例进行点评总结,以飨读者。
浙江省肿瘤医院胃外科
中国抗癌协会肿瘤胃病学专委会青年委员
浙江省医师协会肿瘤MDT专委会青年委员会青年委员
浙江省抗癌协会肿瘤微创诊治专委会青年委员会青年委员
浙江省抗癌协会肿瘤营养专委会青年委员会青年委员
浙江省数理医学会肿瘤热疗专委会委员
浙江省医师协会肿瘤MDT专委会秘书
浙江省肿瘤质控中心肿瘤外科专家组秘书
《胃肠肿瘤手术学》编委
《肿瘤整合医学病例精萃》编委
以第一作者身份发表SCI及核心期刊论文十余篇
主持及参与多项省级及厅局级课题。
第二届中国胃癌领域中青年医师挑战赛全国总冠军,2019西湖杯登峰之旅消化道肿瘤菁英赛冠军,2020、2021西湖杯登峰之旅肿瘤MDT菁英赛胃癌组冠军,CSCO 2020全国中青年胃癌MDT大赛季军,第七届协和杯腹腔镜胃癌手术3D视频大赛全国总决赛优胜奖,第五届“钱潮杯”肿瘤微创手术视频精英赛亚军,2024CACA胃癌整合诊疗康复训练营一等奖
病例简介
基本情况
患者,男性,59岁。
主诉:上腹部饱胀1月。
现病史:患者于1月前上腹部饱胀,伴呕吐,呕吐有胃内容物。 2024-5-20当地胃镜示:考虑胃恶性肿瘤伴梗阻;见胃窦巨大溃疡,黏膜肿胀糜烂,累及幽门,胃内大量食糜潴留。病理:(胃窦)低分化腺癌。
神清,精神可,胃纳可,大小便无殊,体重1月来减轻3kg。
查体:PS 1分,双侧锁骨上未及肿大淋巴结,上腹部轻压痛,无反跳痛,移动性浊音(-),直肠指检(-)。
NRS 2002营养评分2分,BMI 23.53。
既往史无殊。
辅助检查
肿瘤标志物:CA724 18.6 U/ml;AFP 133 ng/ml;CEA 5.13 ng/ml;CA199 34.3 U/ml。
胃镜:胃内大量潴留,胃窦溃疡,伴僵硬感,幽门变形,胃镜难以通过(图1)。
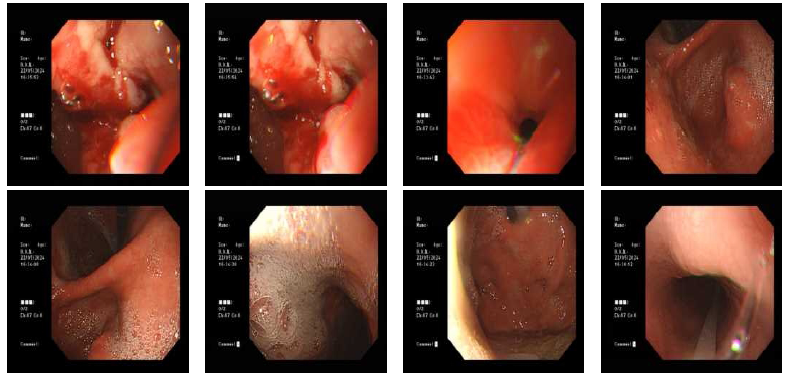
图1. 入院后胃镜结果
胃镜病理:(胃窦)低分化腺癌。
免疫组化:hMLH1(+)、hMSH2(+)、hMSH6(+)、PMS2(+)、Her2(1+)、PD-L1(22C3)(CPS=5)、EBER(-)、Claudin18.2(+~++,约5%)、CgA(-)、Sy(-)、INSM1(-)、GPC3(-)、AFP(-)、Hepa(-)、SALL4(-)。
胃增强CT(2024-5-21):胃窦占位,考虑胃癌,弥漫浸润型。T分期:与胆囊、胰腺局部分界不清;N分期:(小弯侧、幽门上/下、胰头周围),>7,最大短径3.1cm;腹膜后多发小淋巴结影,大者短径约0.6cm。
诊断与分期
胃恶性肿瘤cT4bN3Mx,IVA期;
幽门梗阻。(图2)
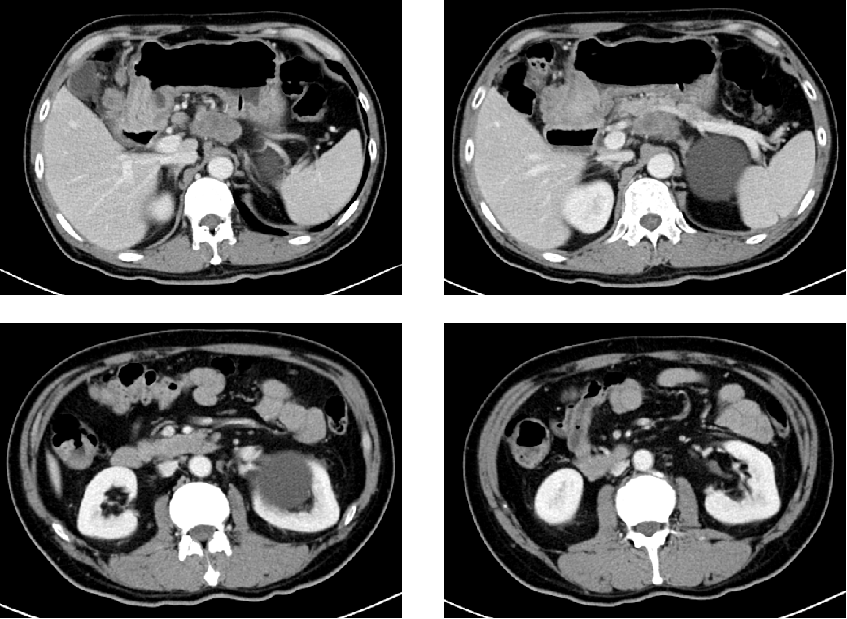 图2. 2024-5-21胃增强CT
图2. 2024-5-21胃增强CT
诊疗经过
腹腔镜探查+胃空肠短路术(2024-5-24):行腹腔镜探查+胃空肠短路术,术中所见及手术范围:腹腔部分粘连,肿瘤位于胃窦,呈浸润溃疡型,已侵出浆膜,侵及胰头胰腺组织,幽门梗阻,近端胃呈梗阻扩张状,胃壁水肿明显。肝圆韧带、小网膜囊、结肠系膜、横结肠、腹膜、盆腔、网膜未见明显结节,胃上部大弯侧胃壁软,留取腹水脱落细胞学检查,遂行胃空肠短路捷径手术。
胃增强CT(2024-6-12):对比2024-5-21 CT,胃癌短路后改变,疾病整体较前相仿;胃周淋巴结部分较前增大。肠系膜、腹膜后多发淋巴结,较前饱满(图3)。
诊断:胃癌T4bN3M1。
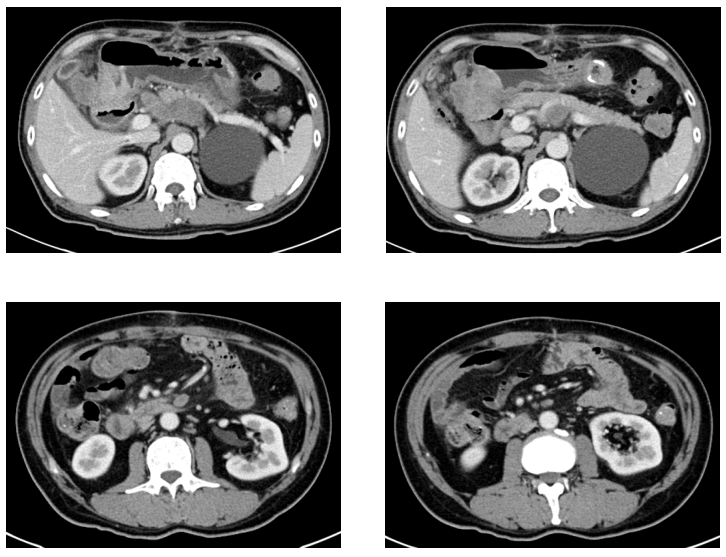
图3. 2024-6-12胃增强CT
一线治疗
治疗方案为胃SOX联合舒格利单抗(PD-L1抑制剂)。治疗包括四个周期,分别于2024-6-13、2024-7-5、2024-7-26和2024-8-16进行。治疗过程中,患者出现了一级神经毒性和一级消化道反应。第四周期时,患者出现三度骨髓抑制,血小板计数降至40×109/L。经过升血小板治疗后,患者病情好转。此外,患者口服营养补充(ONS)进行营养支持治疗。
胃CT(2024-7-24):对比前片2024-6-12胃增强CT,胃癌治疗后、胃肠短路术后,疾病整体较前好转。肠系膜、腹膜后多发淋巴结,肠系膜根部一枚Se8Im35较前明显缩小,考虑转移,余较前相仿(图4)。
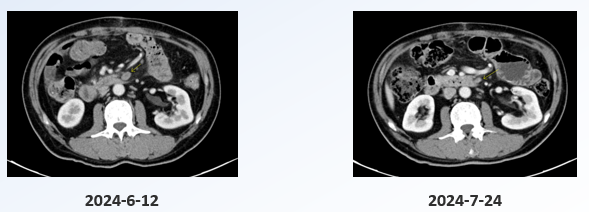 图4. 2024-7-24疗效评估
图4. 2024-7-24疗效评估
胃CT(2024-9-10):对比前片2024-7-24胃专科CT,胃肠短路术后改变;胃窦、幽门部胃壁增厚较前相仿,胃周多发淋巴结部分较前增大,腹主动脉旁转移淋巴结部分较前增大(图5-10)。肝右叶门脉期稍低密度小结节,部分较前新见、部分较前饱满,需警惕转移可能,请结合MR。
肝增强MR(2024-9-21):胃短路术后改变;CT提示可疑结节,MRI未见显示,请复查。
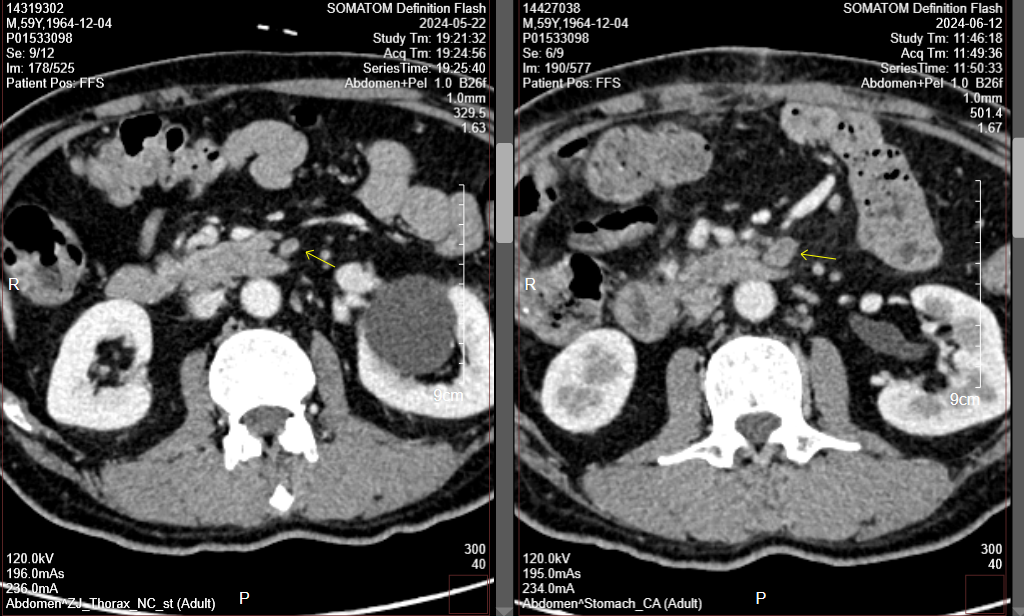
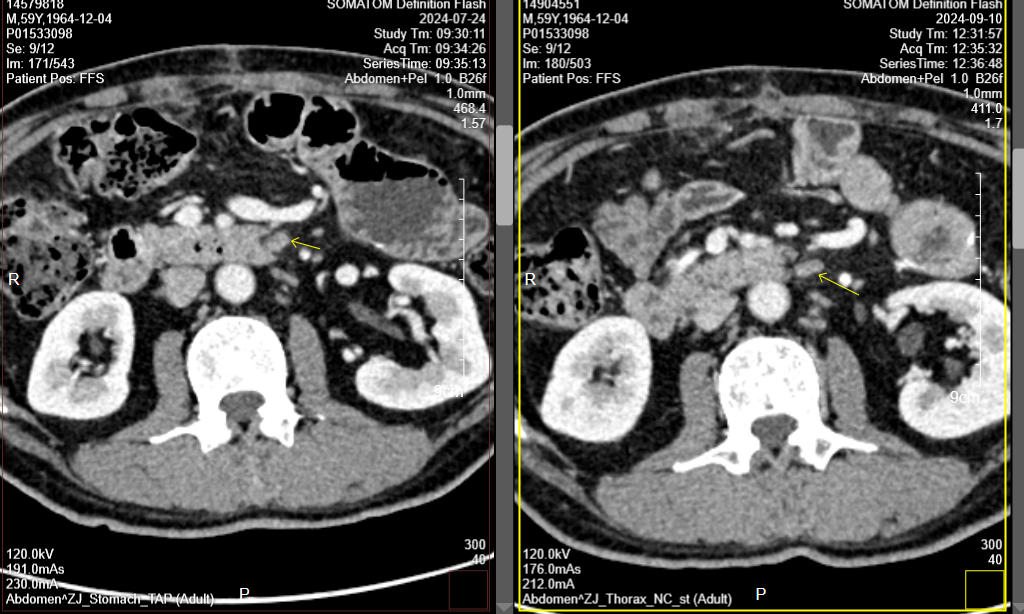
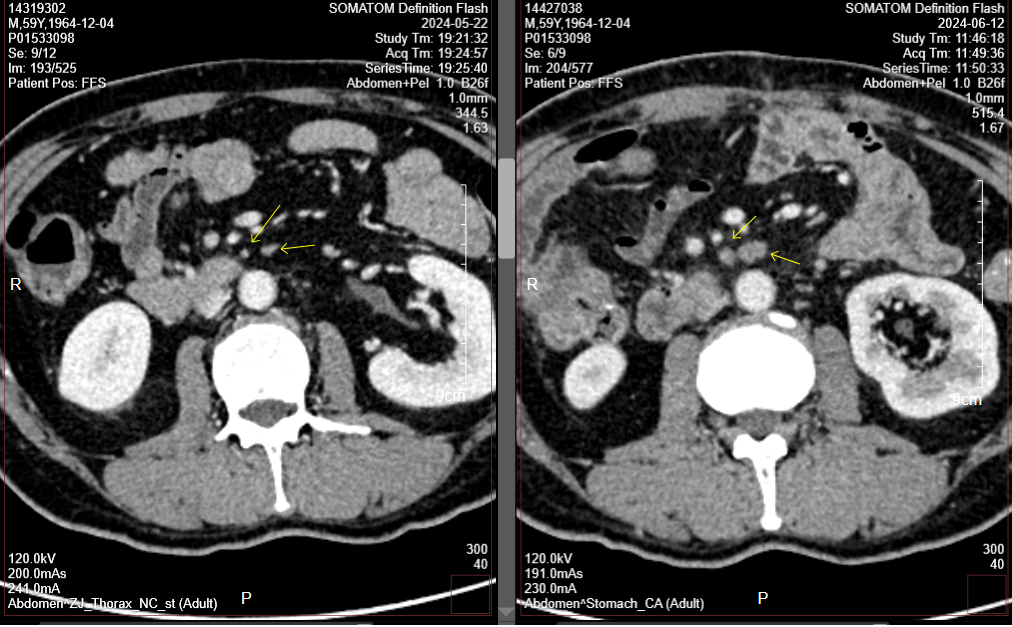
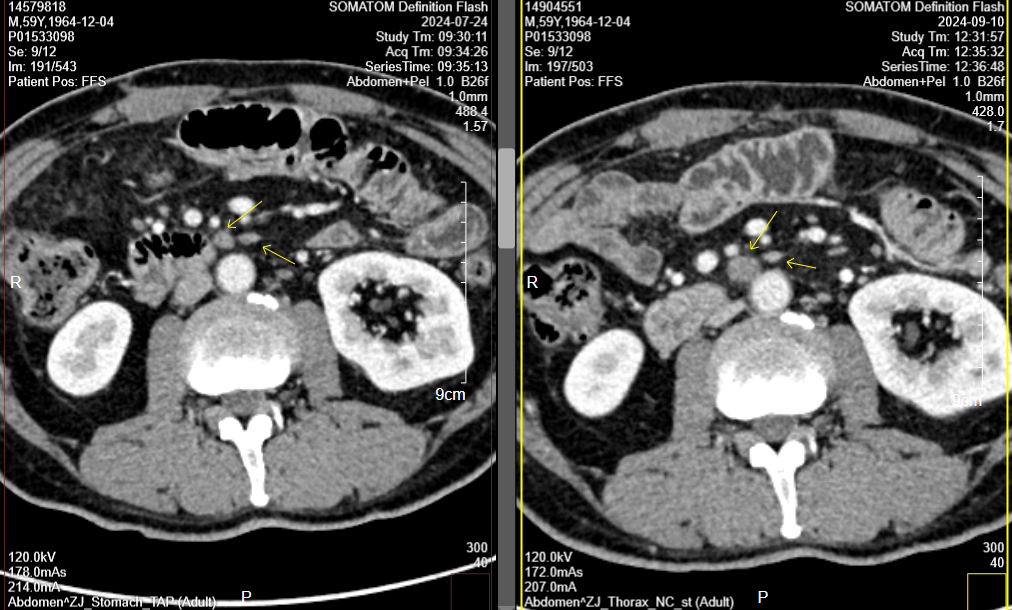
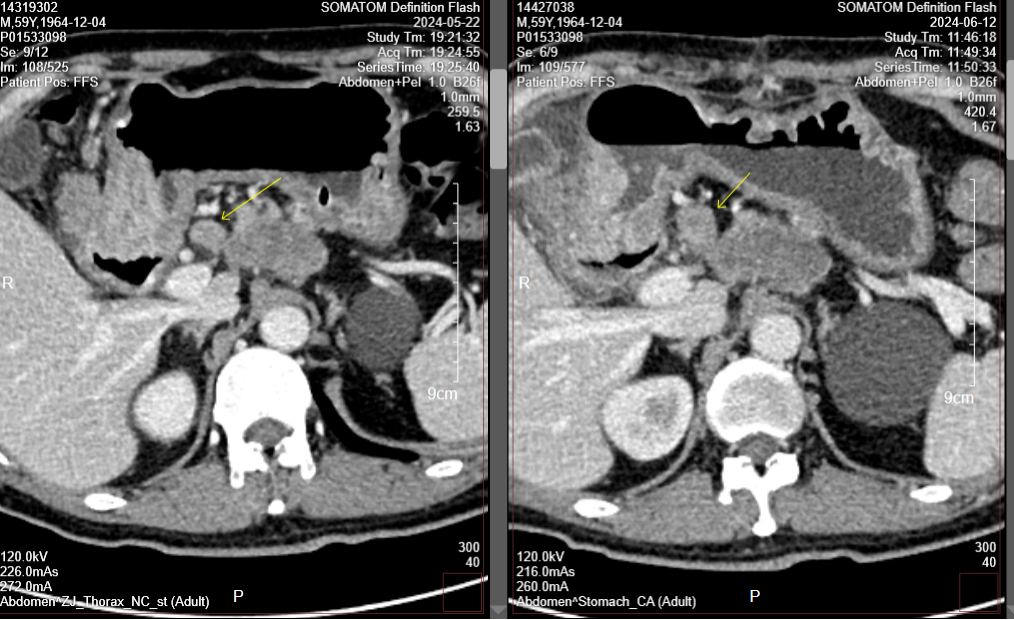
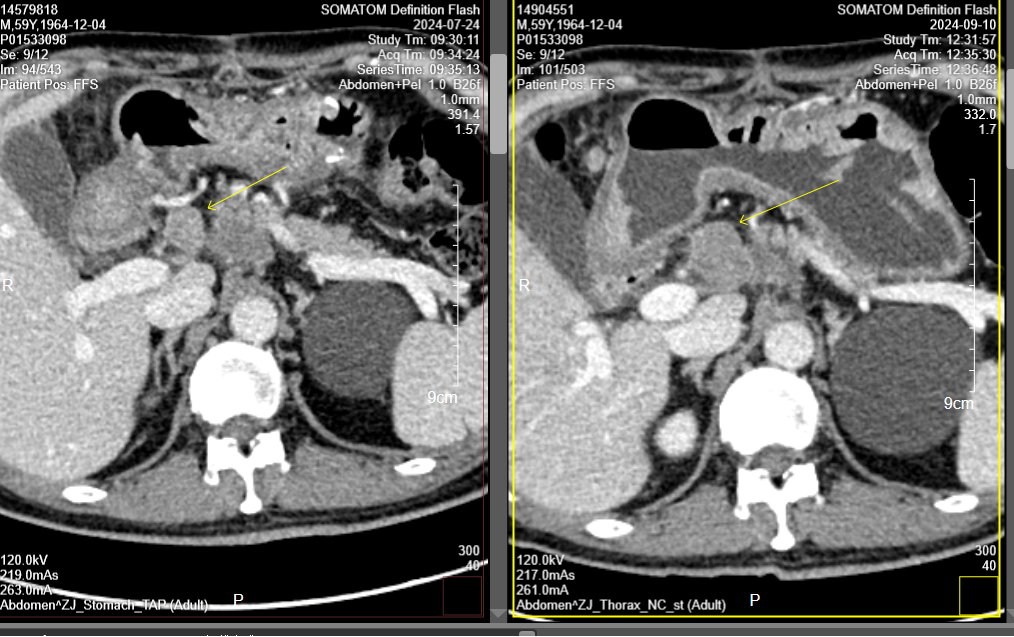 图5-10. 2024-9-10疗效评估
图5-10. 2024-9-10疗效评估
二线治疗
经MDT讨论后,于2024-9-19开始接受放疗。放疗靶区包括胃窦、幽门部原发灶以及胃周、腹主动脉旁淋巴结引流区。放疗采用VMAT技术,处方剂量为95%PTV 4500cGy/25F,共进行25次放疗,于2024-10-23结束。患者于2024-9-26开始接受二线化疗,具体方案为白蛋白紫杉醇联合卡培他滨及舒格利单抗。
胃CT(2024-11-13):对比前片2024-9-10 胃专科CT,胃窦、幽门部胃壁增厚较前缩小,胃周、腹主动脉旁多发转移淋巴结,较前缩小;胃肠短路术后改变(图11)。
 图11. 2024-11-13胃CT
图11. 2024-11-13胃CT
转化手术
经过第三次MDT讨论,患者的疗效评估为部分缓解(PR),提示治疗有效。基于此,团队认为患者存在转化为可手术治疗的可能,并决定为患者安排手术治疗。
远端胃癌根治术+腹膜后淋巴结清扫术(2024-11-19):术中探查:腹腔内结肠及大网膜与脾周粘连,Douglas窝无转移癌结节。胃空肠短路状态,腹主动脉旁肿大淋巴结,肿瘤位于胃窦部,呈浸润溃疡型,侵出浆膜,侵犯胰腺,胃周可及肿大淋巴结,呈治疗后退缩样改变,决定行开腹胃癌根治术,远端胃大部切除+D2淋巴结清扫术,BillrothⅡ吻合术,腹膜后淋巴结清扫术。
手术病理检查(2024-11-26):化疗后低分化腺癌残留(少量),伴纤维组织增生及炎症细胞浸润,符合治疗后改变。瘤床大小4.5cm×4.0cm×2.5cm,NCCN退缩评分1(中等退缩)。
淋巴结:共计23枚,均未见癌转移,部分淋巴结及周围组织见坏死、组织细胞反应及胆固醇结晶沉积,提示治疗后改变。
大网膜:纤维、脂肪组织,无明显肿瘤残留。
 图12. 患者术后病理
图12. 患者术后病理
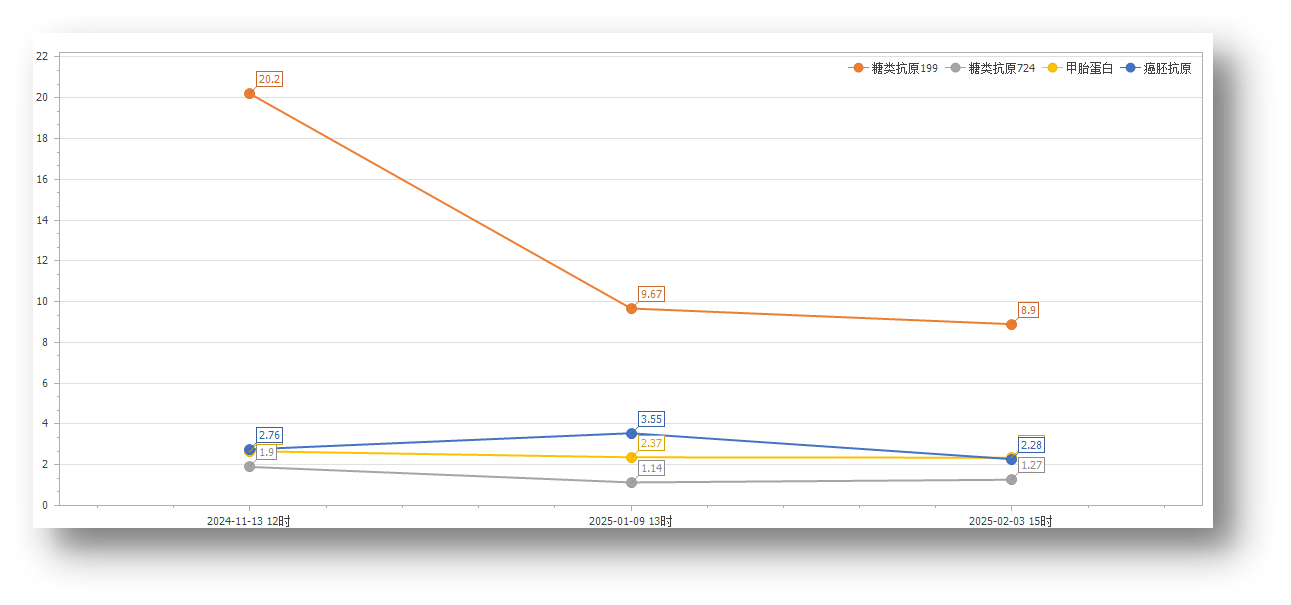 图13. 患者术后肿瘤标志物变化
图13. 患者术后肿瘤标志物变化
术后治疗
患者手术后恢复顺利,顺利出院。为了巩固治疗效果,患者在2024-12-30、2025-2-3以及2025-2-24继续接受白紫联合卡培他滨及舒格利单抗方案的化疗。
患者目前PS 1分,生活质量可,OS 10个月。
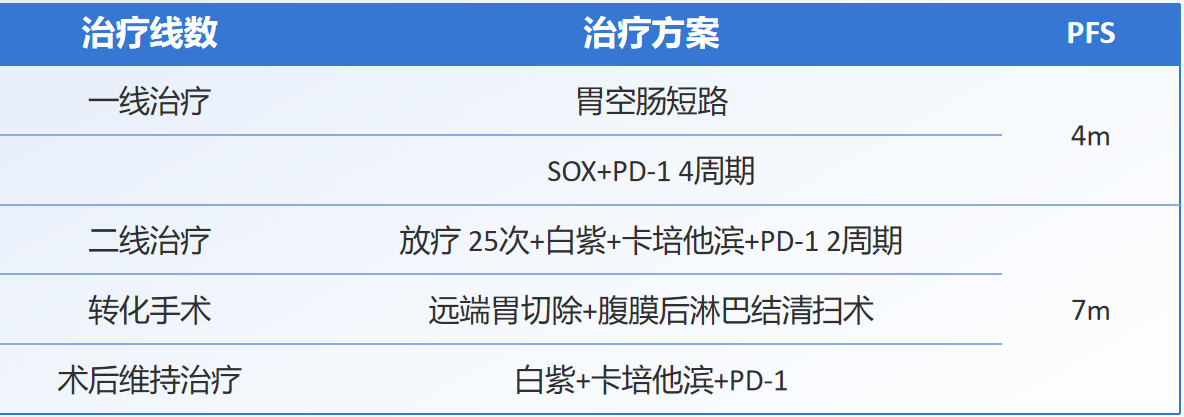
图14. 患者治疗详情
病例总结
该59岁男性患者因上腹部饱胀伴呕吐就诊,胃镜及病理检查确诊为胃窦低分化腺癌,伴幽门梗阻,分期cT4bN3Mx IVA期。行腹腔镜探查+胃空肠短路术后,接受SOX联合舒格利单抗的围手术期治疗4周期,后因疾病进展,行放疗及白蛋白紫杉醇联合卡培他滨及舒格利单抗的二线治疗。治疗后疗效评估为PR,经MDT讨论,患者肿瘤负荷明显下降,局部控制良好,患者具备了手术机会,遂行远端胃癌根治术+腹膜后淋巴结清扫术,术后病理提示治疗反应中等退缩,淋巴结无转移。术后患者继续接受白蛋白紫杉醇联合卡培他滨及舒格利单抗维持化疗,以巩固疗效并降低复发风险。目前,患者PS 1分,自一线治疗起已生存10个月,状态良好。
浙江省肿瘤医院 胃外科副主任
浙江省数理医学学会胃癌专业委员会主任委员
浙江省抗癌协会肿瘤微创诊治专业委员会副主任委员
中国抗癌协会肿瘤胃病学专业委员会常委
中国抗癌协会胃肠间质瘤整合康复专业委员会常委
中华全科医师学会全国贲门癌专业委员会常委
浙江省肿瘤微创联盟胃癌专业委员会副主任委员
浙江省医师协会肿瘤外科分会常委
浙江省抗癌协会胃肿瘤外科专业委员会 常委
浙江省抗癌协会肿瘤营养与支持专业委员会常委
浙江省抗癌协会胃癌专业委员会 委员
浙江省抗癌协会胃肠道间质瘤专业委员会委员
病例点评
胃癌,作为全球常见的恶性肿瘤之一,尤其在东亚地区高发,给患者带来了极大的生存挑战。2020年全球癌症统计数据显示,中国胃癌新发病例47.8万,占全球新发病例43.9%,死亡病例37.3万,占全球死亡病例48.5%[1]。尽管化疗在晚期胃癌治疗中占据主导地位,但其疗效往往有限,患者生存期较短。因此,探索新的治疗手段,尤其是免疫治疗,成为了胃癌治疗的热点。
随着免疫治疗的发展,尤其是PD-1/PD-L1抑制剂的应用,胃癌治疗取得了显著进展。然而,尽管免疫治疗逐渐成熟,仍然只有部分患者能够从中获益。如何精准筛选免疫治疗的受益者,成为了当前临床治疗中的重要课题。
本病例是一例59岁男性进展期胃癌患者(cT4bN3Mx IVA期),伴幽门梗阻,CPS=5,在综合治疗策略下取得了较好的临床获益。在MDT的综合决策下,患者接受SOX联合舒格利单抗的围手术期治疗,尽管在初始治疗后疾病进展,但通过放疗联合白蛋白紫杉醇、卡培他滨及舒格利单抗的二线治疗,实现了肿瘤负荷的显著降低,为手术创造了条件。最终,患者成功接受远端胃癌根治术+腹膜后淋巴结清扫术,术后病理提示治疗反应中等退缩,淋巴结无转移,进一步验证了该综合策略的转化治疗潜力。术后,患者继续接受免疫联合化疗维持治疗,目前PS评分1分,生活质量良好,总生存期(OS)已达10个月。该病例充分体现了舒格利单抗联合化疗和放疗在转化治疗中的应用价值,成功将原本不可切除的进展期胃癌降期至可手术状态,提高了患者的长期生存机会。
舒格利单抗作为一款创新性的PD-L1单克隆抗体,近年来在胃癌治疗中展现了优异的疗效。GEMSTONE-303研究是全球首个将PD-L1表达水平(CPS≥5)作为筛选标准,探索舒格利单抗联合化疗(CAPOX)治疗晚期胃癌的一线治疗方案,并在国际顶级期刊JAMA上发表,充分证明了这一治疗策略的临床价值[2]。
该研究的主要终点为无进展生存期(PFS)和总生存期(OS)。结果显示,舒格利单抗联合CAPOX治疗组在PFS和OS方面均显著优于安慰剂组,尤其在CPS≥10的患者中,PFS和OS的获益更为显著。具体数据表明,舒格利单抗联合化疗组的中位PFS为7.6个月,明显优于安慰剂组的6.1个月(HR=0.66,P<0.001)。此外,OS方面,舒格利单抗治疗组为15.6个月,而安慰剂组为12.6个月(HR=0.75,P=0.006)。在PD-L1 CPS≥5的患者中,舒格利单抗联合化疗组的客观缓解率(ORR)高达68.6%,显著优于安慰剂组的52.7%,且中位缓解持续时间(DoR)也更长,分别为6.9个月和4.6个月,在PD-L1 CPS≥10患者ORR则高达71.4%。亚组分析进一步显示,在PD-L1 CPS≥10的患者中,舒格利单抗联合化疗组的中位OS延长至17.8个月,对照组为12.5个月;中位PFS也达到7.8个月,对照组为5.5个月。进一步验证了这一方案在临床中的优越性。进一步验证了这一方案在临床中的优越性。
GEMSTONE-303研究的成功不仅在于其在治疗晚期胃癌中的突破性进展,更在于其精准筛选患者的策略。研究结果表明,PD-L1表达水平较高(CPS≥5)的患者更有可能从免疫治疗中获得显著的生存获益。这一发现对于临床应用具有重要意义,能够帮助医生根据生物标志物指导治疗决策,避免免疫治疗的不必要浪费,同时提升患者的获益率。
舒格利单抗通过独特的双重抗肿瘤机制,展现了其卓越的疗效。作为一款全人源的PD-L1单克隆抗体,舒格利单抗不仅能够通过Fab段结合肿瘤细胞表面的PD-L1,抑制PD-1/PD-L1信号通路,恢复T细胞的抗肿瘤功能,还能通过Fc段与巨噬细胞表面的FcγR结合,激活抗体依赖的细胞介导的吞噬作用(ADCP),进一步增强免疫系统的抗肿瘤作用[3, 4]。此外,舒格利单抗的创新之处还在于它能够避开抗体依赖的细胞介导的细胞毒作用(ADCC),减少副作用的发生,从而进一步提高其治疗的安全性和耐受性。
舒格利单抗作为全球首个基于PD-L1 CPS≥5生物标志物获批的晚期胃癌一线治疗药物,为胃癌患者提供了精准免疫治疗的新选择。通过GEMSTONE-303研究,舒格利单抗联合化疗的疗效得到了充分验证,特别是在PD-L1高表达的患者群体中,展现了显著的生存获益。
未来,随着更多临床数据的积累,免疫治疗将在胃癌治疗中发挥越来越重要的作用,尤其是在精准筛选获益人群及优化联合治疗策略方面。本病例的成功治疗进一步验证了舒格利单抗在晚期胃癌中的临床价值,体现了免疫治疗联合化疗在提高患者生存获益方面的潜力。通过精准筛选PD-L1高表达(CPS≥5)患者,并结合围手术期免疫治疗、化疗及放疗,该病例实现了肿瘤负荷显著降低,并最终完成了手术转化,为晚期胃癌患者提供了新的治疗思路。此外,多学科团队(MDT)的介入在治疗方案的优化中发挥了关键作用,强调了个体化治疗在胃癌管理中的重要性。未来,随着舒格利单抗更多临床数据的积累和应用推广,免疫治疗联合策略有望成为晚期胃癌患者的重要治疗选择,助力更多患者获得长期生存获益。
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3):209-249. doi: 10.3322/caac.21660. Epub 2021 Feb 4. PMID: 33538338.
2. Zhang X, Wang J, Wang G, Zhang Y, Fan Q, Lu C, Hu C, Sun M, Wan Y, Sun S, Wang J, Zhang L, Shu Y, Luo J, Zhu D, Shen Z, Yao S, Shi Q, Yang J, Shen L; GEMSTONE-303 Investigators. First-Line Sugemalimab Plus Chemotherapy for Advanced Gastric Cancer: The GEMSTONE-303 Randomized Clinical Trial. JAMA. 2025 Feb 24:e2428463.
3. Abdin SM, Zaher DM, Arafa EA, Omar HA. Tackling Cancer Resistance by Immunotherapy: Updated Clinical Impact and Safety of PD-1/PD-L1 Inhibitors. Cancers (Basel). 2018 Jan 25;10(2):32.
4. Gül N, van Egmond M. Antibody-Dependent Phagocytosis of Tumor Cells by Macrophages: A Potent Effector Mechanism of Monoclonal Antibody Therapy of Cancer. Cancer Res. 2015 Dec 1;75(23):5008-13.
排版编辑:肿瘤资讯-ZLG











 苏公网安备32059002004080号
苏公网安备32059002004080号


