第一期:认识新对手,恶性血液病中的IDH1突变-机制篇
第二期:认识新对手,恶性血液病中的IDH1突变-AML治疗篇
本期目录(第三期)
● IDH1突变MDS的疾病特点
● IDH1突变对MDS预后的影响
● IDH1突变MDS患者治疗现状
● 新型疗法艾伏尼布用于IDH1突变MDS治疗
骨髓增生异常综合征(MDS)是一组起源于造血干细胞的异质性髓系克隆性疾病,其特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少,高风险向急性髓系白血病(AML)转化1。根据流行病学数据统计,全球人群中MDS的发病率正在逐年上升2。中国上海年平均新发发病率为1.51/10万人,MDS多见于老年人,18-34岁、35 - 59岁、≥60岁人群年发病率分别为0.34/10万人、1.09/10万人、3.97/10万人3。与西方国家相比,包括中国在内的亚洲患者更多地分布在中、高、极高危人群中4。
IDH1突变MDS的疾病特点
随着近年来基因组测序在血液病领域的广泛应用,我们对包括IDH1在内的许多基因突变有了更加深入的认识。
不同报道中我国MDS患者中的IDH1发生率为1.73%~5.56% 5,6,7。IDH1突变在较高风险MDS中的发生率更高,且与更高的MDS疾病负荷有关8,9。其常与DNMT3A、ASXL1和SRSF2等共突变10。携带IDH1突变的高风险MDS患者更容易发生AML转化 11。尤其当IDH1作为髓系肿瘤的初始突变出现时,其往往与疾病发展有关12。
IDH1突变对MDS预后的影响
IDH1突变与MDS较短的PFS/OS有关,有研究4,13,14发现IDH1突变、染色体核型风险、IPSS-R风险是MDS的独立不良预后因素。2014年,瑞金医院与上海市第六人民医院联合完成了国内首个大样本MDS测序分析及预后模型研究。对196名MDS患者进行了下一代测序。结果表明,EZH2、IDH1/IDH2、RUNX1、STAG2和TP53突变可作为独立的不良预后因素。因此,建立了一个新的IPSS-RM系统,结合临床参数和分子信息,以更好地对MDS中的预后组进行分层。
2016年,日本一项研究15对699例MDS患者进行靶向深度测序,结果表明:FLT3、PTPN11、WT1、IDH1突变等在继发性急性髓系白血病(sAML)中富集,与更快进展为sAML和更短的OS相关。
2022年,MDS预后国际工作组(IWG-PM)报道通过研究全球24个中心新诊断的2957例MDS患者,中位随访3.8年,构建了一个基于网络的新预后评估工具(http:/mds-risk-model.com),即IPSS-M评分16,17。最新版本的IPSS-M纳入了分子基因突变(例如IDH1和IDH2),以指导MDS的风险分层和治疗决策。相较既往传统评分系统,IPSS-M更适合于基因组时代下预测MDS转白风险、无白血病生存及总生存期。
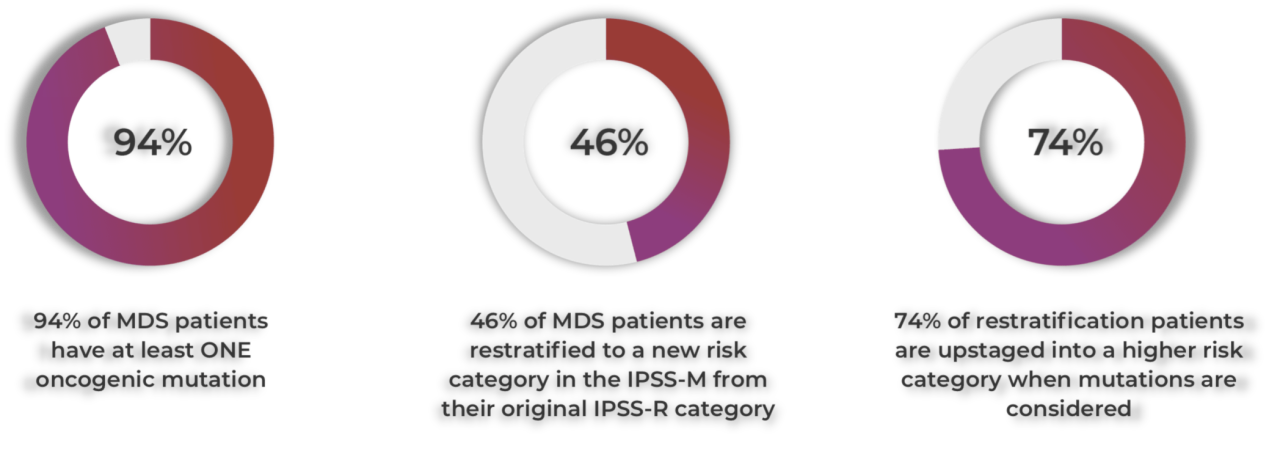
有报道显示94%的MDS患者至少有一个致癌突变。46%的患者被IPSS-M模型重新分配风险级别。当考虑到突变时,74%重新分配的患者被提升到更高的风险级别18。
IDH1突变MDS患者治疗现状
在目前的治疗模式下,IDH1突变MDS患者的生存期存在改善的空间。浙大一附院一项回顾性队列研究5纳入108例新诊断的MDS患者(6例IDH1突变),其中男64例,女44例,中位年龄54岁。染色体危险分层根据IPSS评分系统,有染色体检测结果的共106例,其中低危组72例,中危组21例,高危组13例。对低危患者主要运用支持治疗,而对高危患者运用传统化疗(如CAG、HAG、IA)或地西他滨去甲基化治疗。结果表明IDH1突变组中位OS仅165天,显著短于非突变组的740天(P=0.023)。
浙大一附院一项荟萃分析19纳入了7项研究(美国2项,德国1项,亚洲4项)共1782例MDS患者(其中111例IDH1/2突变),其中男1143例,女639例,年龄范围18-98岁。治疗方式包含低剂量化疗、联合化疗、保守和支持治疗等。结果表明:IDH1突变在总生存期的HRs为2.21(95% CI, 1.45-3.38),无白血病生存(LFS)的HRs为2.65(95% CI, 1.53-4.59),提示IDH1突变的存在是OS的不良预后因素。
新型疗法艾伏尼布用于IDH1突变MDS治疗
2023年10月FDA批准艾伏尼布片用于治疗IDH1突变的R/R MDS,该申请已获得优先审查、突破性疗法认证和孤儿药认定20。这是艾伏尼布在IDH1突变癌症领域的第五项适应症21,是第一个也是唯一一个获批的针对这一分子定义亚群中诊断为 R/R MDS 患者的靶向疗法22。IDH1抑制剂受到国内外权威指南(CSCO、NCCN等)23,24推荐用于MDS的治疗。
AG 120-C-001研究(NCT02074839)25
AG120-C-001是一项单臂、多中心、剂量递增+队列扩增研究,入组的258例恶性血液病患者中19例为携带IDH1突变的R/R MDS患者,接受艾伏尼布500 mg PO QD,中位治疗时间9.3个月,18例患者可进行疗效评价,CR率为38.9%。既往研究26结果表明,高危R/R MDS患者的中位OS持续时间为5.6个月,1年和2年OS率仅28.9%和15.3%。而在AG120-C-001研究中,中位OS持续时间为35.7个月,1年和5年OS率分别为 86.9% 和 46.3%。重要的是在基线时依赖输血的11例患者中,8例(72.7%)摆脱输血依赖。8例患者(42.1%)发生了TRAE,几乎全部为轻-中等级别,未发生因TRAE停药。基于AG120-C-001研究数据,FDA于2023年10月23日批准了艾伏尼布治疗IDH-1突变复发难治MDS成人患者的适应症20。
IDIOME研究(NCT03503409)27,28
“临床使用的去甲基化药物(HMA)如阿扎胞苷和地西他滨需要DNA复制和嘧啶补救途径的酶来合成DNA,以发挥其作用。艾伏尼布可以触发嘧啶补救途径的转录上调。因此,艾伏尼布使 IDH1突变型AML对阿扎胞苷更加敏感,从而诱导深度和持久的缓解29。”
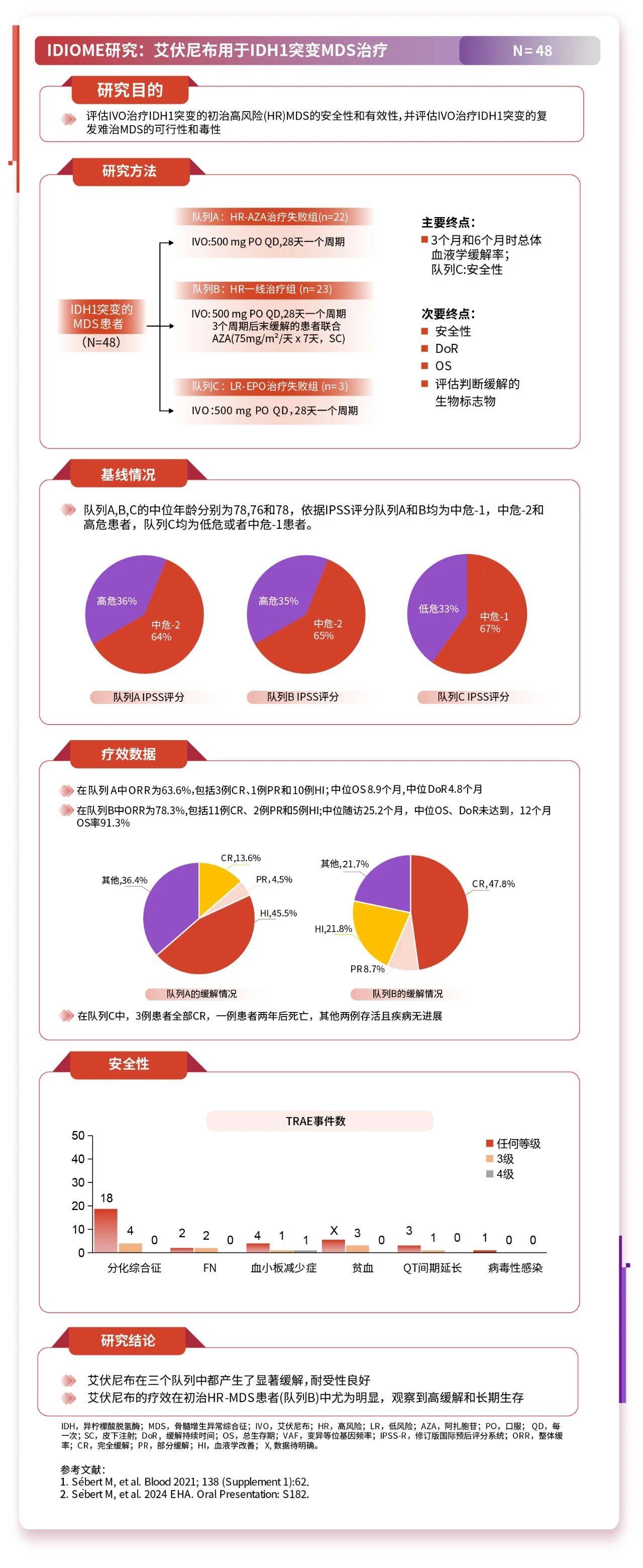
2024EHA年会公布了艾伏尼布在IDH1突变MDS人群中开展的IDIOME研究27,28的最终分析结果,为临床提供了重要参考。IDIOME研究评估了艾伏尼布在3个MDS队列中的应用情况:A队列:HR-AZA治疗失败(R/R);B队列:一线治疗HR-MDS;C队列:LR-EPO治疗失败。研究目的是评估艾伏尼布在HR-MDS队列的ORR以及在LR-EPO治疗失败队列的安全性。所有患者均接受艾伏尼布500 mg PO QD。在B队列中,若艾伏尼布治疗3个周期后未达缓解,则联合阿扎胞苷治疗。
在2019年3月至2023年2月期间,共筛选了64例患者,其中48例患者纳入研究(A、B、C队列分别为22、23和3例),其中43例患者可评价主要终点。队列A,B,C的中位年龄分别为78,76和78,队列A IPSS评分中危-2 为64%和高危36%,队列B 中危-2为65%和高危35%,队列C低危为33%,中危-1为67%。令人印象深刻的是在队列B中,ORR达到78.3%,CR率达到47.8%。mCR+HI率为17%。仅3例患者在3周期后联合AZA治疗,但未获得进一步缓解。中位随访25.2个月,中位OS和DOR均未达到,12个月OS率为91.3%。安全性:9例患者发生与治疗相关的不良事件,主要是分化综合征,在所有病例中均可逆。此研究提示,艾伏尼布单药治疗伴有IDH1突变MDS患者可实现较高的缓解率,且治疗相关的不良事件发生率低。在初治HR-MDS患者中观察到的高OR率和OS延长,表明艾伏尼布单药治疗可作为伴有IDH1突变HR-MDS患者包括HSCT候选者的一线治疗方案。
艾伏尼布+维奈克拉±阿扎胞苷用于MDS治疗30
NCT03471260是一项单臂,多中心,Ib/II期研究30,按照干预措施,研究分为4个剂量级别组。在入组31例可评价患者时,患者中位年龄67岁,其中9(29%)例患者为MDS/MPN患者。
总体人群中, Ivo+Ven±Aza 大多数(91%)不良事件为1级或2级, IVO + VEN ± AZA 的耐受性与 IVO + AZA 或 AZA + VEN 报告的耐受性相当。鉴于在 DL4(IVO + VEN 800 mg + AZA)和 DL3(IVO + VEN 400 mg + AZA)接受治疗的两名患者中观察到的长期骨髓抑制现象,因此选择了 DL3 作为推荐的第二阶段剂量。研究未达到最大耐受剂量。MDS/MPN患者的复合CR(CR+CRi+CRh)为100%,中位总生存期42个月
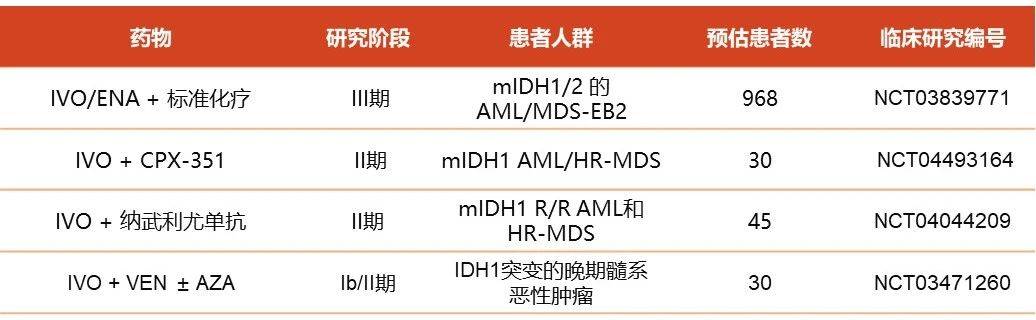
正在进行中的研究31
1. 骨髓增生异常综合征中国诊断与治疗指南(2019年版).
2. Li H, et al.Nat Rev Dis Primers,2022,8(1):74.
3. Wang W, et al. Ann Hematol. 2012 Aug;91(8):1321-2.
4. Jiang Y, et al. Cancers (Basel). 2021 Jan 27;13(3):481.
5. 佟红艳等. 中华医学杂志,2013,93(40):3180-3184.
6. 赵红玉. 山东大学, 2022.
7. 张婷. 青岛大学, 2021.
8. Wang N, et al. Acta Haematol. 2017;138(3):143-151.
9. Della Porta MG, et al. J Clin Oncol. 2016 Oct 20;34(30):3627-3637.
10. Lin CC, et al. Am J Hematol. 2014 Feb;89(2):137-44.
11. Molenaar RJ, et al. Leukemia. 2015 Nov;29(11):2134-42.
12. Miles LA, et al. Nature. 2020 Nov;587(7834):477-482.
13. Feng JH, et al. Am J Blood Res. 2012;2(4):254-64.
14. Xu Q, et al. Clin Cancer Res. 2017 Aug 1;23(15):4511-4522.
15. Makishima H, et al. Nat Genet. 2017 Feb;49(2):204-212.
16. 孙京男等.中国实用内科杂志,2023,43(07):534-539.
17. https://mds-risk-model.com/
18. Bernard E, et al NEJM Evid. 2022 Jul;1(7):EVIDoa2200008.
19. Jin J, et al. PLoS One. 2014 Jun 17;9(6):e100206.
20. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-ivosidenib-myelodysplastic-syndromes
21. https://www.drugs.com/history/tibsovo.htm
22. https://www.drugs.com/newdrugs/servier-announces-fda-approval-tibsovo-ivosidenib-idh1-mutated-relapsed-refractory-r-r-6126.html
23. 中国临床肿瘤学会指南工作委员会, 《中国临床肿瘤学会(CSCO)恶性血液病诊疗指南2024》
24. NCCN Myelodysplastic Syndromes Guideline. 2024 Version 3.
25. DiNardo CD, et al. Blood Adv. 2024 Aug 13;8(15):4209-4220.
26. Prebet T, et al. J Clin Oncol. 2011;29(24):3322-3327.
27. Sébert M, et al. Blood 2021; 138 (Supplement 1):62
28. Sébert M, et al. 2024 EHA. Oral Presentation:S182(1).
29. Gruber E, et al. Cell Rep. 2022 Aug 16;40(7):111182.
30. Lachowiez CA, et al. Blood Cancer Discov. 2023 Jul 5;4(4):276-293.
31. Ryan J. Beechinor, et al. Blood Adv 2024; 8 (15): 4207–4208.
排版编辑:肿瘤资讯-张钰晴











 苏公网安备32059002004080号
苏公网安备32059002004080号


