从2023 ASCO中探寻胰腺癌未来研究之路?
2023年美国临床肿瘤学会(ASCO)年会已于6月2日至6日盛大召开,作为目前全球规模最大、学术水平最高、最具权威的临床肿瘤学会议之一,汇集了众多世界一流的肿瘤学专家,也公布了诸多研究的最新进展结果。胰腺癌素有“癌中之王”的称号,得益于近年来的诊疗手段的进步,5年生存率已从20年前的4%提升至12%[1]。针对此次ASCO中胰腺癌领域中的相关研究进展,特别邀请北京协和医院张太平教授结合ASCO中相关热点研究为国内专家学者进行深入解读,发表个人学术观点。
见微知著
2023 ASCO胰腺癌研究热点一览
结合今年ASCO胰腺癌领域热点,张太平教授表示:“今年ASCO中胰腺癌领域的确没有取得重大的突破性进展,但从一些口头报告及壁报中仍可获得一些重要信息。在今年ASCO上公布了两项口头报告,一项是围绕新辅助治疗领域的NORPACT-1研究,令人遗憾的是最终为阴性结果;一项是NAPOLI-3研究,也是我们在晚期胰腺癌领域非常关注的研究,此前ASCO GI上已经公布了阳性总生存期(OS)和无进展生存期(PFS)数据,此次ASCO上公布了12个月和18个月生存率的结果。另外,有一项免疫抑制剂(ICIs)治疗微卫星高度不稳定/错配修复缺陷(MSI-H/dMMR)晚期胰腺癌的疗效研究。以上是今年ASCO上令我较为关注的研究。”
洞见底蕴,剖析新辅助治疗阴性结果


摘要号 LBA4005(ORAL):
Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: A multicenter randomized phase-II trial (NORPACT-1)[2]
短程FOLFIRINOX新辅助治疗vs直接手术治疗可切除胰腺头癌的多中心随机II期NORPACT-1研究
研究背景:
在其他瘤种中,新辅助治疗或可早期控制病灶,可提高R0切除率。但新辅助治疗目前在可切除胰腺癌患者中的疗效尚不清楚,因此开展该项研究探索胰腺癌新辅助治疗疗效。
研究方法:
研究纳入了2017年-2021年期间来自北欧12家中心的140例患者。可切除胰头癌患者被随机分配接受4周期FOLFIRINOX新辅助治疗,随后接受手术和8周期mFOLFIRINOX辅助治疗(新辅助组,n=77),或直接手术和12周期mFOLFIRINOX辅助治疗(直接手术组,n=63)。主要研究终点为OS。
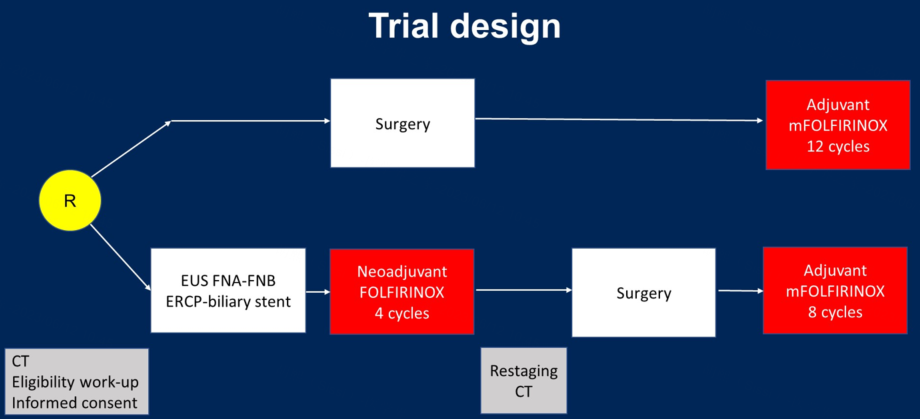
研究结果:
新辅助组和直接手术组手术切除率分别为81.8%和88.9%;治疗意向(ITT)人群中术后辅助治疗的起始率分别为66.2%和74.6%。
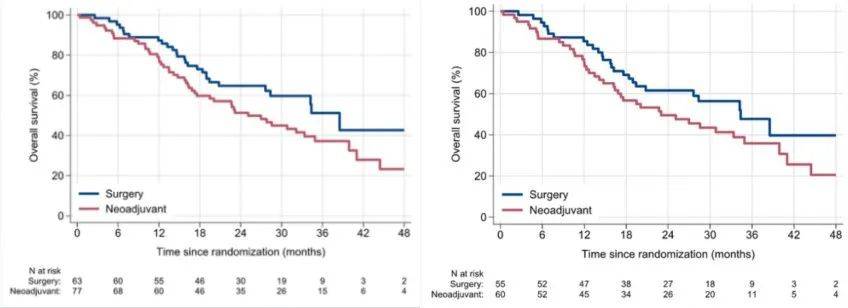
中位OS(ITT人群):新辅助组(25.1个月)vs 直接手术组(38.5个月)(HR=1.52,95%CI:0.94-2.46,p=0.096)(图2左)。
18个月生存率:新辅助组(60%)vs 直接手术组(73%)(p=0.1)。
安全性:共有120例接受至少1个周期的新辅助和辅助化疗的患者纳入安全性分析,≥3级不良事件(AE)发生率为新辅助组(57.5%)vs 直接手术组(40.4%)。
对于至少接受1周期FOLFIRINOX新辅助治疗的60例胰腺导管腺癌患者和直接手术组的55例患者进行符合方案(PP)分析显示,中位OS:新辅助组(23.0个月)vs (34.4个月)(HR=1.46,95%CI:0.89-2.41,p=0.158)(图2右)。
在PP分析中,新辅助组N0(p=0.002)和R0切除率(p=0.011)较直接手术组高。
研究结论:
与直接手术相比,新辅助FOLFIRINOX治疗未改善可切除胰头癌的OS,该项研究结果不支持新辅助化疗作为标准治疗,后期开展加入基于生物标志物的研究。但新辅助FOLFIRINOX显示出R0切除率的提高,有待进一步的随访结果来验证新辅助治疗组N0和R0切除率改善后的长期疗效。
张太平教授表示:“该项新辅助治疗研究的阴性结果确实令人较为诧异,虽然新辅助治疗与直接手术相比没能带来生存获益,但该项研究值得进行进一步分析,以指导后期临床研究。
从既往的新辅助治疗研究来看,不同的新辅助治疗方案、周期及适宜人群,可能带来了不尽相同的结果,多数新辅助治疗还是可以为患者带来获益。思考该研究阴性结果可能有以下原因,一方面在临床实践过程中进行胰头癌手术时,胰十二指肠切除对于患者的创伤较大,患者术前接受高效、毒性较大的新辅助治疗方案能否带来获益是存疑的;另一方面,患者接受手术直到可以接受辅助治疗的间隔时间较长,可能影响术后辅助治疗疗效。同时,在新辅助治疗期间,部分患者可能由可切除胰腺癌进展为不可切除的转移性胰腺癌,从而影响总生存时间。但目前该研究可以看到新辅助治疗对于R0切除率还是有一定提升,后续可进一步进行亚组分析及更长时间的随访,另外对于新辅助治疗模式还有待进一步探索,包括联合放疗等其他治疗手段来提升新辅助治疗疗效。”
“目前,NCCN指南、中华医学会指南等均未明确提出对于可切除胰腺癌进行新辅助治疗相关推荐。但是针对有高危因素的胰腺癌,如肿块较大、CA-199较高、伴有明显疼痛的临床症状、分期相对偏晚的胰腺癌患者推荐行新辅助治疗。但指南明确推荐交界可切除、局部进展期胰腺癌应该优先行新辅助治疗,对于可切除胰腺癌,应该进一步开展临床研究,探索新辅助治疗方案、周期和模式。”张太平教授补充道。
再添新证
NAPOLI-3研究为胰腺癌一线治疗提供新方案


摘要号 LBA4006(ORAL):
Liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (mPDAC): 12- and 18-month survival rates from the phase 3 NAPOLI 3 trial[3].
伊立替康脂质体+5-FU/LV+奥沙利铂(NALIRIFOX)vs白蛋白结合型紫杉醇+吉西他滨在初治mPDAC的疗效:NAPOLI-3Ⅲ期研究的12个月和18个月生存率结果
研究背景:
伊立替康脂质体+5-FU/LV已在美国、欧洲及中国获批用于治疗接受吉西他滨治疗后进展的转移性胰腺癌患者。在2023 ASCO GI上报告了NAPOLI-3研究结果,提示与Gem+NabP相比,NALIRIFOX一线治疗mPDAC具有临床意义和统计学意义OS和PFS改善。此次ASCO上公布了NAPOLI-3研究的12个月和18个月生存率结果。研究主要终点是OS,次要研究终点是PFS、客观缓解率(ORR)和安全性。
研究方法:
研究共纳入了770例未经治疗的mPDAC患者,随机分配至NALIRIFOX组(n=383)和Gem+NabP组(n=387)。
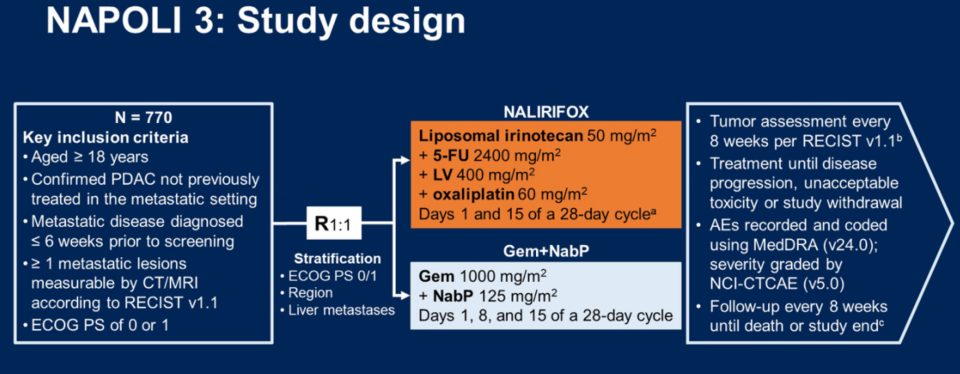
研究结果:
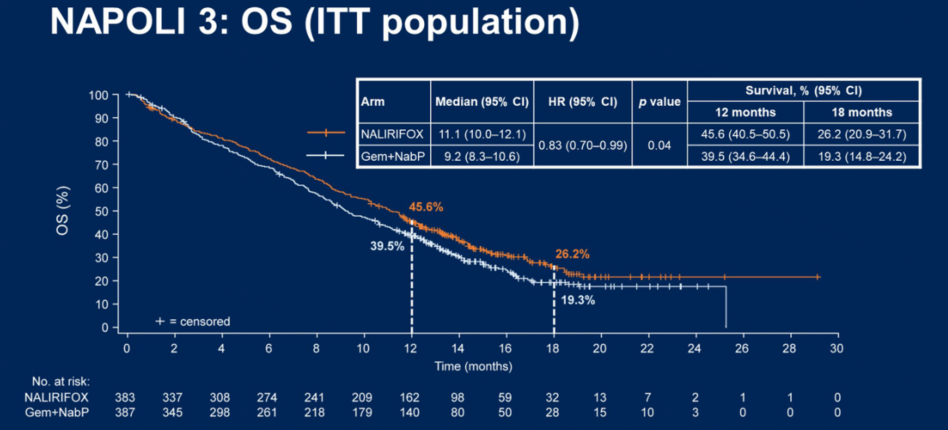
NALIRIFOX组中位OS为11.1个月,而Gem+NabP组为9.2个月,中位OS显著延长1.9个月,降低17%死亡风险(HR=0.83,95%CI:0.70–0.99,p=0.04)。
在ITT人群中,NALIRIFOX组和Gem+NabP组12个月OS率为45.6% vs 39.5%;18个月OS率为26.2%和19.3%。
NALIRIFOX组的中位PFS为7.4个月,而Gem+NabP组为5.6个月,中位PFS显著延长1.8个月,降低31%疾病进展或死亡风险(HR=0.69,95CI:0.58–0.83,p<0.0001)。
NALIRIFOX组和Gem+NabP组12个月PFS率为27.4% vs 13.9%,18个月PFS率为11.4% vs 3.6%。
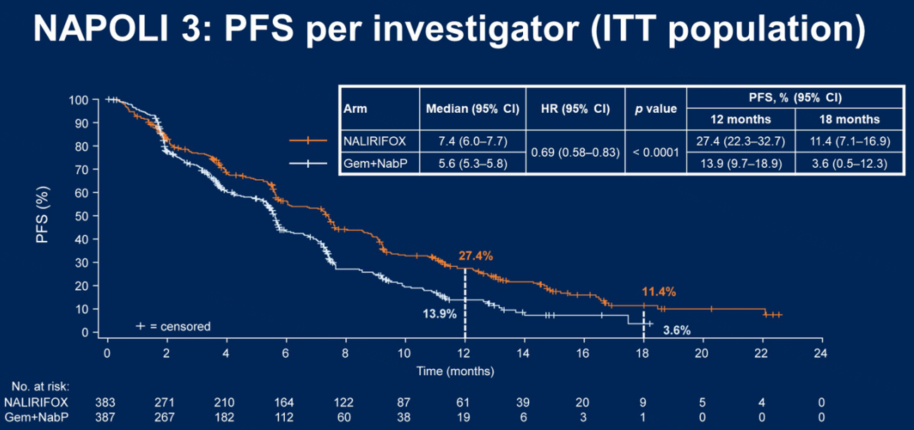
NALIRIFOX组和Gem+NabP组ORR为41.8% vs 36.2%;中位治疗持续时间(DoR)为24.3个月vs17.6个月。
安全性:NALIRIFOX组和Gem+NabP组≥3级AE的发生率相似,为87% vs 86%。
研究结论:
NALIRIFOX三药化疗方案相较于Gem+NabP两药一线治疗mPDAC具有临床意义和统计学意义OS和PFS改善。同时,NALIRIFOX方案未出现新的安全性信号,整体安全性与Gem+NabP两药方案相似,此次更新的NAPOLI-3研究12个月和18个月的生存率结果再次夯实NALIRIFOX方案一线治疗证据。
张太平教授表示:“上述研究中NALIRIFOX三药化疗方案相较于Gem+NabP两药一线治疗mPDAC具有一定优势,两组在中位OS和中位PFS数据上有统计学差异。目前化疗仍是晚期胰腺癌治疗的基石,该大型Ⅲ期研究结果也可能改变一线的治疗格局,为一线方案提供了新的有效选择”。同时张太平教授分析了伊立替康脂质体这个药物为什么能在胰腺癌中发挥疗效:“伊立替康脂质体的结构独特,与普通剂型的伊立替康相比,脂质体可通过‘高渗透、长滞留(EPR)效应’使肿瘤局部组织中药物浓度更高,同时也能延长血浆半衰期[4-5]。因此伊立替康脂质体的肿瘤生长抑制作用更强,可以在胰腺癌中发挥疗效。”
积微成著,胰腺癌免疫治疗最新证据


摘要号 4148(Poster):
Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repairdeficient advanced pancreatic adenocarcinoma: An AGEO European Cohort[6].
免疫检查点抑制剂治疗微卫星不稳定/错配修复缺陷晚期胰腺癌的疗效:一项AGEO欧洲队列研究
研究背景:
ICIs已被批准用于MSI-H/dMMR实体瘤。然而,与其他恶性肿瘤相比,MSI-H/dMMR胰腺导管腺癌(PDAC)患者的预后结局似乎较差。
研究方法:
该研究回顾性分析了从2016年2月至2022年5月,在欧洲和以色列共16个中心接受ICIs治疗,分析了31例MSI-H/dMMR型PDAC患者的疗效性和安全性数据,中位随访时间为18个月。研究终点包括中位PFS、中位OS、反应率(RR)和DCR及AE分析。
研究结果:
ORR达到48.4%;DCR达到67.7%;中位PFS为26.7个月;目前该研究的中位OS未达到;12个月和24个月的生存率分别为76.2%和64.3%。安全性方面,接受免疫治疗的患者耐受性良好,没有发生3级以上的不良事件。
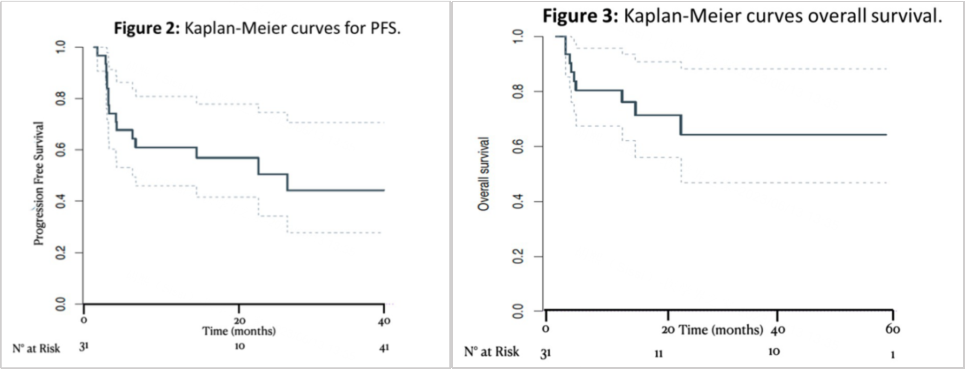
研究结论:
ICIs在MSI-H/dMMR晚期PDAC患者中疗效及耐受良好,也支持ICIs在MSI-H/dMMR晚期PDAC应用。但研究存在一定局限性,研究样本量较小,且为回顾性研究分析。在接受免疫治疗的患者中,所应用的ICIs不一,同时该研究纳入了超过5年生存的患者,可能导致数据的偏倚。
张太平教授表示:“该项免疫治疗相关研究虽然是小样本的研究,确实看到了免疫治疗在胰腺癌中的一定疗效,但免疫治疗在胰腺癌的循证医学证据仍不够充分,有待进一步大样本的随机对照、前瞻性研究来验证免疫治疗疗效。同时,MSI-H/dMMR的在胰腺癌患者占比较低,能够从免疫治疗获益的这部分胰腺癌患者占比少,免疫治疗也仍是有待进一步探索的热点。”
步履不停,未来胰腺癌如何突破生存获益
张太平教授总结道:“从此次ASCO的一些研究结果来看,我们可以得出未来胰腺癌领域探索的一些热点和方向。一是免疫治疗在胰腺癌的治疗中取得了一定突破,未来免疫治疗的应用还有待进一步探索,包括优势获益人群的筛选及免疫联合治疗模式的探索。二是近年来也开展了诸多靶向治疗相关临床试验,但是相关靶点突变在胰腺癌患者中发生率较低,胰腺癌在靶向治疗中获益的仍占少数,相信通过每一个靶点的叠加,进一步开发新型靶点及相应的靶向药物,未来能扩大胰腺癌患者精准治疗的获益人群。三是新辅助治疗,上述研究虽然没有取得阳性结果,但新辅助治疗模式有待进一步的探索。未来也包括在局晚期胰腺癌患者中转化治疗的相关探索,以期为患者带来可手术机会。
另外,未来可以从胰腺癌微环境角度开展相关研究,像透明质酸酶等相关基础研究已经有所报道,期待其在临床研究中有所突破。以及RNA疫苗应用在胰腺癌领域的相关探索也取得了初步疗效。总而言之,尽管在今年ASCO中,胰腺癌领域虽然没有看到重大突破性的研究进展,但对于临床诊疗仍具有一定的指导意义,特别是NAPOLI-3研究,可能影响晚期胰腺癌一线治疗格局。后续也期待更多新药的研发及治疗方案的探索,能进一步改善胰腺癌患者的生存获益。”
专家简介
北京协和医院基本外科主任,教授,博士生导师
中华医学会外科学分会常委兼副秘书长,外科手术学组副组长
中国研究型医院学会胰腺疾病专业委员会主任委员
中国医师协会胰腺病学专业委员会副主任委员
《中华肝胆外科杂志》、《中华胰腺病学杂志》、《中华普通外科手术学杂志电子版》和《中华肝脏手术学电子版》副主编,《中华医学杂志》、《中华外科杂志》、《中华普通外科杂志》、《中华消化外科杂志》、《中国实用外科杂志》、《外科理论与实践》、《临床肝胆病杂志》、《国际外科杂志》等杂志编委。
长期从事胰腺外科的临床与基础研究,获得国家及省部级课题20余项。发表论文及综述300余篇,参加专著和教材编写40余部,以第二、第三完成人获得国家科技进步二等奖、北京市科技进步一等奖、中华医学科技奖一等奖等奖励10余项。
[1]American Cancer Society, Cancer Facts and Figures, 2001-2023. SEER-9 and SEER-18 databases.
[2]Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: A multicenter randomized phase-II trial (NORPACT-1).2023 ASCO Abstract #LBA4005.
[3]Liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma (mPDAC): 12- and 18-month survival rates from the phase 3 NAPOLI-3 trial.2023 ASCO Abstract #LBA4006.
[4]Steichen SD, Caldorera-Moore M, Peppas NA. A review of current nanoparticle and targeting moieties for the delivery of cancer therapeutics. Eur J Pharm Sci. 2013 Feb 14;48(3):416-27.
[5]杨艳芳,等.粒径与表面电荷影响脂质体体内药物靶向递送的研究进展[J].药学学报,2013,48(11):1644-1650.
[6]Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repairdeficient advanced pancreatic adenocarcinoma: An AGEO European Cohort.2023 ASCO Abstract #4148.
本资料旨在促进医药信息的沟通和交流。本资料仅供医疗卫生专业人士作学术参考,而非针对一般公众,亦非广告宣传。处方请参考国家药品监督管理局批准的药品说明书。请勿分发或转发本资料。
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


