在肿瘤治疗领域,双特异性抗体作为一种经精妙工程改造的抗体,正逐渐崭露头角,展现出巨大的治疗潜力。其独特之处在于能同时结合两个不同靶点,通常一个是恶性细胞上的肿瘤特异性抗原,另一个是免疫细胞。凭借这一特性,双特异性抗体可巧妙激活免疫系统,触发一系列如引发细胞凋亡、增强免疫激活信号传导、减少免疫抑制因子等有利于抗肿瘤的生物学过程,这些机制协同作用,极大地促进了抗肿瘤活性。本文基于领域综述1,对双特异性抗体和细胞疗法等新型疗法展开介绍。
双特异性抗体的研究进展
早在2017年,FDA首次批准了一种用于治疗B 细胞急性淋巴细胞白血病的双特异性抗体——blinatumomab(靶向CD3和CD19)。而在乳腺癌研究领域,众多肿瘤相关抗原(TAA)成为了双特异性疗法的靶点,其中包括HER2、HER3、PD-L1和CD3 等。
HER2双特异性抗体
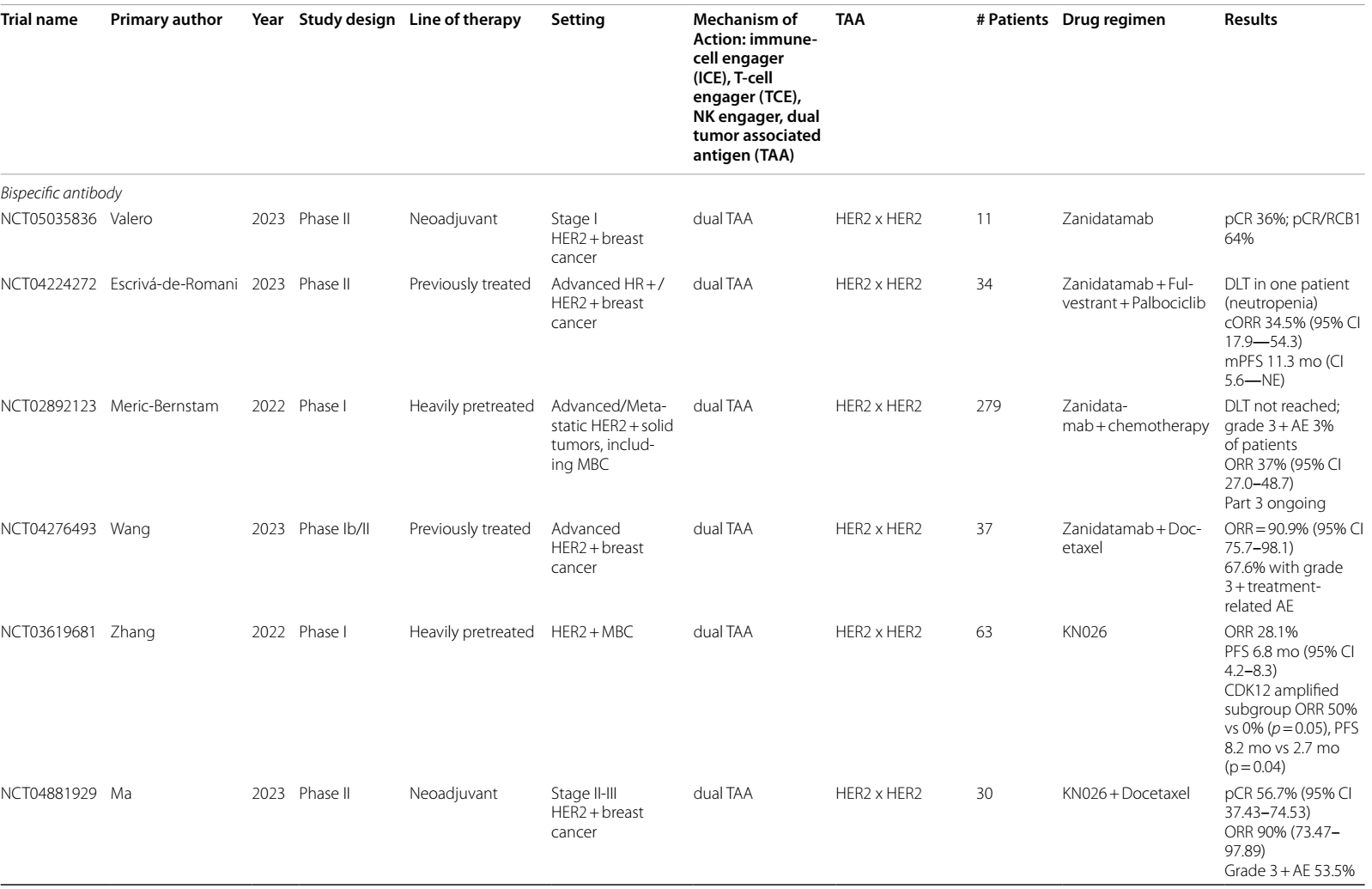
HER2 是乳腺癌中研究最为广泛的双特异性TAA之一。在相关治疗策略中,常将其与其他靶点联合,如 HER3、CD3 和 CD16 等。Zanidatamab是一种HER2双特异性抗体[靶点包括HER2 ECD4(曲妥珠单抗结合位点)和HER2 ECD2(帕妥珠单抗结合位点)],已于2024年11月获FDA批准用于治疗不可切除或转移性HER2阳性(IHC 3+) 胆道癌成人患者。并且,在晚期和早期 HER2 阳性乳腺癌(BC)的治疗中均展现出初步疗效。
在晚期BC的治疗研究中,针对HER2阳性实体瘤(涵盖BC)患者开展的zanidatamab I 期临床试验结果显示,单药使用zanidatamab 时,客观缓解率(ORR)达37%2 。在HER2阳性mBC患者中,zanidatamab与多西他赛联合使用,ORR 高达90.9%3。而对于HR+/HER2+ mBC患者,zanidatamab联合哌柏西利和氟维司群治疗方案,中位无进展生存期(PFS)达到11.3个月,ORR为34.5%4 。
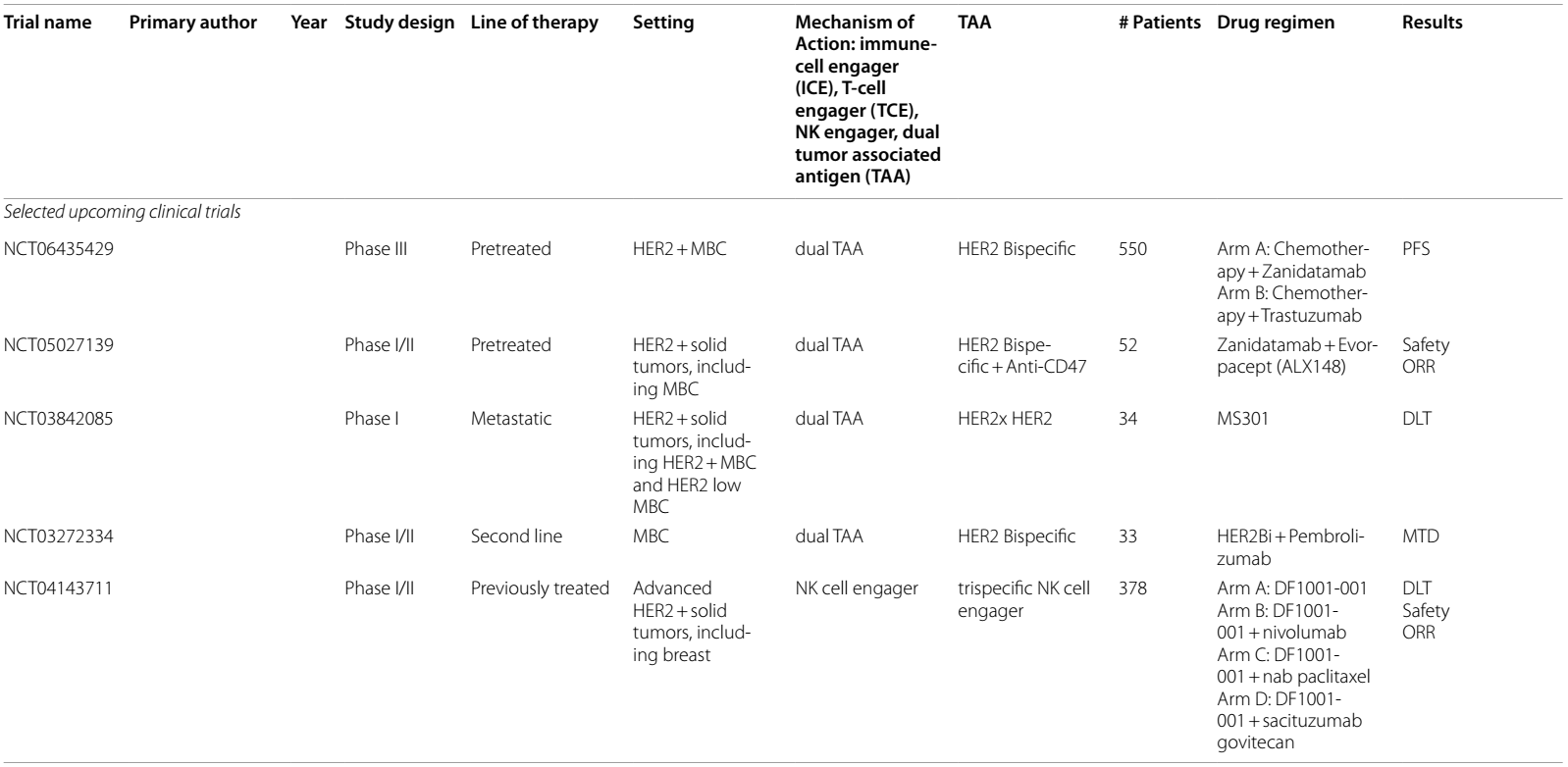
在新辅助治疗方面,针对 1 期淋巴结阴性HER2阳性BC患者,采用无化疗的zanidatamab治疗方案,初步数据表明,36%的患者达到病理完全缓解(pCR),64%的患者达到pCR或残留癌负荷 1 级(RCB-1)5。目前,一项即将开展的 III 期试验(NCT06435429),将着重探究zanidatamab或曲妥珠单抗化疗方案,用于经T-DXd治疗后病情进展的HER2阳性BC患者的治疗效果。
另一种双特异性HER2抗体KN026也在乳腺癌治疗中取得了初步成果。在针对HER2阳性mBC患者的 I 期试验中,总体ORR为28.1%,中位PFS为6.8个月。有趣的是,HER2 阳性且CDK12共扩增的患者反应更为显著,ORR达到了50%,中位PFS为8.2个月6。这可能是由于HER2和CDK12基因都位于17号染色体上,且相距约200千碱基对。
当KN026联合KN046(一种抗PD-L1/CTLA-4双特异性抗体)治疗HER2阳性mBC患者时,ORR提升至50%7。在新辅助治疗中,KN026联合多西他赛的pCR达到了56.7%8。不过,一项关于KN026联合哌柏西利和氟维司群的试验(NCT04778982)因入组人数不足而遗憾终止。此外,即将开展的一项 I 期临床试验(NCT03842085)将探究另一种双特异性HER2抗体MBS301在HER2阳性实体瘤中的疗效。
HER2×HER3双特异性抗体
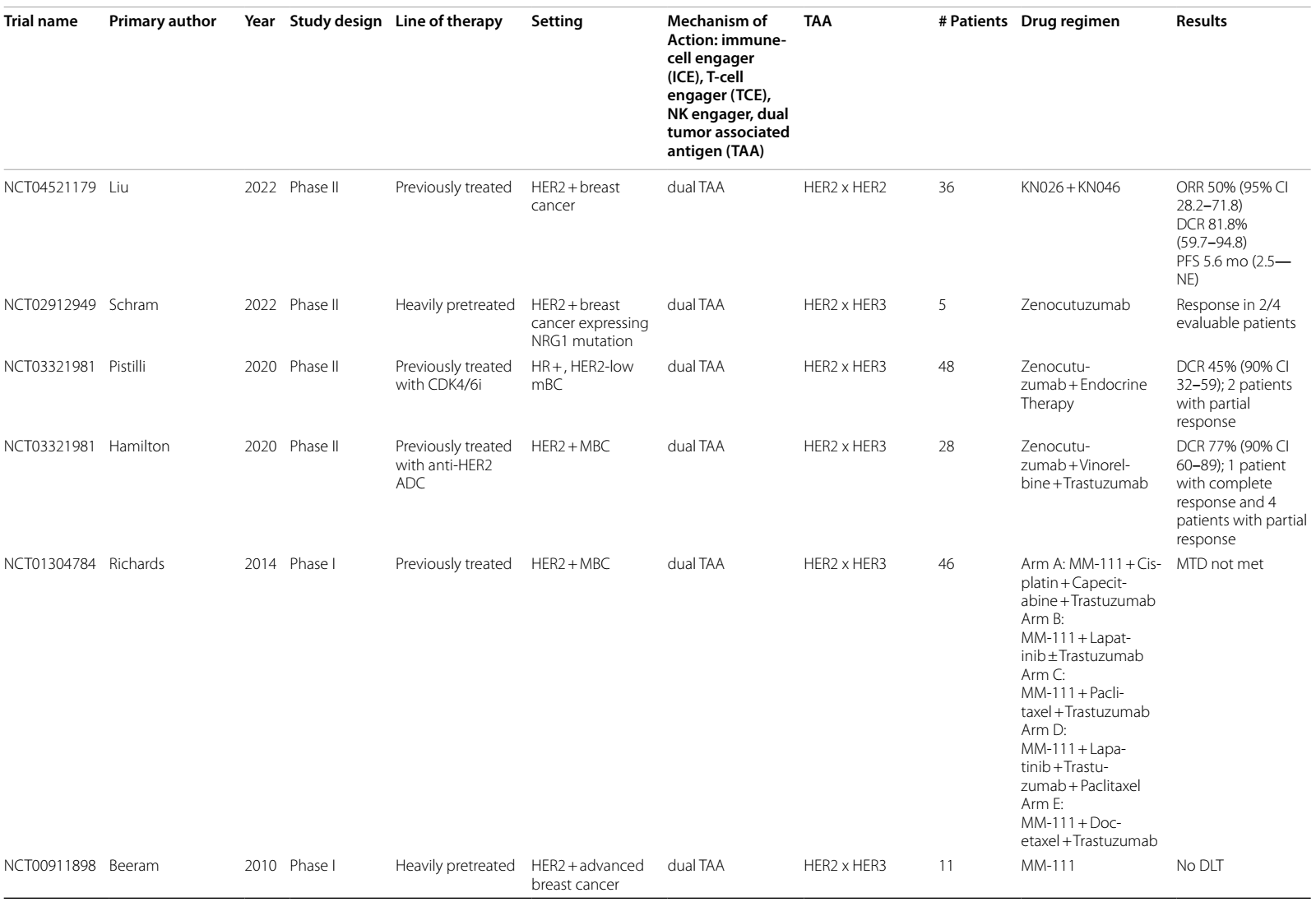
靶向HER2和HER3的双特异性抗体包括MCLA-128/Zenocutuzumab和MM-111。
Zenocutuzumab联合内分泌治疗用于既往接受过CDK4/6抑制剂治疗的HR阳性、HER2低表达的mBC患者的II期试验发现,疾病控制率(DCR)为45%9,而Zenocutuzumab联合曲妥珠单抗和长春瑞滨用于既往接受过T-DM1治疗的HER2阳性mBC患者的疾病控制率为77%10。MM-111在I期临床试验中也被证明是安全的11,12,不过尚未在II期及后续试验中进一步研究。
HER2×CD3双特异性抗体
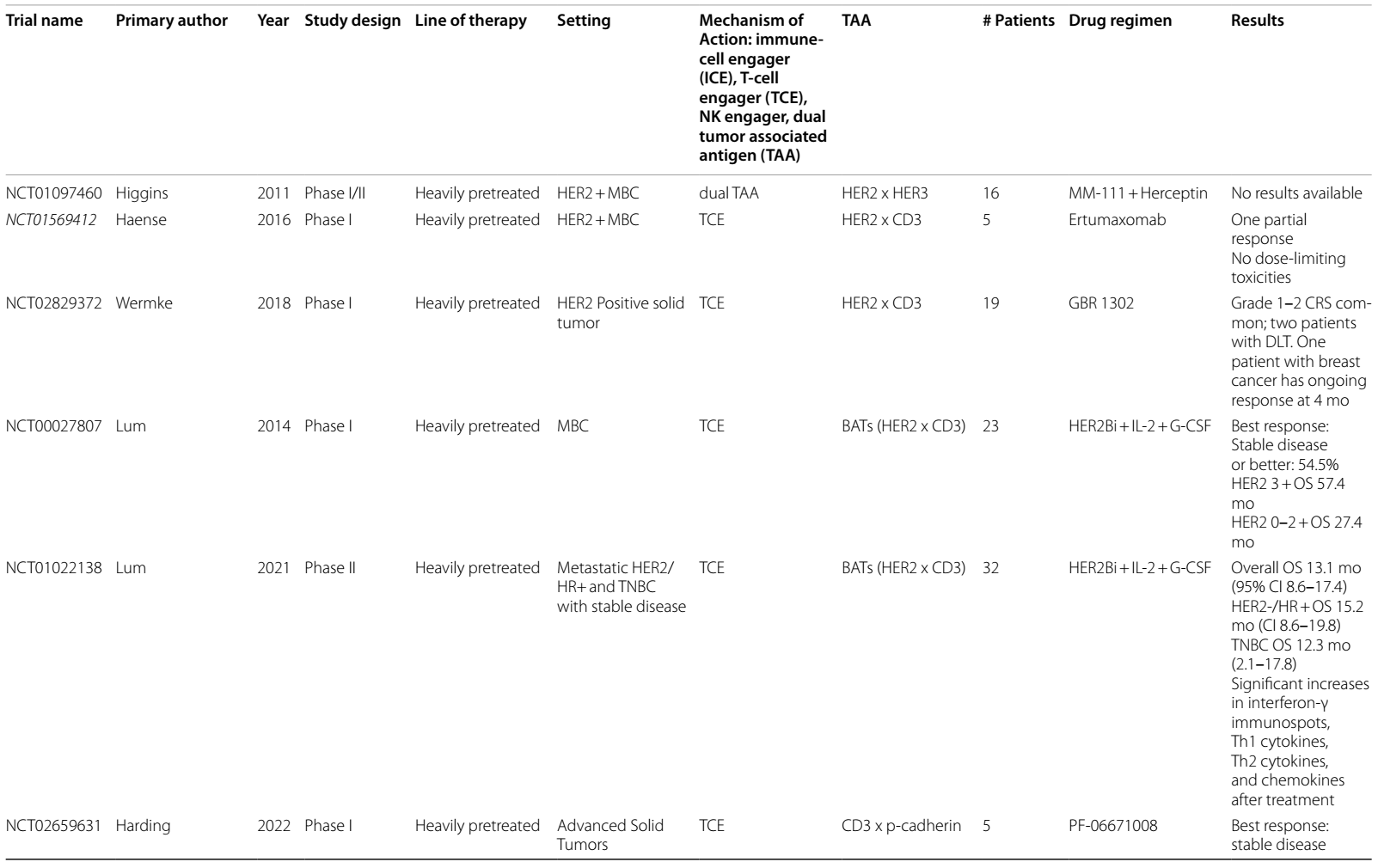
目前,处于研究阶段的 HER2 和CD3双特异性抗体有ertumaxomab13、p95HER214和GBR130215 。然而,在当前进行的临床试验中,这些抗体尚未取得进一步的进展。
在针对HER2阴性(IHC 0-2+)mBC的研究中,有一项 II 期临床试验采用了抗CD3×抗HER2 双特异性抗体武装活化的 T 细胞(HER2 BAT)进行巩固治疗。结果显示,在适应性免疫应答和先天性免疫应答中均发现了免疫激活的证据,患者的中位OS达到 13.1 个月16 。此外,一项评估 HER2 BAT 在 HER2 阳性患者中作用的 I 期临床试验,结果表明,HER2 高表达(免疫组化检测为 IHC 3+)的患者OS长于HER2表达为IHC 0-2+ 的患者(57个月 vs. 27个月)17。后续,即将开展的 I/II 期研究(NCT03272334)将对 HER2 BAT 与帕博利珠单抗的联合治疗效果展开探究。
表1 目前和即将进行的双特异性抗体治疗乳腺癌的临床试验
过继性细胞疗法:TILS, CAR-T和TCR
尽管免疫检查点抑制剂(ICIs)对乳腺癌的治疗效果产生了巨大影响,但仍有相当一部分患者无法从ICIs治疗中获益。这可能部分是由于通过抗原呈递缺陷和其他异常信号通路导致的免疫逃逸。克服这一障碍的机制包括过继性细胞转移,即把抗原特异性T细胞输注到患者体内,从而引发增强的免疫反应。
诸如肿瘤浸润淋巴细胞(TILs)、嵌合抗原受体T细胞(CAR-T)和细胞受体工程化T细胞(TCR)等治疗方法,都涉及从患者体内采集T细胞,在体外进行扩增,扩增过程中可进行或不进行基因改造,然后再将这些T细胞回输到患者体内。自2017年FDA首次批准针对B细胞急性淋巴细胞白血病的CD-19特异性嵌合抗原受体T细胞疗法以来18,细胞疗法已经改变了血液系统恶性肿瘤的治疗模式。
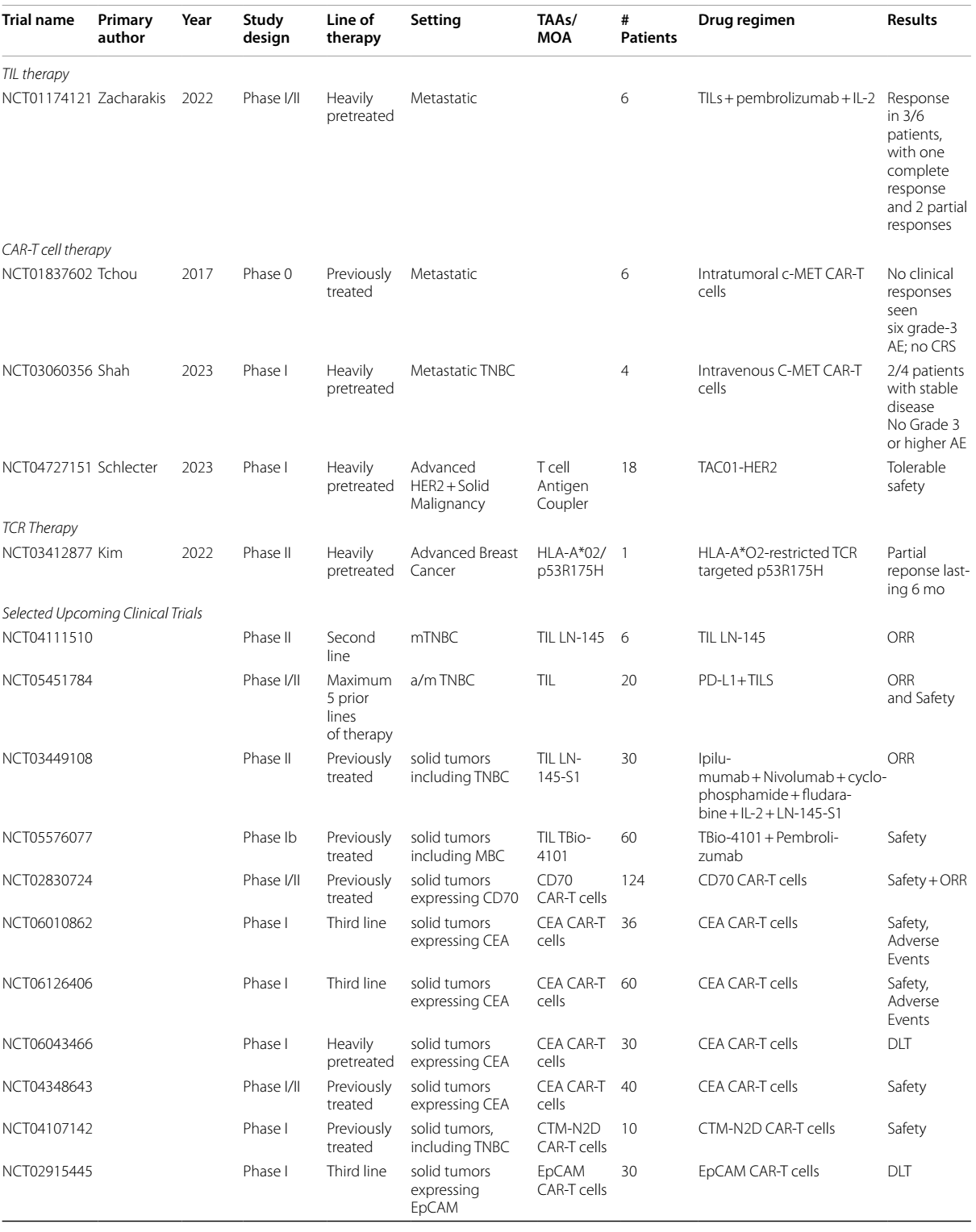
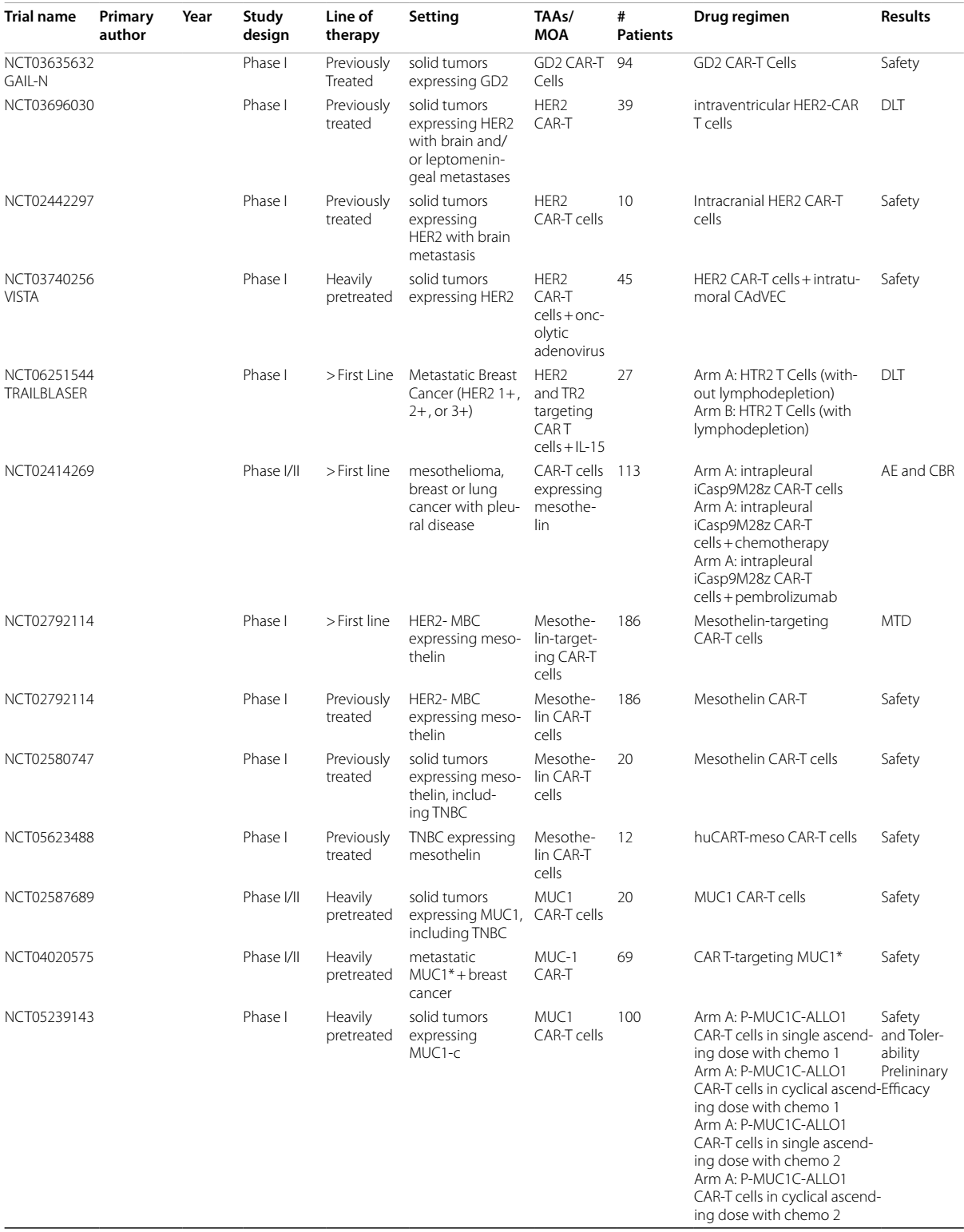
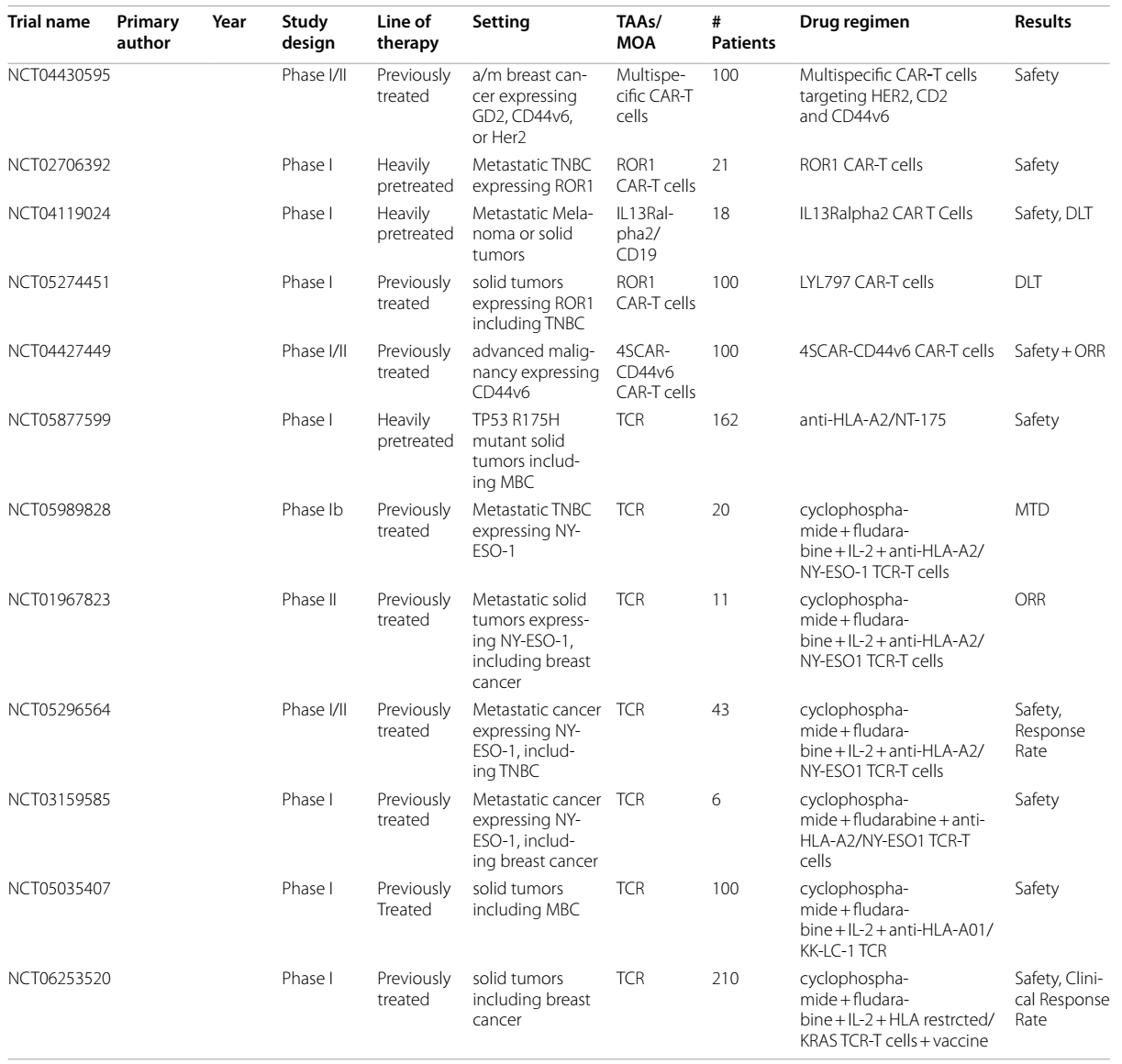
TILs疗法
TILs疗法是指从肿瘤内部提取T细胞,在不进行基因改造的情况下使其增殖,然后再将其回输到患者体内。2024年2月,基于一项II期研究(NCT02360579)的结果,TILs疗法获得了FDA的批准,用于治疗复发/难治性转移性黑色素瘤。这一成功促使人们对TILs疗法在其他实体恶性肿瘤中的应用展开研究。随后,一项在BC患者中使用TILs疗法联合白细胞介素-2(IL-2)和帕博利珠单抗的I期试验显示出了有前景的结果,6例患者中有3例缓解,其中包括1例完全缓解19。
即将开展的TILs疗法用BC的试验包括:一项II期试验(NCT04111510)正在研究LN-145 TILs疗法在转移性三阴性乳腺癌(mTNBC)中的应用;一项I/II期试验(NCT05451784)研究PD-L1+ TILs在TNBC中的应用;一项Ib期研究(NCT05576077)研究TBio4101联合帕博利珠单抗在包括BC在内的实体瘤中的应用;以及一项II期试验(NCT03449108)研究LN-145-S1联合ICI在mTNBC中的应用。
CAR-T疗法
CAR-T疗法通过对T细胞受体进行工程改造,使其靶向细胞表面的TAA。CAR-T疗法是血液系统恶性肿瘤治疗的主要手段之一,也是包括BC在内的实体瘤的研究热点领域。
在CAR-T疗法针对BC的研究中,早期的 I 期研究已经证明了该疗法的安全性是可耐受的20,并且部分患者出现了病情稳定的情况。随后,一项针对mBC患者的 0 期试验,将针对细胞表面分子 c-MET 的 CAR-T 进行瘤内注射。结果显示,肿瘤内部虽出现了炎症反应的迹象,但未实现临床缓解 21。基于这些结果,促成了一项针对 cMET 的静脉注射 CAR-T 的 I 期研究。在该研究中,4 例TNBC患者里有 2 例在第 25 天病情达到稳定状态22。
即将开展的研究,包括一项针对表达黏蛋白1(Muc1)生长因子受体(称为Muc1*)的mBC的I/II期(NCT04020575)研究,以及一项针对表达酪氨酸蛋白激酶跨膜受体1(ROR1)的血液系统恶性肿瘤和实体瘤的CAR-T疗法I期(NCT02706392)研究。
据推测,到目前为止,CAR-T疗法在实体瘤治疗中疗效有限,这可能与肿瘤抗原的调节、靶抗原特异性不足、T细胞耗竭、T细胞向肿瘤部位的迁移能力差以及肿瘤免疫微环境(TIME)对效应功能的调节异常等因素有关。CAR-T细胞在输入体内后有限的扩增不仅限制了其治疗效果,同时也限制了其毒性。然而大量扩增又会出现更严重 “靶向 - 脱瘤” 毒性。例如,一位接受ERBB2-CAR-T疗法治疗的患者,因“靶向-脱瘤”效应而出现了致命的细胞因子释放综合征23。鉴于此,目前人们已经认识到,CAR-T疗法的靶点应局限于在肿瘤外表达量有限的细胞表面抗原,但这类抗原数量稀少。此外,CAR-T疗法还会引发其他毒性反应,如巨噬细胞活化综合征和免疫细胞相关的神经毒性综合征等,这些也会对正常健康组织造成影响。
TCR
TCR 疗法与 CAR-T 疗法类似,但它表达的是受人类白细胞抗原(HLA)限制的 T 细胞受体。主要组织相容性复合体(MHC)能够表达膜蛋白和细胞内蛋白,而这种受 HLA 限制的 T 细胞受体能够特异性地与 MHC 表达的相应蛋白结合。由于这种结合的特异性,使得 T 细胞在攻击肿瘤细胞时,能够更精准地识别,从而减少对其他健康细胞的攻击,有效限制了对健康细胞的毒性。
2024年8月,afamitresgene autoleucel(“afami-cel”,一种受HLA-A*02限制、靶向MAGE-4的TCR疗法)获得了FDA的批准,用于治疗表达MAGE-4的肉瘤。正在进行的针对MAGE-A1和MAGE-A3的I期试验已经在各种实体瘤中发现了可耐受的安全性和潜在的临床疗效,但尚未有针对BC患者的报告结果。在BC方面,一例患者接受了来自外周血淋巴细胞的、受HLA-A*02限制、靶向p53R175H的TCR疗法,该患者出现了持续6个月的部分缓解24。即将开展的针对BC的TCR疗法试验包括:一项针对表达受HLA-A*02限制的NY-ESO-1的mTNBC患者的Ib期试验(NCT05989828);一项针对包括BC在内的实体瘤、研究受HLA-A*02限制的NT-175的I期试验(NCT05877599);以及两项针对包括BC在内的实体瘤、研究受HLA-A*01限制的KK-LC-1的I期研究(NCT05483491,NCT05035407)。
表2 乳腺癌细胞治疗的当前和即将进行的临床试验
小结
目前,已有十四种双特异性抗体获批用于实体瘤治疗。然而,像zanidatamab和zenocutuzmab等双特异性抗体在BC治疗中的作用仍需深入研究,以明确其在现有治疗模式中的地位。
未来,无论是双特异性抗体疗法还是CAR-T疗法,都应探究增强T细胞反应的机制,可通过双重检查点抑制和/或共刺激信号来实现。 即将开展的临床试验有望拓宽治疗前景,助力我们进一步了解ICIs、ADC、双特异性抗体和/或细胞疗法联合使用的潜在优势。此外,除了关注PD-L1的表达,对生物标志物及肿瘤免疫微环境的其他特征展开更多研究,能提升我们预测患者对含ICI治疗方案应答情况的能力,进而为患者制定更个性化的治疗方案。
1. Heater NK, Warrior S, Lu J. Current and future immunotherapy for breast cancer. J Hematol Oncol. 2024 Dec 25;17(1):131. doi: 10.1186/s13045-024-01649-z.
2. Meric-Bernstam F, Beeram M, Hamilton E, Oh D-Y, Hanna DL, Kang Y-K, et al. Zanidatamab, a novel bispecific antibody, for the treatment of locally advanced or metastatic HER2-expressing or HER2-amplified cancers: a phase 1, dose-escalation and expansion study. Lancet Oncol. 2022;23(12):1558–70.
3. Wang X, Lee KS, Zeng X, Sun T, Im YH, Li H, Wang K, Li H, et al. Zanidatamab (zani), a HER2-targeted bispecific antibody, in combination with docetaxel as first-line therapy (1L) for patients (pts) with advanced HER2-positive breast cancer (BC): Updated results from a phase 1b/2 study. J Clin Oncol. 2023;41(16_suppl):1044–1044. 10.1200/JCO.2023.41.16_suppl.1044.
4. Escrivá-de-Romani S, Alba E, Rodríguez-Lescure Á, Hurvitz S, Cejalvo JM, Gión M, et al. Abstract PD18-10: Treatment of HER2-positive (HER2+) hormone-receptor positive (HR+) metastatic breast cancer (mBC) with the novel combination of zanidatamab, palbociclib, and fulvestrant. Cancer Res. 2023;83(5_Supplement):PD18-10-PD18-10. 10.1158/1538-7445.SABCS22-PD18-10.
5. Valero V, Mouabbi J, Alonzo H, Ilheme AN, Murthy R, Huang X, et al. 132P Neoadjuvant zanidatamab for stage I node-negative HER2- positive breast cancer (BC). ESMO Open. 2023;8(1):101471.
6. Zhang J, Ji D, Cai L, Yao H, Yan M, Wang X, et al. First-in-human HER2-targeted bispecific antibody KN026 for the treatment of patients with HER2-positive metastatic breast cancer: results from a phase I study. Clin Cancer Res. 2022;28(4):618–28.
7. Liu J, Song C, Wang X, Ni M, Wang X, Chen L, et al. Abstract P5-16-04: preliminary safety and efficacy results of KN046 (an anti-PD-L1/CTLA-4 bispecific antibody) in combination with KN026 (a HER2-targeted bispecific antibody) in patients with metastatic HER2-positive breast cancer: a phase II trial. Cancer Res. 2022;82(4_Supplement):P5-16-04-P5-16-04. 10.1158/1538-7445.SABCS21-P5-16-04.
8. Ma L, Yang B, Zhang M, Wang K, Chen Y, Fan Z, et al. 247P KN026 in combination with docetaxel as neoadjuvant treatment for HER2+ early or locally advanced breast cancer (BC): a single-arm, multicenter, phase II study. Ann Oncol. 2023;34:S282.
9. Pistilli B, Wildiers H, Hamilton EP, Ferreira AA, Dalenc F, Vidal M, et al. Clinical activity of MCLA-128 (zenocutuzumab) in combination with endocrine therapy (ET) in ER+/HER2-low, non-amplified metastatic breast cancer (MBC) patients (pts) with ET-resistant disease who had progressed on a CDK4/6 inhibitor (CDK4/6i). J Clin Oncol. 2020;38(15_suppl):1037–1037. 10.1200/JCO.2020.38.15_suppl.1037.
10. Hamilton EP, Petit T, Pistilli B, Goncalves A, Ferreira AA, Dalenc F, et al. Clinical activity of MCLA-128 (zenocutuzumab), trastuzumab, and vinorelbine in HER2 amplified metastatic breast cancer (MBC) patients (pts) who had progressed on anti-HER2 ADCs. J Clin Oncol. 2020;38(15_suppl):3093–3093. 10.1200/JCO.2020.38.15_suppl.3093.
11. Beeram M, Denlinger CS, Tolcher AW, Goldstein LJ, Patnaik A, Papadopoulos K, et al. Abstract P6-15-15: MM-111 - a novel bispecific antibody targeting HER-2/HER-3 Z heterodimer: safety and tolerability in a first-in human phase I/II study in patients with refractory HER2-positive (HER-2+) cancers. Cancer Res. 2010;70(24_Supplement):P6-15-15-P6-15-15. 10.1158/0008-5472.SABCS10-P6-15-15.
12. Richards DA, Braiteh FS, Garcia AA, Denlinger CS, Conkling PR, Edenfield WJ, et al. A phase 1 study of MM-111, a bispecific HER2/HER3 antibody fusion protein, combined with multiple treatment regimens in patients with advanced HER2-positive solid tumors. J Clin Oncol. 2014;32(15_suppl):651–651. 10.1200/jco.2014.32.15_suppl.651.
13. Haense N, Atmaca A, Pauligk C, Steinmetz K, Marmé F, Haag GM, et al. A phase I trial of the trifunctional anti Her2 × anti CD3 antibody ertumaxomab in patients with advanced solid tumors. BMC Cancer. 2016. 10.1186/s12885-016-2449-0.
14. Ruiz IR, Vicario R, Morancho B, Morales CB, Arenas EJ, Herter S, et al. p95HER2–T cell bispecific antibody for breast cancer treatment. Sci Trans Med. 2018. 10.1126/scitranslmed.aat1445.
15. Wermke M, Alt J, Kauh JS, Back J, Salhi Y, Reddy V, et al. Preliminary biomarker and pharmacodynamic data from a phase I study of single-agent bispecific antibody T-cell engager GBR 1302 in subjects with HER2-positive cancers. J Clin Oncol. 2018;36(5_suppl):69–69. 10.1200/JCO.2018.36.5_suppl.69.
16. Lum LG, Al-Kadhimi Z, Deol A, Kondadasula V, Schalk D, Tomashewski E, et al. Phase II clinical trial using anti-CD3 × anti-HER2 bispecific antibody armed activated T cells (HER2 BATs) consolidation therapy for HER2 negative (0–2+) metastatic breast cancer. J Immunother Cancer. 2021;9(6):e002194.
17. Lum LG, Thakur A, Al-Kadhimi ZS, Colvin GA, Cummings FJ, Legare RD, et al. Long-term follow up for a phase I trial HER2/neu-targeted T cells in women with advanced breast cancer. J Clin Oncol. 2014;32(15_suppl):3075–3075. 10.1200/jco.2014.32.15_suppl.3075.25092783.
18. Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. N Engl J Med. 2018;378(5):439–48.
19. Zacharakis N, Huq LM, Seitter SJ, Kim SP, Gartner JJ, Sindiri S, et al. Breast cancers are immunogenic: immunologic analyses and a phase II pilot clinical trial using mutation-reactive autologous lymphocytes. J Clin Oncol. 2022;40(16):1741–54.
20. Specht JM, Lee SM, Turtle C, Berger C, Balakrishnan A, Srivastava S, et al. Abstract P2-09-13: a phase I study of adoptive immunotherapy for ROR1+ advanced triple negative breast cancer (TNBC) with defined subsets of autologous T cells expressing a ROR1-specific chimeric antigen receptor (ROR1-CAR). Cancer Res. 2019;79(4_Supplement):P2-09-13-P2-09-13. 10.1158/1538-7445.SABCS18-P2-09-13.
21. Tchou J, Zhao Y, Levine BL, Zhang PJ, Davis MM, Melenhorst JJ, et al. Safety and efficacy of intratumoral injections of chimeric antigen receptor (CAR) T cells in metastatic breast cancer. Cancer Immunol Res. 2017;5(12):1152–61.
22. Shah PD, Huang AC, Xu X, Orlowski R, Amaravadi RK, Schuchter LM, et al. Phase I trial of autologous RNA-electroporated cMET-directed CAR T cells administered intravenously in patients with melanoma and breast carcinoma. Cancer Res Commun. 2023;3(5):821–9.
23. Morgan RA, Yang JC, Kitano M, Dudley ME, Laurencot CM, Rosenberg SA. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther. 2010;18(4):843–51.
24. Kim SP, Vale NR, Zacharakis N, Krishna S, Yu Z, Gasmi B, et al. Adoptive cellular therapy with autologous tumor-infiltrating lymphocytes and T-cell receptor-engineered T cells targeting common p53 neoantigens in human solid tumors. Cancer Immunol Res. 2022;10(8):932–46.
排版编辑:肿瘤资讯-Jina











 苏公网安备32059002004080号
苏公网安备32059002004080号


