对于临床研究的评估,总生存期(OS)就像一炉烈火,让每一种新方案接受终极淬炼。免疫治疗具有明显的“生存拖尾”效应,能让部分患者获得长期生存,达到“临床治愈”。随着免疫治疗从后线到一线再到早期治疗的迁移,全面的OS获益进一步奠定其在肺癌治疗中的基石地位。
本期特邀专家——李醒亚 教授
郑州大学第一附属医院 主任医师
教授、博士、博士生导师
美国康州大学博士后
中国临床肿瘤学会(CSCO)理事
中国医药教育学会肿瘤化疗专业委员会副主委
中国老年学和老年医学学会精准诊疗分会副主委
中国医疗保健国际交流促进会肿瘤内科分会常务委员
中国医药教育协会肿瘤免疫治疗专业委员会常务委员
河南省卫生科技领军人才
河南省呼吸与危重症学会肺癌专科分会主任委员河南省抗癌协会化疗专业委员会副主任委员
组建肺癌多学科会诊专家组(2014.5),创建肺癌多学科会诊微信公众号
为何OS是检验肿瘤治疗获益的金标准?
抗肿瘤药物临床研究的终点是药物临床研究中最重要、最关键的指标。我们熟知的客观缓解率(ORR)、疾病控制率(DCR)、无进展生存期(PFS)和总生存期(OS)这四个终点指标可以分为近期疗效和远期疗效指标。近期疗效指标主要用于评估药物对肿瘤的直接影响(包括导致肿瘤消失或退缩等),包括ORR和DCR,以ORR最为关键;而远期疗效指标主要用于评估药物对患者生存时间的影响,需要长时间随访观察,包括PFS和OS。
不少研究会选择PFS或ORR作为抗肿瘤药物研究的主要终点,而这些终点通常被认为是替代性终点,因为在短期随访中观察到抗肿瘤药物的疗效并不能真正的满足患者的终极治疗需求。“PFS最高,疗效就一定最好么?”,“PFS最终一定能转化为OS获益么?”随着这些疑问的提出,不难看出对于PFS/ORR等替代终点能否作为抗肿瘤药物研究的主要终点一直存在争议。
既往有系统综述阐述了替代终点(PFS/DFS、ORR等)与OS的相关性,在已发表肿瘤研究中,82%的替代终点与OS之间仅呈现低-中度的相关性,且这一结果在多项研究中被证实,如仑伐替尼联合帕博利珠单抗的LEAP研究,贝伐珠单抗联合靶向治疗的NEJ026研究、WJOG-8715L研究、CTONG1509研究均未观察到OS的提升。令人十分遗憾的是即使在机制上具有理论支持的疗法,也可能因为PFS的获益无法转化为OS获益而失去指导或改变临床实践的可能性。
此外,从国家监管机构的角度来看,OS是新药审评的重要依据和硬门槛,同时也是平衡风险获益的“标尺”。我国国家食品药品监督管理局在《以临床价值为导向的抗肿瘤药物临床研发指导原则》中指出,对于抗肿瘤药物,提高疗效和延长患者的生存时间仍是当下追求的主要目标,因此通常会选择可以反映生存获益的临床终点,如总生存期 (OS) 。在注册临床研究设计方面,强调随机对照试验(RCT)是确证药物疗效最为可靠的方法,OS为反映抗肿瘤药物临床获益的金标准,通常作为RCT的主要终点。FDA最新发布的《肿瘤临床试验中OS评估方法》中强烈建议,对于支持适应症获批的肿瘤新药随机对照研究,在可行的情况下,应将总生存期作为主要研究终点。OS不仅是“疗效终点”,同时也是“安全性终点”。
因此,OS才是检验肿瘤治疗的金标准,无论是在进行临床研究设计还是研究结果解读,我们应该高度关注研究终点的选择及OS数据。
如何正确评估OS获益?
OS作为抗肿瘤临床研究的常用研究终点,具有客观、精确和易评估等优点。在OS评估中涉及到不同的指标,包括中位生存期(mOS)、OS 风险比(HR)和OS率。不同OS指标在特定的评估场景中代表着不同的临床意义。将这些指标综合在一起,可以多维度、准确的进行患者长期生存获益的评估。
表1 常见抗肿瘤药物临床试验OS评估指标

众所周知,近年来免疫治疗在抗肿瘤治疗领域取得巨大的成功,与传统的化疗相比,免疫治疗的疗效普遍具有“长拖尾”效应。单纯的中位OS数值并非最佳评估,因为中位OS不能提供位于曲线尾部患者 (治疗分数)的相关信息(图1),同时,也不建议在过少的事件数(如不足计划OS 事件数 50%)时对主要终点开展期中分析。
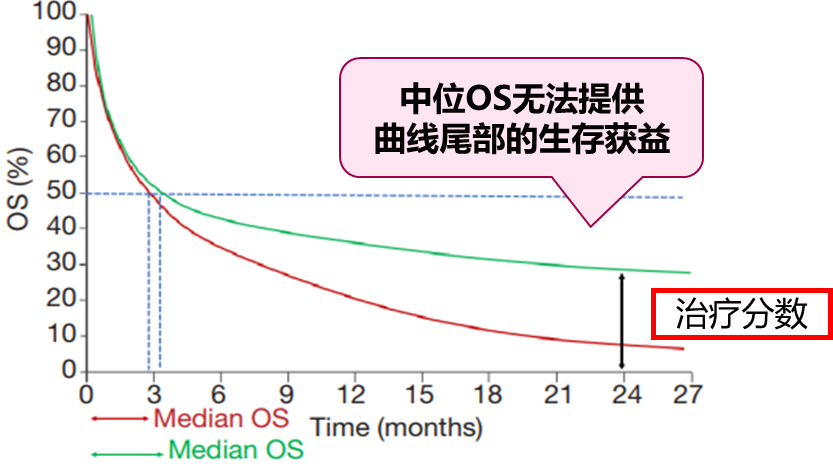
OS HR可以反映整体生存改善幅度,更直观的反映了获益程度。CDE发布的《晚期非小细胞肺癌临床试验终点技术指导原则》中明确提到,对于晚期NSCLC,在后续治疗均衡的情况下,目标HR的点估计值通常不高于0.80被认为是OS获益的临床价值标准。显然,HR值会受到后续治疗的影响,如对照组患者交叉至试验组接受治疗而导致两组后续治疗出现差异,往往还需要还需要通过统计学方法对生存时间进行校正分析,从而避免转组造成的混杂对疗效判定的影响。通常OS的风险比和中位数均达到统计学意义时,获益更加稳健。
OS率是在生存曲线上另一个比较直观的观测指标,它提供了特定治疗方案潜在在特定时间点(如3年、4年、5年)的治愈比例。相比中位OS,里程碑OS率信息量更大,反映患者的基本需求。在研究结果报道中,5年生存率是衡量抗癌进展最常用的指标,也更适用于评估免疫治疗的长期疗效。《健康中国行动——癌症防治行动实施方案(2023-2030年)》1提出,到2030年我国总体癌症5年生存率实现46.6%,可见5年OS率已经提升至国家癌症防治的目标,具有重大意义。
此外,免疫治疗时代OS获益的评估还需要综合考虑多个因素,如是否预设统计学检验,交叉治疗和后线治疗的影响,研究纳入人群的差异等。结合统计学方法、校正分析和临床实践,避免片面解读数据,才能更准确地反映试验疗法的真实价值。
NSCLC免疫治疗全面撬动OS获益
晚期免疫治疗OS获益已得到多重验证:
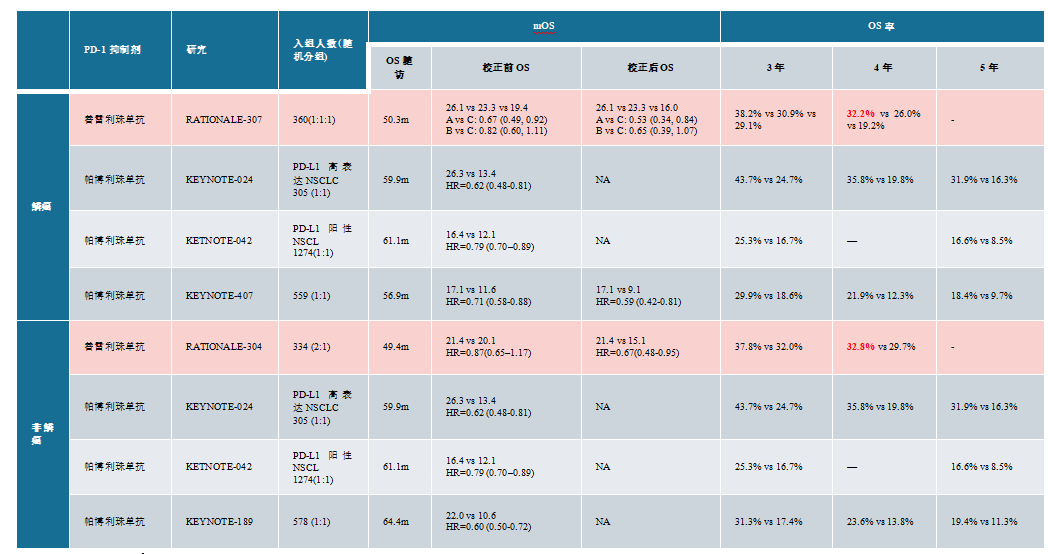
免疫治疗显著提升肺癌患者的长期生存,RATIONALE-304 & RATIONALE-307研究长随访结果显示替雷利珠单抗联合化疗的4年OS率均达到32%以上,替雷利珠单抗联合化疗一线治疗晚期肺鳞癌显著延长患者生存,4年总生存率达32.2%,已全面实现三分之一患者活过4年。此外两项研究中接受≥35周期替雷利珠单抗长治疗(Long-term exposure, LTE)患者的4年OS率更是振奋人心,高达89.3%-97.5%,几乎接近临床治愈。无论是鳞癌还是非鳞癌患者,一线免疫联合化疗5年OS率约为20%,在PD-L1高表达患者中,免疫单药治疗的5年OS率达到30%,全面实现了生存突破。
表2 晚期NSCLC一线治疗研究数据汇总
围术期免疫治疗OS获益初露端倪,值得期待
早中期 NSCLC 主要的治疗手段是根治性手术,但术后复发是临床治疗不可避免的难题,既往在手术的基础上加入围术期化疗仅能将 5 年生存率提高约 5%1,迫切需要更优的系统治疗手段。近年来,以 PD-1/PD-L1 单抗为代表的免疫治疗探索逐步从晚期 NSCLC 突破至早中期,并取得了突破性进展。从新辅助免疫治疗、辅助免疫治疗模式到围术期免疫治疗模式,全面开启了可切除 NSCLC 患者围术期免疫治疗新时代。
KEYNOTE-671研究是首个以 OS 作为主要终点并取得阳性结果的 III 期临床研究。2024 年公布的OS 更新数据显示,在中位随访 41.1 个月时,帕博利珠单抗组 4 年 OS 率为 68.0%,对照组为 56.7%,OS HR 0.73(0.58-0.92),中位 OS 仍未达到2。
2025年ASCO大会公布CheckMate-816研究5年总生存期(OS)数据,与单纯化疗组(中位 OS 73.7 个月)相比,纳武利尤单抗+化疗组的 OS 获益具有统计学意义(中位 OS 尚未达到,HR = 0.72), 5 年 OS 率为 65%,与仅接受新辅助化疗相比,绝对值提升了 10%。
此外,RATIONALE 315研究期中分析(IAs)显示,在可切除的NSCLC患者中,围术期替雷利珠单抗联合新辅助化疗较单纯新辅助化疗,在主要病理缓解(MPR)、无事件生存(EFS)和病理完全缓解(pCR)方面均取得了统计学显著改善,OS数据也即将在2025WCLC大会重磅公布。目前摘要已披露的数据十分亮眼,在随访38.5个月时,OS HR 0.65 (95% CI: 0.45, 0.93)3,进一步奠定了免疫治疗在早期NSCLC治疗中的基石地位,详细数据值得期待。
SCLC免疫治疗OS获益渐入佳境
与NSCLC有所不同的是,尽管小细胞肺癌对初始的放化疗非常敏感,但绝大多数患者在6个月内出现疾病进展,而且复发后的治疗选择非常有限,中位生存时间仅8~10个月左右。患者对于长生存追求的渴望更加迫切。RATIONALE-312研究是一项替雷利珠单抗联合标准化疗与安慰剂联合标准化疗一线治疗ES-SCLC患者的Ⅲ期随机对照研究,以OS作为主要研究终点。替雷利珠单抗+化疗将患者中位OS显著延长至15.5个月(对照组13.5个月, HR: 0.75),3年OS率达到25%(对照组:9%),意味着四分之一的ES-SCLC患者可以生存超过3年,刷新ES-SCLC患者生存的新高度,成为广泛期小细胞肺癌一线治疗新的标准。
总结
从晚期到早期,免疫治疗已经全面改变肺癌的治疗格局,随着时间的沉淀,越来越多的更新数据充分展示了免疫治疗对患者长期生存的极大改善,全面撬动OS获益。唯有经得起OS这一烈火的淬炼,才能真正助力肿瘤患者活得更久、活的更好。
1. 关于印发健康中国行动—癌症防治行动实施方案(2023—2030年)的通知. 2023-10-30.
2. 中国抗癌协会肺癌专业委员会, 中国胸部肿瘤研究协作组, 中华医学会肿瘤学分会肺癌专家委员会. 非小细胞肺癌围术期免疫治疗的共识与争议(2024 版)[J]. 中华肿瘤杂志, 2024, 46(12): 1107-1126.
3. Margarita Majem Tarruella,et al.2024ESMO-IO,LAB3.
4. 2025WCLC, MA04.08.
排版编辑:肿瘤资讯-CTY











 苏公网安备32059002004080号
苏公网安备32059002004080号


