大会热点最新速递。
胰腺癌由于具有高度侵袭性和高死亡率,被称为“癌中之王”,其死亡发病比约为0.94[1],严重威胁人类生命健康。随着近年来规范化诊疗水平的提升和临床研究的开展,其5年生存率已从20年前4%提升至12%[2],但如何提升胰腺癌患者的生存获益一直是学界研究的热点。在今年美国临床肿瘤学会胃肠肿瘤研讨会(ASCO GI)上报告了诸多胰腺癌领域的最新研究进展,包括新辅助治疗、一线治疗以及靶向治疗的突破。特别邀请来自华中科技大学同济医学院附属同济医院邱红教授撷取其中几项代表性研究进行解读,期待启迪临床诊疗新思路。
摘要号:655
Results of a phase II, open-label pilot study evaluating the safety and activity of liposomal irinotecan (Nal-IRI) in combination with 5-FU and oxaliplatin (NALIRIFOX) in preoperative treatment of pancreatic adenocarcinoma (NEO-Nal-IRI study)
一项评估伊立替康脂质体(Nal-IRI)联合5-FU和奥沙利铂(NALIRIFOX)术前治疗胰腺癌患者安全性和活性的Ⅱ期、开放标签探索性研究(NEO-Nal-IRI研究)的结果
研究背景:新辅助治疗在可手术的胰腺导管腺癌(PDAC)中的治疗模式和可行性已经越来越被临床医生所接受,但标准治疗方案仍未建立。改良FOLFIRINOX(伊立替康+奥沙利铂+5-氟尿嘧啶/亚叶酸钙)由于毒性问题通常需要剂量调整或者延迟给药。此前,基于NAPOLI-1研究结果,美国食品药品监督管理局(FDA)批准伊立替康脂质体在复发、难治性转移性胰腺导管腺癌(mPDAC)二线治疗的使用;NAPOLI-3研究数据发布后,FDA正在审查NALIRIFOX一线治疗mPDAC的申请。本研究使用伊立替康脂质体代替mFOLFIRINOX方案中的传统伊立替康,以探索NALIRIFOX(伊立替康脂质体+奥沙利铂+5-氟尿嘧啶/亚叶酸钙)方案在新辅助治疗中的安全性。
研究方法:该项Ⅱ期、开放标签、多中心单臂研究纳入了可手术PDAC患者,ECOG 评分0-1分。患者接受每2周一次的NALIRIFOX方案(具体剂量如图1)共4个月,随后进行影像学评估,4-8周后接受外科手术切除。主要研究终点是术后30天综合的主要并发症发生率(包括再入院、死亡、二次手术或延长住院时间的主要并发症),次要研究终点为毒性、治疗完成率、R0切除率等。
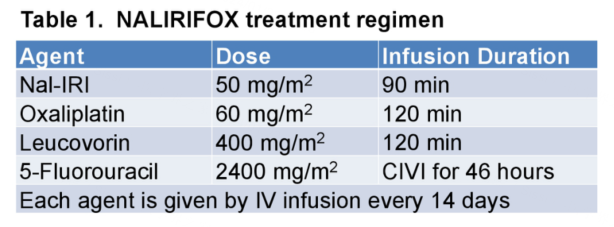
研究结果:从2019年5月至2023年2月,共纳入了来自4个中心共45例患者(包括30例临界可切除和15例可切除PDAC患者)。所有患者均接受初始治疗,后有34例(76%)患者进行手术,其中29例患者完成了手术切除。
33例(73%)患者完成了8周期的NALIRIFOX新辅助治疗。
NALIRIFOX方案新辅助治疗后(经RECIST v1.1评估)达到疾病完全缓解(CR)或部分缓解(PR)的患者为45%,达到CR或PR或者疾病稳定(SD)的患者为73%。
R0切除率为90%(包括15例临界可切除和14例可切除患者)。
最常见的3级以上不良事件(AE)为非发热性中性粒细胞减少症(41%)、腹泻(30%)和厌食(22%)。
专家观点:PDAC新辅助治疗一直是探索的热点,尤其是对于临界可切除的PDAC,新辅助化疗能提高R0切除率,并可改善患者生存,但目前尚无标准方案。PREOPANC研究[3]表明,与直接手术相比,以吉西他滨为基础的新辅助放化疗进一步提升临界可切除PDAC患者R0切除率以及mOS。对于FOLFIRINOX新辅助化疗与以吉西他滨为基础的新辅助放化疗孰优孰劣尚未有定论,PREOPANC-2研究[4]对比了FOLFIRINOX与吉西他滨为基础的放化疗在新辅助治疗中的疗效,结果显示在临界可切除和可切除胰腺癌患者中,FOLFIRINOX新辅助化疗与以吉西他滨为基础的新辅助放化疗两种方案在R0切除率、生存获益方面旗鼓相当,表明在未来的临床实践中,对于临界可切除和可切除胰腺癌,特别是临界可切除胰腺癌而言,FOLFIRINOX新辅助化疗与以吉西他滨为基础的新辅助放化疗均是可选择的方案,可依据患者的体能状态、耐受性等因素进行选择。
NEO-Nal-IRI这项Ⅱ期研究初步证实了NALIRIFOX新辅助治疗在可切除及临界可切除PDAC患者的可行性和安全性,R0切除率达到90%。安全性方面,NALIRIFOX新辅助治疗方案3级以上腹泻发生率为30%。既往的NAPOLI-1研究[5]数据显示,亚洲人群接受伊立替康脂质体联合5-FU/LV方案3级及以上腹泻发生率为3%,远低于总体人群的13%,提示亚洲人群对于伊立替康脂质体的耐受性可能更好。目前这项研究正在对生存数据进行随访,期待该项研究为可切除及临界可切除PDAC患者带来远期生存获益。
摘要号:687
Kinetics of CA19-9 decline in a randomized phase III study of irinotecan liposome injection, oxaliplatin, 5-fluorouracial/leucovorin (NALIRIFOX) or nab-paclitaxel plus gemcitabine (GEM+NABP) in patients who have not previously received chemotherapy for metastatic adenocarcinoma of the pancreas (NAPOLI 3)
随机Ⅲ期NAPOLI 3研究中,NALIRIFOX或白蛋白紫杉醇+吉西他滨(Gem+NabP)治疗既往未接受过化疗的mPDAC患者糖类抗原19-9(CA19-9)下降的动力学
研究背景:在NAPOLI-3研究(n=770)中,NALIRIFOX一线治疗mPDAC患者相较于Gem+NabP方案延长了中位OS(11.1个月VS 9.2个月)和中位无进展生存期(mPFS)(7.4个月VS 5.6个月),且安全性良好。此前有研究表明,治疗期间CA19-9水平降低与治疗反应和结局改善相关。在这一研究中,探索了CA19-9水平变化与胰腺癌预后的关系。

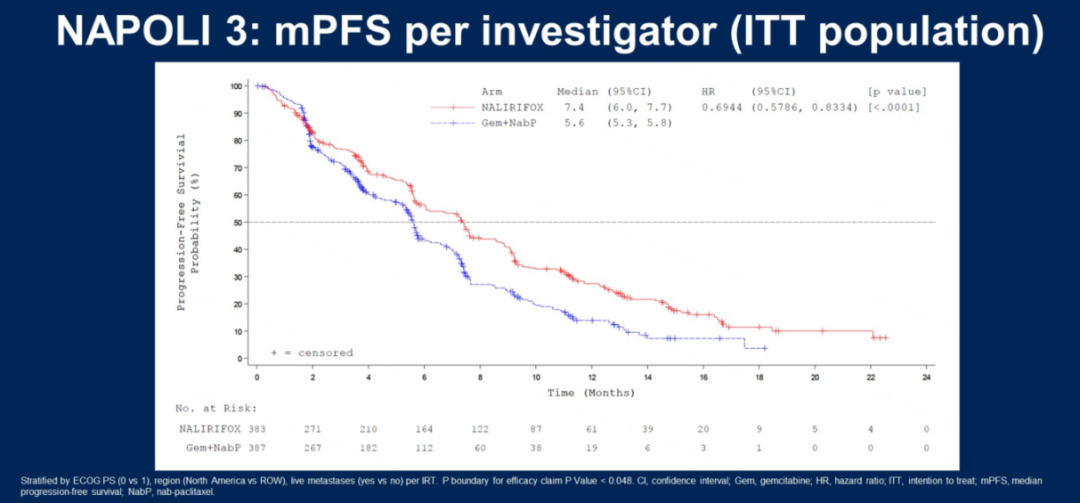
研究方法:在NAPOLI-3研究中,基线评估CA19-9指标,每8周进行一次评估直至患者停止治疗。该研究中CA19-9检测上限为8000 U/ml,研究采用Cox比例风险回归和logistic回归分析以探索CA19-9下降与OS、PFS和客观缓解率(ORR)之间的关系。
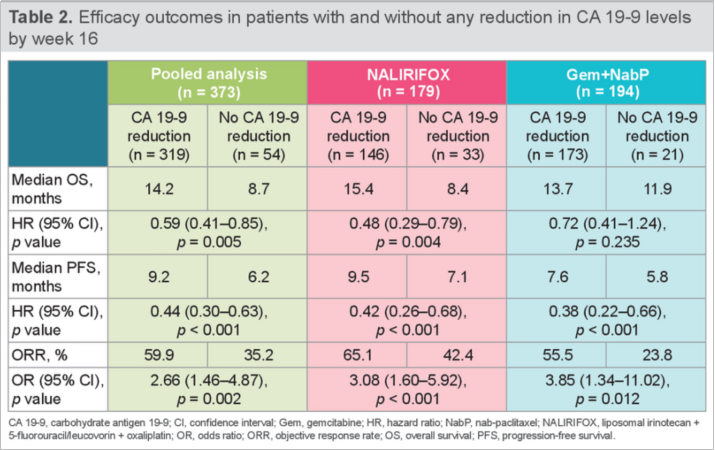
研究结果:基线CA19-9可评估(8000 U/ml)以及第8周、第16周继续监测CA19-9指标的患者被纳入分析(NALIRIFOX,n=179;Gem+NabP,n=194)。
整体而言,第16周CA19-9下降相较于未下降的患者ORR(59.9% VS 35.2%,p=0.002)、mPFS(9.2个月 VS 6.2个月,p<0.001)及mOS(14.2个月 VS 8.7个月,p=0.005)均显著获益。
在NALIRIFOX组中,第16周CA19-9下降相较于未下降的患者ORR(65.1% VS 42.4%,p<0.001),mPFS(9.5个月 VS 7.1个月,p<0.001)及mOS(15.4个月 VS 8.4个月,p=0.004)均显著获益。
在Gem+NabP组中,第16周CA19-9下降相较于未下降的患者ORR更高(55.5% VS 23.8%,p=0.012),mPFS更长(7.6个月 VS 5.8个月,p<0.001),但mOS(13.7个月 VS 11.9个月,p=0.235)未见显著获益。
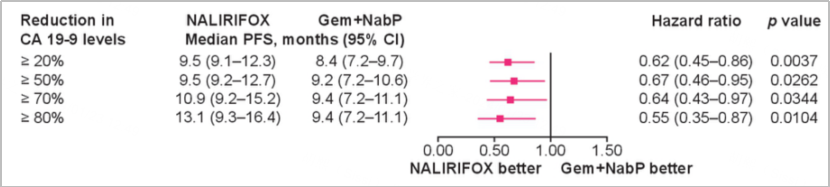
不论CA19-9水平下降幅度如何,NALIRIFOX组相较于Gem+NabP组均能获得更长的PFS。
专家观点:基于NAPOLI-3阳性研究结果,《NCCN指南》(2023.V2)已将NALIRIFOX作为局部晚期或转移性胰腺癌一线治疗方案(1A类)推荐,期待在今年《CSCO胰腺癌指南》的更新中纳入一线治疗推荐。
胰腺癌作为一种恶性程度极高的消化道肿瘤,位置隐蔽,早期症状不明显,进展速度快,分子机制复杂且预后差,筛选和验证具有预测价值的生物标志物非常重要。CA19-9作为最常用的肿瘤标志物,可作为胰腺癌的预后因子。该项研究提示第16周时CA19-9的下降与OS、PFS和ORR获益显著相关。同时,不论CA19-9下降幅度如何,NALIRIFOX方案相较于Gem+NabP方案获益更为显著。但值得注意的是,该研究中有超过一半患者由于CA19-9水平超出8000 U/ml的检测限制而未纳入分析,因此这一研究结论还有待更多循证医学证据加以证实。
摘要号:605
Alternating application of gemcitabine/nab-paclitaxel (Gem/nab-Pac) and Gem monotherapy or continuous application of Gem/nab-Pac after induction treatment for first-line treatment of metastatic pancreatic cancer (mPC): First results from the randomized phase 2 ALPACA study from the German AIO study group (AIO-PAK-0114)
诱导治疗后交替应用吉西他滨/白蛋白紫杉醇(Gem/nab-Pac)和Gem单药治疗或继续应用Gem/nab-Pac用于转移性胰腺癌(mPC)的一线治疗:来自德国AIO研究组(AIO-PAK-0114)的随机2期ALPACA研究的初步结果
研究背景:ALPACA研究旨在探讨经过3周期诱导治疗后,Gem/nab-Pac和Gem单药交替治疗,与标准的Gem/nab-Pac连续治疗相比,是否可改善mPC患者总体耐受性,同时提高治疗疗效。
研究方法:德国AIO研究组的随机、多中心Ⅱ期ALPACA研究纳入了确诊的mPC一线患者。经3周期Gem/nab-Pac诱导治疗后,患者被随机(1:1)分配到继续使用Gem/nab-Pac方案治疗,或接受Gem/nab-Pac治疗和Gem单药治疗的交替使用。主要研究终点是随机化后的OS。
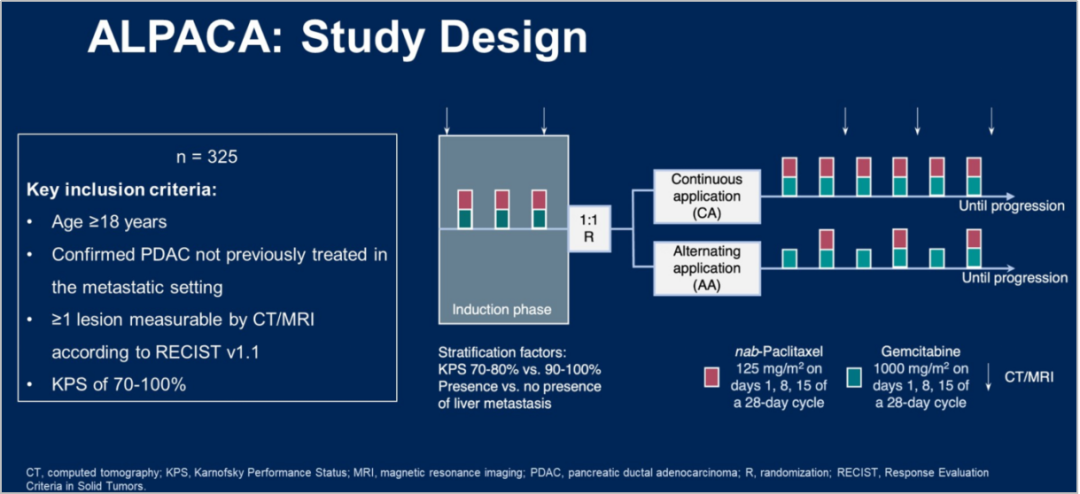
研究结果:2016年5月至2021年5月,来自德国29个中心的325名患者入组。诱导治疗3周期后,174例(53.5%)患者随机入组。其他过早退出研究的患者主要原因是死亡(24.8%)、疾病进展(22.8%)和不良事件(15.9%)。
随机化后交替治疗组的mOS(10.5个月 VS 10.4个月,HR=0.90,P=0.56),mPFS(5.5个月 VS 5.4个月,HR=0.80,P=0.18)与标准治疗组相当。
与标准治疗相比,交替治疗组mPC患者的耐受性得到改善,特别是≥3级周围神经病变(21.3% VS 14.1%)和感染的发生率(20.0% VS 10.6%)更低。
专家观点:目前化疗仍是mPC的基石,吉西他滨作为mPC一线化疗用药已经在临床使用超过20余年,2013年的MPACT研究[6]证实在在吉西他滨单药基础上联合白蛋白结合型紫杉醇可显著延长患者mOS(8.5个月 VS 6.7个月,P<0.01),但3级及以上不良事件发生率较吉西他滨单药更高,如中性粒细胞减少、白细胞减少、周围神经病变等,在一定程度上影响其临床使用。探索维持治疗策略,以及如何在疗效与毒副作用之间进行平衡是胰腺癌姑息性化疗的艺术性问题。ALPACA研究表明在标准Gem/nab-Pac诱导治疗3周期后,Gem/nab-Pac和Gem单药交替治疗的减剂量方案是可行的,其mOS与标准治疗相当,同时≥3级周围神经病变和感染的发生率更低,为mPC患者带来耐受性更好的治疗选择。
摘要号:604
Preliminary activity and safety results of KRAS G12C inhibitor glecirasib (JAB-21822) in patients with pancreatic cancer and other solid tumors
KRAS G12C抑制剂glecirasib(JAB-21822)在PDAC及其他实体瘤中的初步疗效及安全性结果
研究背景:KRAS G12C突变是实体瘤中一种致癌驱动因素和有效的治疗靶点。Glecirasib(JAB-21822)是一种高选择性、共价、口服的KRAS G12C抑制剂,已在非小细胞肺癌(NSCLC)和结直肠癌(CRC)中显示出具有前景的临床活性。然而,Glecirasib在PDAC和其他具有KRAS G12C突变实体瘤中的疗效和安全性尚不清楚,因此该研究进行了探索。
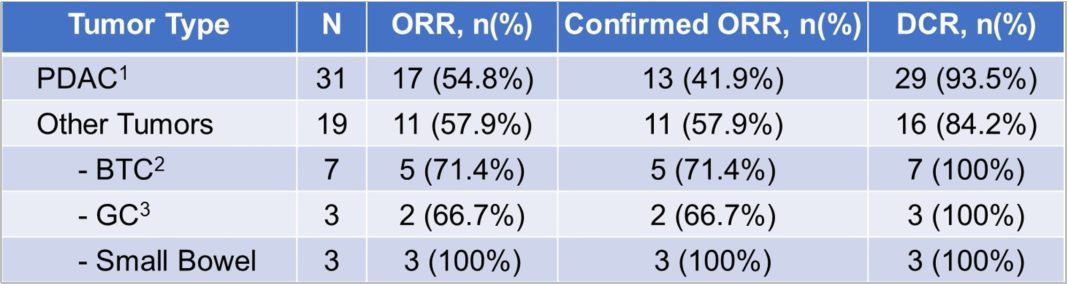
研究方法:研究汇总了两项临床试验(JAB-21822-1001和JAB-21822-1002)的数据,共纳入了52例患者,接受Glecirasib单药治疗,其中50例进入疗效分析(31例PDAC和19例其他实体瘤患者)。此外,患者既往接受过系统治疗的中位线数为一线(范围:0至4;23名患者既往接受了一线治疗)。主要研究终点是ORR,次要研究终点是安全性和耐受性、DOR、PFS和OS等。
研究结果:
对于全部患者,经确认的ORR为48.0%(24/50),经确认的DCR为90.0%(45/50)。PDAC患者经确认的ORR为41.9%,DCR为93.5%,其他实体瘤患者经确认的ORR为57.9%,DCR为84.2%(具体为图7)。
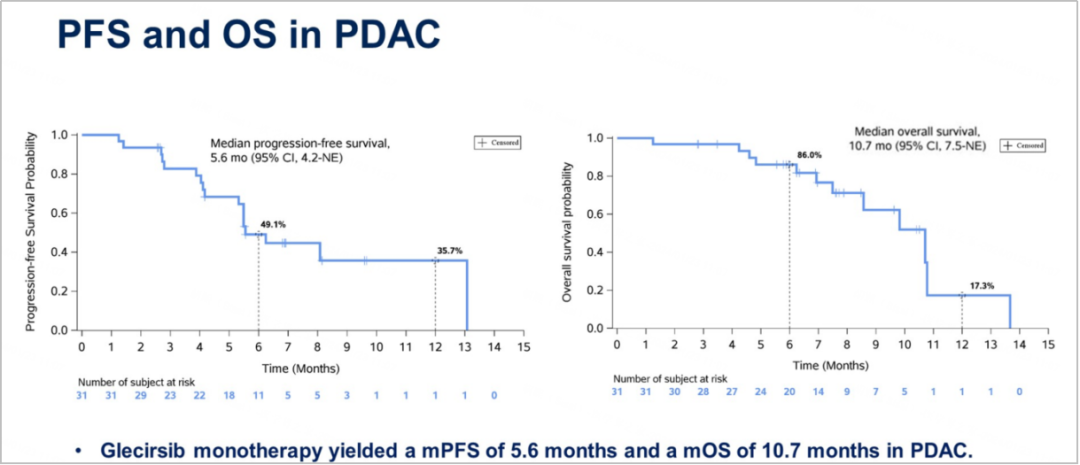
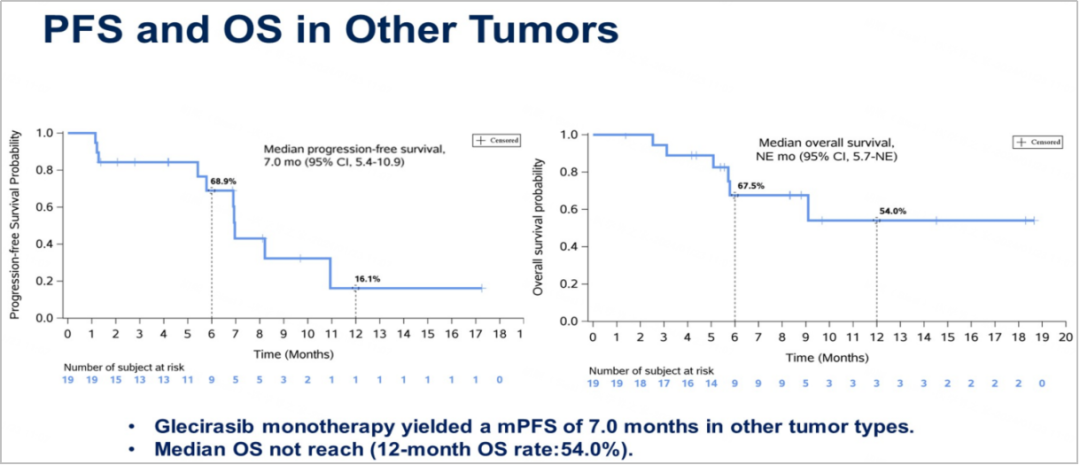
PDAC患者和其他实体瘤患者的mPFS分别为5.6个月和7.0个月,mOS分别为10.7个月和未达到。
在安全性方面,≥3级与治疗相关不良事件(TRAE)发生率为25%,最常见的≥3级TRAE为贫血(5.8%),未见TRAE导致的死亡或治疗中断。
专家观点:这一研究是由我国北京大学肿瘤医院李健教授团队主导的KRAS G12C抑制剂Glecirasib(JAB-21822)在晚期实体瘤患者的Ⅰ/Ⅱ期研究,并入选今年ASCO GI的口头报告。KRAS驱动基因突变作为实体瘤中非常重要的分子分型,在多个瘤种如NSCLC、CRC、胰腺癌、胆道癌等被发现,长久以来被认为是“不可成药”靶点。直至靶向KRAS G12C的Sotorasib在美国FDA获批上市打破了KRAS靶点无药可用的局面,“不可成药”靶点也正在逆袭成为新药研发的热门靶点。
胰腺癌作为难治性的消化道肿瘤,由于肿瘤存在高度异质性,许多靶向及免疫治疗相关研究折戟沉沙。尽管KRAS G12C突变的胰腺癌患者占比较小,但这一研究初步证实了KRAS G12C抑制剂在胰腺癌中具有前景的临床活性。另外该研究也纳入了其他KRAS G12C突变的阑尾癌、胆道癌、胃癌、卵巢癌、宫颈癌等实体瘤患者,也显示了Glecirasib在这些瘤种中具有治疗疗效。在这项研究中,JAB-21822单药使用的ORR明显高于以往结肠癌KRAS G12C抑制剂单药治疗数据。虽然样本量较小,但也可能激发不同KRAS G12C抑制剂之间的疗效差异及癌种差异的讨论。
总结
近年来,临床研究学者围绕胰腺癌发病、诊断、治疗及预后等阶段均在开展相关研究进行探索,也不断取得突破。尽管相较于其他瘤种进步较为缓慢,但临床专家学者都在一步一个脚印地努力克服目前治疗困境。在今年ASCO GI大会上,报告了围绕新辅助治疗和晚期系统性治疗方案在胰腺癌领域的探索,同时靶向、免疫治疗在胰腺癌领域的应用也有一定收获。
在mPC一线治疗中,NAPOLI-3研究证实了NALIRIFOX较Gem+NabP方案取得了疗效上的突破,在NAPOLI-3研究进一步研究分析中提示CA19-9下降可能作为mPC患者预后更好的相关预测因素。新辅助治疗方面,胰腺癌目前尚无标准方案,期待NALIRIFOX方案的进一步探索能早日为胰腺癌新辅助治疗,尤其是临界可切除胰腺癌患者的新辅助治疗带来可能。除了提升治疗疗效,改善患者耐受性也是探索热点,Gem/nab-Pac和Gem单药交替治疗的减剂量方案在不影响疗效的前提下,保证患者有更好的耐受性。期待更多新药研发、治疗方案的探索与组合为mPC患者带来疗效好、安全性佳的一线治疗方案选择。
另外,针对精准靶向治疗一直是包括胰腺癌在内的实体瘤的研究热点,尽管基因突变占比人群低,但靶向治疗能为这部分人群带来毒性更低、疗效更好的治疗方案。期待未来有更多靶向药物的研发,能为这部分携带基因突变的肿瘤患者带来更多生存获益。
专家简介
华中科技大学附属同济医院肿瘤中心教研室副主任/消化系统肿瘤科常务副主任
教授,主任医师,博士生导师
武汉市青年医生骨干人才/湖北省医学青年拔尖人才
中国抗癌协会靶向治疗专业青年委员会 副主任委员
中国抗癌协会肿瘤支持治疗青年委员会 副主任委员
北京癌症防治学会胃癌专业委员会 副主任委员
中国女医师协会临床肿瘤专业委员会 常委
CSCO胃癌/肝癌/胰腺癌/药物安全委员会 委员
湖北省抗癌协会理事会 副秘书长
湖北省抗癌协会肿瘤内科治疗专业委员会 副主任委员
湖北省抗癌协会胃癌专业委员会 常委
CSCO胃癌指南执笔成员
[1]Zheng RS, Zhang SW, Zeng HM, et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center, 2022, 2(1):1−9.[2]American Cancer Society, Cancer Facts and Figures, 2001-2023. SEER-9 and SEER-18 databases.[3]Versteijne E, van Dam JL, Suker M,et al. Neoadjuvant Chemoradiotherapy Versus Upfront Surgery for Resectable and Borderline Resectable Pancreatic Cancer: Long-Term Results of the Dutch Randomized PREOPANC Trial. J Clin Oncol. 2022 Apr 10;40(11):1220-1230.[4]Neoadjuvant chemotherapy with FOLFIRINOX versus neoadjuvant gemcitabine-based chemoradiotherapy for borderline resectable and resectable pancreatic cancer (PREOPANC-2): A multicenter randomized controlled trial.2023 ESMO LBA83.[5]Bang YJ, Li CP, Lee KH, et al. Liposomal irinotecan in metastatic pancreatic adenocarcinoma in Asian patients: Subgroup analysis of the NAPOLI-1 study. Cancer Sci. 2020;111(2):513-527.[6]Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine. N Engl J Med. 2013 Oct 31;369(18):1691-703.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


