2022年癌症数据统计显示胰腺癌死亡率位居肿瘤相关死亡原因的第四位,其死亡发病比约为0.94,在所有常见瘤种中位列第一[1],反映了其极高的恶性程度和不良预后。据估计,到2030年在美国胰腺癌将成为仅次于非小细胞肺癌的第二大肿瘤相关死因[2]。随着近年来在胰腺癌领域中的不断探索,其5年生存率已从20年前4%提升至12%[3],但胰腺癌患者的生存获益仍亟待进一步的改善。对此学界在胰腺癌基础研究和临床研究一直在持续探索,围绕今年胰腺癌领域的研究进展,特别邀请北京大学第一医院杨尹默教授择取了2023年国际学术年会中的数项胰腺癌领域中代表性研究进行深入解读,共同谈谈胰腺癌进展前沿。
2023 ASCO GI
NAPOLI-3研究公布阳性结果
带来一线治疗方案新可能
①摘要号:LBA66
NAPOLI-3: A randomized, open-label phase 3 study of liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naıve patients with metastatic pancreatic ductal adenocarcinoma (mPDAC)
NAPOLI-3研究:一项伊立替康脂质体+5-氟尿嘧啶/亚叶酸钙+奥沙利铂(NALIRIFOX)对比白蛋白紫杉醇+吉西他滨一线治疗转移性胰腺导管腺癌(mPDAC)患者的随机、开放标签Ⅲ期研究
研究方法:经组织病理学/细胞学证实未经治疗的mPDAC合格患者随机(1:1)在28天治疗周期的第1天和第15天接受NALIRIFOX治疗,或在28天治疗循环周期的第1、8和15天接受白蛋白紫杉醇+吉西他滨(NabP+Gem);随机分组按ECOG表现状态、地理区域和是否存在肝转移进行分层;主要终点是总生存期(OS);次要终点为无进展生存期(PFS)、客观缓解率(ORR)和安全性。
研究结果:共纳入770例患者(NALIRIFOX,n=383;Gem+NabP,n=387)。两组的基线特征可以很好的平衡。中位随访16.1个月,发生了544例事件。
NALIFIROX组中位OS为11.1个月,而Gem+NabP组为9.2个月,中位OS显著延长1.9个月,降低16%死亡风险(HR=0.84[95%CI:0.71–0.99];p=0.04);
NALIFIROX组的中位PFS为7.4个月,而Gem+NabP组为5.6个月,中位PFS显著延长1.8个月,降低30%疾病进展风险(HR=0.70[95CI:0.59–0.84];p=0.0001)。
NALIFIROX组的ORR为41.8%(95%CI:36.8-46.9),而Gem+NabP组为36.2%(95%CI:31.4-41.2)。
接受NALIRIFOX与Gem+NabP治疗的患者中发生率≥10%的3/4级治疗期间不良事件(TEAE)包括腹泻(20.3%vs4.5%)、恶心(11.9%vs2.6%)、低钾血症(15.1%vs4.0%)、贫血(10.5%vs17.4%)和中性粒细胞减少症(14.1%vs24.5%)。
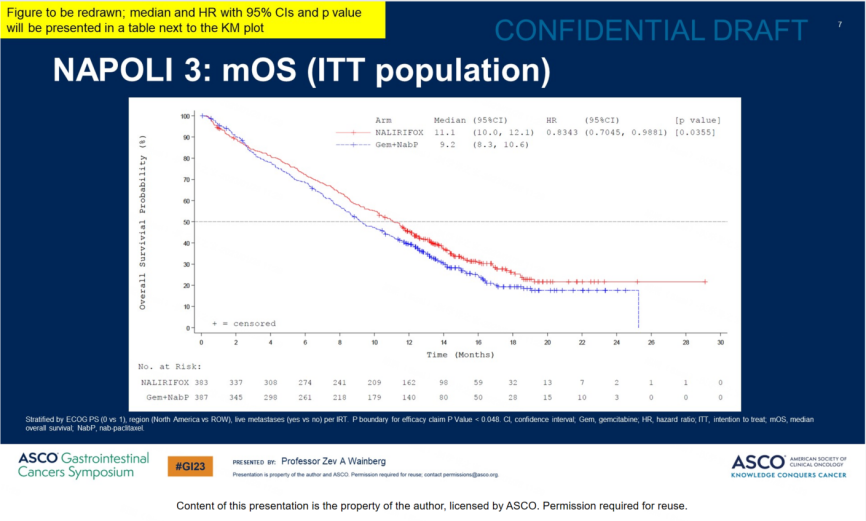
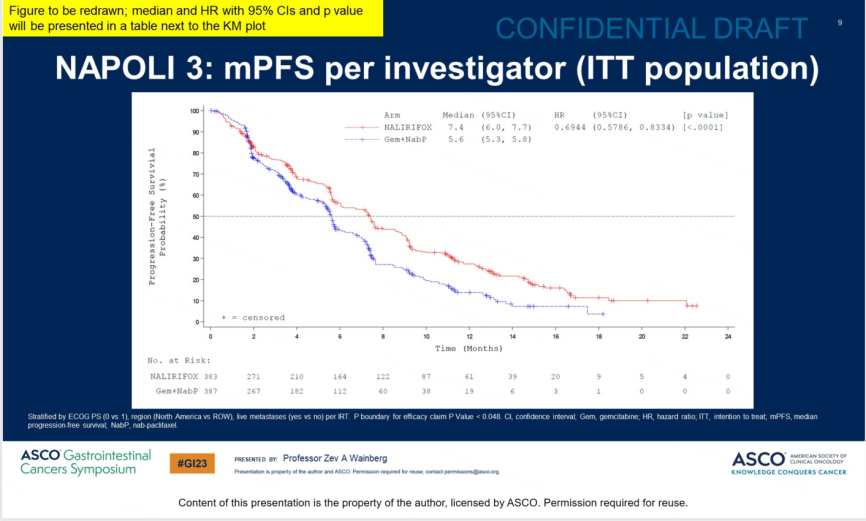
结论:与Gem+NabP相比,NALIRIFOX一线治疗mPDAC的患者,其OS和PFS的改善具有临床意义和统计学意义,且其安全性可控,未见新的安全性信号。
专家点评:在既往的NAPOLI-1研究[4]中,评估了伊立替康脂质体与5-FU/LV联合应用对比5-FU/LV方案治疗吉西他滨治疗失败的晚期胰腺癌的疗效与安全性。研究结果显示接受伊立替康脂质体联合5-FU/LV患者相较于5-FU/LV方案,能为患者带来显著的OS和PFS获益。基于该研究阳性结果,伊立替康脂质体在国内外成功获批胰腺癌二线治疗。
NAPOLI-3研究将伊立替康脂质体探索步伐前移至一线治疗,将FOLFIRINOX升级为NALIRIFOX。在今年ASCO GI上首次重磅公布了NAPOLI-3阳性研究结果,证实了NALIRIFOX方案一线治疗mPDAC可显著延长中位OS和中位PFS,且整体安全性良好。在《NCCN指南》(2023.V2)版中,已将NALIRIFOX作为局部晚期或转移性胰腺癌一线治疗方案推荐。今年ASCO上更新了OS和PFS结果,12个月和18个月的更新结果再次确证NALIRIFOX一线治疗胰腺癌获益。在ESMO GI上公布了NAPOLI 3研究生存敏感性分析结果[5],在ESMO上公布了患者生存质量分析[6]。上述研究结果均提示NALIRIFOX方案既能带来患者生存的延长,同时安全性可控,也能改善患者的生活质量,再次证明方案可能作为一线治疗的获益方案。目前转移性胰腺癌一线治疗主要有FOLFIRINOX方案和AG方案,未来NALIRIFOX方案有望改变临床一线诊疗格局,为临床医生提供更多有效的一线治疗选择。
2023 ASCO
NORPACT-1研究阴性结果
新辅助治疗方案仍有待更多探索
②摘要号:LBA4005
Short-course neoadjuvant FOLFIRINOX versus upfront surgery for resectable pancreatic head cancer: A multicenter randomized phase-II trial (NORPACT-1)
短程FOLFIRINOX新辅助治疗vs直接手术治疗可切除胰腺头癌的多中心随机Ⅱ期研究(NORPACT-1)
研究方法:研究纳入了2017年-2021年期间来自北欧12家中心的140例患者。可切除胰头癌患者被随机分配接受4周期FOLFIRINOX新辅助治疗,随后接受手术和8周期mFOLFIRINOX辅助治疗(新辅助组,n=77),或直接手术和12周期mFOLFIRINOX辅助治疗(直接手术组,n=63)。主要研究终点为OS。

研究结果:新辅助组和直接手术组手术切除率分别为81.8%和88.9%;治疗意向(ITT)人群中术后辅助治疗的起始率分别为66.2%和74.6%。
中位OS(ITT人群):新辅助组(25.1个月)vs 直接手术组(38.5个月)(HR=1.52,95%CI:0.94-2.46,p=0.096)(图6左)。
18个月生存率:新辅助组(60%)vs 直接手术组(73%)(p=0.1)。
安全性:共有120例接受至少1个周期的新辅助和辅助化疗的患者纳入安全性分析,≥3级不良事件(AE)发生率为新辅助组(57.5%)vs 直接手术组(40.4%)。
对于至少接受1周期FOLFIRINOX新辅助治疗的60例胰腺导管腺癌患者和直接手术组的55例患者进行符合方案(PP)分析显示,中位OS:新辅助组(23.0个月)vs (34.4个月)(HR=1.46,95%CI:0.89-2.41,p=0.158)(图6右)。
在PP分析中,新辅助组N0(p=0.002)和R0切除率(p=0.011)较直接手术组高。
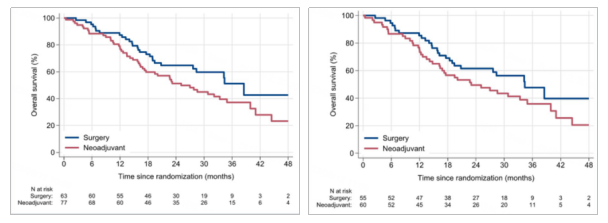
研究结论:与直接手术相比,新辅助FOLFIRINOX治疗未改善可切除胰头癌的OS,该项研究结果不支持新辅助化疗作为标准治疗,后期开展加入基于生物标志物的研究。但新辅助FOLFIRINOX显示出R0切除率的提高,有待进一步的随访结果来验证新辅助治疗组N0和R0切除率改善后的长期疗效。
专家点评:该项研究结果是今年ASCO中备受胰腺癌外科医生关注的一项研究,尽管研究的阴性结果令人较为意外,对于可切除胰腺癌是否需要行新辅助治疗目前仍然缺乏高质量证据。对于该研究的结果需要进行辩证分析,一方面,该项研究是一项Ⅱ期研究,样本量有限,因此不能仅依据单一的研究结果来“一锤定音”,新辅助治疗在可切除胰腺癌中的价值仍有待更多探索,包括新辅助治疗方案、模式、强度及周期,以及基于Biomarker的研究来筛选获益人群来提升新辅助治疗疗效。
另一方面,对于该研究阴性结果需要思考背后原因,由于胰腺癌进展速度较快,在新辅助治疗期间患者可能出现疾病快速进展,由可切除胰腺癌进展为不可切除的局晚期或转移性胰腺癌,从而丧失手术切除机会。患者接受手术直到可以接受辅助治疗的间隔时间较长,可能影响术后辅助治疗疗效。另外FOLFIRINOX方案的高毒性也是影响患者手术和化疗耐受性的重要原因。但目前该研究可以看到新辅助治疗对于R0切除率还是有一定提升,后续可进一步进行亚组分析及更长时间的随访。
目前,NCCN指南、中华医学会指南等均未明确提出对于可切除胰腺癌进行新辅助治疗相关推荐。但是针对有高危因素的胰腺癌,如肿块较大、CA-199较高、伴有明显疼痛的临床症状、分期相对偏晚的胰腺癌患者推荐行新辅助治疗。在指南没有明确推荐的情况下,可继续开展包括交界可切除、局部进展期胰腺癌新辅助治疗相关临床研究,及进一步探索新辅助治疗周期、模式等。
2023 ASCO
免疫治疗小样本回顾性研究添加新证据
③摘要号:P469
Efficacy of immune checkpoint inhibitors in microsatellite unstable/mismatch repair-deficient advanced pancreatic adenocarcinoma:An AGEO European Cohort.
免疫检查点抑制剂在微卫星不稳定/错配修复缺陷型晚期胰腺癌中的疗效:AGEO欧洲队列
研究方法:纳入了2016年2月至2022年5月期间来自16家中心接受免疫检查点抑制剂(ICIs)治疗的31例错配修复缺陷(dMMR)/微卫星高度不稳定(MSI-H)型晚期PDAC患者。
研究结果:中位随访18个月,ORR达48.4%,DCR达67.7%;中位PFS为26.7个月,中位OS尚未达到,12个月和24个月OS率分别为76.2%和64.3%。整体安全性良好,未发生3级以上不良事件。
专家点评:胰腺癌由于其乏血供微环境和抑制性免疫微环境,被称为“冷肿瘤”,免疫治疗难以发挥疗效。在既往的KEYNOTE-158研究[7]中,22例晚期MSI-H型胰腺癌患者在使用帕博利珠单抗治疗后,ORR为18.2%,中位PFS为2.1个月,中位OS为4个月。美国FDA也基于该项研究批准ICI单药治疗MSI-H/dMMR型晚期实体瘤的治疗。但是MSI-H/dMMR型患者在胰腺癌中占比仅为1%[8],获益人群相当有限。同时单药ICI免疫治疗疗效有限,ORR(18.2%)在所有肿瘤中位列最后。在目前CSCO指南中,推荐dMMR/MSI-H转移性胰腺癌一线治疗中体能状态较差的患者可选择PD-1/PD-L1抑制剂(Ⅱ级推荐),二线及以上治疗无论体能状态均可考虑PD-1/PD-L1抑制剂(Ⅲ级推荐),推荐强度相较于胃癌、结直肠癌等瘤种来说力度较弱。
虽然上述研究是一项小样本的回顾性分析研究,但在胰腺癌免疫治疗证据有限的情况下,增添了新的循证医学证据,提示免疫治疗能为dMMR/MSI-H型PDAC患者带来一些的生存获益,增加临床用药信心,具有一定的临床意义和价值。但目前免疫治疗仍只适用于小范围胰腺癌患者群体。未来在双免疫抑制剂、免疫联合放化疗等有待更多探索,期待“个体化”免疫治疗组合疗法能为胰腺癌诊治带来新选择。
2023 ESMO GI
NASOX Ⅰ/Ⅱ期研究一线治疗显示治疗
前景,或带来更便利的一线方案
④摘要号 SO-7
First-line liposomal irinotecan (nal-IRI), oxaliplatin and S-1 (NASOX) in unresectable or metastatic pancreatic ductal adenocarcinoma (PDAC): A phase I/II study
伊立替康脂质体+奥沙利铂+S-1(NASOX)一线治疗不可切除或转移性胰腺导管腺癌(PDAC):一项Ⅰ/Ⅱ期研究
研究方法:既往Ⅰ期研究[9]明确了NASOX方案的Ⅱ期研究推荐剂量(R2PD),该研究纳入了确诊为局部晚期不可切除或转移性PDAC患者,伊立替康脂质体50 mg/m2 D1、奥沙利铂60 mg/m2 D1、S-1 40 mg/m2 BID D1~7,每2周一次。研究旨在确定Ⅰ期研究中的最大耐受剂量、ORR和用药安全性。
研究结果:在截至数据分析时,12例(29%)患者治疗正在进行中。中位随访时间9.7个月。
ORR为58%,分别有1例 (2%) 和23例 (56%) 患者达到疾病完全缓解(CR)和部分缓解(PR)。
中位 PFS 为7.0个月,中位 OS 为12.6个月。
2例Ⅳ期mPDAC患者转为手术治疗而中止研究。
恶心 (66%)、腹泻 (61%)、中性粒细胞减少症 (49%) 和厌食 (39%) 是最常见的任何级别的不良事件,而3-4级中性粒细胞减少症 (29%) 和腹泻 (12%) 是常见的重度不良事件。
研究结论:一线NASOX方案治疗不可切除或mPDAC患者可行且有效。
专家点评:在一线治疗探索中,除了NAPOLI-3研究的NALIRIFOX(伊立替康脂质体+5-FU/LV+奥沙利铂)三药方案已经报告了阳性结果,目前正在开展这项伊立替康脂质体+S-1+奥沙利铂用于不可切除或转移性胰腺癌一线治疗的Ⅰ/Ⅱ期研究(NASOX研究)也已显示出初步的前景。替吉奥(S-1)是一种口服氟尿嘧啶类药物,在临床中也已经有应用。。该研究通过将NALIRIFOX方案中的5-FU/LV(静脉输注)更换为口服替吉奥,对于临床患者用药而言可以避免连续46小时中央静脉导管输注,大大提升了治疗的便利性和患者用药的舒适性。同时研究初步结果表明NASOX方案一线治疗不可切除或转移性胰腺癌患者显示了与NALIRIFOX方案相似的疗效,并有较高的ORR率,且安全性整体可控,未出现新的安全性信号,NASOX方案可能成为便利有效的一线方案选择。期待未来有进一步的Ⅲ期研究继续验证NASOX方案在不可切除和转移性PDAC患者中的疗效和安全性。
2023 ESMO
JCOG1611研究
AG与mFOLFIRINOX和S-IROX方案
在一线治疗的头对头比较
⑤摘要号:1616O
Nab-paclitaxel plus gemcitabine versus modified FOLFIRINOX or S-IROX in metastatic or recurrent pancreatic cancer (JCOG1611, GENERATE): A multicentred, randomized, open-label, three-arm, phase II/III trial
白蛋白紫杉醇联合吉西他滨对比mFOLFIRINOX或S-IROX治疗转移性或复发性胰腺癌(JCOG1611, GENERATE):一项多中心、随机、开放、三臂、Ⅱ/Ⅲ期研究
研究方法:研究共纳入527例转移或复发性胰腺癌患者,被随机分配(1:1:1)至AG组(白蛋白结合紫杉醇125 mg/m²,吉西他滨1000 mg/m²,d1、d8、d15,q4w)、mFOLFIRINOX组(奥沙利铂85 mg/m²,伊立替康150 mg/m²,LV 200 mg/m²,5-FU 2400 mg/m²,d1-3,q2w)和S-IROX组(奥沙利铂85 mg/m²,伊立替康150 mg/m²,S-1 80 mg/m²/天,d1-7,q2w)。第三阶段研究的主要研究终点为OS。
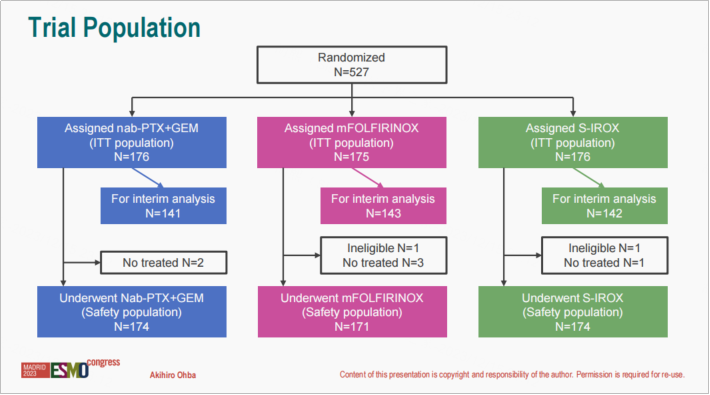
研究结果:426例患者被纳入分析。
在2023年5月最终分析时,AG 组、mFOLFIRINOX 组和 S-IROX 组的中位 OS 分别为 17.0 个月、14.0 个月和 13.6 个月。
在次要终点 PFS 方面,AG 组、mFOLFIRINOX 组和 S-IROX 组的中位 PFS 分别为 6.7 个月、5.8 个月和 6.7 个月。
在安全性方面,mFOLFIRINOX组和S-IROX组最常见3-4级非血液学毒性事件厌食症发生率较AG组更为常见(23.3% vs 27.5% vs 5.0%)。
mFOLFIRINOX方案和S-IROX方案的最终分析疗效预计优越性概率分别为0.73%和0.48%。最终HR值分别为1.31(mFOLFIRINOX)和1.35(S-IROX),未达到试验预期,提前终止。
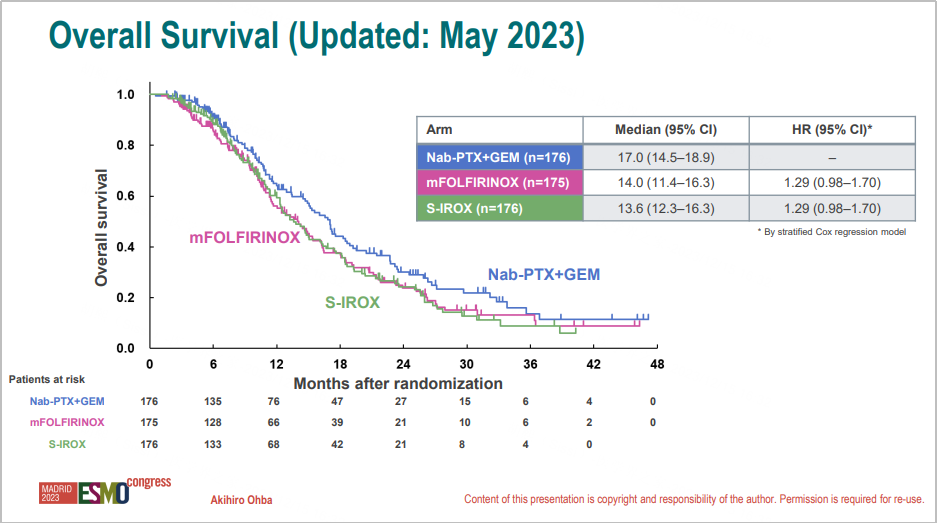
研究结论:与mFOLFIRINOX和S-IROX相比,AG可能是转移性或复发性胰腺癌患者的一线推荐方案。
专家点评:一直以来尚无前瞻性研究头对头比较AG方案和mFOLFIRINOX方案一线治疗晚期胰腺癌的疗效。S-IROX在FOLFIRINOX方案基础上进行改良,替吉奥作为口服氟尿嘧啶类药物增加了用药便利性,但疗效是否一致或者更优不得而知。因此JCOG1611研究旨在评估这AG、mFOLFIRINOX和S-IROX方案在转移性或复发性胰腺癌中的疗效和安全性,该项研究结果表明mFOLFIRINOX和S-IROX方案在OS及安全性方面的表现均不如AG方案。目前晚期胰腺癌一线标准治疗方案包括FOLFIRINOX和AG方案,该项研究将AG方案和mFOLFIRINOX方案进行头对头比较,可能一定程度上影响后续临床医生在一线治疗方案上的选择。尽管最终结果显示不同治疗方案的疗效呈现差异,亚组分析显示在复发性胰腺癌患者中,mFOLFIRINOX方案似乎更优于AG方案。关于一线治疗用药方案,还需要医生结合临床经验和患者实际状况来灵活选择。
2023 ESMO
PREOPANC-2研究
围术期三药化疗与放化疗方案无明显差异
⑥摘要号:LBA83
Neoadjuvant chemotherapy with FOLFIRINOX versus neoadjuvant gemcitabine-based chemoradiotherapy for borderline resectable and resectable pancreatic cancer (PREOPANC-2): A multicenter randomized controlled trial
FOLFIRINOX 新辅助化疗对比吉西他滨新辅助放化疗治疗临界可切除和可切除胰腺癌 (PREOPANC-2):一项多中心随机对照试验
研究设计:PREOPANC-2 Ⅲ期研究在荷兰19家研究中心共纳入375例临界可切除和可切除的胰腺癌患者(需要注意的是荷兰可切除胰腺癌的标准与《NCCN指南》中有所不同),1:1随机接受吉西他滨放化疗[CRT组,接受3个周期的新辅助吉西他滨联合低分割放疗(36Gy/15f,第2周期进行),随后进行手术和4个周期的吉西他滨辅助治疗和FOLFIRINOX(FFX组,每14天接受一次FOLFIRINOX治疗,共8个周期,随后进行手术,术后不行辅助治疗)治疗。研究的主要终点为OS,次要终点包括手术切除率和严重不良事件(SAE)发生率。

研究结果:研究中位随访时间为41.7个月,共发生253起事件。
FFX组和CRT组的中位OS为21.9个月和21.3个月(HR=0.87,95%CI :0.68-1.12;P=0.28)。
FFX 组和 CRT 组的整体手术切除率分别为 77%、75%(P = 0.69),其中两组的 R0 切除率分别为 61%、67%(P = 0.28)。但 CRT 组术后淋巴结阴性(N0)的患者显著多于 FFX 组(58% vs 47%,P<0.01)。
FFX 组和 CRT 组的 SAE 发生率分别为 49%、43%(P = 0.26),3~4 级不良事件的发生率分别为 67%、60%(P = 0.16)。但在 3~4 级腹泻和粒细胞减少性发热方面 CRT 组显著少于 FFX 组。
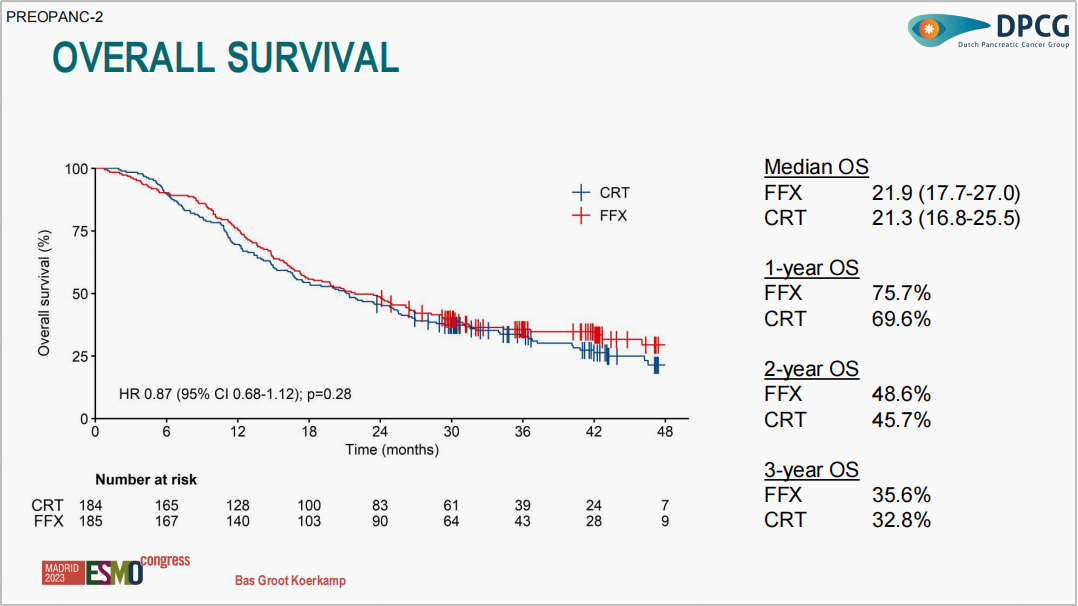
研究结论:对于临界可切除和可切除胰腺癌患者,应用FOLFIRINOX(5-FU+亚叶酸钙+伊立替康+奥沙利铂)与吉西他滨放化疗方案在生存获益、手术切除率及严重不良反应方面未见明显差异。
专家点评:手术治疗仍是胰腺癌可能达到治愈的主要手段,然而胰腺癌患者即使进行了手术切除,仍面临着术后复发高风险问题,术后5年生存率低于20%。因此进一步提升术后患者的5年生存率,探索胰腺癌围术期治疗策略也是临床的一大研究热点,对于新辅助治疗、辅助治疗在胰腺癌围术期治疗模式和价值有待进一步明晰。
既往的PREOPANC研究证实了基于吉西他滨的新辅助放化疗较单纯手术治疗能进一步提升R0切除率,PREOPANC-2研究对比了FOLFIRINOX新辅助治疗是否优于基于吉西他滨新辅助放化疗。研究结果表明在临界可切除和可切除胰腺癌患者中,FOLFIRINOX新辅助化疗与以吉西他滨为基础的新辅助放化疗两种方案在生存获益、手术切除率及SAE方面旗鼓相当,未见明显差异。但吉西他滨新辅助放化疗组术后淋巴结阴性(N0)的患者明显高于FOLFIRINOX新辅助化疗组,且腹泻发生率更少。对于FOLFIRINOX新辅助化疗与以吉西他滨为基础的新辅助放化疗孰优孰劣没有定论,未来需要更多研究去探索临界可切除和可切除胰腺癌患者的最佳新辅助治疗方案、以及新辅助治疗究竟可带来多少获益。
2023 ESMO AISA
首个关于DpR和ETS可能作为胰腺癌
标准化疗后OS预测因素的研究
⑦摘要号:151P
Relationship between depth of response and early tumor shrinkage with overall survival in advanced pancreatic cancer
晚期胰腺癌肿瘤缓解深度(DpR)和肿瘤早期退缩(ETS)与总生存期的关系
研究方法:本研究是作为2项多中心回顾性研究(NAPOLEON和NAPOLEON-2)的一部分进行的,研究对象为有可测量病灶的晚期胰腺癌患者。队列1有292例患者,接受吉西他滨/白蛋白紫杉醇(GnP,184例)和FOLFIRINOX(FFX,108例)作为一线化疗,队列2有88例患者,接受伊立替康脂质体+5FU/LV作为二线化疗。通过DpR将患者分为3组:对照组(A组)、应答者(B组)和深度应答者(C组)。ETS定义为从治疗开始至第二次评价降低肿瘤退缩比例≥20%。
研究结果:
在队列1中,A组的DpR为-2.3%至1550%,B组为-28.6至-2.5%,C组为-100.0%至-28.6%。C组和B组的中位OS显著长于A组,分别为17.2个月、11.5个月和8.4个月(HR=0.30,p < 0.01;和HR=0.58,p < 0.01)
队列1中达到肿瘤早期退缩超过20%相较于未达到的中位OS显著更长(HR 0.46,p < 0.01)。
在队列2中,A组DpR 为18.4 至128.6%,B组DpR 为−2.9 至17.9%,C组DpR 为-80.0至-3.2%。C组中位OS为10.9个月,显著长于A组的4.6 个月(HR=0.33p < 0.01),但B组中位OS为6.8个月,与A组的差异无统计学意义(p = 0.10)。
研究结论:DpR和ETS可能作为接受标准化疗胰腺癌患者OS的预测因素。
专家点评:此前已有其他瘤种的研究表明DpR、ETS可能与患者的OS及PFS延长相关,但是由于缺乏统一的判定标准等原因,尚未在临床使用中推广。这是首个关于DpR和ETS可能作为胰腺癌标准化疗后OS预测因素的报道,在该项研究中,研究结果表明DpR和ETS可能作为胰腺癌标准化疗后OS预测因素。临床中不同患者对治疗方案的反应及生存获益存在差别,通过早期有效的预测指标可以帮助患者筛选治疗方案,未来有待进一步评估把DpR和ETS作为预测因素的有效性,为“个性化”定制肿瘤治疗反应预测和选择临床诊疗方案提供重要依据。
总 结
本文筛选了今年学术年会中胰腺癌领域中颇具代表性的数项研究,NAPOLI-3研究作为大型Ⅲ期研究有较高的循证医学证据级别,为晚期胰腺癌一线治疗带来了更多有效的用药方案。在晚期胰腺癌一线治疗探索中,NASOX相关研究的开展旨为在有疗效获益和安全性的前提下,能为胰腺癌患者提供更为便利性更高、治疗体验更好、更具人文关怀的用药选择。不同一线方案的头对头比较也为临床上治疗方案的选择带来提示,临床医生需根据临床实际情况为患者选择适宜的一线治疗方案。
围绕胰腺癌围术期治疗方案,虽然NORPACT-1研究和PREOPANC-2研究未能提供明确的新辅助治疗方案,期待更多高质量的研究探索、更精准的人群划分以及更多新型药物的研发,未来能够在胰腺癌新辅助治疗领域带来突破。另外,虽然今年免疫治疗的一项小样本研究证据有限,但“积微成著”,增加了一些在胰腺癌领域对于免疫治疗应用的经验。
在免疫、靶向治疗时代里,我们看到众多实体瘤在5年生存率中一次次获得新的突破,胰腺癌有着“癌王”之称,通过近些年研究者、医学工作者及制药企业的不断努力,也将胰腺癌的5年生存率倍速式地提升。尽管胰腺癌生存获益目前相较于其他瘤种仍十分有限,但相信在现有药物的基础上通过剂量调整、组合药物、方案变换等不断探索下,未来在精准、联合、整合的基础上,在新药研究上持续发力,希望为胰腺癌患者的治疗前景带来改善。
专家简介
医学博士 主任医师 教授 博士研究生导师
【专业特长】各种类型肝胆胰腺手术,执笔撰写多版《中国胰腺癌诊疗指南》
【学术任职】中华医学会外科学分会胰腺学组副组长,美国外科学院会员(FACS),中国研究型医院学会消化道肿瘤专业委员会副主任委员,中华医学会外科学分会委员,中华肝胆外科杂志、中华普通外科杂志、中华消化外科杂志副主编,中国实用外科杂志、中华实验外科、世界胃肠病学杂志、Langenbeck Archivesof Surgery杂志编委。
【曾获奖项】曾获2019年华夏医学科技奖三等奖、2022年中国抗癌协会科技奖二等奖。荣获“国之名医,卓越建树”奖、“金柳叶刀奖”、北京市优秀教师称号。
[1] Zheng RS, Zhang SW, Zeng HM, et al. Cancer incidence and mortality in China, 2016. J Natl Cancer Center, 2022, 2(1):1−9.
[2] Rahib L, Smith BD, Aizenberg R, Rosenzweig AB, Fleshman JM, Matrisian LM: Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer research 2014, 74(11):2913-2921.
[3] American Cancer Society, Cancer Facts and Figures, 2001-2023. SEER-9 and SEER-18 databases.
[4] Bang YJ, Li CP, Lee KH, et al. Liposomal irinotecan in metastatic pancreatic adenocarcinoma in Asian patients: Subgroup analysis of the NAPOLI-1 study.Cancer Sci. 2020;111(2):513-527.
[5] D. Melisi,et al. 2023 ESMO abstract 1619P.
[6] Z. Wainberg et al. Liposomal irinotecan + 5-fluorouracil/leucovorin + oxaliplatin (NALIRIFOX) versus nab-paclitaxel + gemcitabine in treatment-naive patients with metastatic pancreatic ductal adenocarcinoma: sensitivity analysis of survival from the NAPOLI 3 trial.2023WCGIC Abstr.O-1.
[7] Marabelle A, Le DT, Ascierto PA, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the PhaseⅡKEYNOTE-158 Study[J]. J Clin Oncol, 2020, 38(1): 1-10.
[8] LuchiniC, BrosensL, WoodLD, et al. Comprehensive characterisation of pancreatic ductal adenocarcinoma with microsatellite instability: histology, molecular pathology and clinical implications[J]. Gut, 2021, 70(1):148-156.
[9] Wainberg ZA, Bekaii-Saab T, Boland PM, et al. First-line liposomal irinotecan with oxaliplatin, 5-fluorouracil and leucovorin (NALIRIFOX) in pancreatic ductal adenocarcinoma: A phase I/II study. Eur J Cancer. 2021 Jul;151:14-24.
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


