
摘要
目的 分析肝细胞癌患者肝移植术后长期生存及肿瘤复发情况以及预后影响因素。
方法 回顾性分析2000年5月1日至2012年5月1日在北京大学人民医院肝胆外科因原发性肝癌进行肝移植手术的228例患者资料,共有166例患者满足入组条件。收集患者围手术期及随访资料,分析其总体生存率、无瘤生存率及其影响因素。
结果 166例肝细胞癌患者肝移植术后1、5、10年总体生存率和无瘤生存率分别为80.7%、52.4%、45.8%和60.2%、47.6%、44.0%,其中符合加州大学旧金山分校(University of California,San Francisco,UCSF)标准患者共96例,术后1、5、10年总体生存率和无瘤生存率分别为83.3%、66.7%、59.4%和74.0%、62.5%、57.3%。多因素分析发现,超出UCSF标准、移植前甲胎蛋白(alpha fetoprotein,AFP)≥ 400 ng/ml及组织学低分化是影响总体生存率及无瘤生存率的独立危险因素,差异有统计学意义(均 P < 0.05)。
结论 肝移植是治疗肝细胞癌的有效手段。除了肿瘤大小及个数之外,移植前AFP ≥ 400 ng/ml及组织学低分化也是肝细胞癌患者预后不良的高危因素。

一、研究对象
回顾性分析2000年5月1日至2012年5月1日在北京大学人民医院肝胆外科因HCC进行肝移植手术的228例患者的临床及随访资料。纳入标准:(1)术后病理确诊为HCC;(2)术后规律随访至患者死亡或术后生存时间超过10年,随访截止日期为2022年5月1日。排除标准:(1)术后病理确诊为胆管细胞癌、混合型肝癌等其他原发性肝癌;(2)有大血管侵犯;(3)资料不完整,无法统计分析。共入组166例患者,其中男142例(85.5%),女24例(14.5%),年龄17~72岁,平均年龄(51 ± 3)岁。
将上述患者按照肝移植术后是否长期生存分为生存时间≥ 10年组及生存时间< 10年组。比较两组患者的性别、年龄、是否有病毒性肝炎(乙肝、丙肝)、肝储备功能分级(Child分级)、终末期肝病模型(model for end-stage liver disease,MELD)评分、移植前甲胎蛋白(alpha fetoprotein,AFP)水平、手术时间、术中无肝期时间、冷缺血时间、术中输血量、是否满足加州大学旧金山分校(University of California,San Francisco,UCSF)标准、有无微卫星灶、肿瘤组织学分化程度、总体生存时间、无瘤生存时间等资料,分析HCC肝移植患者总体生存率和无瘤生存率的影响因素。
二、免疫抑制剂使用方案
所有的肝移植患者术后均接受他克莫司/环孢霉素 + 霉酚酸酯 + 激素的三联免疫抑制方案,如果没有急性排斥反应,激素使用时间一般不超过1个月。其中18例最初采用环孢霉素 + 霉酚酸酯 + 激素,并在2003年后将环孢霉素替换成他克莫司。长期存活的患者中,多采用他克莫司单药免疫抑制方案,并将他克莫司浓度控制在< 5 μg/L这一较低的浓度范围内;若出现HCC复发,则替换为西罗莫司免疫抑制治疗。
三、乙肝患者围手术期抗病毒治疗方案
合并乙肝的患者,肝移植术前口服拉米夫定或者恩替卡韦抗病毒治疗,并在术中无肝期给予乙肝免疫球蛋白2 000 IU静脉注射,术后继续口服拉米夫定或恩替卡韦,同时监测乙肝表面抗原(hepatitis B surface antigen,HBsAg)、乙肝病毒脱氧核糖核酸(hepatitis B virus-deoxyribonucleic acid,HBV DNA)及乙肝表面抗体(hepatitis B surface antibody,HBsAb)滴度以确定继续注射乙肝免疫球蛋白的剂量及频率,预防乙肝复发。
四、随访方法
术后对患者规律随访,包括电话问询、门诊检查、住院复查等方式。检查项目包括:血常规、肝肾功能、他克莫司血药浓度、AFP、肝炎病毒相关检查、CT或MRI等。术后发现HCC复发者,根据个体情况行再次肝移植、手术切除、局部消融、经肝动脉栓塞化疗等方法治疗。
五、统计学分析
采用SPSS 20.0。使用独立样本 t 检验比较组间符合正态分布的数据,使用Kaplan-Meier法绘制总体生存曲线及无瘤生存曲线,使用Cox比例风险模型进行单因素及多因素分析, P < 0.05为差异有统计学意义。

随访日期截至2022年5月1日,所有166例患者均获得有效随访,平均随访时间(94 ± 60)个月,术后1、5、10年总体生存率分别为80.7%、52.4%和45.8%,1、5、10年的无瘤生存率分别为60.2%、47.6%和44.0%。共有68例患者复发转移,其中移植肝内转移12例,肝外转移28例,肝内、外同时转移28例。
二、影响HCC肝移植患者总体生存的危险因素分析
对所有166例患者的生存时间进行单因素分析发现,是否合并病毒性肝炎、术前AFP是否超过400ng/ml、是否满足UCSF标准、肿瘤组织学分化程度以及是否合并微卫星灶是独立危险因素,差异有统计学意义(均 P< 0.05),见表1。
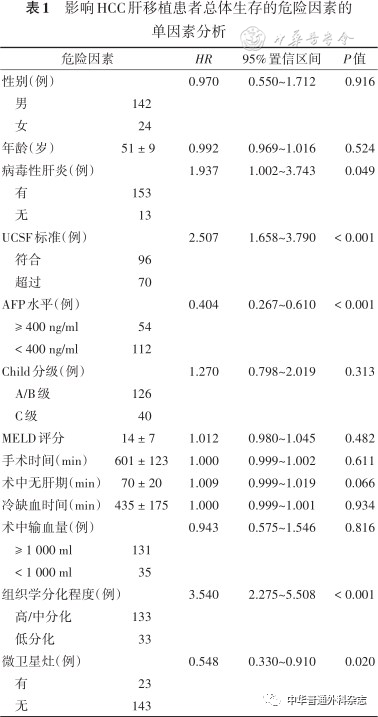
表1 影响HCC肝移植患者总体生存的危险因素的单因素分析
进一步进行多因素分析发现,肝移植术前AFP ≥ 400 ng/ml、超过UCSF标准及组织学低分化是影响其生存的独立危险因素(均 P< 0.05)(表2)。满足UCSF标准患者与超过UCSF标准患者的术后1、5、10年的总体生存率分别为83.3%、66.7%、59.4%和77.1%、32.9%、27.1%(图1);AFP < 400 ng/ml和AFP ≥ 400 ng/ml患者的术后1、5、10年的总体生存率分别为87.5%、65.2%、56.3%和66.7%、25.9%、24.1%(图2);组织学高/中分化和组织学低分化患者的术后1、5、10年的总体生存率分别为85.7%、61.7%、55.6%和57.6%、15.2%、6.1%(图3)。
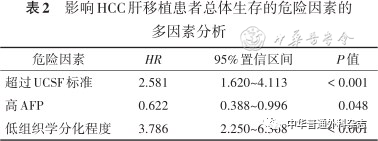
表2 影响HCC肝移植患者总体生存的危险因素的多因素分析

图1 满足与超过UCSF标准HCC肝移植患者总体生存曲线比较
图2 不同移植前AFP水平HCC肝移植患者总体生存曲线比较
图3 组织学分化程度不同的HCC肝移植患者总体生存曲线比较
三、影响HCC肝移植患者无瘤生存的危险因素分析
统计所有166例患者的无瘤生存时间并进行单因素分析发现,是否合并病毒性肝炎、是否满足UCSF标准、术前AFP是否超过400ng/ml、组织学分化程度以及是否合并微卫星灶是影响HCC肝移植患者无瘤生存的独立危险因素,差异有统计学意义( P< 0.05),见表3。
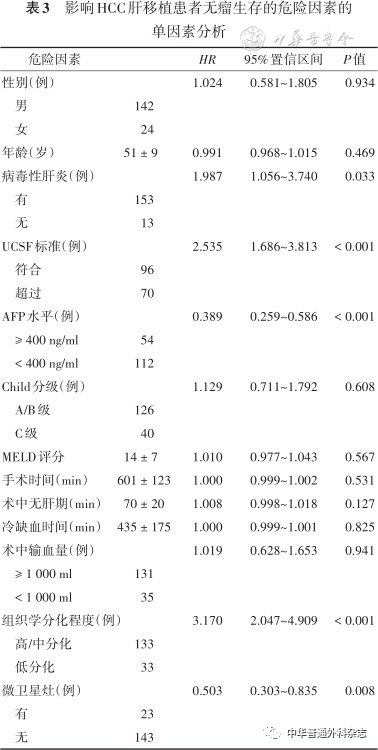
表3 影响HCC肝移植患者无瘤生存的危险因素的单因素分析
进一步进行多因素分析发现,肝移植超过UCSF标准、术前AFP ≥ 400 ng/ml以及组织学低分化,是影响无瘤生存的独立危险因素( P< 0.05)(表4)。满足UCSF标准患者与超过UCSF标准患者的术后1、5、10年的无瘤生存率分别为74.0%、62.5%、57.3%和41.4%、27.1%、25.7%(图4),AFP < 400 ng/ml和AFP ≥ 400 ng/ml患者的术后1、5、10年的无瘤生存率分别为73.2%、59.8%、54.5%和31.5%、22.2%、22.2%(图5);组织学高/中分化和组织学低分化患者的术后1、5、10年的无瘤生存率分别为67.7%、55.6%、53.4%和30.3%、15.2%、6.1%(图6)。
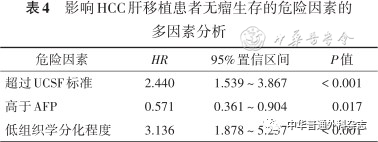
表4 影响HCC肝移植患者无瘤生存的危险因素的多因素分析

图4 满足与超过UCSF标准HCC肝移植患者无瘤生存曲线比较
图5 不同AFP水平HCC肝移植患者无瘤生存曲线比较
图6 组织学分化程度不同的HCC肝移植患者无瘤生存曲线比较
四、生存时间≥ 10年组和生存时间< 10年组患者情况比较
肝移植术后生存时间≥ 10年组患者共有76例(45.8%),其中存活时间最长的患者已达20年;生存时间< 10年组患者共有90例(54.2%)。生存时间 ≥ 10年组中,术前AFP ≥ 400 ng/ml、超过UCSF标准、组织学低分化及合并微卫星灶的患者人数显著低于生存时间< 10年组( P< 0.05),而在性别、年龄、是否合并病毒性肝炎、Child分级、MELD评分、手术时间、术中无肝期、冷缺血时间及术中输血量方面,两组则差异无统计学意义( P> 0.05),见表5。
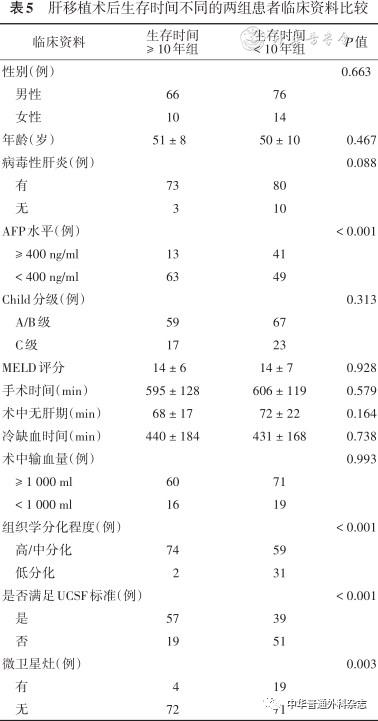
表5 肝移植术后生存时间不同的两组患者临床资料比较
五、生存时间≥ 10年组患者其他随访资料
生存时间≥ 10年组的76例患者中,HCC复发转移3例(3.9%):其中1例术后20个月出现移植肝复发,行二次肝移植后无瘤存活至今;1例患者术后14个月出现肺转移,行γ刀治疗后无瘤存活至今;另1例术后7个月出现腹腔大网膜转移,手术切除后未再复发。4例(5.3%)患者术后新发其他器官恶性肿瘤:1例患者术后6年新发结肠癌,行根治性手术后无瘤存活至今;1例患者术后7年新发肾癌,行根治性手术后无瘤存活至今;1例患者术后13年新发胃癌,无根治性手术机会,发现2个月后因胃癌死亡;1例患者术后14年新发肺癌,行根治性手术后无瘤存活至今。该组患者术后新发肾功能不全13例(17.1%),糖尿病15例(19.7%),高血压12例(15.8%),高脂血症1例(1.3%),胆道并发症12例(15.8%),血管并发症2例(2.6%),其中,出现胆道并发症及血管并发症的患者经过介入治疗或手术治疗后均好转。共有4例患者死亡,其中1例因新发胃癌死亡,3例因心血管并发症死亡。

在我国,多数HCC患者有乙肝、肝硬化背景,而肝移植既可以完整切除肿瘤,又可以同时移除肝炎肝硬化的肝脏组织,是目前公认的治疗HCC的有效手段之一 [3, 4] 。Vitale等 [5] 对1 028例合并肝硬化的HCC患者进行的多中心回顾性研究发现,肝移植组患者的10年总体生存率高于肝切除组。Meng等 [6] 对1 255例单一结节的HCC患者进行的回顾性研究发现,相对于肝切除及消融,肝移植具有较高的10年生存率。本中心无大血管侵犯的HCC患者,肝移植术后10年总体生存率及无瘤生存率分别为45.8%和44.0%,与文献报道结果相近 [7, 8, 9, 10] 。HCC肝移植术后复发严重影响患者长期生存 [11] ,其中大血管侵犯是公认的HCC复发的高危因素。本项回顾性研究剔除了大血管侵犯的HCC患者,研究评估其他影响HCC肝移植患者长期生存及肿瘤复发的危险因素。
米兰标准是目前得到广泛认可的HCC肝移植标准 [12] ,但由于其标准过于严格,让很多HCC患者失去了行肝移植的机会。近年来的研究则发现,适当扩大米兰标准,既不显著降低术后生存率,又能有效扩大肝移植受者人群。我国最新的《原发性肝癌诊疗指南(2022年版)》推荐采用UCSF标准,即①单个肿瘤直径≤ 6.5 cm;②肿瘤数目≤ 3个且最大直径≤ 4.5 cm,肿瘤直径之和≤ 8 cm;③无肝内大血管侵犯及肝外转移 [13] 。对于满足UCSF标准的HCC患者,肝移植相对于手术切除及消融等,可以获得更好的总体生存率及无瘤生存率 [14] 。本中心满足UCSF标准的HCC患者肝移植后10年的总体生存率及无瘤生存率分别为59.4%和57.3%,均显著高于超过UCSF标准的患者,与文献报道结果相近 [15] 。
近年来,越来越多的学者提出,肿瘤大小、数目等形态学因素无法完全反映HCC的生物学特性。国内常用的杭州标准首次引入肿瘤生物学特性和病理学特征作为肝移植受者选择标准,并且多项研究均证实满足杭州标准的HCC患者肝移植术后可以获得满意的术后生存率 [16, 17] 。以AFP为代表的反映肿瘤生物学特性的分子标记物也可以预测HCC肝移植术后复发风险 [18] 。AFP与HCC的分化及血管侵犯程度相关,移植前AFP水平升高往往提示肝移植术后HCC复发风险较高 [19] 。那么预测HCC肝移植术后复发的AFP临界值是多少呢?目前尚存在争议。肝移植法国研究小组发现,术前AFP > 1 000 ng/ml的HCC患者,即使满足米兰标准,其术后5年HCC复发率仍较高;而超出米兰标准但术前AFP < 100 ng/ml的患者,术后5年HCC复发率较低 [20] 。国内外有些学者则将AFP的临界值定为400 ng/ml [21] 。本中心的数据也显示,术前AFP ≥ 400 ng/ml的HCC患者肝移植后的总体生存率和无瘤生存率均显著低于AFP < 400 ng/ml的患者。
肿瘤分化程度、微卫星灶、微血管侵犯(microvascular invasion,MVI)等也是HCC患者肝移植后长期生存及肿瘤复发的影响因素。EI-Fattah [22] 分析了美国国家癌症研究所监测、流行病学和最终结果数据库的数据发现,移植前穿刺活检提示肿瘤低分化及合并MVI是直径 ≥ 2 cm的HCC患者肝移植后预后不良的高危因素,但并不影响直径 < 2 cm的HCC肝移植患者的长期生存。Zeair等 [23] 进行的单中心回顾性研究发现,HCC分化程度差是肝移植术后HCC复发的高危因素。本研究也发现,高/中分化的HCC患者肝移植后总体生存率及无瘤生存率显著高于低分化的HCC患者,是否合并微卫星灶虽然不是影响HCC患者肝移植后的总体生存率及无瘤生存率的危险因素,但肝移植后生存时间≥ 10年的患者中,合并微卫星灶的患者人数显著低于生存时间 < 10年的患者。需要注意的是,肝移植术前获得肿瘤组织学标本的常用方法是穿刺活检,但其并不是HCC诊断的必备条件,并且HCC具有高度异质性 [24] 。Court等 [25] 进行的回顾性研究发现,术前穿刺活检获得的HCC组织学分级与移植后获得的HCC组织学分级不符,并且穿刺活检病理提示分化程度差,不是HCC肝移植术后复发的高危因素。与此同时,有些患者因为肿瘤的位置及严重的凝血障碍等原因无法在移植术前行穿刺活检。因此,肝移植术前穿刺活检病理作为HCC肝移植的标准尚存在争议 [26] 。
HCC肝移植术后复发转移是影响患者生存的重要因素之一。针对具有高复发风险的HCC肝移植术后的部分患者,尤其是超移植标准的患者,分子靶向药物及系统性化疗可能有助于预防复发,提供生存获益;而对于HCC肝移植后复发的患者,若复发灶可切除,手术切除则是首选治疗方案 [27] 。本研究发现,76例生存时间≥ 10年的患者中仅有3例出现肝移植术后HCC复发,复发率3.9%,经手术切除复发灶后,上述患者均获得长期生存。受限于本研究是一项回顾性研究,针对HCC肝移植术后高复发风险患者合适的术后辅助治疗方案还需要进一步随访研究。此外,本研究也发现对于生存时间超过10年的患者,长期使用免疫抑制剂所致糖尿病、高血压、高脂血症、肾功能损害及新发肿瘤也是影响其长期存活及生存质量的重要因素。Dopazo等 [28] 回顾性分析了28例存活时间超过20年的肝移植患者资料,其术后肾功能损害、糖尿病、高血压、高脂血症及新发肿瘤的发生率分别为40%、21%、61%、43%和25%。Park等 [29] 进行的回顾性研究发现,肝恶性肿瘤肝移植术后新发恶性肿瘤发生率为4.4%,显著高于良性肝病肝移植组患者,发生率由高至低依次为:移植后淋巴系统增生性疾病、肺癌、胃癌、结肠癌及膀胱癌。Aguiar等 [30] 进行的多中心真实世界研究发现,因肾功能损伤而减少肝移植术后免疫抑制剂用量后,肾功能可较前有显著改善。本中心肝移植术后生存时间≥ 10年的HCC患者的他克莫司浓度控制在< 5 μg/L这一较低的浓度范围内。
综上所述,肝移植是治疗HCC的有效手段,对于满足特定移植标准的患者可以获得良好的长期生存。除了肿瘤大小及个数之外,移植前AFP ≥400 ng/ml及组织学低分化是HCC患者预后不良的高危因素。对于HCC肝移植后长期存活的患者随访,除了肝功能、肿瘤指标及免疫抑制剂水平之外,也不能忽视肾功能、血糖、血压、血脂及心功能的监测评估,有助于提高患者生活质量,改善长期生存。
[1] 中华人民共和国国家卫生健康委员会医政医管局. 原发性肝癌诊疗指南(2022年版) [J].中华消化外科杂志,2022,21(2):143-168. DOI: 10.3760/cma.j.cn115610-20220124-00053 .
[2] Kanneganti M, Mahmud N, Kaplan DE, et al. Survival benefit of liver transplantation for hepatocellular carcinoma [J]. Transplantation, 2020,104(1):104-112. DOI: 10.1097/TP.0000000000002816 .
[3] Pinna AD, Yang T, Mazzaferro V, et al. Liver transplantation and hepatic resection can achieve cure for hepatocellular carcinoma [J]. Ann Surg, 2018,268(5):868-875. DOI: 10.1097/SLA.0000000000002889 .
[4] Mehta N, Bhangui P, Yao FY, et al. Liver transplantation for hepatocellular carcinoma. working group report from the ILTS transplant oncology consensus conference [J]. Transplantation, 2020,104(6):1136-1142. DOI: 10.1097/TP.0000000000003174 .
[5] Vitale A, Cucchetti A, Qiao GL, et al. Is resectable hepatocellular carcinoma a contraindication to liver transplantation? A novel decision model based on "number of patients needed to transplant" as measure of transplant benefit [J]. J Hepatol, 2014,60(6):1165-1171. DOI: 10.1016/j.jhep.2014.01.022 .
[6] Meng F, Zhang H, Peng H, et al. Comparison of 10-year survival outcomes for early single hepatocellular carcinoma following different treatments [J]. Biomed Res Int, 2021,2021:6638117. DOI: 10.1155/2021/6638117 .
[7] Doyle MB, Vachharajani N, Maynard E, et al. Liver transplantation for hepatocellular carcinoma: long-term results suggest excellent outcomes [J]. J Am Coll Surg, 2012,215(1):19-30. DOI: 10.1016/j.jamcollsurg.2012.02.022 .
[8] Otto G, Pitton MB, Hoppe-Lotichius M, et al. liver transplantation and BCLC classification: limitations impede optimum treatment [J]. Hepatobiliary Pancreat Dis Int, 2021,20(1):6-12. DOI: 10.1016/j.hbpd.2020.12.009 .
[9] Herrero JI, Sangro B, Pardo F, et al. Liver transplantation in patients with hepatocellular carcinoma across Milan criteria [J]. Liver Transpl, 2008,14(3):272-278. DOI: 10.1002/lt.21368 .
[10] Donat M, Alonso S, Pereira F, et al. Impact of histological factors of hepatocellular carcinoma on the outcome of liver transplantation [J]. Transplant Proc, 2016,48(6):1968-1977. DOI: 10.1016/j.transproceed.2016.04.002 .
[11] Foerster F, Hoppe-Lotichius M, Vollmar J, et al. Long-term observation of hepatocellular carcinoma recurrence after liver transplantation at a European transplantation centre [J]. United European Gastroenterol J, 2019,7(6):838-849. DOI: 10.1177/2050640619840221 .
[12] Mazzaferro V, Regalia E, Doci R, et al. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis [J]. N Engl J Med, 1996,334(11):693-699. DOI: 10.1056/NEJM199603143341104 .
[13] Yao FY, Xiao L, Bass NM, et al. Liver transplantation for hepatocellular carcinoma: validation of the UCSF-expanded criteria based on preoperative imaging [J]. Am J Transplant, 2007,7(11):2587-2596. DOI: 10.1111/j.1600-6143.2007.01965.x .
[14] Xu X, Pu X, Jiang L, et al. Living donor liver transplantation or hepatic resection combined with intraoperative radiofrequency ablation for Child-Pugh A hepatocellular carcinoma patient with Multifocal Tumours Meeting the University of California San Francisco (UCSF) criteria [J]. J Cancer Res Clin Oncol, 2021,147(2):607-618. DOI: 10.1007/s00432-020-03364-x .
[15] Qu Z, Ling Q, Gwiasda J, et al. Hangzhou criteria are more accurate than Milan criteria in predicting long-term survival after liver transplantation for HCC in Germany [J]. Langenbecks Arch Surg, 2018,403(5):643-654. DOI: 10.1007/s00423-018-1696-8 .
[16] Xu X, Lu D, Ling Q, et al. Liver transplantation for hepatocellular carcinoma beyond the Milan criteria [J]. Gut, 2016,65(6):1035-1041. DOI: 10.1136/gutjnl-2014-308513 .
[17] Chen J, Shen T, Li J, et al. Clinical practice guideline on liver transplantation for hepatocellular carcinoma in China (2021 edition) [J]. Chin Med J (Engl), 2022,135(24):2911-2913. DOI: 10.1097/CM9.0000000000002515 .
[18] Mehta N, Heimbach J, Harnois DM, et al. Validation of a risk estimation of tumor recurrence after transplant (RETREAT) score for hepatocellular carcinoma recurrence after liver transplant [J]. JAMA Oncol, 2017,3(4):493-500. DOI: 10.1001/jamaoncol.2016.5116 .
[19] Özdemir F, Baskiran A. The importance of AFP in liver transplantation for HCC [J]. J Gastrointest Cancer, 2020,51(4):1127-1132. DOI: 10.1007/s12029-020-00486-w .
[20] Duvoux C, Roudot-Thoraval F, Decaens T, et al. Liver transplantation for hepatocellular carcinoma: a model including α-fetoprotein improves the performance of Milan criteria [J]. Gastroenterology, 2012,143(4):986-994. DOI: 10.1053/j.gastro.2012.05.052 .
[21] Citores MJ, Lucena JL, de la Fuente S, et al. Serum biomarkers and risk of hepatocellular carcinoma recurrence after liver transplantation [J]. World J Hepatol, 2019,11(1):50-64. DOI: 10.4254/wjh.v11.i1.50 .
[22] El-Fattah MA. Hepatocellular carcinoma biology predicts survival outcome after liver transplantation in the USA [J]. Indian J Gastroenterol, 2017,36(2):117-125. DOI: 10.1007/s12664-017-0732-x .
[23] Zeair S, Rajchert J, Stasiuk R, et al. Recurrence of hepatocellular carcinoma after liver transplantation: a single-center experience [J]. Ann Transplant, 2019,24:499-505. DOI: 10.12659/AOT.918150 .
[24] Friemel J, Rechsteiner M, Frick L, et al. Intratumor heterogeneity in hepatocellular carcinoma [J]. Clin Cancer Res, 2015,21(8):1951-1961. DOI: 10.1158/1078-0432.CCR-14-0122 .
[25] Court CM, Harlander-Locke MP, Markovic D, et al. Determination of hepatocellular carcinoma grade by needle biopsy is unreliable for liver transplant candidate selection [J]. Liver Transpl, 2017,23(9):1123-1132. DOI: 10.1002/lt.24811 .
[26] Sapisochin G, Bruix J. Liver transplantation for hepatocellular carcinoma: outcomes and novel surgical approaches [J]. Nat Rev Gastroenterol Hepatol, 2017,14(4):203-217. DOI: 10.1038/nrgastro.2016.193 .
[27] 中国医师协会器官移植医师分会, 中华医学会器官移植学分会肝移植学组. 中国肝癌肝移植临床实践指南(2021版) [J].中华消化外科杂志,2022,21(4):433-443. DOI: 10.3760/cma.j.cn115610-20220316-00135 .
[28] Dopazo C, Bilbao I, Castells LL, et al. Analysis of adult 20-year survivors after liver transplantation [J]. Hepatol Int, 2015,9(3):461-470. DOI: 10.1007/s12072-014-9577-x .
[29] Park GC, Hwang S, Ahn CS, et al. Pretransplant hepatic malignancy increases risk of De Novo malignancy after liver transplantation [J]. J Korean Med Sci, 2020,35(11):e69. DOI: 10.3346/jkms.2020.35.e69 .
[30] Aguiar D, Martínez-Urbistondo D, Baroja-Mazo A, et al. Real-world multicenter experience of immunosuppression minimization among 661 liver transplant recipients [J]. Ann Transplant, 2017,22:265-275. DOI: 10.12659/aot.902523 .











 苏公网安备32059002004080号
苏公网安备32059002004080号


