急性髓系白血病(AML)是一种好发于老年人、常伴随分子生物学异常、高度异质性的血液系统恶性肿瘤。目前“3+7”化疗方案和维奈克拉(VEN)联合阿扎胞苷(AZA)是新诊断(ND)AML的标准治疗方案,但初始治疗无应答、缓解后复发和复发后预后差是AML治疗失败的主要原因和挑战1-6。因此,临床仍亟需更多安全有效的新型治疗方案来改善AML患者的预后。
较2013-2016年相比,2017-2022年期间,随着年轻患者移植率的增加、分子检测率的提高和靶向治疗药物的应用,AML患者的中位生存期(OS)得到明显改善(16.0 m vs 11.0 m,P=0.039)7。其中新型IDH抑制剂的上市为IDH突变AML患者的生存带来了新曙光。为此,此次特别邀请到北京大学人民医院江浩教授与我们共同分享IDH抑制剂联合方案治疗AML的最新研究进展,以图为广大血液科医师的治疗决策带来启发。
MD Anderson Cancer Center:
IVO+VEN±AZA治疗IDH1突变髓系恶性
肿瘤的临床Ib/II期研究8-10
研究背景
IDH1突变是AML的常见基因突变之一,检出率约7%-8%。艾伏尼布(IVO)是一种靶向IDH1突变的小分子抑制剂,被美国食品和药物管理局(FDA)批准用于携带IDH1突变新诊断(ND)和复发难治性(R/R)AML成人患者的治疗。一项随机临床III期研究(AGILE研究)显示,与安慰剂联合AZA相比,IVO联合AZA治疗不适合强化疗的IDH1突变ND AML可显著提高临床缓解率和改善生存期[完全缓解(CR)+完全缓解伴血液学不完全恢复(CRi):53% vs 18%,中位OS:29.3 m vs 7.9 m]8,11。此外,临床前研究表明,IDH抑制剂和VEN通过增加促凋亡激活蛋白在分化白血病原始细胞方面发挥协同作用。因此,研究者设计此项研究,以评估IVO+VEN±AZA联合方案治疗IDH1突变AML患者的疗效和安全性。本次分析报道的是临床Ib期研究结果。
研究方法
研究人群:采用非随机、开放标签、剂量递增临床研究设计,纳入≥18岁、ECOG评分(PS)0-2、携带IDH1 R132突变的髓系恶性血液肿瘤患者,包括ND AML和R/R AML、高危骨髓增生异常综合征(HR-MDS)、骨髓增殖性肿瘤(MPN)和慢性粒-单核细胞白血病(CMML)。并排除既往使用过VEN和IVO治疗的患者。
给药方案:设4个给药剂量队列,分别为:VEN 400 mg(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第15天开始)、VEN 800 mg(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第15天开始)、VEN 400 mg(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第15天开始)+ AZA 75 mg/m2(IV/SC,D1-7)、VEN 800 mg(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第15天开始)+ AZA 75 mg/m2(IV/SC,D1-7)。每周期为连续28天。
研究指标:安全性、耐受性、最大耐受剂量(MTD)、推荐临床II期剂量(RP2D)、复合缓解率[CRc:完全缓解伴部分血液学恢复(CRh)+CRi+CR]、总缓解率[ORR:CRc+PR(部分缓解)+MLFS(形态学无白血病状态)]等。
研究结果
2018年3月20日至2021年5月28日,共纳入31例患者,中位年龄67(44-84)岁,ECOG PS 0、1和2的患者比例分别为27%、60%和13%。包括MDS/MPN患者9例、ND AML患者14例和R/R AML 8例。按照2022年欧洲白血病网(ELN)标准,AML患者的风险分层为:低危36%(8例)、中危14%(3例)和高危50%(11例)。
接受IVO+VEN和IVO+VEN+AZA治疗的患者,达最佳缓解的中位时间分别为55天(约2个周期)和37天(约1个周期)。接受治疗的总体患者ORR率为94%,CRc率为87%;获得CRc的可评估MRD的患者中MFC-MRD阴性率为63%;39%患者桥接移植。中位随访24个月,中位缓解持续时间(DOR)为34.6个月,中位无事件生存期(EFS)和中位OS分别为36个月和42个月。
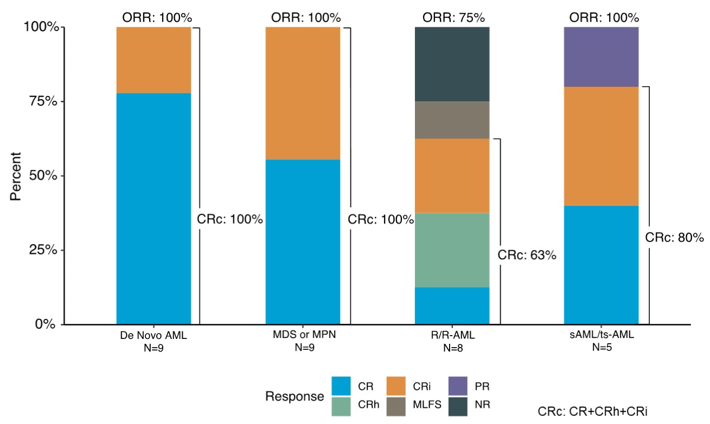
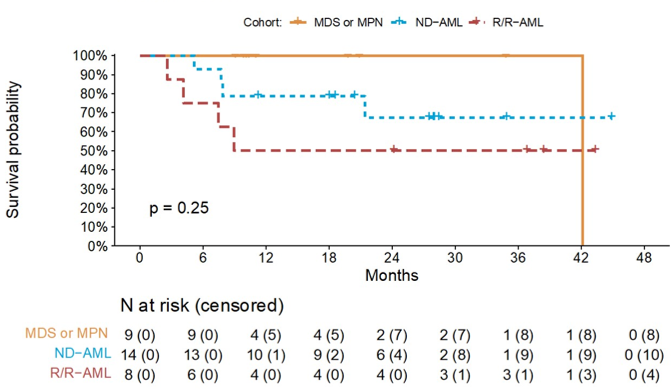
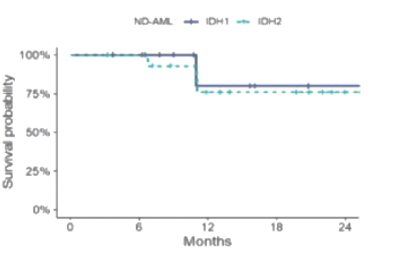
14例ND AML患者的CRc率为93%(原发性AML和继发性AML分别为100%和80%),ORR率为100%(图1),≥5个治疗周期的应答者IDH1突变清除率为71%;中位随访24个月,中位EFS为36个月,中位OS未达到,12个月和24个月OS率分别为79%和67%(图2)。
8例R/R AML患者的CRc率为63%,ORR率为75%(图1),≥5个治疗周期的应答者IDH1突变清除率为50%;中位随访24个月,中位EFS为6个月,中位OS为9个月(图2)。
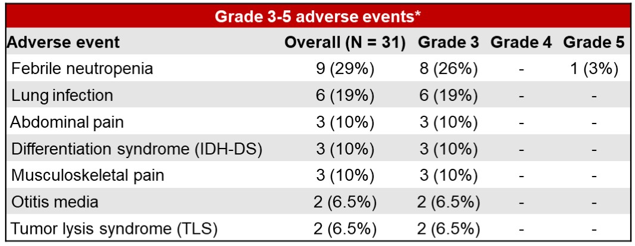
患者整体治疗耐受性良好:研究期间61%(19例)患者因血液学不良事件(AE)发生剂量调整;91%的非血液学AE为1-2级,发热性中性粒细胞减少症和肺部感染是最常见的感染事件(3-5级AE的发生率分别为29%和19%)(表1);无患者停用IVO;治疗MTD未达到;RP2D为IVO+VEN 400 mg+AZA。
研究结论
IVO+VEN+AZA联合方案治疗IDH1突变髓系恶性肿瘤是安全有效的,有助于克服靶向药物单药治疗潜在的耐药性问题,且可获得较高的MRD阴性率,为患者提供有效的疾病缓解和生存获益。
ASH 2023年会:
ASTX727+VEN+IVO或ENA治疗IDH突变AML的临床Ib/II期研究12,13
研究背景
IDH1/2突变在AML中的检出率高达20%。据报道,VEN联合IDH抑制剂和去甲基化药物(HMA)对于此类患者是一种有效的治疗方案。其中,IDH1抑制剂IVO+VEN±AZA方案治疗IDH1突变AML患者的CRc率近90%9。为进一步探索IDH突变AML患者的有效治疗方案,研究人员选择ASTX727(由地西他滨和cedazuridine组成的新型口服制剂)+VEN+IDH1抑制剂IVO或IDH2抑制剂ENA三药联合方案治疗IDH突变AML患者,以探究此方案的疗效和安全性。
研究方法
研究人群:≥18岁不适合强化疗的IDH突变ND AML和R/R AML患者。包括既往使用过VEN、HMA和IDH抑制剂的R/R AML患者。
给药方案:IDH1突变组:ASTX727(PO,D1-5)+ VEN(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第8天开始);IDH2突变组:ASTX727(PO,D1-5)+ VEN(PO,D1-14)+ ENA 100 mg QD(PO,从第1个周期第8天开始)。每周期为连续28天。
研究指标:ASTX727+VEN+IVO或ENA方案的安全性、RP2D和CRc(CRh+CRi+CR)等。
研究结果
该研究结果报道时共纳入57例患者,其中ND AML患者27例(IDH1突变组为11例),R/R AML患者30例(IDH1突变组为11例)。中位年龄72岁(41-86)。82%(47/57)患者因携带剪接体基因突变,归为ELN预后不良组。
临床Ib研究确定的RP2D分别为:IDH1突变组,ASTX727(PO,D1-5)+ VEN 600 mg(PO,D1-14)+ IVO 500 mg QD(PO,从第1个周期第8天开始);IDH2突变组,ASTX727(PO,D1-5)+ VEN 400 mg(PO, D1-14)+ ENA 100 mg QD(PO,从第1个周期第8天开始)。
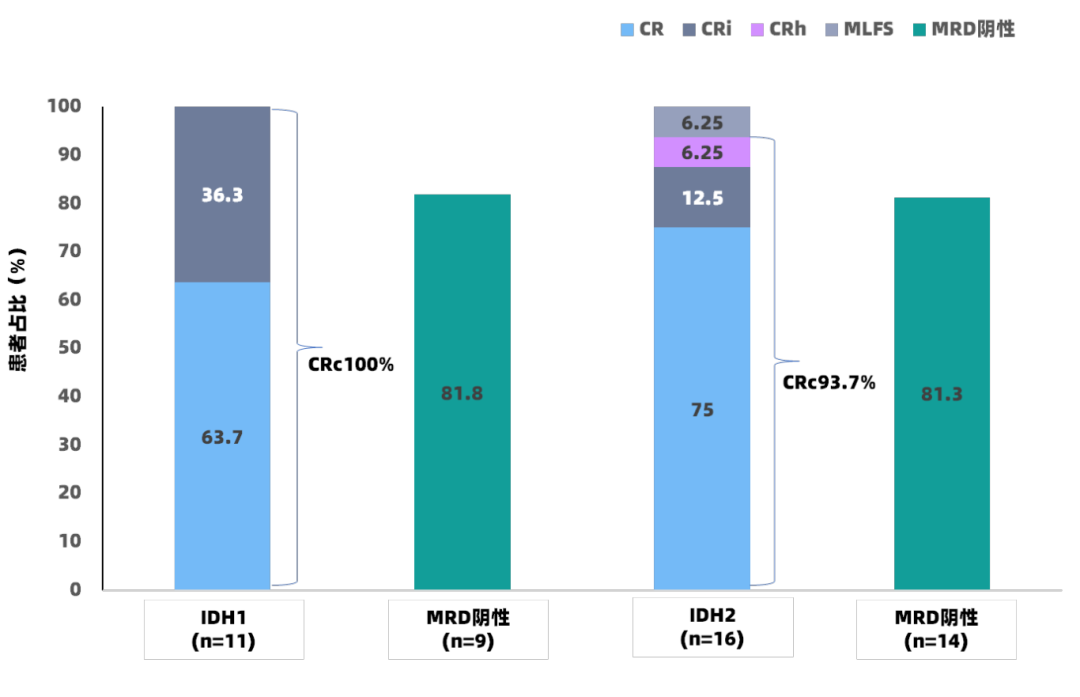
在ND AML患者中,总人群、IDH1突变组和IDH2突变组的CRc率分别为96.2%、100%和93.7%(图3),MFC-MRD阴性率分别为85%、81.8%和81.3%,IDH1突变组和IDH2突变组的中位DOR和中位OS均未达到(中位随访时间为11个月,图5)。
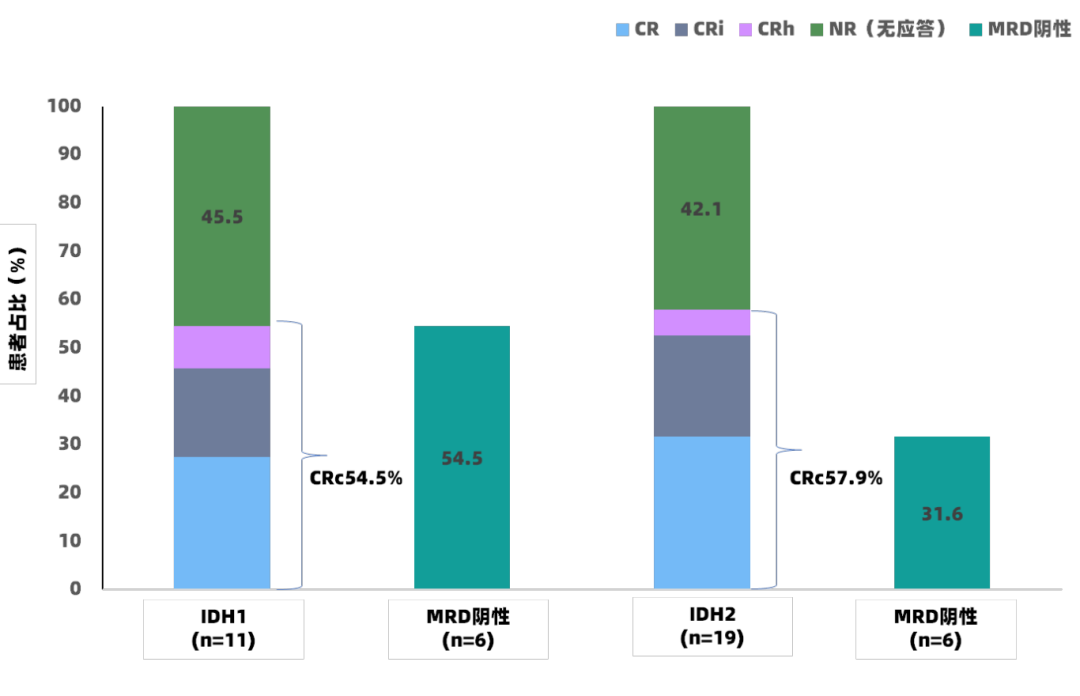
在R/R AML患者中,总人群、IDH1突变组和IDH2突变组的CRc率分别为56.6%、54.5%和57.9%(图4),MFC-MRD阴性率分别为70.5%、54.5%和31.6%,IDH1突变组和IDH2突变组患者的中位DOR分别为13.8个月和16.1个月,中位OS分别为17.7个月和10.4个月(中位随访时间为14.6个月)。
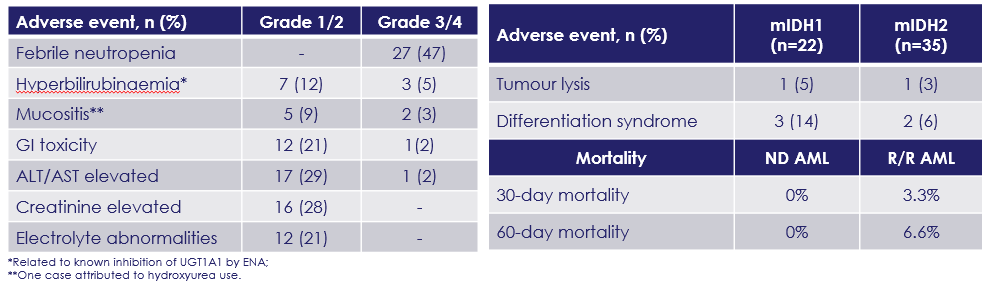
该三药联合方案的不良事件整体可控可管理,ND AML和R/R AML治疗早期死亡率较低(表2)。
研究结论
ASTX727+VEN+IVO或ENA三药联合方案与IDH突变AML患者良好的预后相关:ND AML总人群CRc率为96.2%(IDH1突变组为100%),中位OS未达到(IDH1突变组中位OS亦未达到);R/R AML总人群CRc率为56.6%,其中IDH1突变组CRc率为54.5%,中位OS为17.7个月。且该联合方案具有符合预期和可接受的安全性。
专家展望
IDH突变是AML常见的基因突变之一。既往研究显示,HMA联合VEN方案对于不适合强化疗的IDH突变AML可以提供一定的疾病缓解和生存改善。随着针对IDH突变的特异性靶向药物的问世,IDH抑制剂联合VEN和HMA的三药联合新型疗法为IDH突变AML的治疗提供了新选择。本文中的两项临床研究结果表明,此三药联合新型疗法可以为IDH突变AML患者带来快速、深度、持久的疾病缓解和生存获益,且整体安全性可控可管理,给药方便,具有潜在的应用前景。
期待未来科研工作者可以持续探索新型治疗组合,争取获得更多突破性进展,为更多的AML患者带来生命的曙光。
北京大学人民医院血液研究所病区主任
中华医学会血液学分会白血病淋巴瘤专业学组委员
中国医疗保健国际交流促进会血液学分会常务委员
中国老年医学会血液学分会常务委员
中国抗癌协会血液肿瘤专委会委员
主持科技部重点研发计划项目、首都特色专项基金等国家、省部级项目,以第一作者或者通讯作者等发表中英文论著50余篇
1.Curr Treat Options Oncol. 2020 Jun 29;21(8):66. doi:10.1007/s11864-020-00765-5.
2.黄佳瑜,等.白血病淋巴瘤. 2023,32(2):343-347.
3.Blood. 2020 Aug 27;136(9):1023-1032. doi:10.1182/blood.2019001982.
4.Ther Adv Hematol. 2022 Mar 23:13:20406207221081637.
5.Haematologica. 2023 Sep 1; 108(9): 2289–2304.
6.中国实验血液学杂. 2022, 30 (06): 1907-1911. DOI:10.19746/j.cnki.issn1009-2137.2022.06.044.
7.Grinblatt DL, et al. ASH 2023 Oral #593.
8.Lachowiez CA,et al. Blood Cancer Discov. 2023 Jul 5;4(4):276-293.
9.Lachowiez CA, et al. ASCO 2022 Poster #7018.
10.Lachowiez CA,et al. Blood Cancer Discov. 2023, Supplementary Appendix.
11.De Botton et al. ASCO 2023 Poster #142.
12.Atluri H,et al. ASH 2023 Oral #968.
13.Atluri H,et al. ASH 2023 Abstrate #968.
审批号:M-TIBSO-CN-202408-00008
本文转自:医脉通血液科
排版编辑:肿瘤资讯-展思懿











 苏公网安备32059002004080号
苏公网安备32059002004080号


