乳腺癌是全球女性中最常见的恶性肿瘤,腋窝淋巴结(ALN)转移是其预后的重要影响因素之一。准确评估乳腺癌新辅助化疗(NAC)后腋窝淋巴结(ALN)反应在制定后续至方案中具有重要价值。近日,一项研究构建动态对比增强磁共振成像MRI(DCE-MRI)和临床病理学特征的人工智能系统,在预测NAC后腋窝病理完全缓解(pCR)率方面具有良好表现[1],有望为指导患者个体化治疗带来新手段。【肿瘤资讯】整理如下,以飨读者。

研究背景
乳腺癌患者常发生ALN转移。NAC后,腋窝pCR率约为35%~68%[2,3]。腋窝淋巴结切除(ALND)是评估腋窝pCR的金标准,但是伴有水肿不良事件。近来临床研究显示对于ALN受累的患者,辅助放疗可降低手术并发症,同时具有良好的临床结局,可能是NAC后达到腋窝pCR患者ALND的替代[4]。因此,准确预测腋窝pCR对于腋窝治疗决策十分重要。
DCE-MRI是评估乳腺癌ALN状态的客观方法,然而其预测腋窝pCR的准确性数据有限。放射组学可将数字影像信息转化为高维空间特征载体,近年来引发关注。深度学习是影像学中达到良好结果的有效技术。因此,研究使用临床病理学特征和肿瘤及ALN的DCE-MRI,构建基于深度学习的全自动化整合系统(FAIS-DL),以早期预测乳腺癌NAC后腋窝pCR率。
研究方法
纳入病理确诊浸润性乳腺癌伴单侧ALN转移的患者,接受标准NAC和手术治疗,NAC前2周内行DCE-MRI。构建多区域DCE-MRI深度学习模型。使用年龄、肿瘤最大径、ALN短径、ER、PR、HER2、Ki67和分子亚型等构建临床模型。最后构建FAIS-DL(图1),评估FAIS-DL表现。
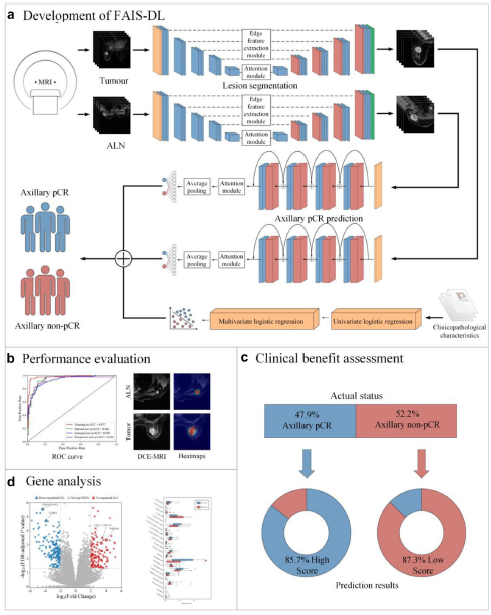
研究结果
在回顾性研究中,204/506例(40.3%)训练和验证集的患者,48/127例(37.8%)内部验证集的患者,202/414例(48.8%)汇总外部验证集的患者达到腋窝pCR。前瞻性研究中,43/98例(43.9%)的患者达到腋窝pCR。
FAIS-DL表现
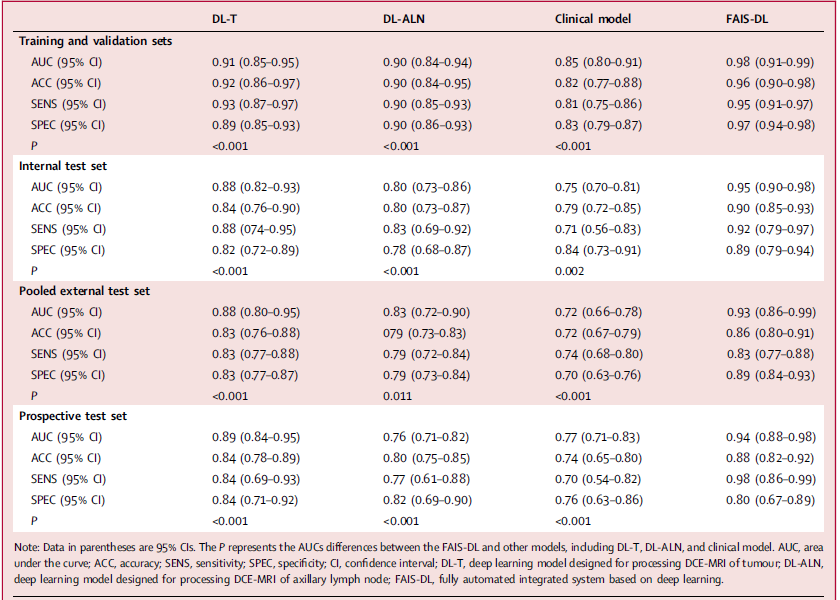
乳腺肿瘤中,观察者间人工描绘的戴斯相似性系数(DSC)是0.92~0.95,观察者内人工描绘的DSC是0.91~0.93。ALNs则分别是0.94~0.97和0.91~0.94。FAIS-DL具有满意分割表现,肿瘤平均DSCs为0.82~0.91,ALNs为0.80~0.90。FAIS-DL评分=−7.211+5.708×DL-T评分+4.128×DL-ALN评分+3.692×临床模型评分。训练和验证集中将患者分为高分和低分组的最佳界值为0.469。训练和验证集、内部、汇总外部和前瞻验证集中,FAIS-DL鉴别腋窝pCR的AUC分别为0.98(95%CI 0.91-0.99),0.95(95%CI 0.90-0.98),0.93(95%CI 0.86-0.99)和0.94(95%CI 0.88-0.98)(图2a-d),敏感性和特异性良好(表1)。
此外,4个数据集中腋窝pCR的患者较未达到腋窝pCR的患者具有更高FAIS-DL评分(P<0.001)。决策曲线分析提示在6.7%~98.5%,0~91.5%,4.0%~100%和3.1%~100%范围时,FAIS-DL较其他模型具有最高净获益(图2e-h)。校正曲线显示ALN预测状态和实际状态间具有良好一致性(图2i-l)。
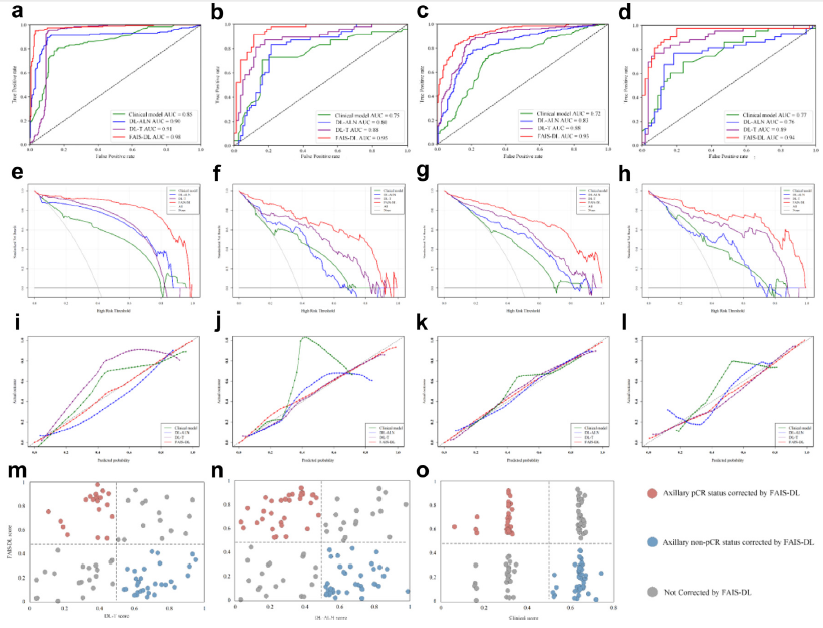
表1. FAIS-DL对比DL-T,DL-ALN和临床模型的预测表现
FAIS-DL与DL-T和DL-ALN的比较
内部、汇总外部和前瞻验证集中,DL-T对比FAIS-DL的AUCs分别是0.88 vs 0.95,0.88 vs 0.93,0.89 vs 0.94(P<0.001)。DL-ALN和FAIS-DL的AUCs分别是0.80 vs 0.95,0.83 vs 0.93,0.76 vs 0.94(P<0.001)(图2b-d)。FAIS-DL较DL-T和DL-ALN也具有更高的准确性,敏感性和特异性(表1)。汇总外部和前瞻性验证集中,FAIS-DL可以纠正DL-T错误分类的21例(51.2%)腋窝pCR和31例(67.4%)腋窝非pCR的患者(图2m),和DL-ALN错误分类的33例(62.3%)腋窝pCR和37例(67.3%)腋窝非pCR的患者(图2n)。
FAIS-DL和临床模型的比较
单变量和多变量分析显示HER2状态和Ki67指数是独立风险因素。和FAIS-DL相比,临床模型表现不满意,内部、汇总外部和前瞻验证集中,AUCs分别是0.75 vs 0.95,0.72 vs 0.93,0.77 vs 0.94(P<0.05)(图2b-d,表1)。汇总外部和前瞻性验证集中,FAIS-DL可以纠正临床模型错误分类的38例(58.5%)腋窝pCR和45例(58.4%)腋窝非pCR的患者(图2o)。
FAIS-DL亚组分析
汇总外部验证集中,腔面A+B型,HER2过表达和三阴性亚组的FAIS-DL AUCs分别是0.92,0.96和0.93;前瞻性验证集的AUCs分别是0.93,0.94和0.91。对于肿瘤长径≤2 cm和>2 cm亚组,汇总外部验证集中FAIS-DL达到AUCs 0.88和0.94,前瞻性验证集中分别是0.85和0.94。
临床获益评估
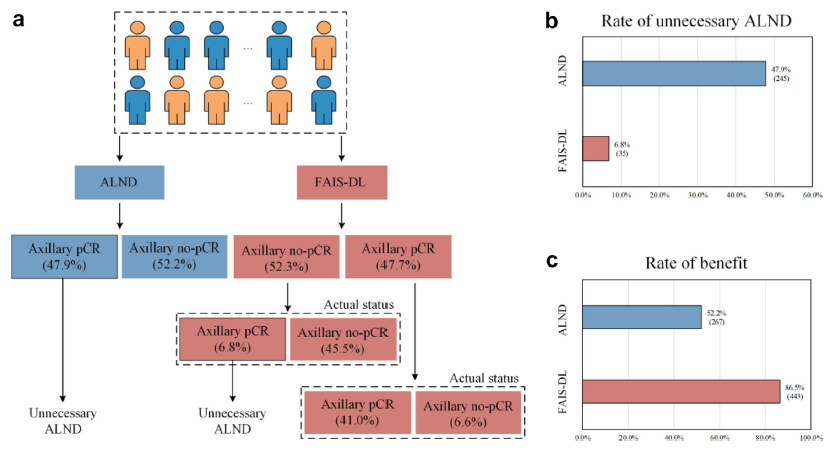
512例汇总外部和前瞻性验证集患者接受ALND,其中245例(47.9%)病理确认腋窝pCR,267例(52.2%)腋窝非pCR。对于达到腋窝pCR的患者,231例(87.3%)腋窝非pCR的患者被准确挑出。如果基于FAIS-DL结果进行ALND,ALND将从47.9%降至6.8%,最终获益率从52.2%增加至86.5%(图3a-c)。
生物学功能探索
FAIS-DL将45例患者分为26例FAIS-DL高分和19例FAIS-DL低分患者。二者间发现免疫相关差异表达基因如TMEM26,CCL5和CXCL13(图4a)。GO分析提示免疫相关通路如氨基酸代谢修饰,顶端质膜和氧化还原驱动活性跨膜转运子活性都在高分患者中显著上调(图4b)。此外,和低分患者相比,高分肿瘤显示出更多单核细胞浸润(P=0.036)和M0巨噬细胞(P=0.022)(图4c,d)。和免疫微环境分析一致,高分标本比低分标本显示出更多单核细胞和M0巨噬细胞(棕点)。
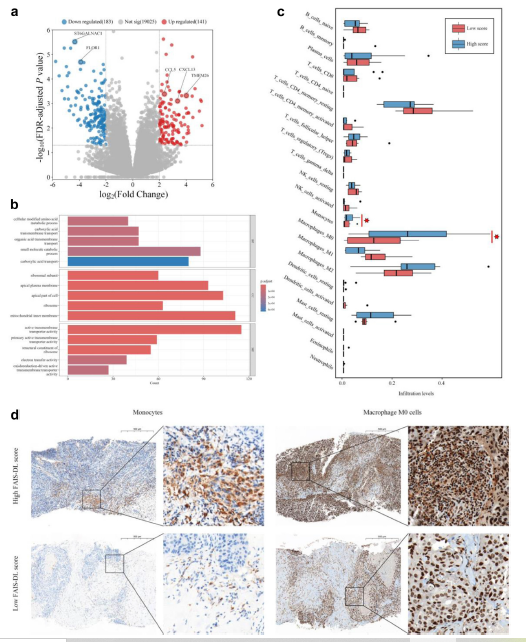
研究讨论
该研究开发并验证了基于深度学习的全自动化多任务系统(FAIS-DL),用于早期预测乳腺癌患者NAC后的腋窝pCR。FAIS-DL通过整合DCE-MAI和临床病理学特征显示出良好使用性。研究还验证了使用FAIS-DL指导ALND的有效性,支持其在腋窝手术决策中的潜在作用。进一步的分析表明,高FAIS-DL评分与免疫反应通路的上调密切相关。
DCE-MRI已被广泛应用于评估乳腺癌NAC的疗效。然而,现有研究显示其在预测腋窝pCR方面的能力存在较大变异,敏感性为55%~88%,特异性为50%~82% [5]。近来有研究显示放射组学可预测腋窝pCR[6],但是其手动效率影响临床应用。研究研发全自动多任务系统,不仅有效生成可信病灶轮廓,也可自动进行数据分析,有助于改善临床解释的效率和可行性。
之前研究使用超声为基础的深度学习模型来预测腋窝pCR,但仅依赖肿瘤影像难以全面评估腋窝pCR [6]。我们之前的研究显示基于多区域DCR-MRI的深度学习模型在预测ALN转移方面优于仅基于肿瘤或ALN的DCE-MRI[7]。因此发展FAIS-DL,研究显示其表现确实优于DL-T,Dl-ALN和临床模型。
尽管预测能力良好,研究依旧存在局限性。首先,回顾性研究不可避免地存在选择偏倚,因此需要通过国际多中心前瞻性研究进一步验证结果。第二,前哨淋巴结活检(SLNB)能够评估NAC后腋窝淋巴结状态,并降低并发症风险,未来的研究应纳入SLNB患者,以增强其临床适用性。第三,研究仅包括单侧ALN转移的乳腺癌患者,还需要纳入双侧ALN转移等患者增强FAIS-DL普适性。第四,研究仅使用峰值增强时相影像,需要明确其他MRI序列的价值。第五,标准乳腺MRI对于腋窝覆盖性可能有限。最后,为了全面理解生物学过程,未来需要整合组织学和单细胞RNA测序技术,以提供更深入的生物学见解。
研究结论
FAIS-DL在评估腋窝pCR中显示出良好表现,可降低不必要的ALND率,增加获益率。此外,FAIS-DL的潜在生物学基础可能和调节免疫反应通路相关。未来,应整合各国家人种数据以增强预测表现和临床应用普适性。
[1] Li Z, et al. Multiregional dynamic contrast-enhanced MRI-based integrated system for predicting pathological complete response of axillary lymph node to neoadjuvant chemotherapy in breast cancer: multicentre study. EBioMedicine. 2024:107:105311.
[2] Hennessy BT, et al. Outcome after pathologic complete eradication of cytologically proven breast cancer axillary node metastases following primary chemotherapy. J Clin Oncol. 2005;23(36):9304-11.
[3] Pilewskie M, et al. Axillary nodal management following neoadjuvant chemotherapy: a review. JAMA Oncol. 2017;3(4):549-555.
[4] Donker M, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, openlabel, phase 3 non-inferiority trial. Lancet Oncol. 2014;15(12):1303-10.
[5] Li Z, et al. Diagnostic performance of MRI for assessing axillary lymph node status after neoadjuvant chemotherapy in breast cancer: a systematic review and metaanalysis. Eur Radiol. 2024;34(2):930-942.
[6] Gu J, et al. Deep learning radiomics of ultrasonography for comprehensively predicting tumor and axillary lymph node status after neoadjuvant chemotherapy in breast cancer patients: a multicenter study. Cancer. 2023;129(3):356-366.
[7] Gu J, et al. Attention-based deep learning for the preoperative differentiation of axillary lymph node metastasis in breast cancer on DCE-MRI. J Magn Reson Imaging. 2023;57(6):1842-1853.
声明:材料由阿斯利康支持,仅供医疗卫生专业人士参考
审批编号:CN-149552
过期日期:2025-12-09
责任编辑:肿瘤资讯-Kelly
排版编辑:肿瘤资讯-江江











 苏公网安备32059002004080号
苏公网安备32059002004080号


