胚系BRCA1/2(gBRCA1/2)突变显著增加乳腺癌患者的发病风险并影响其预后,其中,TNBC和HR+/HER2阴性乳腺癌是gBRCA突变的主要亚型。PARP抑制剂的出现改变了gBRCA1/2突变相关乳腺癌的治疗预后。基于OlympiA研究的结果,推动了PARP抑制剂迈向早期乳腺癌辅助治疗。本期特邀华中科技大学同济医学院附属同济医院李兴睿教授针对gBRCA突变早期乳腺癌辅助治疗的新标准进行了深入探讨,以飨读者。
gBRCA突变早期乳腺癌亟需精准治愈方案
2024年,根据世界卫生组织(WHO)下属国际癌症研究机构(IARC)发布的最新数据,估计2022年全球乳腺癌新发病例数230万例,死亡67万例,成为全球第四大癌症杀手,其中,中国乳腺癌新发病例位居全球首位,死亡病例位居全球第二[1] 。研究表明,5%~10%的乳腺癌患者具有明确的遗传基因突变,其中BRCA1/2基因突变占15%[2]。中国乳腺癌患者BRCA基因检测与临床应用专家共识(2018年版)[2]表明,60%-80%的BRCA1基因突变乳腺癌为三阴性,超过75%的BRCA2基因突变乳腺癌为Luminal型。
BRCA1/2突变乳腺癌患者确诊年龄更轻,恶性程度更高。研究显示:中国人群中, BRCA1/2突变携带者乳腺癌诊断的平均年龄为39-45岁[3,4],且具有更高的组织学分级[5]。此外,还有多项研究表明[6,7,8]:BRCA突变乳腺癌比非BRCA突变乳腺癌淋巴结受累更多;BRCA1/2突变乳腺癌患者对侧乳腺癌发生风险增高;BRCA 突变乳腺癌患者无病生存期更短,远处转移风险更高。综上,针对BRCA突变乳腺癌的精准治疗是提高HER2阴性早期乳腺癌治愈率的关键。
OlympiA研究推动PARP抑制剂
迈向早期辅助治疗
PARP抑制剂可通过合成致死效应,阻止DNA损伤修复,诱导BRCA突变肿瘤细胞凋亡。即当BRCA1/2突变而引起同源重组缺陷(HRD)时,PARP能代偿BRCA的修复作用;当两种DNA损伤修复途径均出现障碍,则促进肿瘤细胞的凋亡[9]。
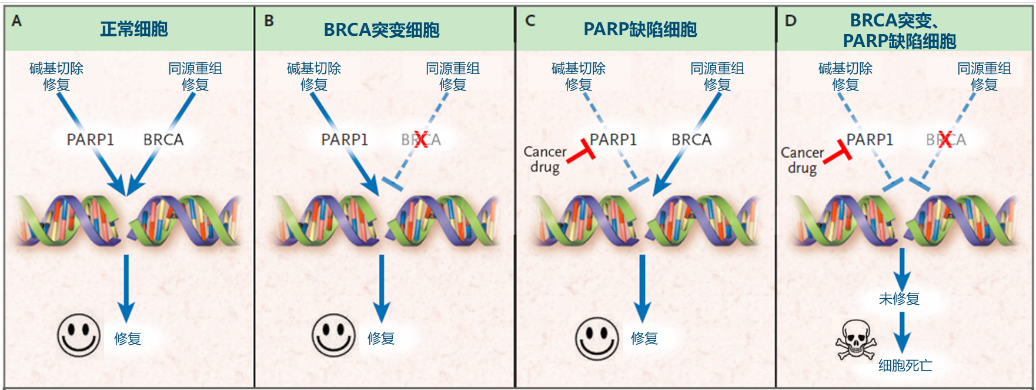
奥拉帕利是全球及国内首个获批上市的 PARP抑制剂,也是首个同时获批用于晚期乳腺癌挽救治疗及早期乳腺癌辅助治疗的PARP抑制剂[10]。
OlympiA研究[11]推动了PARP抑制剂迈向早期乳腺癌的辅助治疗,该双盲、随机对照、国际多中心的Ⅲ期临床研究共纳入1836例 HER2阴性、gBRCA突变的高复发风险早期乳腺癌患者,在完成新辅助治疗或辅助治疗以及局部治疗后被随机分配接受奥拉帕利或安慰剂治疗1年。主要终点是iDFS。

基线数据显示,奥拉帕利组中患者的中位年龄为42岁;根据gBRCA基因分类,奥拉帕利组中gBRCA1突变占比为72.3%,gBRCA2突变占比为27.7%;根据激素受体状态分类,奥拉帕利组中HR+/HER2-乳腺癌占比为18.2%,三阴性乳腺癌占比为 81.5%。

奥拉帕利组显著改善gBRCA突变、HER2阴性早期乳腺癌患者的3年iDFS(85.9% vs 77.1%),降低浸润性疾病复发或死亡风险42%(HR=0.58,P<0.001),达到了研究的主要终点。

奥拉帕利组显著改善gBRCA突变、HER2阴性早期乳腺癌患者的3年DDFS(87.5% vs. 80.4%),降低远处疾病复发或死亡风险43%(HR=0.57,P < 0.01)。
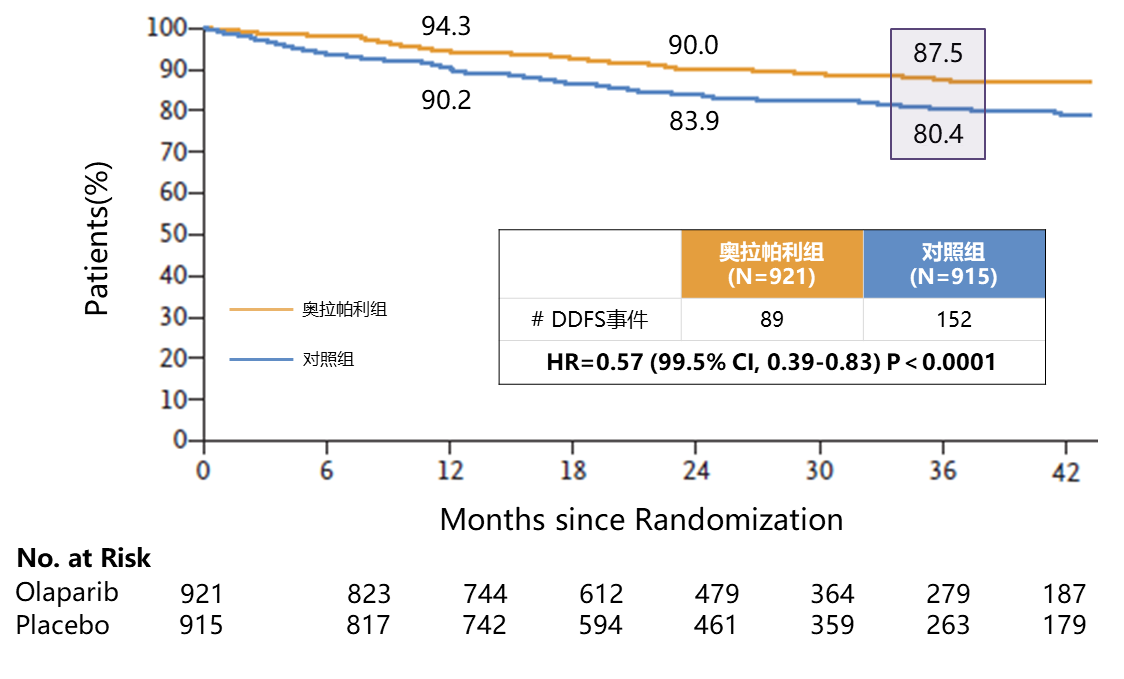 图5:OlympiA研究DDFS分析
图5:OlympiA研究DDFS分析
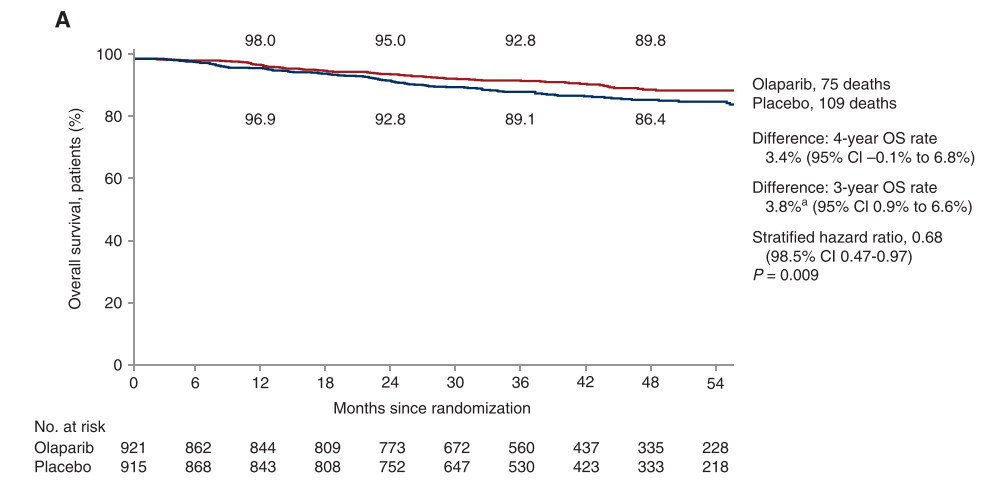
此外,两组4年OS率分别为89.8% vs 86.4%(HR=0.68;P=0.01),奥拉帕利显著降低32%的死亡风险[12]。
基于 OlympiA研究的结果,NCCN指南[13]推荐对于携带gBRCA1/2突变的患者,可以考虑加用奥拉帕利辅助治疗1年,研究具体纳入人群如下:
■TNBC患者:1)辅助化疗后,疾病分期≥pT2或pN1;或2)新辅助化疗后non-pCR
■HR+/HER2阴性乳腺癌患者:1)辅助化疗后,淋巴结阳性≥4个;或2)新辅助治疗后non-pCR,且临床病理分期、雌激素受体状态及肿瘤分级(CPS+EG)评分≥3
PARP抑制剂是gBRCA突变早期乳腺癌的
标准治疗
TNBC
■新辅助治疗后奥拉帕利 vs 帕博利珠单抗
KEYNOTE-522研究[14]旨在对比帕博利珠单抗联合化疗与单纯化疗在TNBC患者中的疗效和安全性。研究结果显示,与单独化疗相比,帕博利珠单抗联合化疗显著提高了TNBC患者的3年EFS率(84.5% vs 76.8%,HR = 0.63,P<0.001)。该研究结果支持将帕博利珠单抗作为高风险早期TNBC患者的推荐治疗方案。然而,该研究未分析BRCA1/2状态的亚组疗效,其中82.1%的患者gBRCA1/2状态未知,仅54例为已知gBRCA突变携带者,因此无法明确不同gBRCA突变状态患者的疗效差异。
在KEYNOTE-522研究中,帕博利珠单抗+化疗组中位随访39.1个月后,约35%的non-pCR患者在36个月内发生事件或死亡。OlympiA试验针对gBRCA突变的HER2阴性早期乳腺癌患者显示出OS获益(显著降低32%的死亡风险)。
■新辅助治疗后奥拉帕利 vs卡培他滨
CREATE-X研究[15]显示,术后接受6至8个周期的卡培他滨治疗可为新辅助化疗后non-pCR患者带来iDFS和OS获益。然而,CREATE-X的亚组分析未包括gBRCA状态。
此外,PARP抑制剂通过抑制DNA损伤修复起效,而卡培他滨通过抑制胸腺核苷酸合成作用,PARP抑制剂可能在化疗耐药后可能保持敏感性[16,17,18]。
还有一项Meta分析[19],共纳入 9 项随机临床试验和 3842 例TNBC患者,评估卡培他滨对早期TNBC患者生存率的影响及其安全性,结果显示,卡培他滨胃肠道反应及手足综合征发生风险显著高于无卡培他滨组,患者耐受性差。
HR+乳腺癌
■阿贝西利vs奥拉帕利
monarchE[20]是首个在HR+、HER2阴性高复发风险早期乳腺癌辅助治疗中获得阳性结果的临床研究。研究结果显示:试验组中观察到显著的iDFS获益(HR 0.664; 95% CI,0.58-0.76,P < 0.0001),但初步数据未显示OS获益(HR 0.93; 95% CI,0.74-1.15; P = 0.50)。由于缺乏gBRCA状态的亚组分析,目前尚不清楚gBRCA突变携带者是否能从阿贝西利治疗中获得与BRCA野生型患者相同的益处。
在monarchE研究中,高复发风险定义为:病理阳性腋窝淋巴结≥4个,或阳性腋窝淋巴结数为1至3个且至少具有以下一种高风险特征:原发肿瘤≥5cm;肿瘤组织学分级3级;Ki-67≥20%。而在OlympiA研究中,对于ER阳性早期乳腺癌患者,要求纳入新辅助治疗后non-pCR且CPS+EG评分≥3,或辅助治疗后≥4枚阳性腋窝淋巴结的患者。值得注意的是,奥拉帕利获FDA批准的适应症并不严格限定淋巴结数或CPS+EG评分[21]。
综上所述,gBRCA突变高危乳腺癌患者的辅助治疗目前以奥拉帕利为基础,目前尚无其他药物在此类患者中显示出可比的OS获益[21]。
总结
BRCA1/2突变乳腺癌需格外关注, 其在HER2阴性乳腺癌中更常见,确诊年龄更轻,恶性程度更高、预后更差。针对BRCA突变乳腺癌的精准治疗是提高HER2阴性早期乳腺癌治愈率的关键。OlympiA研究推动PARP抑制剂迈向早期辅助治疗,基于OlympiA试验结果,奥拉帕利显著降低32%的死亡风险,推荐高危gBRCA突变、HER2阴性早期乳腺癌患者进行1年奥拉帕利辅助治疗。
专家介绍
华中科技大学同济医学院附属同济医院 甲乳外科科主任
中华医学会外科学分会甲状腺及代谢外科学组委员
中国医师协会外科医师分会委员
中国医疗保健国际交流促进会临床使用技术分会青年委员会副主任委员
中国抗癌协会乳腺癌专业委员会青年委员会委员
中国老年学和老年医学学会肿瘤康复分会乳腺癌专家委员会委员
中国成人教育协会医学继续教育专业委员会腔镜国际培训中心副主任委员
湖北省医学会普外分会委员
湖北省抗癌协会乳腺癌专业委员会副主任委员
湖北省抗癌协会乳腺癌专业委员会青年委员会主任委员
湖北省临床肿瘤学会乳腺癌专家委员会副主任委员
[1]Bray F, et al. CA Cancer J Clin. 2024 May-Jun;74(3):229-263.
[2]中国医师协会精准治疗委员会乳腺癌专业委员会,等. 中国癌症杂志,2018,28(10):787-798.
[3]Eun-Kyu Kim, et al. J Pathol Transl Med. 2020 Jul; 54(4): 265–275.
[4]Pankaj Taneja, et al. Clin Med Insights Oncol . 2010 Apr 20;4:15-34.
[5]Mavaddat N, et al. Cancer Epidemiol Biomarkers Prev. 2012;21:134-147;
[6]. Goodwin PJ, et al. J Clin Oncol, 2012,30(1):19–26.
[7]. Su L, et al. Int J Cancer. 2020 Feb 9.
[8]Wang YA, et al. BMC Cancer. 2018 Mar 22;18(1):315.
[9]Pilié PG, et al. Nat Rev Clin Oncol 2019;16(2):81-104
[10]黎立喜, 等. 国际肿瘤学杂志,2023,50(2):91-96.
[11]Tutt ANJ, et al. N Engl J Med. 2021 Jun 24;384(25):2394-2405.
[12]Geyer CE Jr, et al. Ann Oncol 2022;33:1250–1268.
[13]NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Genetic/Familial High-Risk Assessment: Breast, Ovarian, and Pancreatic V.5.2024.
[14]Schmid P, et al. N Engl J Med. 2022;386(6):556-567.
[15]Masuda N, et al. N Engl J Med. 2017;376(22):2147-2159.
[16] O’Connor MJ. Mol Cell. 2015;60:547–560;
[17]Drew Y, et al. Br J Cancer. 2015;113(suppl 1):S3–S9;
[18]Armstrong N, et al. Clin Epidemiol. 2019;11:543-561;
[19]Xingfa Huo, et al. BMC Cancer . 2021 Jan 19;21(1):78.
[20]Harbeck N, et al. Ann Oncol. 2021;32(12):1571-1581.
[21]Morganti S, et al. Oncologist. 2023 Jul 5;28(7):565-574.
责任编辑:肿瘤资讯-Annie
排版编辑:肿瘤资讯-yu











 苏公网安备32059002004080号
苏公网安备32059002004080号


